hPP10-Cu,Zn-SOD融合蛋白的制备、穿膜效应及其抗氧化、抗炎症功效



摘要:目的 探究人源性细胞膜穿透肽hPP10携带人源性抗氧化蛋白Cu,Zn-SOD的穿膜效应并观察其抗氧化、抗炎功效。方法利用RT-PCR技术扩增人源性SOD基因片段、酶切连接法构建重组质粒pET15b-Cu,Zn-SOD,pET15b-hPP10-Cu,Zn-SOD;利用镍柱亲和层析法、分子筛方法纯化Cu,Zn-SOD、hPP10-Cu,Zn-SOD融合蛋白并利用Western blotting法鉴定其正确性;利用免疫荧光法、荧光共定位实验、Western blotting法鉴定hPP10-Cu,Zn-SOD在细胞中的穿膜效应;利用Western blotting法鉴定hPP10-Cu,Zn-SOD融合蛋白穿膜时间梯度和浓度梯度效应;利用SOD酶活性测定试剂盒检测hPP10-Cu,Zn-SOD穿膜后的SOD酶活性;利用MTT法检测hPP10对细胞活性的影响。利用H2O2建立HEK293氧化应激细胞模型,通过流式细胞分析术(FCM)分析hPP10-Cu,Zn-SOD穿膜后细胞凋亡情况;并RT-qPCR分析hPP10-Cu,Zn-SOD穿膜后凋亡相关因子的表达情况;通过ROS检测分析hPP10-Cu,Zn-SOD穿膜后抗氧化能力。TPA诱导建立小鼠耳部炎症模型(5只/组,共4组),然后RT-qPCR分析hPP10-Cu,Zn-SOD穿膜后,NFκB,IL-1β、IL-6、TNFα因子的转录情况;Western blotting检测NFκB p65、p-NFκB p65、IL-1β、TNFα基因的表达;免疫组化分析炎性因子p-NFκB p65、TNFα基因的表达。结果 成功构建了重组质粒pET15b-Cu,Zn-SOD,pET15b-hPP10-Cu,Zn-SOD,并获得Cu,Zn-SOD蛋白和hPP10-Cu,Zn-SOD融合蛋白;免疫荧光试验结果表明5 μmol/L浓度的hPP10-Cu,Zn-SOD转导HEK293细胞具有明显的穿膜效应;荧光共定位实验显示融合蛋白hPP10-Cu,Zn-SOD入胞后定位在细胞膜内,部分蛋白定位在细胞核内;Western blotting实验结果表明hPP10-Cu,Zn-SOD转导Hela(Plt;0.05),HEK293(Plt;0.01)细胞具有浓度依赖性,细胞内hPP10-Cu,Zn-SOD存在可持续24 h;5 μmol/L的hPP10-Cu,Zn-SOD转导细胞具有较好的抗氧化活性(Plt;0.01);MTT结果显示高达10 μmol/L浓度的hPP10-Cu,Zn-SOD对于细胞活力的影响小。在氧化应激模型中,FCM结果显示hPP10-Cu,Zn-SOD融合蛋白孵育细胞降低了细胞的早期凋亡(Plt;0.01)和晚期凋亡(Plt;0.05);RT-qPCR结果显示hPP10-Cu,Zn-SOD融合蛋白孵育细胞使Bcl2、Mcl1、Deptor 等抗凋亡因子升高(Plt;0.05),降低了Bad、P21、P27 等促凋亡因子的表达(Plt;0.05);ROS 结果显示hPP10-Cu,Zn-SOD融合蛋白孵育细胞显著降低了细胞内的活性氧含量(Plt;0.01)。在炎症模型中,hPP10-Cu,Zn-SOD融合蛋白可显著降低IL-1β、IL-6、TNFα因子的转录(Plt;0.05);p-NFκB p65、IL-1β及TNFα的表达都呈现了抑制作用(Plt;0.05);hPP10-Cu,Zn-SOD融合蛋白处理组较Cu,Zn-SOD蛋白处理组,降低了炎性因子p-NFκB p65及TNFα基因的表达(Plt;0.05)。结论 融合蛋白hPP10-Cu,Zn-SOD具有明显的穿膜入胞、抗氧化、抗炎功效,且对细胞毒副作用很小。这些结果为hPP10作为新的递送载体奠定基础,也为hPP10-Cu,Zn-SOD应用于护肤品等提供了理论依据。
关键词:人源性细胞膜穿透肽hPP10;铜锌超氧化物歧化酶Cu,Zn-SOD;抗氧化;抗炎;酶活力测定
细胞有氧代谢产生的活性氧,是细胞氧化损伤的重要原因,氧化损伤被认为是衰老甚至疾病发生的特征之一。超氧化物歧化酶(SOD)是体内重要的抗氧化酶,能有效地清除氧自由基,解除氧化造成的衰老甚至疾病,具有延缓衰老、抗炎、抗辐射、抗肿瘤等功效[1, 2]。根据所含金属离子不同分为:Cu,Zn-SOD、Mn-SOD 和Fe-SOD[3]。其中,Cu,Zn-SOD是人体内重要的抗氧化酶,用以维系细胞内活性氧的稳态[4],避免过多的自由基对体内生物大分子造成损害[5],因其在细胞内含量最多,活性最稳定而受到广泛关注[6]。但是,Cu,Zn-SOD是生物大分子,必须进入细胞内才能发挥功效[7, 8]。
自1988 年Green 和Frankel 等[9, 10]首次发现了TAT——人免疫缺陷病毒(HIV)的转录调节蛋白可以穿透细胞膜、核膜进入细胞核,掀起了对于细胞膜穿透肽(CPP)的研究热潮。CPPs 不依赖受体[11],多组织普适性[12]使其很快被应用到靶向治疗和导入技术研究中来,其传递的分子包括核酸、治疗肽、小分子抑制剂、抗癌剂[13-15]等,穿膜肽可融合核酸酶在特定位点切割基因组DNA并诱导修复和重组[16]。为推动基因工程药物发展,建立高效、安全的蛋白分子导入技术提供了非常有价值的载体工具。国内外学者探索了将穿膜肽融合到Cu,Zn-SOD,制备TAT-Cu,Zn-SOD[17],LMWP-Cu,Zn-SOD[18],PEP1-Cu,Zn-SOD[19-21],PTD4-Cu,Zn-SOD[22, 23]等融合蛋白,表现出抗氧化、抗辐射等功效,缓解了氧化应激模型下细胞的炎症反应及皮肤细胞老化现象。但是病毒源的穿膜肽仍存在潜在的细胞毒性,目前尚未有人源性穿膜肽融合Cu,Zn-SOD,降低氧化损伤的报道。
课题组从KDM4A蛋白的c端片段中发现了一种新的人源性穿膜肽(命名为hPP10)。前期研究[24-26]表明,hPP10-FITC可以被Caski细胞摄取定位于细胞质和细胞核,hPP10-GFP融合蛋白可以穿透B16细胞膜定位于细胞质中,且穿膜效应高于TAT组;hPP10-Apoptin 融合蛋白有效导入细胞,诱导B16黑色素瘤细胞凋亡,发挥抗肿瘤作用;hPP10-GCLC(谷氨酸-半胱氨酸连接酶催化亚基)可通过抑制肝脏相关基因,特别是胶原和α-平滑肌肌动蛋白(α-SMA),显著减轻肝纤维化的过程。
因此,运用基因工程技术表达hPP10-Cu,Zn-SOD,有望解决非人源性蛋白的抗原性刺激以及大分子蛋白SOD不能穿透细胞膜进入细胞内发挥抗氧化功能的缺陷,从而制备更有效、更经济、更安全的具有护肤、保健和药用功效的SOD,更有效地保护人体细胞,发挥抗氧化、抗炎功效,达到护肤美容和预防治疗的作用。
1 材料和方法
1.1 材料
pET15b 质粒、E.coli DH 5α、Rossatta(DE3)、Hela细胞株和HEK293细胞株由本实验室保存;限制性核酸内切酶、T4 DNA连接酶、Taq 酶、dNTP、RT-PCR试剂盒(Fermentas);BCA蛋白浓度测定试剂盒(Thermos);核糖核酸酶、溴化乙锭、EDTA、DAPI(Sigma);超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所);羊抗鼠IgG-HRP、羊抗兔IgG-HRP、鼠源一抗GAPDH(北京中杉金桥公司);His 单克隆抗体(Abmart);β-actin 单克隆抗体、SOD 单克隆抗体(Santa Cruz);白细胞介素IL-1β、肿瘤坏死因子TNF-α等抗体(Affinity);兔源一抗NFκB p65(Proteintech);Cy3 标记的羊抗鼠二抗(NovoGene);PCR仪、蛋白质电泳系统(Bio-Rad);GelLogic-200 凝胶成像系统(Kodak);倒置荧光显微镜(尼康);全波长酶标仪(Thermo);生物安全柜(ECSO);移液枪(Eppendorf);免疫荧光共聚焦显微镜(Leica)。
1.2 方法
1.2.1 pET15b-Cu,Zn-SOD 及pET15b- hPP10-Cu,Zn-SOD重组质粒的构建
Trizol 法提取HEK293 细胞总RNA;以此为模板通过RT-PCR法克隆人Cu,Zn-SOD的cDNA片段,上游引物为:5'-aatctcgaggcgacgaaggccgtgtgcgtg-3',下游引物为:5'-cggggatccttattgggcgatcccaattac-3',并于上下游引物两端分别插入Xho I和BamH I酶切位点;将Cu,Zn-SOD 的PCR 产物与酶切回收的pET15b 载体经T4 DNA连接酶连接,构建成重组质粒pET15b-SOD。通过退火PCR获得hPP10基因片段,上游引物为:5'- tatgaaaatccccctgccccgcttcaaactgaaatgtatcttctgtaagaagcggaggaaaagaggcggttctc-3',下游引物为:5'-tcgagagaaccgcctcttttcctccgcttcttacagaagatacatttcagtttgaagcggggcagggggattttca-3',并于上下游引物两端分别插入NdeI和Xho I酶切位点;将退火得到的hPP10双链片段与经酶切回收的pET15b-Cu,Zn-SOD载体经T4 DNA连接酶连接,构建成重组质粒pET15b-hPP10-Cu,Zn-SOD。重组表达载体转化至感受态大肠杆菌E. coliDH5α,涂布于含Amp+琼脂平板,37 ℃倒置培养过夜。挑取单菌落,37 ℃震荡培养提取质粒进行酶切鉴定。送上海生物工程有限公司测序。
1.2.2 Cu,Zn-SOD、hPP10-Cu,Zn-SOD重组蛋白诱导表达和纯化
质粒转化感受态细胞Rossatta(DE3),形成稳定的高表达细菌株。在含100 μg/mL氨苄青霉素的LB平板上划单菌落,挑取单克隆至3 mL培养基中扩大培养,细菌生长至对数期时加入1 mmol/L IPTG诱导6 h,收集细菌。超声裂菌,4 ℃,12 000 r/min 离心20 min,取上清和Ni-NTA-agarose 亲和层析柱进行纯化。经经典透析液TGE 透析后,纯化产物进行SDSPAGE电泳分析及Western blotting验证。
纯化试剂配方:Binding buffer(5 mmol/Limidazole,0.5 mol/L NaCl,20 mmol/L Tris-HCl,pH7.9);Washing buffer (60 mmol/L imidazole, 0.5 mol/LNaCl,20 mmol/L Tris-HCl,pH 7.9);Elution buffer(1 mol/L imidazole,0.5 mol/L NaCl,20 mmol/L Tris-HCl, pH 7.9)。变性条件下使用含有6 mol/L urea 的Binding buffer超声,破碎菌体。
透析液配方:50 mmol/L Tris(pH=8.0) 100 mL,0.5 mmol/L EDTA(pH=8.0) 2 mL,50 mmol/L NaCl100 mL,100%丙三醇100 mL,还原型谷胱甘肽1 g,ddH2O定容至2 L,透析液的pH值要偏离目的蛋白的等电点。
1.2.3 Western blot 检测纯化原核蛋白
Cu,Zn-SOD、hPP10-Cu,Zn-SOD纯化蛋白用BCA试剂盒测定蛋白浓度,按5 μg 蛋白上样量制样,经SDS-PAGE 电泳分析,湿转法将蛋白转移至PVDF膜上,条件为100 mA,90 min;用含1%脱脂牛奶封闭2 h;弃牛奶,一抗结合目的蛋白室温孵育2 h;TBST洗涤5 min×3 次后,加入二抗室温孵育40~50 min;TBST洗涤5 min×3 次后,使用ECL法显影。
1.2.4 蛋白转导细胞
24/6 孔板中传代培养Hela 细胞(或HEK293 细胞),待细胞生长90%左右时弃去培养基,换为RPMI 无血清细胞培养基处理1 h;5% DMSO预处理1 h促进穿膜效应;加入一定浓度的过滤除菌的纯化蛋白处理一定时间。
1.2.5 免疫荧光法鉴定穿膜效应
24 孔板中传代培养HEK293细胞,预热PBS洗3次,4%多聚甲醛固定细胞20 min;预热PBS洗3次,0.1% triton-X100处理15 min;预热PBS洗3次,1%山羊血清封闭30 min;加入1:2000稀释的一抗(His单抗)室温2 h;预热PBS洗5 min×3次,加入1∶400稀释的二抗(Cy3标记的羊抗鼠IgG抗体)置37 ℃避光处理1 h;PBS 洗5 min×3 次,DAPI 染细胞核5 min,上述所有操作要保证每孔加入量不少于200 μL足以覆盖住全部细胞;PBS洗5 min×3 次后,每孔加入200 μL PBS,倒置荧光显微镜观察有无穿膜效应。
1.2.6 荧光共定位实验
将HEK293细胞种植在大鼠尾胶原蛋白(Roche)预处理的盖玻片上12~16 h,PBS短暂洗涤2 次后,用4% 多聚甲醛在PBS 中固定20 min,0.1% Triton X-100 渗透,分别用鼠抗SOD、兔抗EGFR的单克隆抗体原代封闭孵育,与羊抗鼠、羊抗兔抗体孵育后,细胞用PBS洗涤,用DAPI染色并用固定剂固定,通过3D共聚焦扫描显微镜成像。
1.2.7 Western blotting分析
6孔板中传代培养HEK293(Hela)细胞株,待细胞生长至80%~90%的融合度时弃培养基,预热PBS洗2次,做蛋白转导试验;冰上裂解细胞2 h,期间不断弹EP管,4 ℃离心12 000 r/min,25 min。用BCA试剂盒测定蛋白浓度,按10 μg上样量取上清液与5×上样缓冲液混合后,煮沸5 min,12 000 r/min 离心1 min,点样;SDS-PAGE 胶电泳条件为:60 V 电泳30 min,待样品进入分离胶后,改为120 V;待电泳完成后,湿转法将蛋白转移到PVDF膜上,条件为100 mA,90 min;转膜完成后,含1%脱脂牛奶封闭2 h;弃牛奶,兔源SOD 多克隆抗体结合目的蛋白室温孵育2 h;TBST洗涤5 min×3 次后,加入辣根过氧化物酶标记的羊抗兔IgG抗体室温孵育40~50 min;TBST洗涤5 min×3次后,使用ECL法显色。
1.2.8 SOD酶活力测定
本试剂盒采用黄嘌呤氧化法测定SOD酶活力,细胞超声破碎后,4000 r/min,15 min,离心取上清测定。本试剂盒内含试剂共7种:其中试剂五和六按照比例配制显色剂(现用现配),试剂七用于样品前处理,清除其他SOD,保留Cu,Zn-SOD酶活力。取样本0.2 mL加试剂七0.2 mL,涡旋混匀器充分混匀1 min后,以3500~4000 r/min,离心15 min,取上清测定。同时取生理盐水0.2 mL加试剂七0.2 mL,涡旋混匀器充分混匀1 min后,以3500~4000 r/min,离心15 min,取上清做对照组。按照表1依次加入各种试剂盒样本。
计算公式如下:
SOD活力(U/mgprot ) =(对照管A550 - 测定管A550/对照管A550)÷ 50% ×(反应总体积/取样量(mL)) ÷ 待测样本蛋白浓度(mgprot/mL)
1.2.9 MTT 检测细胞毒性
取对数生长期HEK293 细胞,以1.2×105/孔的密度接种于96 孔板;待细胞生长至对数期,弃培养基,换为1640-培养液,处理1 h;每孔分别换成浓度梯度为0.5 μmol/L、1 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L 及无血清的1640-培养液,处理24 h;弃培养基,用500 μL/孔预热PBS 洗涤3 次;加入80 μL/孔含血清的正常培养液及20 μL MTT溶液,处理4 h后弃去培养液,加入150 μL/孔DMSO,摇床振荡30 min至结晶物彻底溶解后测定A490;该实验需设置3 个以上复孔,重复3次以上,最终求得细胞存活率。
1.2.10 流式细胞分析术(FCM)
用25 μmol/L H2O2孵育HEK293细胞3 h诱导ROS水平,建立体外细胞氧化应激模型后,流式细胞分析术分别检测空白对照组Vehicle+Vehicle,H2O2+Vehicle 组,H2O2+Cu,Zn-SOD组,H2O2+hPP10-Cu,Zn-SOD组4组细胞凋亡的情况。
1.2.11 RT-qPCR分析
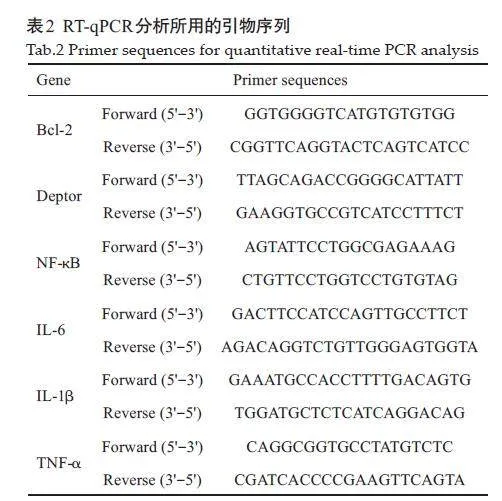
使用Trizol 试剂盒提取细胞中的总RNA,然后采取RT-qPCR检测抗凋亡因子Bcl2、Mcl1、Deptor,促凋亡因子Bad、P21、P27的表达情况,以及α核因子κB(NFκB),促炎性因子IL-1β、IL-6、TNF-α等的表达情况,引物见表2。
1.2.12 DCFH-DA探针检测细胞内ROS含量
取对数生长期的HEK293细胞接种于6孔板中过夜(同1.3.9分组),去上清,PBS 漂洗3次,每孔加入胰酶1 mL,收集细胞,离心弃上清,将细胞重悬于DCFH-DA 稀释液(1∶1000)中,混匀,置在37 ℃、CO2的细胞培养箱中孵育20 min。1500 r/min,4 ℃离心3~4 min,沉淀细胞,弃上清。用无血清培养基洗涤3次,流式细胞仪定量细胞中ROS的含量。1500 r/min,4 ℃离心3~4 min,沉淀细胞,弃上清。重悬细胞后上多功能微孔板检测仪分析,488 dm激发,525 nm发射。
1.2.13 TPA诱导的皮肤炎症及组织样本的收集与实验
20只8周大的雌性裸鼠购自珠海百试通生物科技有限公司(许可证号SCXK(粤)2020-0051)。局部应用TPA诱导小鼠耳部皮肤炎症,设计4 组体内实验(5 只/组):Vehicle+Vehicle组、TPA+Vehicle组、TPA+Cu,Zn-SOD组、TPA+hPP10-Cu,Zn-SOD组。10 μg TPA溶解于20 μL丙酮,涂于小鼠耳部内外表面,2次/d,连续3 d。TPA处理1 h 后Cu,Zn-SOD、hPP10-Cu,Zn-SOD融合蛋白局部涂于小鼠耳部。第4天处死小鼠,每只小鼠取直径为8 mm的穿孔收集组织进行实验分析。PBS 洗涤耳部组织,Trizol 试剂盒从20 mg 样品中提取总RNA,RTqPCR检测NFκB,IL-1β、IL-6、TNF-α等的表达情况,并Western blot分析NFκB p65,p-NFκB p65,IL-1β、TNF-α等的活化或蛋白表达情况。本研究动物实验经南方医科大学深圳医院实验动物伦理委员会批准(批准号:NO.2023-0359)。
1.2.14 免疫组化分析
60 ℃烤箱烤片30 min,二甲苯和梯度酒精脱蜡,过氧化氢去除内源性过氧化酶,EDTA或柠檬酸钠高压修复,5% BSA 37 ℃封闭,TNF-α和p-NFκB p65单克隆抗体4 ℃孵育,羊抗鼠二抗37 ℃孵育,DAB显色,清水终止,苏木素复染,盐酸酒精分化和流水冲洗返蓝和树胶封片,在显微镜下观察并拍照。
1.3 统计学分析
使用SPSS22.0统计软件进行数据分析。数据采用均数±标准差表示,两组比较采用t检验,Plt;0.05时认为差异有统计学意义。
2 结果
2.1 pET15b-Cu,Zn-SOD、pET15b-hPP10-Cu,Zn-SOD重组质粒的构建和鉴定
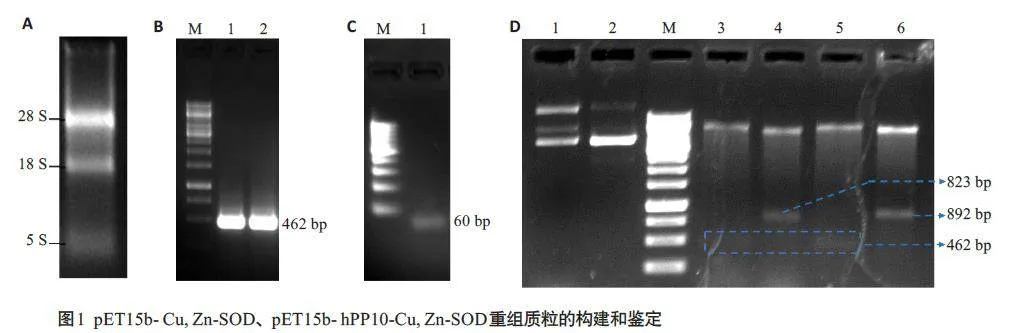
质粒构建结果显示:获得HEK293 细胞总RNA(图1A);反转录PCR获得人Cu,Zn-SOD基因片段,大小约为462 bp(图1B);获得hPP10的基因片段,大小约为60 bp(图1C);重组质粒pET15b-Cu,Zn-SOD经XhoⅠ、BamHⅠ和NcoⅠ、Hind Ⅲ两组酶切反应得到基因片段大小约为462 bp、823 bp;重组质粒pET15b- hPP10-Cu,Zn-SOD经XhoⅠ、BamHⅠ和NcoⅠ、HindⅢ两组酶切反应得到基因片段大小约为462 bp、892 bp(图1D)。经上海生工测序证实重组质粒构建成功,且无突变。
2.2 Cu, Zn-SOD、hPP10-Cu, Zn-SOD 融合蛋白的表达、纯化及鉴定
SDS-PAGE结果显示:在18 000 和25 000 附近出现Cu,Zn-SOD、hPP10-Cu,Zn-SOD 融合蛋白强表达带,并获得咪唑透析的天然融合蛋白及尿素透析的变性融合蛋白(图2)。
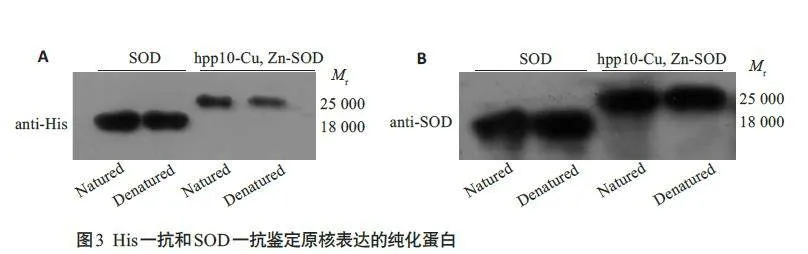
Western blotting 结果显示:融合蛋白Cu,Zn-SOD和hPP10-Cu,Zn-SOD大小正确,且无杂带(图3A、B)。
2.3 hPP10-Cu,Zn-SOD融合蛋白能有效的穿透并进入Hela、HEK293细胞内
免疫荧光结果显示:在HEK293细胞中2.5 μmol/L天然hPP10-Cu,Zn-SOD融合蛋白处理组较Cu,Zn-SOD蛋白已有明显的红色荧光,5 μmol/L 天然hPP10-Cu,Zn-SOD融合蛋白处理组红色荧光强度更明显(图4)。
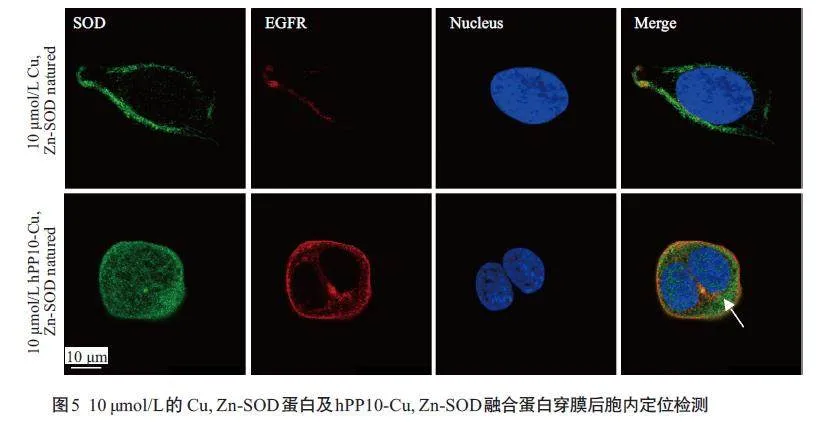
荧光共定位实验结果显示:在HEK293 细胞中,10 μmol/L hPP10-Cu,Zn-SOD融合蛋白处理组较Cu,Zn-SOD蛋白处理组有明显的代表SOD的胞内绿色荧光,其主要位于代表膜蛋白EGFR的红色荧光之内(图5)。
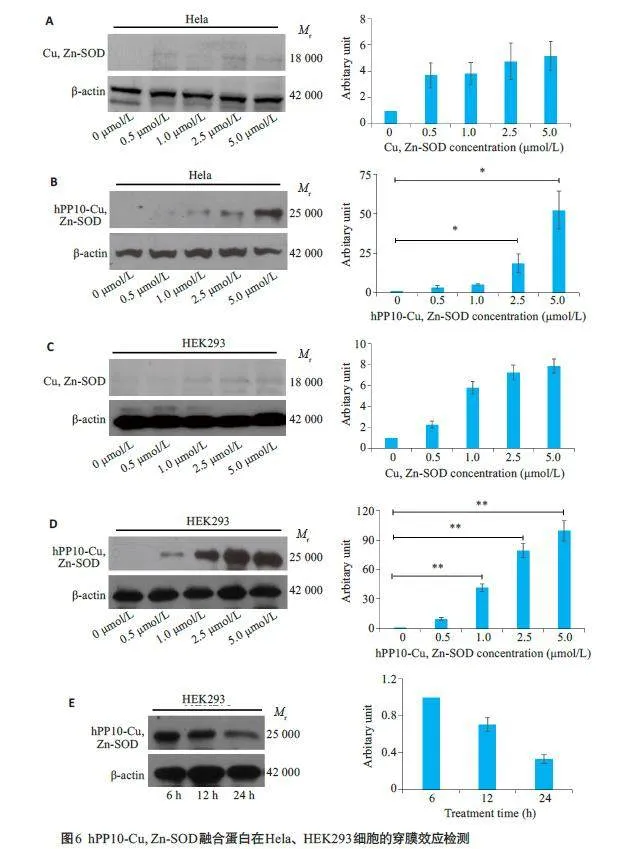
Western blotting结果显示:在Hela细胞(图6A、B)和HEK293细胞(图6C、D)中,随着hPP10-Cu,Zn-SOD融合蛋白浓度的增大,其穿膜能力有显著提高;而Cu,Zn -SOD融合蛋白处理组并不能有效的穿膜进入细胞内。同时,hPP10-Cu,Zn-SOD融合蛋可以在HEK293细胞中可持续存在24 h以上(图6E)。
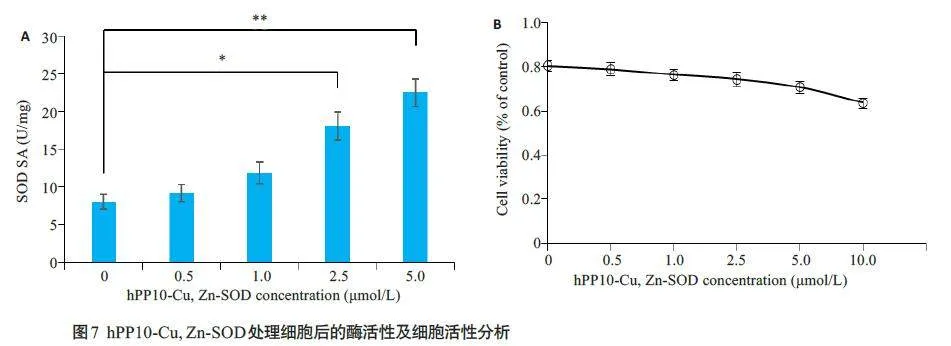
2.4 hPP10-Cu,Zn-SOD入胞后保持有意义的酶活力且其毒副作用小
SOD 酶活力实验结果显示:随着hPP10-Cu,Zn-SOD处理浓度的提高,细胞内SOD酶活力也一致的提高,其中5 μmol/L浓度组的Cu,Zn-SOD酶活力提高最明显(图7A)。MTT实验结果显示:在一定浓度范围内hPP10-Cu,Zn-SOD长时间处理后活细胞数量依然保持在80%以上,对细胞的活性影响甚微(图7B)。
2.5 hPP10-Cu,Zn-SOD入胞后抗凋亡、抗氧化能力
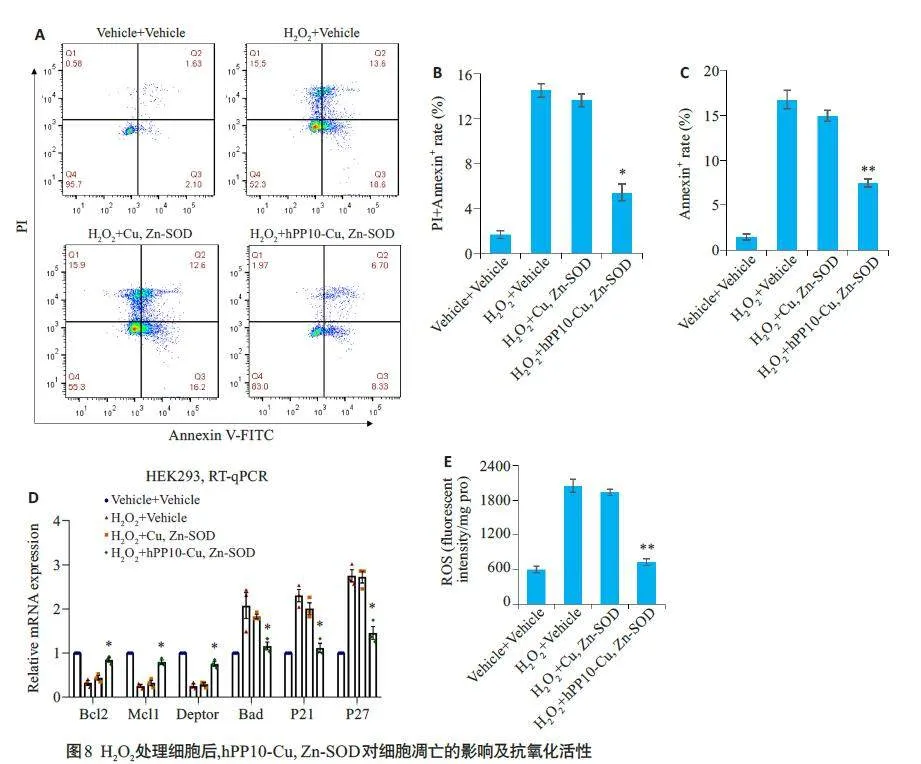
FCM结果显示:hPP10-Cu,Zn-SOD融合蛋白入胞后,显著抑制了细胞早期凋亡和晚期凋亡现象的发生(图8A~C)。RT-qPCR结果显示hPP10-Cu,Zn-SOD融合蛋白入胞后,显著提高了抗凋亡因子Bcl2、Mcl1、Deptor的表达,抑制了促凋亡因子Bad、P21、P27的表达(图8D)。ROS检测结果显示:hPP10-Cu,Zn-SOD融合蛋白入胞后,细胞的氧自由基含量显著下降(图8E)。
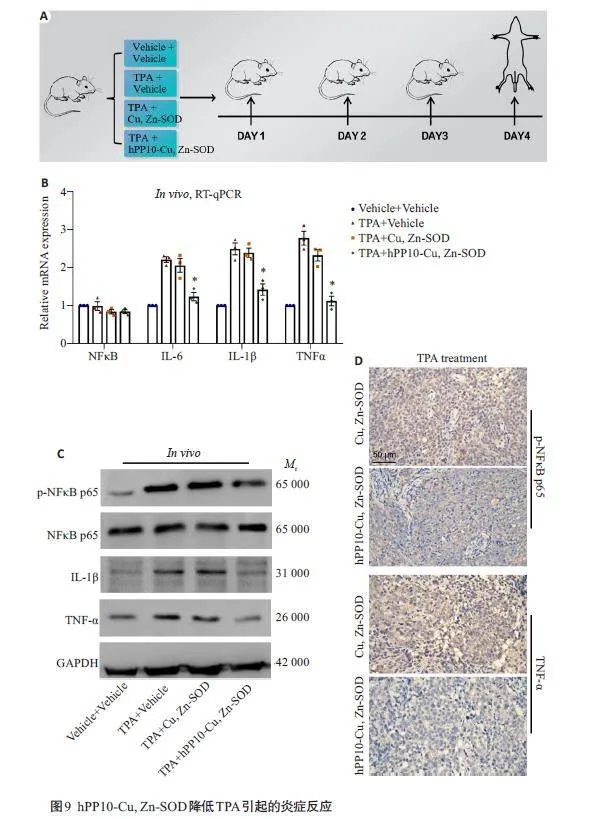
2.6 hPP10-Cu,Zn-SOD对TPA诱导的小鼠耳部炎症的抗炎作用
RT-qPCR结果显示:hPP10-Cu,Zn-SOD可显著降低小鼠体内炎性因子的表达,差异有统计学意义(Plt;0.05,图9B)。Western blotting 结果显示:TPA+Vehicle组和TPA+Cu,Zn-SOD 组耳部组织中p-NFκB p65、IL-1β、TNFα表达升高;而TPA+hPP10-Cu,Zn-SOD组炎性因子的表达有所下降(图9C)。免疫组化结果显示:hPP10-Cu,Zn-SOD 处理组降低了炎性因子p-NFκBp65及TNFα的表达(图9D)。
3 讨论
氧化应激被认为是ROS生成和抗氧化防御之间的平衡受损,与皮肤衰老及炎症反应的发生有关。SOD是胞内核心的自由基清除剂,其中Cu,Zn-SOD在人体内占比80%,且最为稳定,在抗氧化过程的早期发挥作用,其在疾病治疗、化妆品业中具有广阔的前景[27,28]。然而,Cu,Zn-SOD相对分子质量大,外源补充难以进入细胞内发挥作用,利用基因工程表达穿膜肽介导的Cu,Zn-SOD融合蛋白成了当下的研究热点。皮肤的衰老机制复杂,目前多数学者认为ROS过多引发氧化损伤是核心机制之一。据报道,SOD2低表达会引发果蝇的嗅觉衰老加快[29];SOD模拟物可抑制自由基并减轻衰老引起的认知障碍[30];适当浓度的PTD-Cu,Zn-SOD乳膏可有效减少氧化损伤,缓解D-半乳糖诱导的亚急性衰老模型,防治皮肤衰老[23]。本研究中hPP10-Cu,Zn-SOD处理组显著降低了ROS含量,提高了氧化应激初期细胞的抗氧化能力,这与上述研究结果一致。不同的是,PTD是病毒源的跨膜转导结构域,免疫原性和安全性还是存在一定风险。而本研究所用的hPP10源于人类细胞核蛋白,赖氨酸特异性去甲基酶4A的一段多肽序列,可携带蛋白、核酸跨膜进入细胞,是安全有效的跨膜运输载体[25]。
炎症是许多疾病的主要驱动因素,炎症介质在各种疾病的发展过程中起着至关重要的作用[31]。NFκB引发和放大炎症过程中涉及的主要信号通路,在炎性发生中起着核心作用,直接参与1L-1β、1L-6、TNF-α等炎性基因的调控与表达[32]。有报道称银屑病[33]作为一种慢性炎症性皮肤病,ROS表达增多,发病机制可能与NF-κB炎性通路失调有关。TPA诱导的小鼠耳部炎性模型[5]中,利用变性TAT-SOD融合蛋白(避免金属离子影响酶活及考虑成本因素)局部涂抹可抑制促炎性细胞因子表达,被认为是通过调控NFκB信号通路的表达实现的。本研究亦证实了TPA可导致ROS的过量产生从而诱导炎性反应,而且hPP10-Cu,Zn-SOD融合蛋白有效清除ROS,降低了NFκB 信号通路中p-NFκB p65、IL-1β、TNFα的表达,抑制NFκB信号通路,调节其下游基因的表达从而起到抗炎的作用。不同的是本研究咪唑透析纯化的天然条件下hPP10-Cu,Zn-SOD融合蛋白表现出更好的穿膜入胞效应,且有效减轻TPA诱导小鼠皮肤炎症。
本研究证实了融合蛋白hPP10-Cu,Zn-SOD具有较好的穿膜入胞、抗氧化、抗炎功效,且对细胞毒性微弱。并通过荧光共定位实验呈现了融合蛋白穿膜入胞后定位于细胞膜内,甚至于细胞核内。本研究和多数文献相似之一在于融合蛋白的作用均具有浓度依赖性升高,却有报道[23]指出,外源性抗氧化剂补充,钟形图或成为未来考虑的重要因素之一。与此同时,hPP10是通过何种机制介导Cu,Zn-SOD穿膜入胞的,穿膜机制尚不明确。值得注意的是,hPP10-Cu,Zn-SOD融合蛋白进入皮肤会如何代谢,效果可持续多久还待进一步研究。后续研究可以考虑制备SOD 单乳及不同浓度的hPP10-Cu,Zn-SOD乳膏,外用观察小鼠涂抹部位皮肤致敏性及安全性,hPP10-Cu,Zn-SOD融合蛋白的透皮机制、组织定位都有待探究。
综上所述,本研究成功构建了重组质粒pET15bhPP10-Cu,Zn-SOD并获得纯化蛋白,通过多种分子生物学手段证实了融合蛋白hPP10-Cu,Zn-SOD具有一定的穿膜入胞、抗氧化、抗凋亡、抗炎功效。具体的,入胞的hPP10-Cu,Zn-SOD能有效的降低H2O2刺激细胞而产生的ROS的含量,同时,在TPA诱导的炎性模型中,入胞的hPP10-Cu,Zn-SOD可能是通过抑制炎性因子NFκB活化及其相关炎症基因IL-6、IL-1β、TNFα等的表达从而起到了抗炎的效果。总之,hPP10作为一种新型人源性细胞膜穿透肽,具有较高的穿膜效率和安全性。该研究为SOD应用于护肤、人体保健和疾病治疗提供了实验基础,也为hPP10作为分子药物递送载体的应用前景提供理论依据。
参考文献:
[1] Kwon MJ, Jeon YJ, Lee KY, et al. Superoxide dismutase 3 controlsadaptive immune responses and contributes to the inhibition ofovalbumin-induced allergic airway inflammation in mice[J].Antioxid Redox Signal, 2012, 17(10): 1376-92.
[2] Teoh ML, Fitzgerald MP, Oberley LW, et al. Overexpression ofextracellular superoxide dismutase attenuates heparanase expressionand inhibits breast carcinoma cell growth and invasion[J]. CancerRes, 2009, 69(15): 6355-63.
[3] Rabbani G, Ahn SN. Structure, enzymatic activities, glycation andtherapeutic potential of human serum albumin: a natural cargo[J].Int J Biol Macromol, 2019, 123: 979-90.
[4] Culotta VC, Yang M, O’Halloran TV. Activation of superoxidedismutases: putting the metal to the pedal[J]. Biochim BiophysActa, 2006, 1763(7): 747-58.
[5] Liu TP, Chen YP, Chou CM, et al. Therapeutic evaluation of HIVtranduction basic domain-conjugated superoxide dismutasesolution on suppressive effects of the formation of peroxynitrite andexpression of COX-2 in murine skin[J]. J Biomed Sci, 2016, 23: 11.
[6] Eleutherio ECA, Silva Magalhães RS, de Araújo Brasil A, et al.SOD1, more than just an antioxidant[J]. Arch Biochem Biophys,2021, 697: 108701.
[7] 杨方瑶, 简甜甜, 蒋立翔, 等. 人源SOD1及其突变体的表达纯化及酶学性质[J]. 生物学杂志, 2023, 40(2): 20-6.
[8] Perry JJ, Shin DS, Getzoff ED, et al. The structural biochemistry ofthe superoxide dismutases[J]. Biochim Biophys Acta, 2010, 1804(2): 245-62.
[9] Green M, Loewenstein PM. Autonomous functional domains ofchemically synthesized human immunodeficiency virus tat transactivatorprotein[J]. Cell, 1988, 55(6): 1179-88.
[10]Frankel AD, Pabo CO. Cellular uptake of the tat protein from humanimmunodeficiency virus[J]. Cell, 1988, 55(6): 1189-93.
[11] Pescina S, Ostacolo C, Gomez-Monterrey IM, et al. Cell penetratingpeptides in ocular drug delivery: state of the art[J]. J ControlRelease, 2018, 284: 84-102.
[12]Guidotti G, Brambilla L, Rossi D. Cell-penetrating peptides: frombasic research to clinics[J]. Trends Pharmacol Sci, 2017, 38(4):406-24.
[13]Yu M, Li XL, Huang XF, et al. New cell-penetrating peptide (KRP)with multiple physicochemical properties endows doxorubicin withtumor targeting and improves its therapeutic index[J]. ACS ApplMater Interfaces, 2019, 11(2): 2448-58.
[14]Wang LK, Chen HY, Wang FS, et al. The development of peptidedrugconjugates (PDCs) strategies for paclitaxel[J]. Expert OpinDrug Deliv, 2022, 19(2): 147-61.
[15]Sajid MI, Moazzam M, Stueber R, et al. Applications of amphipathicand cationic cyclic cell-penetrating peptides: significant therapeuticdelivery tool[J]. Peptides, 2021, 141: 170542.
[16]Rádis-Baptista G, Campelo IS, Morlighem JRL, et al. Cellpenetratingpeptides (CPPs): from delivery of nucleic acids andantigens to transduction of engineered nucleases for application intransgenesis[J]. J Biotechnol, 2017, 252: 15-26.
[17]Gu Q, Feng TN, Cao H, et al. HIV-TAT mediated proteintransduction of Cu/Zn-superoxide dismutase-1 (SOD1) protects skincells from ionizing radiation[J]. Radiat Oncol, 2013, 8: 253.
[18]Yoo DY, Kim DW, Chung JY, et al. Cu, Zn-superoxide dismutaseincreases the therapeutic potential of adipose-derived mesenchymalstem cells by maintaining antioxidant enzyme levels[J]. NeurochemRes, 2016, 41(12): 3300-7.
[19]Kim W, Kim DW, Yoo DY, et al. Neuroprotective effects of PEP-1-Cu, Zn-SOD against ischemic neuronal damage in the rabbit spinalcord[J]. Neurochem Res, 2012, 37(2): 307-13.
[20]王 伟, 彭 昊. 穿透肽介导的铜-锌超氧化物歧化酶1融合蛋白的抗氧化作用及对脂肪干细胞移植修复脊髓损伤的促进作用[J]. 中华实验外科杂志, 2017, 34(10): 1721-4.
[21] Jia J, Chen F, Wu Y. Recombinant PEP-1-SOD1 improves functionalrecovery after neural stem cell transplantation in rats with traumaticbrain injury[J]. Exp Ther Med, 2018, 15(3): 2929-35.
[22]孟丽华, 薛荣亮, 雷晓鸣, 等. 免疫荧光法检测融合蛋白PTD4-Cu,Zn-SOD在人星形胶质细胞中穿膜能力及保护作用[J]. 西安交通大学学报: 医学版, 2023, 44(2): 309-14.
[23]万婷婷, 魏兰璎, 程 艳, 等. SOD融合蛋白外用对皮肤自然老化的影响[J]. 中国皮肤性病学杂志, 2022, 36(4): 381-90.
[24]Ding Y, Zhao XL, Geng JP, et al. Intracellular delivery of nucleicacid by cell-permeable hPP10 peptide[J]. J Cell Physiol, 2019, 234(7): 11670-8.
[25]Wang H, Ma JL, Yang YG, et al. Efficient therapeutic delivery by anovel cell-permeant peptide derived from KDM4A protein forantitumor and antifibrosis[J]. Oncotarget, 2016, 7(31): 49075-90.
[26]赵雪丽, 宋 阳, 张 明, 等. 穿膜肽凋亡素融合蛋白诱导黑色素瘤细胞凋亡的实验研究[J]. 中国药学杂志, 2017, 52(2): 115-8.
[27]Guo JK, Xu JS, Chen TB, et al. Effects of TAT-SOD at acupoints onessential hypertension by monitoring meridians electrical potential[J]. Chin J Integr Med, 2020, 26(9): 694-700.
[28]Reigado GR, Adriani PP, dos Santos JF, et al. Delivery of superoxidedismutase by TAT and abalone peptides for the protection of skincells against oxidative stress[J]. Biotechnol Appl Biochem, 2022, 69(6): 2673-85.
[29]Paul A, Belton A, Nag S, et al. Reduced mitochondrial SOD displaysmortality characteristics reminiscent of natural aging[J]. MechAgeing Dev, 2007, 128(11/12): 706-16.
[30]Levin ED. Extracellular superoxide dismutase (EC-SOD) quenchesfree radicals and attenuates age-related cognitive decline:opportunities for novel drug development in aging[J]. CurrAlzheimer Res, 2005, 2(2): 191-6.
[31]Ben-Neriah Y. Regulatory functions of ubiquitination in the immunesystem[J]. Nat Immunol, 2002, 3(1): 20-6.
[32]Sabio G, Davis RJ. TNF and MAP kinase signalling pathways[J].Semin Immunol, 2014, 26(3): 237-45.
[33]Lee YS, Cheon IS, Kim BH, et al. Loss of extracellular superoxidedismutase induces severe IL-23-mediated skin inflammation in mice[J]. J Invest Dermatol, 2013, 133(3): 732-41.
(编辑:余诗诗)
基金项目:国家自然科学基金(81902788);深圳市科技计划(JCYJ20210324130801004);海南省重点研发项目基金(社发方向,SQ2021SHFZ0739)

