2,6-二甲氧基-1,4-苯醌通过抑制NLRP3 炎症小体活化缓解小鼠的感染性休克

摘要:目的 探究发酵小麦胚芽提取物主要活性成分2,6-二甲氧基-1,4-苯醌(DMQ)抑制NLRP3炎症小体活化并缓解小鼠感染性休克的作用机制。方法 细胞学水平: 在BMDM细胞中,经脂多糖(LPS)预处理、DMQ 干预后,利用尼日利亚菌素(Nigericin)、ATP、尿酸钠结晶(MSU)分别活化经典NLRP3炎症小体以及胞内转染LPS活化非经典NLRP3炎症小体。利用聚脱氧腺苷酸(Poly A:T)活化AIM2炎症小体。在THP-1细胞中,利用Nigericin活化经典NLRP3炎症小体,通过Western blotting和ELISA方法测定NLRP3炎症小体活化产物的表达水平。蛋白分子水平:利用免疫共沉淀探究DMQ阻断NLRP3炎症小体活化的具体机制。动物水平:将8 周龄雄性C57BL/6J 小鼠随机分为空白对照组、感染性休克LPS 组、DMQ 20 mg/kg 治疗组、DMQ 40 mg/kg治疗组,6只/组,待DMQ治疗组小鼠预注射相应浓度DMQ后,对照组小鼠注射无菌PBS,其余3组小鼠腹腔注射相同剂量LPS,利用ELISA检测DMQ干预对LPS诱导的小鼠感染性休克模型中血清和腹腔灌洗液中TNF-α和IL-1β分泌水平的影响。DMQ预处理后注射LPS观察记录小鼠36 h内的生存状态并绘制生存曲线。结果 DMQ可有效抑制小鼠BMDM细胞和人THP-1细胞中经典NLRP3炎症小体活化(Plt;0.05),在小鼠BMDM细胞中对非经典NLRP3炎症小体活化也起到有效抑制作用(Plt;0.05),DMQ对AIM2炎症小体活化无影响(Pgt;0.05)。进一步实验结果揭示DMQ可阻断ASC和NLRP3之间的相互作用。DMQ治疗组可显著降低小鼠血清和腹腔液中IL-1β的分泌水平(Plt;0.05)并延长小鼠生存时间(Plt;0.05)。结论 发酵小麦胚芽提取物主要活性成分DMQ通过阻断ASC和NLRP3之间的相互作用有效抑制NLRP3炎症小体活化并缓解LPS诱导的小鼠感染性休克。
关键词:2,6-二甲氧基-1,4-苯醌;NLRP3 炎症小体;感染性休克;发酵小麦胚芽提取物
核苷酸结合寡聚化结构域受体蛋白3(NLRP3)小体是由NOD样受体家族中NLRP3、接头蛋白ASC和效应蛋白caspase-1 前体组成的一类多聚蛋白复合物[1]。
NLRP3 炎症小体是先天免疫系统的一个重要组成部分,普遍存在于免疫细胞中,它在多种刺激下(如微生物感染和细胞损伤)通过激活caspase-1,促进炎性细胞因子IL-1β/IL-18的分泌,从而介导炎症反应,同时还可剪切GSDMD进而诱导细胞焦亡[2]。NLRP3 炎症小体的正常活化对维持机体稳态至关重要[3]。NLRP3炎症小体失调可导致大量炎性因子分泌,参与多种疾病的发生和发展,例如神经退行性疾病、代谢紊乱疾病、自身免疫炎性疾病与心血管疾病,其中包括癫痫[4]、酒精性肝炎[5]、慢性粒细胞白血病[6]和动脉粥样硬化[7]等。NLRP3炎症小体与多种炎性相关疾病的发生和发展有关。目前 NLRP3炎症小体相关疾病的临床治疗以IL-1β为靶点[8],例如IL-1β抑制剂Canakinumab。但是靶向IL-1β的治疗手段存在具有非特异性和局限性的弊端,因此筛选出一种特异性好且作用显著的NLRP3炎症小体抑制剂尤为重要。
发酵小麦胚芽提取物,商品名为爱维麦(Avamer),是一种在2002年在匈牙利被注册为可应用于癌症患者的特殊营养品。有研究表明爱维麦具有独特的抗癌的作用[9]。爱维麦可导致肿瘤细胞中MHC Ⅰ类蛋白的下调,增加NK细胞识别、杀伤转移性肿瘤细胞的敏感性,可在化疗、手术、放疗后抑制转移性肿瘤的扩散和增殖[10]。除此之外,在人HT29 结肠癌细胞中,爱维麦可抑制细胞的核糖核苷酸还原酶活性,诱导细胞凋亡[11]。天然化学物质2,6-二甲氧基-1,4-苯醌(DMQ)是发酵小麦胚芽提取物中的主要生物活性成分[12],存在于各种植物中,可以调节多种生物过程,例如电子传递活性[13]和氧化磷酸化[14]。DMQ通过调节AKT/mTOR信号通路和增强线粒体功能来增加骨骼肌质量和性能,可能有助于骨骼肌萎缩的治疗和预防[15]。据报道,DMQ具有良好的抗炎活性,能剂量依赖性地抑制LPS诱导的NO生成[16]。DMQ还具有显著的抗肿瘤活性,对TPA诱导的皮肤致癌作用有预防作用[16]、对4-(甲基亚硝胺)-1-(3-吡啶基)-1-丁酮(NNK)诱导的小鼠肺肿瘤有明显抑制作用[17],还可以抑制胃癌细胞生长和诱导胃癌细胞凋亡。DMQ可以降低胃癌细胞中的mTOR信号通路Ki-67、磷酸化mTOR和磷酸化p70S6K的表达,是一种新型mTOR蛋白激酶抑制剂[18]。除此之外,DMQ在脂肪生成抑制中也发挥重要作用,可显著降低各种脂肪形成转录因子的表达,包括过氧化物酶体增殖物激活受体-γ(PPARs-γ),CCAAT/增强子结合蛋白α(CEBPα)以及脂肪细胞蛋白2(aP2)和脂肪酸合酶[19]。以上研究表明,DMQ对炎症、肿瘤以及脂肪生成均表现出良好的抑制效果,鉴于NLRP3炎症小体在恶性肿瘤、高脂诱发的2型糖尿病等疾病发生发展过程中发挥重要作用,但目前尚未有DMQ对NLRP3 炎症小体活化影响的报道。因此,本研究通过体内外实验探究发酵小麦胚芽提取物主要活性成分DMQ对NLRP3炎症小体活化的影响,以期为NLRP3炎症小体相关炎性疾病的治疗提供潜在的药物治疗方案。
1 材料和方法
1.1 实验动物和细胞株
6~8周龄的SPF级C57BL/6J雄性小鼠购自江苏集萃药康生物科技股份技术有限公司,所有小鼠均饲养于无特定病原体(SPF)环境,温度22~24℃,光照时间为8:00~22:00,保持光照循环14 h光照10 h黑暗,定期观察小鼠生活状态,及时调整饲养条件,实验严格按照实验动物管理规范进行。急性单核细胞白血病细胞系(THP-1)购自武汉普诺赛生命科技有限公司。本研究所有动物实验均经蚌埠医科大学伦理委员会审核批准(伦动科批字[2020]第57号)。
1.2 试剂
2,6-Dimethoxy-1,4-benzoquinone(上海陶术生化,纯度99.46%);高糖DMEM培养基;RPMI 1640 培养基;OPTI-MEM培养基;胎牛血清(Gibco);红细胞裂解液、NP-40 裂解液(Beyotime);巨噬细胞集落刺激因子(M-CSF)(Navoprotein);尼日利亚菌素(Nigericin,MCE);三磷酸腺苷(ATP)、尿酸钠结晶(MSU)(Sigma);聚脱氧腺苷酸(Poly A:T)、脂多糖(LPS)、三酰酯肽(Pam3CK4)、佛波醇(PMA)、Lipofectamine2000(Invitrogen);ELISA试剂盒(Mouse IL-1β、TNF-α、IL-6,Human IL-1β ELISA kit)(Ramp;D);Anti-mouse caspase-1(p20)、Anti-NLRP3(AdipoGen);Anti-mouse IL-1β(Ramp;D)、Anti- β-actin(Proteintech);Anti-human p20、Anti-IgG、Anti-ASC(Cell Signaling Technology) ;Protein G Agarose(Merck)。
1.3 细胞提取与培养
小鼠骨髓来源巨噬细胞(BMDM)的获取与培养:首先选取SPF级6~8周龄的雄性小鼠,经颈脱臼法处死后,浸泡酒精消毒,取腿骨存放于1.5 mL EP管,在经紫外灭菌超30 min 的超净工作台中剪去腿骨两端,用20 mL注射器吸取DMEM培养基反复冲洗获取腿骨中的细胞,离心后快速弃掉上清,根据细胞量加入2~3 mL红细胞裂解液,静置裂解2~3 min,于完全DMEM培养基中加入M-CSF 用于分化细胞,置于细胞培养箱并及时观察细胞生长状态。BMDM细胞呈细长梭形贴壁生长,通过流式细胞术鉴定巨噬细胞表面标志物(F4/80+CD11b+)。THP-1细胞的复苏与培养:从液氮中取出冻存的THP-1细胞,在37 ℃水浴锅快速化冻,皿中提前加入1640完全培养基,离心后弃上清,重悬之后分入各皿中,置于细胞培养箱培养并及时观察细胞生长状态。
1.4 细胞刺激
镜下观察细胞生长密度和分化状态,选取生长状态良好的BMDM/THP-1细胞,接种至12孔细胞培育板培养过夜。LPS(100 ng/mL)预处理4 h 后加入不同剂量DMQ,30 min 后加入多种经典NLRP3 炎症小体的激活剂,如Nigericin、ATP 和MSU。其中Nigericin 活化25 min、ATP活化35 min、MSU活化3.5 h。对于非经典NLRP3 炎症小体,我们首先用Pam3CK4(200 ng/mL)对BMDM细胞预处理3.5 h后,胞内转染LPS(2 μg/mL)活化非经典NLRP3 炎症小体。LPS(100 ng/mL)预处理4 h 后,Poly A:T(1 μg/mL)胞内转染4 h 活化AIM2炎症小体。
1.5 酶联免疫吸附实验(ELISA)
将捕获抗体稀释后包被于固相载体上,室温孵育过夜,PBST洗板洗去未结合捕获抗体。加入封闭液孵育2 h,PBST洗板去除残余封闭液。加入待测样本(细胞上清液/血清/腹腔灌洗液)孵育1.5 h,PBST洗板去除未结合样本。加入检测抗体孵育1 h,PBST洗板去除未结合检测抗体。加入辣根过氧化物酶(HRP),避光孵育25 min,PBST洗板去除多余HRP。加入底物TMB后等待显色,10 min后加入10%H2SO4终止反应,5 min内于450 nm处读取吸光度,绘制标准曲线并计算各细胞因子分泌水平。
1.6 Western blotting检测
检测caspase-1(p20)和IL-1β蛋白分子的表达:首先收集细胞上清液,离心弃细胞沉淀,利用甲醇氯仿法提取蛋白,加入1.5×Sample Buffer,金属浴10 min。检测Pro-caspase-1(Pro-casp1)、Pro-IL-1β蛋白表达:向细胞培养板中加入1.5×Sample Buffer,裂解后收集至1.5 mL EP管中,100 ℃金属浴10 min。电泳步骤:首先根据蛋白分子量选择适当浓度的聚丙烯酰胺凝胶,之后将蛋白转印到经甲醇激活的PVDF膜上,室温条件下用5 %BSA封闭1 h,使用PBST洗除残余BSA。随后,加入一抗抗体并于4 ℃条件孵育过夜,次日PBST洗去未结合一抗抗体。加入二抗抗体在室温条件下孵育1.5 h,PBST洗去未结合二抗抗体,及时使用凝胶成像系统对条带进行显影。
1.7 免疫共沉淀
选取生长状态良好的BMDM细胞接种至6 孔板中,用LPS进行预刺激,3 h后加DMQ于37 ℃温箱孵育30 min,加入Nigericin 活化NLRP3 炎症小体。待细胞活化后弃上清,加入NP-40裂解液充分裂解细胞,离心取上清,分为Input 组和IP 组。Input 组直接加入5×Sample Buffer,于100 ℃金属浴煮10 min。IP组加入相应抗体(Anti-IgG/Anti-NEK7/Anti-ASC),转盘4 ℃过夜。离心10 min弃上清加入Beads(Protein G),转盘于4 ℃条件孵育1 h,离心弃上清后加入5×Sample Buffer,金属浴10 min。
1.8 构建动物模型
1.8.1 构建小鼠感染性休克模型
挑选SPF级8周龄、体质量在20~21 g 的雄性C57BL/6J 小鼠随机分组(6 只/组):空白对照组(Control组)、感染性休克组(LPS组)、DMQ 20 mg/kg 治疗组(LPS+DMQ 20 mg/kg)和DMQ40 mg/kg治疗组(LPS+DMQ 40 mg/kg)。DMQ治疗组小鼠腹腔注射DMQ(20 mg/kg、40 mg/kg) 50 min 后,Control组小鼠注射无菌PBS,另外3组小鼠腹腔注射等剂量的LPS(20 mg/kg),4 h后摘眼球取血、室温静置3 h离心获得眼球血上层血清。颈脱臼法处死小鼠,用1 mL注射器收集小鼠腹腔灌洗液。ELISA检测各组小鼠血清和腹腔灌洗液中炎性细胞因子IL-1β和TNF-α分泌水平。
1.8.2 绘制生存曲线
用两种浓度(20 mg/kg、40 mg/kg)的DMQ预处理小鼠50 min 后,注射LPS 后观察各组小鼠36 h 内的死亡时间和存活率,使用GraphPadPrism 8.0软件绘制模型生存曲线。
1.9 统计学分析
数据分析和生存曲线的绘制均使用GraphPadPrism 8.0 软件完成。所有数据结果以均数±标准差表示,并采用独立样本t 检验来分析两组数据的差异,生存曲线采用Log-rank 法比较,Plt;0.05 为差异有统计学意义。
2 结果
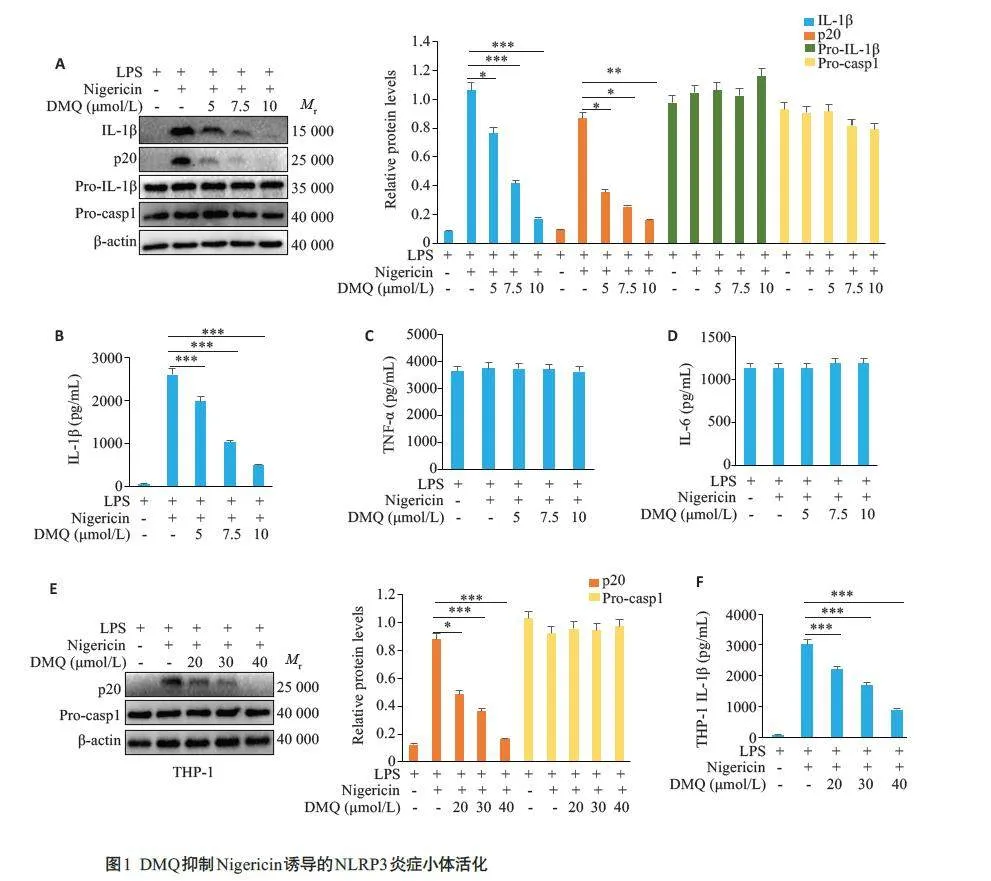
2.1 DMQ抑制Nigericin 诱导的经典NLRP3 炎症小体活化
在鼠BMDM细胞中,Western blotting检测结果显示,IL-1β和p20蛋白表达随DMQ增加呈剂量依赖性的降低趋势(Plt;0.05,图1A),但对Pro-IL-1β和Pro-casp1蛋白表达无影响(Pgt;0.05,图1A)。ELISA结果显示,IL-1β的分泌可随DMQ增加呈剂量依赖性的抑制趋势(Plt;0.05,图1B),但对NF-κB信号通路产生的促炎细胞因子TNF-α和IL-6的分泌无显著影响(Pgt;0.05,图1C、D)。在人THP-1 细胞中,Western blotting 结果显示,p20 蛋白表达随DMQ剂量增加呈降低趋势(Plt;0.05,图1E),但对Pro-casp1 的蛋白表达无显著影响(Pgt;0.05,图1E)。ELISA结果显示,IL-1β的分泌可被DMQ剂量依赖性地抑制(Plt;0.05,图1F)。
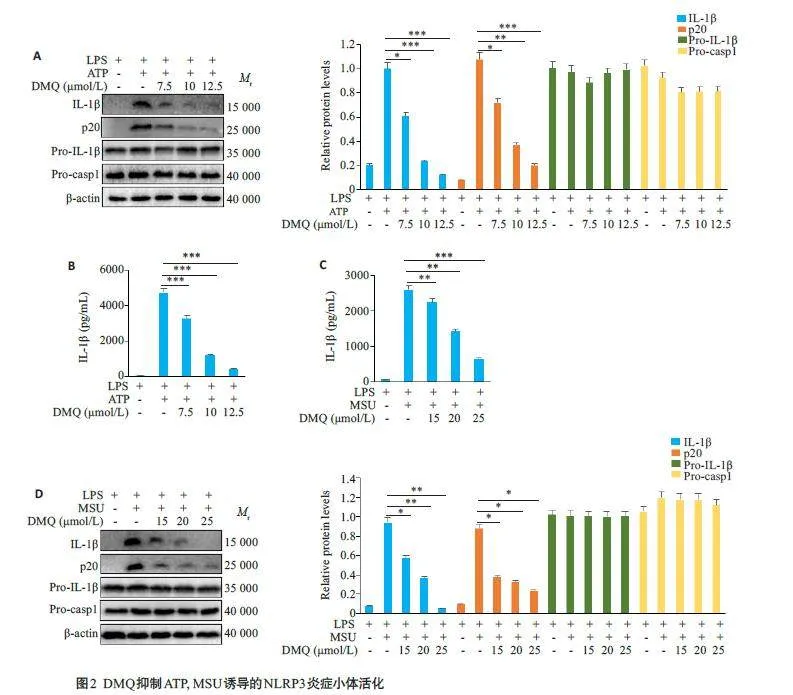
2.2 DMQ抑制ATP、MSU诱导的经典NLRP3炎症小体活化
Western blotting 结果显示,IL-1β和p20 蛋白表达随DMQ剂量增加而降低(Plt;0.05,图2A),但对Pro-IL-1β和Pro-casp1蛋白的表达差异无统计学意义(Pgt;0.05,图2A)。ELISA 结果显示,在ATP、MSU 诱导经典NLRP3炎症小体活化后,IL-1β的分泌可随DMQ增加呈剂量依赖性的抑制趋势(Plt;0.05,图2B、C)在MSU诱导经典NLRP3 炎症小体活化后,Western blotting 结果显示,IL-1β和p20蛋白表达随DMQ增加呈剂量依赖性的降低趋势(Plt;0.05,图2D),但对Pro-IL-1β、Pro-casp-1蛋白的表达差异无统计学意义(Pgt;0.05,图2D)。
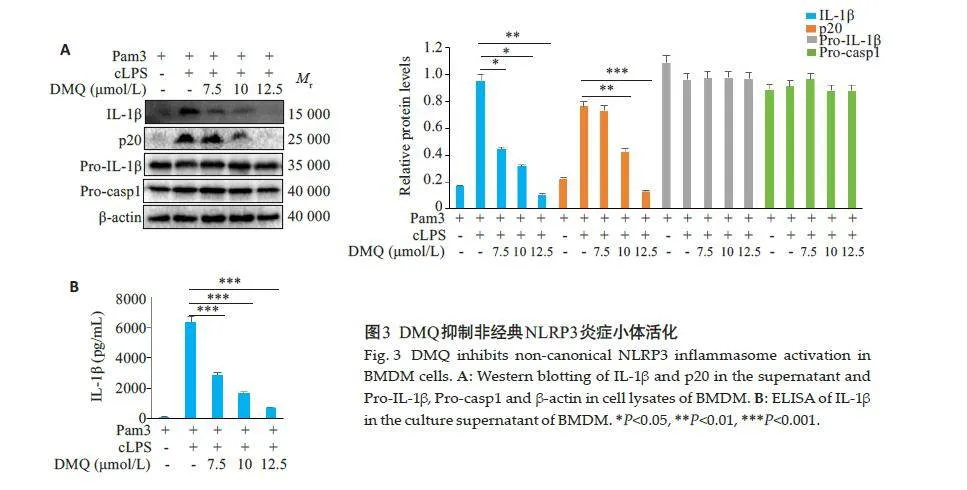
2.3 DMQ抑制胞内转染LPS诱导的非经典NLRP3 炎症小体
Western blotting 结果显示,IL-1β和p20 蛋白表达随DMQ增加呈剂量依赖性的抑制趋势(Plt;0.05,图3A),但对Pro-IL-1β和Pro-casp1 蛋白的表达差异无统计学意义(Pgt;0.05,图3A)。ELISA结果显示,IL-1β的分泌可随DMQ增加,呈剂量依赖性的抑制趋势(Plt;0.05,图3B)。
2.4 DMQ对Poly A:T诱导的AIM2炎症小体无影响
Western blotting 结果显示,与DMQ 抑制Nigericin 活化的NLRP3炎症小体相比,DMQ对AIM2炎症小体活化产生的各组分蛋白表达差异无统计学意义(Pgt;0.05,图4A~E)。ELISA结果显示,DMQ可显著抑制Nigericin 诱导的IL-1β分泌,但对Poly A:T 诱导的IL-1β分泌无抑制作用(Pgt;0.05,图4F)。
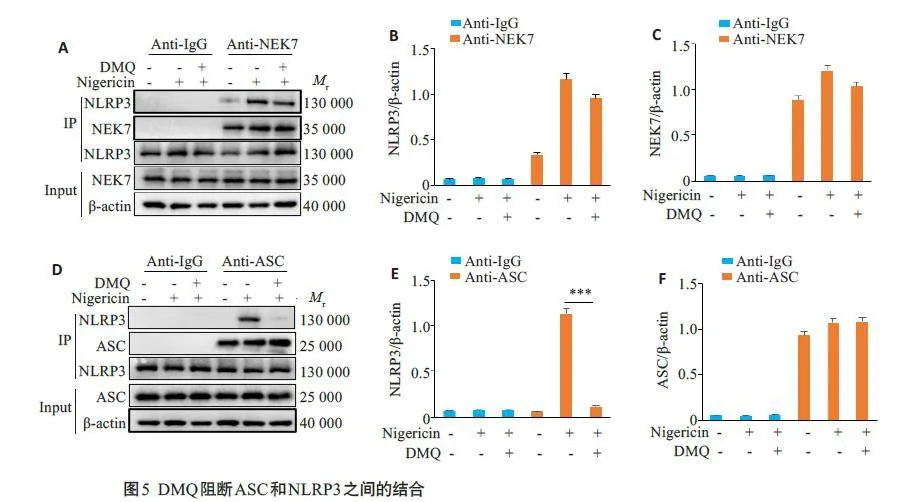
2.5 DMQ抑制NLRP3和ASC的相互作用
免疫共沉淀结果显示,NEK7、ASC与NLRP3存在相互作用,加入DMQ未能阻断NLRP3和NEK7之间的相互作用(Pgt;0.05,图5A~C),但可显著抑制下游NLRP3和ASC之间的相互作用(Plt;0.05图5D~F)。
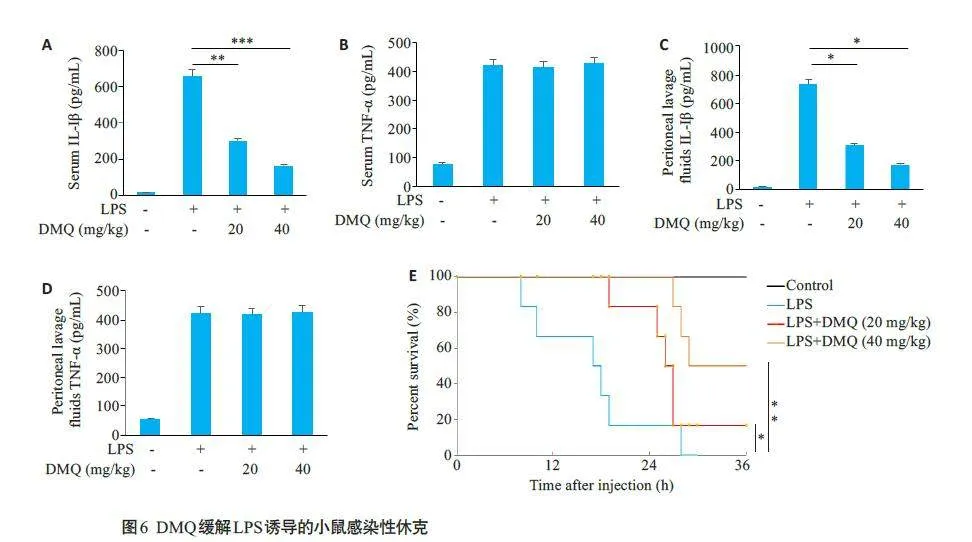
2.6 DMQ可有效缓解LPS诱导的小鼠感染性休克
ELISA结果显示,与空白对照组相比,腹腔注射LPS 可导致感染性休克组小鼠血清和腹腔灌洗液中IL-1β、TNF-α的分泌明显增加,DMQ治疗组中小鼠血清和腹腔灌洗液中IL-1β的分泌水平随DMQ浓度增加呈而下降(Plt;0.05,图6A、C),但对TNF-α的分泌水平无影响(Pgt;0.05,图6B、D)。DMQ给药50 min后腹腔注射LPS,观察并及时记录小鼠36 h 内生存状态。结果显示,感染性休克组小鼠于第10 h开始死亡,29 h时小鼠全部死亡。DMQ 20 mg/kg 治疗组于25 h 开始有小鼠死亡(Plt;0.05,图6E),DMQ 40 mg/kg 治疗组于28 h 开始有小鼠死亡(Plt;0.05,图6E)。
3 讨论
NLRP3炎症小体在人类先天免疫系统扮演着不可或缺的角色,其正常活化对维持机体稳态至关重要,激活caspase-1并促进Pro-IL-1β和Pro-IL-18剪切为成熟的IL-1β和IL-18,以响应微生物感染和细胞损伤[20, 21],但其异常失调可导致大量炎性因子释放并引发多种炎性相关疾病,如感染性休克[22]、冷吡啉相关周期性综合征[23]、类风湿关节炎[24]和缺血性中风[25]等,因此,靶向抑制NLRP3炎症小体活化可以成为干预相关炎性疾病的新思路[26]。
小麦胚芽含有多种矿物质和微量元素以及人体必需的营养物质,具有高营养、低毒性、易获取的优点。由于小麦胚芽易受氧化影响,为方便保存,日常食用的小麦在加工过程中基本去除了富含营养的胚芽,造成多种营养素流失。被去除的小麦胚芽多作为副产品或用于制作动物饲料,故深度开发和有效利用小麦胚芽资源尤为重要。近年来对于发酵小麦胚芽提取物的研究主要集中在其抗癌方面,对其抗炎功效研究不足。
当机体感受到病原微生物或其他危险信号的攻击时,NLRP3炎症小体被活化从而介导炎症反应,维持机体免疫稳态[27]。本研究利用Nigericin活化NLRP3炎症小体,通过检测Pro-casp1、Pro-IL-1β 和活化后的caspase-1(p20)以及IL-1β 分泌水平来观察DMQ 对NLRP3 炎症小体活化的影响,明确DMQ 可以抑制NLRP3炎症小体的活化,但不影响Pro-IL-1β、Pro-casp1蛋白表达水平,相比于其他mTOR抑制剂如红景天苷(Salidroside)对Nigericin 抑制浓度为50 μmol/L[28],醌类化合物如大黄素(Emodin)对Nigericin抑制浓度约为50 μmol/L[29],DMQ仅在10 μmol/L浓度就表现出更显著的抑制作用。此外, DMQ在经典NLRP3 炎症小体的激活剂ATP、MSU诱导的NLRP3炎症小体活化中也表现出良好的抑制效果,证明了DMQ抑制NLRP3炎症小体活化的非单一性。Caspase-11 可通过识别胞内LPS 激活非经典NLRP3 炎症小体[30],实验结果表明,DMQ同样可以抑制非经典NLRP3炎症小体的活化。
AIM2 炎症小体和NLRP3 炎症小体一样,可以活化caspase-1,在抗病毒免疫反应中起重要作用[31],为探究DMQ对NLRP3炎症小体的作用是否具有特异性,利用DMQ干预Poly A:T激活AIM2炎症小体,实验结果表明DMQ对AIM2炎症小体激活并无抑制作用,表明DMQ仅特异性抑制NLRP3炎症小体活化。
免疫共沉淀结果显示,DMQ可有效抑制NLRP3和ASC之间的结合,但对NEK7 和NLRP3 之间的结合无抑制作用,表明DMQ可直接影响NLRP3炎症小体组装活化。
在LPS 诱导的小鼠感染性休克模型中,LPS 使炎性细胞因子IL-1β和TNF-α的分泌显著增加,DMQ在20 mg/kg的浓度即可降低IL-1β的分泌水平,有效缓解小鼠感染性休克,延长小鼠生存时间。与天然产物二氢丹参酮Ⅰ缓解小鼠感染性休克的效果相比,DMQ在40 mg/kg药物浓度时效果更明显,小鼠存活率高于二氢丹参酮Ⅰ[32]。DMQ对于TNF-α的分泌水平无显著影响。以上结果表明DMQ可有效缓解NLRP3炎症小体介导的感染性休克,提示DMQ有作为治疗NLRP3炎症小体相关疾病候选药物的潜力。
综上所述,DMQ能够有效地抑制多种刺激剂在鼠BMDM细胞和人THP-1 细胞中诱导的NLRP3 炎症小体活化,阻断ASC和NLRP3 之间的相互作用,进而影响NLRP3炎症小体的组装和活化过程,缓解LPS诱导的小鼠感染性休克。本研究结果表明,DMQ对调节NLRP3 炎症小体活化中有着明显抑制作用,这为日后探索进一步DMQ抑制NLRP3炎症小体活化的作用机制提供了实验依据,有利于更好的深度开发和有效利用小麦胚芽的资源,同时为感染性休克及其他NLRP3炎症小体相关炎性疾病了治疗提供新的选择和思路。
参考文献:
[1] Paik S, Kim JK, Silwal P, et al. An update on the regulatorymechanisms of NLRP3 inflammasome activation[J]. Cell MolImmunol, 2021, 18: 1141-60.
[2] Toldo S, Mezzaroma E, Buckley LF, et al. Targeting the NLRP3inflammasome in cardiovascular diseases[J]. Pharmacol Ther,2022, 236: 108053.
[3] Pan HM, Jian YT, Wang FJ, et al. NLRP3 and gut microbiotahomeostasis: progress in research[J]. Cells, 2022, 11(23): 3758.
[4] Palumbo L, Carinci M, Guarino A, et al. The NLRP3 inflammasomein neurodegenerative disorders: insights from epileptic models[J].Biomedicines, 2023, 11(10): 2825.
[5] 马婷婷, 马 骁. NLRP3炎症体在肝脏疾病中的作用及研究进展[J].临床消化病杂志, 2022, 34(5): 395-9.
[6] Hurtado-Navarro L, Cuenca-Zamora EJ, Zamora L, et al. NLRP3inflammasome activation and symptom burden in KRAS-mutatedCMML patients is reverted by IL-1 blocking therapy[J]. Cell RepMed, 2023, 4(12): 101329.
[7] Takahashi M. NLRP3 inflammasome as a key driver of vasculardisease[J]. Cardiovasc Res, 2022, 118(2): 372-85.
[8] Dinarello CA, van der Meer JW. Treating inflammation by blockinginterleukin-1 in humans[J]. Semin Immunol, 2013, 25(6): 469-84.
[9] Boros LG, Nichelatti M, Shoenfeld Y. Fermented wheat germ extract(Avemar) in the treatment of cancer and autoimmune diseases[J].Ann N Y Acad Sci, 2005, 1051: 529-42.
[10]Telekes A, Resetar A, Balint G, et al. Fermented wheat germ extract(avemar) inhibits adjuvant arthritis[J]. Ann N Y Acad Sci, 2007,1110: 348-61.
[11] Saiko P, Ozsvar-Kozma M, Madlener S, et al. Avemar, a nontoxicfermented wheat germ extract, induces apoptosis and inhibitsribonucleotide reductase in human HL-60 promyelocytic leukemiacells[J]. Cancer Lett, 2007, 250(2): 323-8.
[12]Otto C, Hahlbrock T, Eich K, et al. Antiproliferative andantimetabolic effects behind the anticancer property of fermentedwheat germ extract[J]. BMC Complement Altern Med, 2016,16: 160.
[13]Sanchez-Cruz P, Garcia C, Alegria AE. Role of quinones in theascorbate reduction rates of S-nitrosoglutathione[J]. Free RadicBiol Med, 2010, 49(9): 1387-94.
[14]Gómez-Toribio V, García-Martín AB, Martínez MJ, et al. Enhancingthe production of hydroxyl radicals by Pleurotus eryngii via quinoneredox cycling for pollutant removal[J]. Appl Environ Microbiol,2009, 75(12): 3954-62.
[15]Yoo A, Jang YJ, Ahn J, et al. 2, 6-Dimethoxy-1, 4-benzoquinoneincreases skeletal muscle mass and performance by regulating AKT/mTOR signaling and mitochondrial function[J]. Phytomedicine,2021, 91: 153658.
[16]Kamiya T, Tanimoto Y, Fujii N, et al. 2, 6-Dimethoxy-1, 4-benzoquinone, isolation and identification of anti-carcinogenic, antimutagenicand anti-inflammatory component from the juice of Vitiscoignetiae[J]. Food Chem Toxicol, 2018, 122: 172-80.
[17]Arimoto-Kobayashi S, Sasaki K, Hida R, et al. Chemopreventiveeffects and anti-tumorigenic mechanisms of 2, 6-dimethoxy-1, 4-benzoquinone, a constituent of Vitis coignetiae Pulliat (crimsonglory vine, known as yamabudo in Japan), toward 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone (NNK)-induced lungtumorigenesis in A/J mice[J]. Food Chem Toxicol, 2021, 154:112319.
[18]Zu XY, Ma XL, Xie XM, et al. 2, 6-DMBQ is a novel mTORinhibitor that reduces gastric cancer growth in vitro and in vivo[J]. JExp Clin Cancer Res, 2020, 39(1): 107.
[19]Son HJ, Jang YJ, Jung CH, et al. 2, 6-dimethoxy-1, 4-benzoquinoneinhibits 3T3-L1 adipocyte differentiation via regulation of AMPKand mTORC1[J]. Planta Med, 2019, 85(3): 210-6.
[20]Fu J, Wu H. Structural mechanisms of NLRP3 inflammasomeassembly and activation[J]. Annu Rev Immunol, 2023, 41: 301-16.
[21]Akbal A, Dernst A, Lovotti M, et al. How location and cellularsignaling combine to activate the NLRP3 inflammasome[J]. CellMol Immunol, 2022, 19(11): 1201-14.
[22]Rathinam VAK, Zhao Y, Shao F. Innate immunity to intracellular LPS[J]. Nat Immunol, 2019, 20: 527-33.
[23]Spel L, Martinon F. Inflammasomes contributing to inflammation inarthritis[J]. Immunol Rev, 2020, 294(1): 48-62.
[24]Werner LE, Wagner U. Calcium-sensing receptor-mediated NLRP3inflammasome activation in rheumatoid arthritis andautoinflammation[J]. Front Physiol, 2022, 13: 1078569.
[25]Zhu H, Jian ZH, Zhong Y, et al. Janus kinase inhibition amelioratesischemic stroke injury and neuroinflammation through reducingNLRP3 inflammasome activation via JAK2/STAT3 pathwayinhibition[J]. Front Immunol, 2021, 12: 714943.
[26]Fusco R, Siracusa R, Genovese T, et al. Focus on the role of NLRP3inflammasome in diseases[J]. Int J Mol Sci, 2020, 21(12): 4223.
[27]Wang LX, Ren W, Wu QJ, et al. NLRP3 inflammasome activation: atherapeutic target for cerebral ischemia-reperfusion injury[J]. FrontMol Neurosci, 2022, 15: 847440.
[28]Chai YH, Cai YW, Fu Y, et al. Salidroside ameliorates depression bysuppressing NLRP3-mediated pyroptosis via P2X7/NF- κB/NLRP3signaling pathway[J]. Front Pharmacol, 2022, 13: 812362.
[29]Han JW, Shim DW, Shin WY, et al. Anti-inflammatory effect ofemodin via attenuation of NLRP3 inflammasome activation[J]. Int JMol Sci, 2015, 16(4): 8102-9.
[30]Schmid-Burgk JL, Gaidt MM, Schmidt T, et al. Caspase-4 mediatesnon-canonical activation of the NLRP3 inflammasome in humanmyeloid cells[J]. Eur J Immunol, 2015, 45(10): 2911-7.
[31]Cridland JA, Curley EZ, Wykes MN, et al. The mammalian PYHINgene family: phylogeny, evolution and expression[J]. BMC EvolBiol, 2012, 12: 140.
[32]Wei ZY, Zhan XY, Ding KX, et al. Dihydrotanshinone I specificallyinhibits NLRP3 inflammasome activation and protects against septicshock in vivo[J]. Front Pharmacol, 2021, 12: 750815.
(编辑:余诗诗)
基金项目:国家自然科学基金(82071775);安徽省自然科学基金(2108085QH349);慢性疾病免疫学基础与临床安徽省重点实验室开放课题基金(AHIAI2022K01);安徽省科研编制计划优秀青年科研项目(2022AH030140);蚌埠医学院2023 年度研究生科研创新计划项目(Byycx23070);2022 年安徽省大学生创新创业训练计划项目(S202210367134)

