蛋白4.1R对肝细胞HL-7702 增殖、凋亡以及糖酵解的影响


摘要:目的 探究蛋白4.1R对肝细胞增殖、凋亡以及糖酵解的影响,并初步阐明其分子机制。方法 以肝细胞株HL-7702为材料,利用CRISPR/Cas9技术构建4.1R-/- HL-7702细胞株。设置对照组为正常培养的4.1R+/+ HL-7702细胞,实验组为4.1R-/- HL-7702细胞。细胞在培养24、48以及72 h时,分别用CCK-8及EdU-488染色,然后利用酶标仪以及流式细胞术检测细胞的增殖能力。细胞经Annexin V-FITC/PI染色后,流式细胞术检测HL-7702细胞在培养24、48以及72 h时的凋亡水平。利用生化试剂盒分别检测HL-7702 细胞葡萄糖摄取量、乳酸分泌量以及ATP生成的变化。pH计检测培养48 h HL-7702 细胞上清培养基的pH值。qRT-PCR检测HL-7702 细胞糖酵解过程关键调节酶HK2、PFKL、PKM2 以及LDHA的mRNA表达量。Western blotting 检测AMPK、p-AMPK、Raptor以及p-Raptor的蛋白表达量。结果 Western blotting以及基因测序结果表明4.1R-/- HL-7702细胞株构建成功。与对照组相比,4.1R-/-组的CCK-8和EdU-488实验结果均显示HL-7702细胞的增殖能力降低;细胞凋亡实验结果表明,4.1R-/- HL-7702 细胞凋亡水平升高。蛋白4.1R的缺失导致HL-7702 细胞葡萄糖摄取量(Plt;0.05)、乳酸分泌量(Plt;0.001)、ATP生成(Plt;0.001)下降,细胞上清培养基pH值(Plt;0.01)升高。qRT-PCR实验结果表明糖酵解过程关键调节酶的mRNA表达量均下降(Plt;0.001)。相较于HL-7702 细胞,4.1R-/- HL-7702 细胞的AMPK和Raptor 蛋白表达量下降,p-AMPK和p-Raptor 蛋白表达量升高。结论 蛋白4.1R的缺失导致HL-7702 细胞增殖能力降低、凋亡水平增加,糖酵解过程被抑制,其调控机制与下游AMPK-mTORC1信号通路的激活密切相关。
关键词:蛋白4.1R;肝细胞;增殖与凋亡;糖酵解
肝脏主要由肝细胞、胆管上皮细胞、肝星状细胞、库普弗细胞以及肝窦内皮细胞组成[1],其中肝细胞含量最高,占总重量的70%~85%[2]。肝脏作为人体重要的代谢器官,与糖、脂以及蛋白质代谢密切相关。肝脏能量代谢异常会促进胰岛素抵抗、糖尿病以及非酒精性脂肪肝等疾病的发生,严重影响人类健康和生活质量[3, 4]。在糖代谢方面,肝脏起着维持机体血糖水平相对稳定的重要作用,而葡萄糖代谢作为机体提供能源的初级代谢途径,与其他代谢密切相关。过去对糖代谢的研究多关注于胞内信号分子的调控,随着研究的深入,发现一些能够向胞内传递信号的膜蛋白也参与代谢调控。因此,挖掘新型糖代谢关键调控分子,能够为寻找诊断或治疗代谢紊乱相关疾病的新靶点提供新思路。
蛋白4.1R是最早发现于成熟红细胞中的一种膜骨架蛋白[5],具有4个保守结构域[6, 7],可与细胞质膜上的多种蛋白结合或相互作用,参与多种免疫细胞的活化与代谢。已有研究表明,敲低蛋白4.1R可以增强K562细胞的糖酵解能力[8]。课题组前期研究发现,在LPS诱导的巨噬细胞中,蛋白4.1R缺失能够促进细胞的糖酵解过程[9]。以上研究结果提示,蛋白4.1R可能参与调控细胞糖代谢,而肝细胞作为糖代谢的主要场所,蛋白4.1R在其中所起到的功能尚不清楚。本研究基于CRISPR/Cas9 技术构建4.1R-/- HL-7702 细胞株,通过检测蛋白4.1R对糖酵解过程的影响,初步探究蛋白4.1R调控肝细胞糖代谢重编程的分子机制,为研究肥胖、糖尿病等肝脏糖代谢异常相关疾病的发病机制或治疗手段提供理论支持。
1 材料和方法
1.1 材料
肝细胞株HL-7702 与敲除质粒px330-mCherry 由本实验室保存。
EdU-488 细胞增殖检测试剂盒、ATP检测试剂盒、Beta Actin Polyclonal antibody、EPB41 Polyclonalantibody、HRP- 山羊抗兔IgG、AMPK Alpha 2Polyclonal antibody(武汉三鹰),Lipofectamine 2000(赛默飞),Cell Counting Kit-8(上海陶术生物科技),Annexin V-FITC/PI 细胞凋亡检测试剂盒(翌圣生物),Phospho-AMPK alpha 2(Thr172) Rabbit pA (翌圣生物),重组Anti-Raptor 抗体(Abcam),Phospho-Raptor(Ser792)Antibody(CST),UltraSYBR Mixture(康为世纪),葡萄糖测定试剂盒及乳酸测试盒(南京建成生物工程)。
1.2 方法
1.2.1 敲除质粒载体的构建
根据4.1R基因的CCDS序列利用在线网站(https://bioinfogp. cnb. csic. es/tools/breakingcas/index.php)设计sgRNA,从中筛选出3条评分较高、特异性较好的sgRNA序列(表1),在两端加上相应的接头序列后,将其插入至敲除质粒载体px330-mCherry中,再进行测序验证。
1.2.2 HL-7702细胞培养及转染
HL-7702细胞用含有10% FBS 的RPMI 1640 培养基培养,将生长状态良好的细胞铺至合适的培养皿中,待细胞密度长至80%左右时进行转染。转染过程参考Lipofectamine™ 2000试剂说明书,转染48 h后在倒置荧光显微镜下观察转染效果并收集细胞。
1.2.3 4.1R-/- HL-7702细胞株的构建及验证
流式细胞仪分选出成功转入敲除质粒并表达mCherry标签蛋白的细胞,细胞经扩大培养后,采用Western blotting检测3个敲除质粒的敲除效果。选取敲除效率较高的一组细胞,有限稀释法获取单克隆细胞株,采用Westernblotting及基因测序检测敲除效果。
1.2.4 CCK-8 检测细胞增殖
将细胞按照3000/孔的密度接种至96孔板中,分别在细胞培养24、48、72 h时添加CCK-8,每孔10 μL,随后放至细胞培养箱中孵育1~4 h,酶标仪检测吸光值A450 nm。
1.2.5 流式细胞术检测细胞增殖与凋亡
细胞增殖实验是利用胸腺嘧啶脱氧核苷类似物EdU,并通过点击反应使其标记Alexa Fluor 488来完成的,步骤参考EdU-488细胞增殖检测试剂盒说明书。细胞凋亡实验是基于Annexin V-FITC/PI 染色来完成的,步骤参考AnnexinV-FITC/PI 细胞凋亡检测试剂盒说明书。
1.2.6 qRT-PCR和Western blotting 检测相关基因或蛋白表达水平
qRT-PCR实验:取适量生长状态良好的细胞,提取RNA,反转录为cDNA,根据UltraSYBRMixture 染料配制反应体系并加至实时荧光定量PCR板中进行PCR反应,最后得到的Ct值采用2-ΔΔCt算法计算相对表达量。基因引物(表2)由北京擎科生物合成。Western blotting 实验:提取细胞总蛋白,根据蛋白浓度统一上样量,10% SDS-PAGE 电泳完成后将其转至PVDF膜上,封闭液封闭,一抗(4.1R 1∶6000;β‑actin 1∶5000;AMPK 1∶2000;p-AMPK 1∶1000;Raptor 1∶5000;p-Raptor 1∶1000)4 ℃孵育过夜,TBST 洗膜,二抗(1∶10 000)室温孵育1.5 h,TBST洗膜,均匀涂抹ECL发光液后,用凝胶成像仪显影。
1.2.7 细胞培养基pH值的检测
将相同数量的细胞铺至6 孔板中,培养48 h 后收集细胞上清,用校准液校准pH计,合格后进行pH值的测量。
1.2.8 葡萄糖、乳酸、ATP水平检测
细胞内葡萄糖水平的检测:收集适量细胞,在冰浴条件下用超声破碎仪进行细胞破碎,取上清配制葡萄糖反应体系,多功能酶标仪检测样品在505 nm处的吸光值。细胞分泌乳酸水平的检测:收集细胞上清培养基,稀释适当倍数后,配制乳酸反应体系,多功能酶标仪检测样品在530 nm处的吸光值。细胞内ATP水平的检测:细胞裂解液裂解细胞后,取上清,配制ATP检测工作液,用具有luminometer功能的酶标仪检测发光值,根据标准曲线计算样品ATP 浓度。
1.3 统计学分析
采用Excel、GraphPad Prism 8.0.2、Image J、SnapGene、FlowJo_V10 以及Visio 等软件分析数据或制图。实验中需统计分析的数据均进行了独立重复,计量资料以均数±标准差表示,两组样本之间的比较采用t检验,3组及以上样本之间的比较采用单因素方差分析。以Plt;0.05为差异有统计学意义。
2 结果
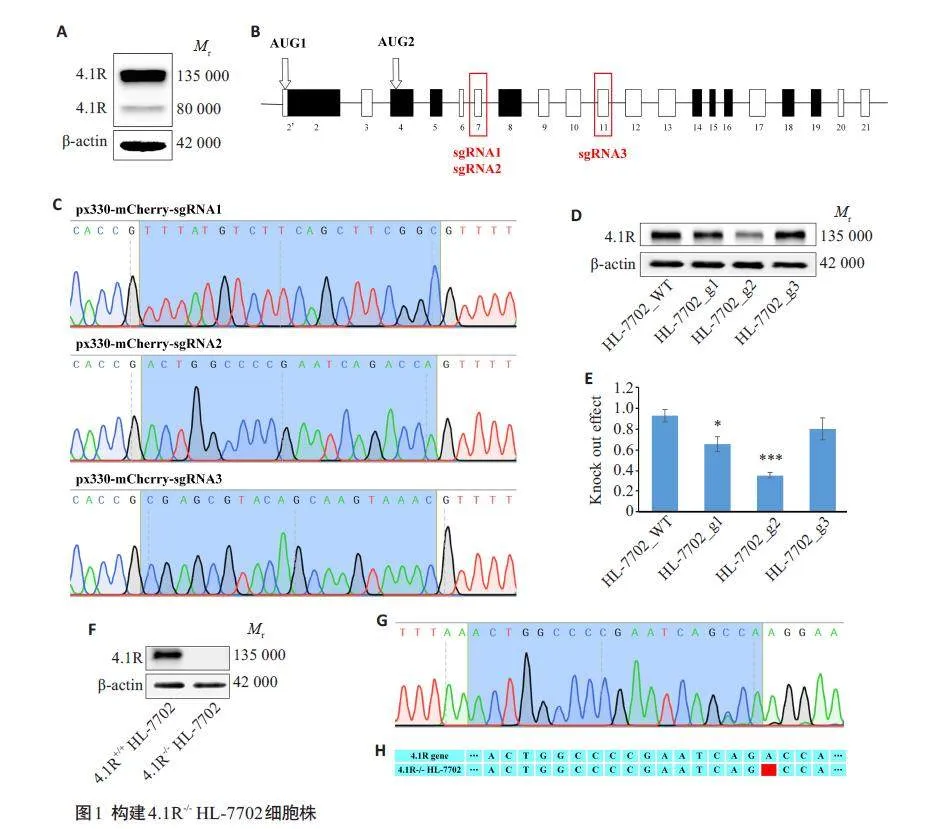
2.1 构建4.1R-/- HL-7702细胞株
Western blotting结果显示,在HL-7702细胞中,高表达蛋白4.1R 135 000,蛋白4.1R 80 000 表达较低(图1A)。在构建的3个敲除质粒中(图1B、C),sgRNA2序列敲除效果较好(图1D、E)。Western blotting以及基因测序结果显示135 000 4.1R-/- HL-7702单克隆细胞株构建成功(图1F~H)。
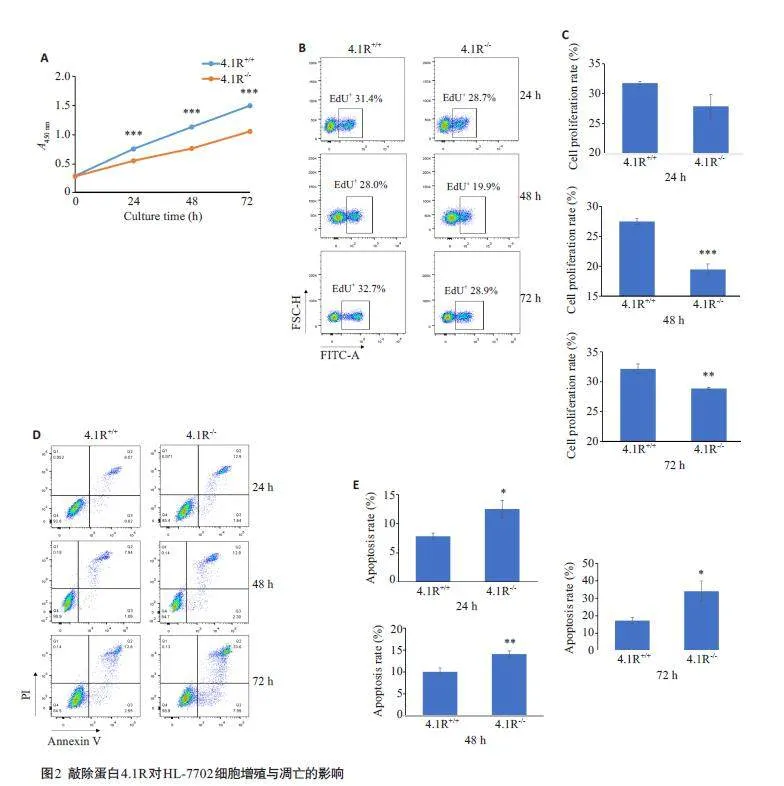
2.2 蛋白4.1R对肝细胞增殖与凋亡的影响
与对照组相比,敲除蛋白4.1R 后,HL-7702 细胞的增殖能力降低(Plt;0.05,图2A~C),凋亡水平升高(Plt;0.05,图2D、E);细胞培养72 h时,4.1R-/- HL-7702细胞早期和晚期凋亡的数量迅速增多。
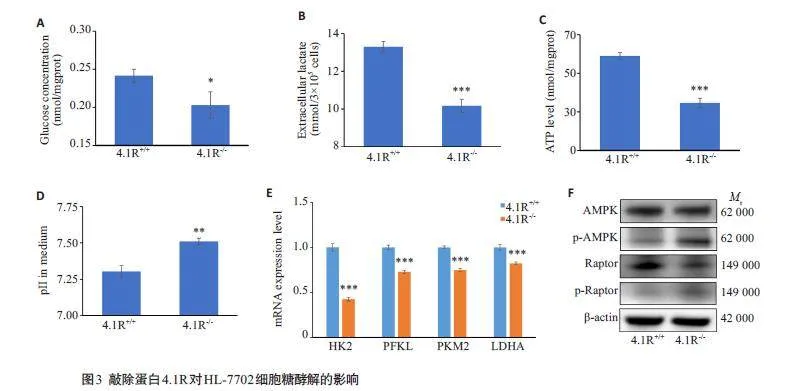
2.3 蛋白4.1R对肝细胞HL-7702糖酵解的影响
相较于对照组,4.1R-/- HL-7702细胞的葡萄糖含量(Plt;0.05,图3A)、乳酸分泌量(Plt;0.001,图3B)及ATP水平(Plt;0.001,图3C)均降低;细胞培养基的pH值升高,碱性增强(Plt;0.01,图3D)。qRT-PCR实验结果显示,实验组细胞的糖酵解过程关键调节酶HK2、PFKL、PKM2以及LDHA的mRNA表达量下降(Plt;0.001,图3E)。
2.4 敲除蛋白4.1R激活AMPK-mTORC1信号通路
相较于对照组,4.1R-/- HL-7702 细胞的AMPK和Raptor(mTORC1的重要组成成分)的蛋白水平降低,磷酸化水平升高(图3F)。
3 讨论
肝脏是调节多种代谢活动的枢纽,在物质代谢、解毒、促消化、免疫调节[10]以及胎儿造血等方面扮演着至关重要的角色。葡萄糖作为人体主要的能源物质,与多种代谢活动相关联。糖代谢紊乱会造成机体血糖浓度过高或过低,最终造成肥胖、糖尿病、高胰岛素血症等疾病的发生[11]。深入研究糖代谢调控分子对糖代谢疾病的诊断及治疗具有深远意义。
蛋白4.1R是一个多功能的膜骨架蛋白,除了维持细胞膜的稳定性[12],在红细胞发育[13]、肿瘤的发生发展[14, 15]以及免疫细胞活化[16, 17]等方面也起着重要作用。已有研究表明,4.1R基因作为肝癌易感基因,能够有效抑制肝癌细胞的增殖、侵袭,并促进细胞凋亡,证明蛋白4.1R在肝癌的发生发展过程中起着重要作用[15]。代谢重编程作为恶性肿瘤的标志,研究蛋白4.1R在肝脏代谢中的作用意义重大。随着研究的深入,蛋白4.1R在小鼠B细胞[18]、巨噬细胞[9]以及人慢性髓系白血病细胞[8]中参与代谢调控的作用被相继发现,但在肝细胞中的作用还未见报道。本研究通过体外实验证实,膜骨架蛋白4.1R的缺失能够影响肝细胞命运,改变细胞内的糖酵解进程,并激活下游信号通路AMPK- mTORC1。既往研究报道,蛋白4.1R对巨噬细胞以及慢性髓系白血病细胞的增殖以及糖酵解过程均起负调控作用[8, 9],在本研究中,敲除蛋白4.1R将导致肝细胞增殖能力降低,并抑制其糖酵解作用,而这种现象可能与肝细胞4.1R基因缺失所导致的细胞凋亡水平升高密切相关,尤其是在细胞培养72 h时,4.1R-/- HL-7702细胞早期以及晚期凋亡的数量急剧上升。
实验结果表明,敲除蛋白4.1R能够抑制肝细胞糖酵解过程,且细胞内AMP水平升高,ATP水平降低。当细胞内AMP/ATP水平升高时,AMPK被激活[19, 20]。被激活的AMPK可以通过直接磷酸化mTORC1的Raptor成分来抑制mTORC1 活性,导致细胞增殖与糖代谢进程减慢[21]。AMPK作为能量代谢的关键调节分子,是机体维持葡萄糖稳态所必需的[22]。mTORC1是多种信号传导过程的关键成分[23, 24],与代谢紊乱、衰老以及癌症等疾病有着密不可分的联系。既往研究表明,蛋白4.1R在BMMC细胞活化过程中对mTORC1 起正向调节作用[25],本研究结果同样表明4.1R 在肝细胞中对mTORC1也起到正向调节作用。因此,4.1R-/- HL-7702细胞增殖和糖酵解过程被抑制可能与AMPKmTORC1信号通路有关。
糖酵解过程会对肌动蛋白的细胞骨架结构特征产生影响,使得细胞代谢与周围组织的机械特性相互作用[26]。细胞机械运动与其自身的代谢密切相关[27],而膜骨架作为细胞运动的主要参与者之一发挥着重要功能。相较于既往研究,本研究从基因水平出发,更加深入地探究了膜骨架蛋白在细胞代谢中的重要作用。蛋白4.1R的4个保守结构域可以与多种跨膜蛋白相结合,比如钙调蛋白[28]、血糖蛋白C[29],以及葡萄糖转运蛋白GLUT1[30]等。有研究发现,膜骨架蛋白Band 3 能够与GLUT1 结合参与红细胞糖代谢过程[31];而GLUT作为大多数细胞摄取葡萄糖的媒介,我们猜测敲除蛋白4.1R可能通过影响GLUT的表达,进而影响细胞命运和糖代谢,而这一假设值得进一步探究。
综上所述,蛋白4.1R的缺失抑制肝细胞的增殖以及糖酵解过程,这一现象可能与下游AMPK-mTORC1信号通路的激活有关。
参考文献:
[1] Trefts E, Gannon M, Wasserman DH. The liver[J]. Curr Biol, 2017,27(21): R1147-51.
[2] Zhou Z, Xu MJ, Gao B. Hepatocytes: a key cell type for innateimmunity[J]. Cell Mol Immunol, 2016, 13(3): 301-15.
[3] Rui LY. Energy metabolism in the liver[J]. Compr Physiol, 2014, 4(1): 177-97.
[4] Ding HR, Wang JL, Ren HZ, et al. Lipometabolism andglycometabolism in liver diseases[J]. Biomed Res Int, 2018, 2018:1287127.
[5] Conboy J, Kan YW, Shohet SB, et al. Molecular cloning of protein4.1, a major structural element of the human erythrocyte membraneskeleton[J]. Proc Natl Acad Sci U S A, 1986, 83(24): 9512-6.
[6] Baines AJ, Lu HC, Bennett PM. The Protein 4.1 family: hub proteinsin animals for organizing membrane proteins[J]. Biochim BiophysActa, 2014, 1838(2): 605-19.
[7] Sun CX, Robb VA, Gutmann DH. Protein 4.1 tumor suppressors:getting a FERM grip on growth regulation[J]. J Cell Sci, 2002, 115(Pt 21): 3991-4000.
[8] 李博文. 蛋白4.1R对白血病K562细胞功能的影响及机制研究[D].郑州: 郑州大学, 2021.
[9] 桑思瑶. 蛋白4.1R 对LPS 诱导的小鼠脓毒症肝损伤的作用研究[D]. 郑州: 郑州大学, 2020.
[10]Kubes P, Jenne C. Immune responses in the liver[J]. Annu RevImmunol, 2018, 36: 247-77.
[11]Adeva-Andany MM, Pérez-Felpete N, Fernández-Fernández C, etal. Liver glucose metabolism in humans[J]. Biosci Rep, 2016, 36(6): e00416.
[12]An XL, Mohandas N. Disorders of red cell membrane[J]. Br JHaematol, 2008, 141(3): 367-75.
[13]唐治航. 蛋白4.1R对红系祖细胞增殖的影响及其在AML中的表达[D]. 郑州: 郑州大学, 2021.
[14]Yuan JP, Xing HX, Li YK, et al. EPB41 suppresses the Wnt/β-catenin signaling in non-small cell lung cancer by sponging ALDOC[J]. Cancer Lett, 2021, 499: 255-64.
[15]Yang XY, Yu DK, Ren YL, et al. Integrative functional genomicsimplicates EPB41 dysregulation in hepatocellular carcinoma risk[J]. Am J Hum Genet, 2016, 99(2): 275-86.
[16]Kang QZ, Yu Y, Pei XH, et al. Cytoskeletal protein 4.1R negativelyregulates T-cell activation by inhibiting the phosphorylation of LAT[J]. Blood, 2009, 113(24): 6128-37.
[17]Liang TT, Guo YY, Li MJ, et al. Cytoskeleton protein 4.1R regulatesB-cell fate by modulating the canonical NF- κB pathway[J].Immunology, 2020, 161(4): 314-24.
[18]梁桃桃. 蛋白4.1R对B细胞活化调控机制研究[D]. 郑州: 郑州大学, 2021.
[19]Hardie DG, Carling D, Carlson M. The AMP-activated/SNF1protein kinase subfamily: metabolic sensors of the eukaryotic cell?[J]. Annu Rev Biochem, 1998, 67: 821-55.
[20]Kemp BE, Mitchelhill KI, Stapleton D, et al. Dealing with energydemand: the AMP-activated protein kinase[J]. Trends Biochem Sci,1999, 24(1): 22-5.
[21]Mulukutla BC, Yongky A, Le T, et al. Regulation of glucosemetabolism-A perspective from cell bioprocessing[J]. TrendsBiotechnol, 2016, 34(8): 638-51.
[22]Zhang BB, Zhou GC, Li C. AMPK: an emerging drug target fordiabetes and the metabolic syndrome[J]. Cell Metab, 2009, 9(5):407-16.
[23]Saxton RA, Sabatini DM. mTOR signaling in growth, metabolism,and disease[J]. Cell, 2017, 169(2): 361-71.
[24]Liu GY, Sabatini DM. mTOR at the nexus of nutrition, growth,ageing and disease[J]. Nat Rev Mol Cell Biol, 2020, 21(4): 183-203.
[25]Draberova L, Draberova H, Potuckova L, et al. Cytoskeletal protein4.1R is a positive regulator of the FcεRI signaling and chemotaxis inmast cells[J]. Front Immunol, 2020, 10: 3068.
[26]Park JS, Burckhardt CJ, Lazcano R, et al. Mechanical regulation ofglycolysis via cytoskeleton architecture[J]. Nature, 2020, 578(7796): 621-6.
[27]Zanotelli MR, Zhang J, Reinhart-King CA. Mechanoresponsivemetabolism in cancer cell migration and metastasis[J]. Cell Metab,2021, 33(7): 1307-21.
[28]Nunomura W, Takakuwa Y, Parra M, et al. Ca(2+)-dependent and Ca(2+ ) -independent calmodulin binding sites in erythrocyte protein4.1. Implications for regulation of protein 4.1 interactions withtransmembrane proteins[J]. J Biol Chem, 2000, 275(9): 6360-7.
[29]Nunomura W, Gascard P, Takakuwa Y. Insights into the function ofthe unstructured N-terminal domain of proteins 4.1R and 4.1G inerythropoiesis[J]. Int J Cell Biol, 2011, 2011: 943272.
[30]Khan AA, Hanada T, Mohseni M, et al. Dematin and adducinprovide a novel link between the spectrin cytoskeleton and humanerythrocyte membrane by directly interacting with glucosetransporter-1[J]. J Biol Chem, 2008, 283(21): 14600-9.
[31]丁 滪, 苏 旸, 姜维华, 等. 以带3蛋白为核心的红细胞膜蛋白复合体研究[C]. 第十次中国生物物理学术大会论文摘要集. 青岛,2006: 108.
(编辑:郎 朗)
基金项目:国家自然科学基金(81870093)

