在抑郁症大鼠模型中MiRNA-103-3p 调控Rab10 促进神经细胞自噬
摘要:目的 探讨与神经保护相关的基因Rab10在抑郁症体内外模型中发挥的功能和作用机制。方法 选取36只大鼠作为慢性应激模型组(CUMS组),每只大鼠单笼饲养,进行6 周慢性不可预测温和应激,另选取12 只作为对照组。CUMS组大鼠完成6周CUMS刺激后,根据旷场实验数据和体质量分成3组(12只/组):CUMS+生理盐水组、CUMS+AAV载体组和CUMS+AAV过表达Rab10组,CUMS+saline组大鼠侧脑室注射生理盐水;CUMS+AAV组大鼠侧脑室注射AAV空病毒载体;CUMS+AAV-oe-Rab10组大鼠侧脑室注射AAV过表达Rab10载体实现Rab10基因过表达,CUMS刺激在整个实验期间持续进行。对照组大鼠始终不进行任何刺激。利用大鼠行为学指标的变化评价大鼠抑郁状态。构建CORT诱导的PC12细胞模型,CCK-8法检测细胞活力。通过TargetScan 数据库预测与Rab10 相互作用的miRNA 及miRNA 结合位点,并结合双荧光素酶和RIP 实验探究miRNA-103-3p与Rab10的相互作用。在CORT刺激的PC12细胞中过表达Rab10,或在转染miRNA-103-3p inhibitor基础上沉默Rab10,qRT-PCR法检测miRNA-103-3p和Rab10的表达水平;Western blotting检测细胞中Rab10、BDNF、CREB、p62、Beclin-1、Wnt3a、Gsk3β、磷酸化(p)-Gsk3β和β-catenin的蛋白含量。结果 病毒过表达Rab10后明显改善CUMS大鼠行为学指标(Plt;0.05)。qRT-PCR和Western blotting证实Rab10基因在CUMS大鼠海马与CORT诱导的PC12细胞中表达下调(Plt;0.05)。生物信息学结合双荧光素酶和RIP实验证实miRNA-103-3p靶向Rab10(Plt;0.05)。过表达Rab10或沉默miRNA-103-3p激活了Wnt/β-catenin信号通路,上调BDNF、CREB和Beclin-1的含量,下调p62蛋白的表达(Plt;0.05);下调miRNA-103-3p的基础上沉默Rab10逆转了miRNA-103-3p的作用(Plt;0.05)。结论 miRNA103-3p靶向Rab10激活Wnt/β-catenin信号通路,改善神经细胞的可塑性,促进细胞自噬,从而对抗CORT诱导的PC12细胞损伤。
关键词:Rab10;miRNA-103-3p;神经可塑性;自噬;抑郁症
抑郁症是一种社会-心理-生物因素相互作用,严重危害人类身心健康的常见神经精神疾病[1,2]。抑郁症的具体发病机制尚不清楚。最近研究表明,神经元自噬可能参与了抑郁症的发展进程[3]。自噬是一种溶酶体依赖的蛋白质降解途径,通过降解和回收受损的细胞器和蛋白质来维持细胞环境的动态平衡。自噬在神经发生和突触重塑中也起着重要作用[4]。由于突触可塑性的发生需要突触蛋白的组成和重建,突触蛋白的降解在这一过程中起着重要的作用[5]。研究发现,自噬可以靶向神经元蛋白质,自噬的失衡会导致错误折叠的蛋白质堆积和细胞器受损,从而导致神经元可塑性受损,进而导致神经元功能障碍甚至死亡。因此,自噬和神经可塑性可能参与了抑郁症的发生和发展[6,7]。
Rab10是Rab家族中小GTP酶家族的成员,Rab家族是囊泡运输的关键调节因子[8]。Rab10在大脑中的所有细胞类型中都有表达,且在神经发育过程中扮演着重要的角色,与神经元的形态和分化有关,在轴突发育和树突分支形成中起关键作用[9]。在神经元发育过程中,Rab10的表达对正常神经元功能的维持非常重要[10]。MicroRNA(MiRNA)是一种17~23个核苷酸的非编码短链RNA,在体内可与靶基因mRNA的3'端UTR区互补结合,抑制靶基因的表达[11]。多种芯片信息显示miR-103-3p在中枢神经系统中高表达,并在中枢神经系统基因表达调控中发挥重要作用[12]。研究发现miR-103-3p的过表达显著抑制神经细胞的增殖,并诱导神经细胞凋亡[13]。
有许多编码蛋白基因在海马、前额叶皮质、下丘脑、纹状体等各种脑组织中表达丰富,可通过影响神经元及神经胶质细胞的炎症、氧化应激、凋亡、自噬等多种进程参与抑郁症的发病与治疗,对抑郁症患者死后脑组织研究发现,前额叶皮质和海马中存在大量基因异常表达[14]。阐明基因在抑郁症中的功能及调控机制,可深入探讨抑郁症的发病机理,为临床抑郁症诊断与治疗提供依据。前期通过转录组测序发现Rab10 在对照组大鼠与抑郁大鼠海马中存在差异表达,且与神经可塑性和自噬功能有关[15]。有研究发现Rab10 是阿尔兹海默病调控网络中的关键基因,且有望成为阿尔兹海默病的治疗靶点[16]。但是目前Rab10在抑郁症中是否发挥作用,以及作用的相关机制还不清楚。本研究拟通过构建抑郁症体内外模型探究miRNA-103-3p 在CORT 诱导的PC12 细胞中调节Rab10发挥神经保护的功能和机制。
1 材料和方法
1.1 实验动物
体质量180~220 g的雄性SD大鼠48只购自中国山东济南朋悦实验动物养殖有限公司,合格编号:SCXK(LU)20190003。大鼠的饲养环境为:12 h 光照和12 h黑暗周期,温度22±2 ℃,相对湿度(50±10)%的标准实验室。实验前所有大鼠适应性饲养7 d。所有动物研究均经皖南医学院实验动物福利与伦理委员会审核批准(伦理批号:WNMC-AWE-2021205)。
1.2 主要试剂及仪器
AAV-过表达片段 Prim1(AAV-oe-Prim1,上海吉满生物科技有限公司);戊巴比妥钠粉末(Sigma);链霉素、青霉素和10% 胎牛血清(Gibco);DMEM 培养基(HyClone);皮质酮粉末,DMSO 溶液(TCI);质粒,siRNA,miRNA inhibitor,Lipofectamine 3000 转染试剂盒,双荧光素酶报告基因试剂盒,Magna RIPTM RNA结合蛋白免疫沉淀试剂盒(广州锐博生物技术有限公司);CCK 8 试剂盒(上海贝博生物科技有限公司);cDNA第一链合成试剂盒,荧光定量PCR试剂盒(北京天根生化科技有限公司);Pierce™ BCA蛋白检测试剂盒(Thermo Scientific™);Rab10 多克隆抗体,BDNF 多克隆抗体,CREB多克隆抗体,P62多克隆抗体,Beclin-1多克隆抗体,Wnt3a多克隆抗体,GSK3β多克隆抗体,磷酸化(p)-GSK 3β多克隆抗体,β-catenin 多克隆抗体(Cell Signaling Technology);山羊抗小鼠及山羊抗兔的二抗(Jackson ImmunoResearch);0.22 μm PVDF 膜(MILLEX GP);细胞培养培养箱(Thermo FisherScientific);酶联免疫检测仪,蛋白/核酸凝胶成像仪(Bio-Rad)。
1.3 慢性应激(CUMS)大鼠抑郁模型的建立
参照以往CUMS方法建立大鼠抑郁症模型[17]。刺激手段有:10 ℃冰水游泳(5 min)、潮湿垫料24 h、针扎尾部(3 次/3~5 s)、禁水禁食(24 h)、悬尾(3 次/min)、昼夜颠倒、45°倾斜鼠笼(24 h)。实验中将CUMS组大鼠单笼饲养,并从第1天开始按照随机的刺激手段对大鼠进行不可预知的刺激;另外一间安静的饲养房间中饲养对照组大鼠,饲养密度为4~5只/笼。
1.4 动物分组及处理
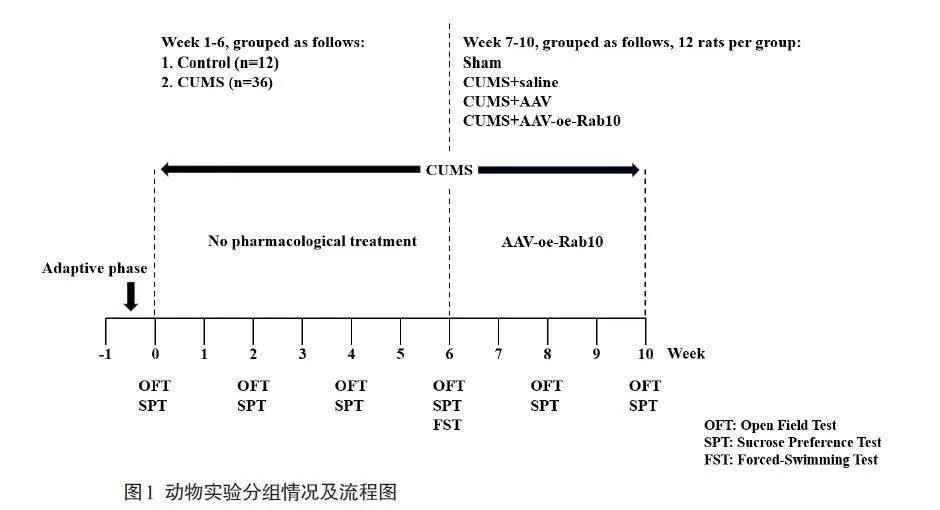
大鼠适应性喂养7 d后,进行旷场实验并称量每只大鼠的体质量,以实验结果为依据将48 只大鼠进行分组:选取36只大鼠作为CUMS组,每只大鼠单笼饲养,进行为期6周的慢性不可预测温和应激;选取12只作为对照组,在一个单独安静的环境中按照4只/笼的密度进行饲养,期间不进行任何刺激。
CUMS组大鼠完成6周的CUMS刺激后,根据旷场实验数据和体质量数据将36 只大鼠分成3 组(12 只/组):CUMS+ 生理盐水组(CUMS+saline)、CUMS+AAV 载体组(CUMS+AAV)、CUMS+AAV 过表达Rab10 组(CUMS+AAV-oe-Rab10)。CUMS+saline 组大鼠侧脑室注射生理盐水;CUMS+AAV组大鼠侧脑室注射AAV空病毒载体;CUMS+AAV-oe-Rab10 组大鼠侧脑室注射AAV过表达Rab10载体。对照组大鼠始终不进行任何刺激(sham组)。本研究第7周经侧脑室注射AAV或生理盐水处理后,大鼠休息3 d 以恢复创面(期间不进行任何刺激),CUMS 刺激在整个实验期间持续进行。其中sham组大鼠仅侧脑室注射生理盐水(图1)。
1.5 侧脑室注射
3%戊巴比妥钠溶液(现配现用)注射于大鼠腹腔内麻醉大鼠(0.2 mL/100 g),麻醉后将大鼠的身体和四肢固定于脑立体定位仪上,剔除毛发后用碘伏擦拭,用剪刀沿头顶正中线将皮肤剪开,用消毒后的颅骨钻在大鼠头部开孔(侧脑室定位注射的坐标为:以前囟点为中心,旁开1.5 mm,向后囟方向1.1 mm,深4.5 mm),开孔后使用微量注射器以0.2 μL/min 的注射速度将saline 或者AAV注入脑内,用骨蜡将小孔封闭后用碘伏擦拭小孔周围,然后用医用手术线将剪开的皮肤缝合。
1.6 行为学检测
1.6.1 体质量的称量
对大鼠的体质量进行称量,1 次/周,记录和分析大鼠每周体质量的变化。
1.6.2 旷场实验(OFT)
实验周期为每2 周1 次。将摄像头与装有动物行为学检测软件的计算机相连接,将大鼠缓慢放入自制的100 cm×100 cm×50 cm的旷场实验行为观察箱中(一般放置于正中央)。摄像头会捕捉大鼠5 min内的运动状态,并实时通过计算机里的软件自动形成大鼠的运动总距离数、站立次数和穿越格子数等数据。
1.6.3 蔗糖偏嗜度实验(SPT)
实验周期为每2周1次。1次完整的SPT实验为期4 d:第1天,给予每只大鼠2瓶1%的蔗糖水(定期更换瓶子的位置);第2天,给予每只大鼠1瓶1%的蔗糖水和1瓶自来水(定期更换瓶子的位置);第3天,不给予大鼠任何食物和水源;第4天,给予每只大鼠1瓶1%蔗糖水和1瓶自来水,并于2 h后称量每个瓶子的质量。蔗糖偏嗜度(%)=蔗糖损耗量/(蔗糖水损耗量+纯水损耗量)×100%。
1.6.4 强迫游泳实验(FST)
实验周期为每6周1次。将摄像头与装有动物行为学检测软件的计算机相连接,将大鼠置于45 cm水深的圆柱形树脂玻璃桶中。摄像头会捕捉大鼠的运动状态,并实时通过计算机里的软件自动形成大鼠5 min内的不动时间等数据。
1.7 海马组织的收集
在第10周完成大鼠行为学检测后,麻醉大鼠,分离脑区并快速地取出各只大鼠的海马组织,放置于提前标记好的EP管中,并将EP管置于液氮中短暂储存,后将其转移至-80 ℃的冰箱中储存。
1.8 细胞培养与溶液配制
来自大鼠嗜铬细胞瘤的PC12细胞系购自中国上海赛百慷生物技术有限公司。PC12细胞于含有100 μg/mL链霉素、100 U/mL青霉素和10%胎牛血清中的DMEM培养基中孵育,并在含5% CO2的37 ℃恒温培养箱中孵育。称量138.58 mg的皮质酮粉末,并在无菌条件下与DMSO溶液定容至1 mL,混合配置成400 mmol/L的母液待用。临用前用培养基将母液浓度稀释成100、200、300、400、500 μmol/L。
1.9 siRNA和质粒转染
使用Invitrogen Lipofectamine™ 3000 转染试剂盒将相应的沉默片段(siRNA)和过表达质粒转染细胞中孵育48 h。具体步骤为首先制备转染相关试剂并标记为A管和B管。A管:每孔加入5 μL lipo3000转染试剂和125 μL DMEM培养基,混合均匀,并在室温下放置5 min。B管:在每孔中,将125 μL DMEM培养基、1~2.5 μg DNA 和2~5 μL P3000(转染siRNA 不添加P3000)混合并在室温下储存5 min。将A管中的液体与B管中的液体混合均匀后缓慢加入六孔板中,置于细胞培养箱中恒温孵育48 h。应用qRT-PCR和蛋白质印迹法评估Rab10的干扰效率。
1.10 细胞活力测定和细胞形态观察
采用CCK 8 试剂盒检测CORT 对细胞活力的影响。将细胞以1.8×103 /孔的密度均匀铺在96 孔板上。孵育24 h后待细胞融合度约为50%时加入不同浓度的CORT溶液孵育24 h。弃去培养基后,添加10 μL CCK8 溶液和90 μL DMEM完全培养基。在细胞培养箱中孵育2 h后,用酶标记仪器检测细胞在450 nm处的吸光度以计算细胞活力。
1.11 双荧光素酶分析
为了构建Rab10-WT,Rab10-MUT荧光素酶报告基因,扩增了Rab10-WT,Rab10-MUT 的3'UTR区,并将其插入到pmirGLO 载体中。使用Lipofectamine ™3000 转染试剂盒将Rab10-WT或Rab10-MUT和miR-103-3p、miR-NC、anti-NC或anti-miR-103-3p 单独或共同转染到细胞中,共同孵育48 h后,用双荧光素酶报告基因检测试剂盒进行双荧光素酶报告基因分析以检测荧光素酶活性。
1.12 Anti-Ago2 RIP检测
使用Lipofectamine™ 3000 转染试剂盒将miR-NC或miR-103-3p分别转染至PC12细胞中孵育48 h,使用Magna RIPTM RNA结合蛋白质免疫沉淀试剂盒对转染的细胞进行RIP分析。然后将细胞与anti-Ago2抗体或阴性对照IgG一起孵育,并通过qRT-PCR检测Rab10的相对富集。
1.13 qRT-PCR
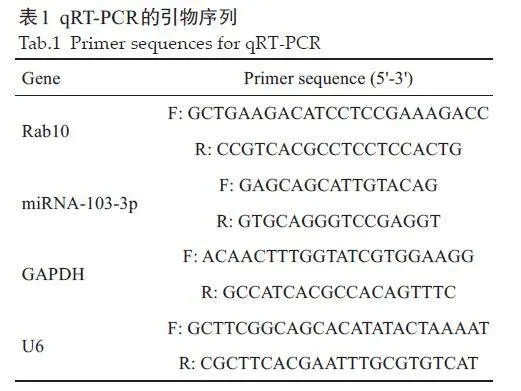
将每组细胞中提取的RNA通过逆转录试剂盒逆转录成cDNA。然后将每组cDNA 和引物与荧光定量PCR 试剂盒溶液混合后加入到96 孔板中,并置于StepOnePlus™ 实时荧光定量PCR仪中进行PCR扩增。U6 和GAPDH分别用作miRNA-103-3p 和Rab10 的内参,RNA的相对表达用2–ΔΔCt方法计算。引物序列如表1所示。
1.14 Western blotting
将各组中提取出的蛋白首先在100 ℃沸水孵育15 min,在10%~12%的十二烷基硫酸钠凝胶上进行电泳。将样品转移至聚偏二氟乙烯膜(PVDF膜)上,用5%脱脂牛奶在室温下密封1 h。然后在4 ℃下与Rab10、BDNF、CREB、p62、Beclin-1、Wnt3a、Gsk3β、p-Gsk3β,β-catenin 和β-actin 抗体孵育过夜。然后,用TBST洗膜。于相应1∶4000比例稀释的二抗中37 ℃孵育1.5 h,ECL显色,曝光、洗片,应用凝胶成像系统(Bio-Rad)对膜进行检测以显示印迹条带。
1.15 统计学分析
所有数据采用SPSS 18.0 统计软件(Armonk,IBM, New York, USA)进行处理。结果以均数±标准差表示。两组间比较采用独立样本t检验分析。3组以上比较采用单因素方差分析,LSD进行两两比较。经样本量计算及参考既往文献,每组至少有6只大鼠可满足检验功效。本研究中所展示图片由GraphPad Prism 8.0和 illustrator2018绘制。Plt;0.05为差异具有统计学意义。
2 结果
2.1 CUMS大鼠抑郁模型的建立
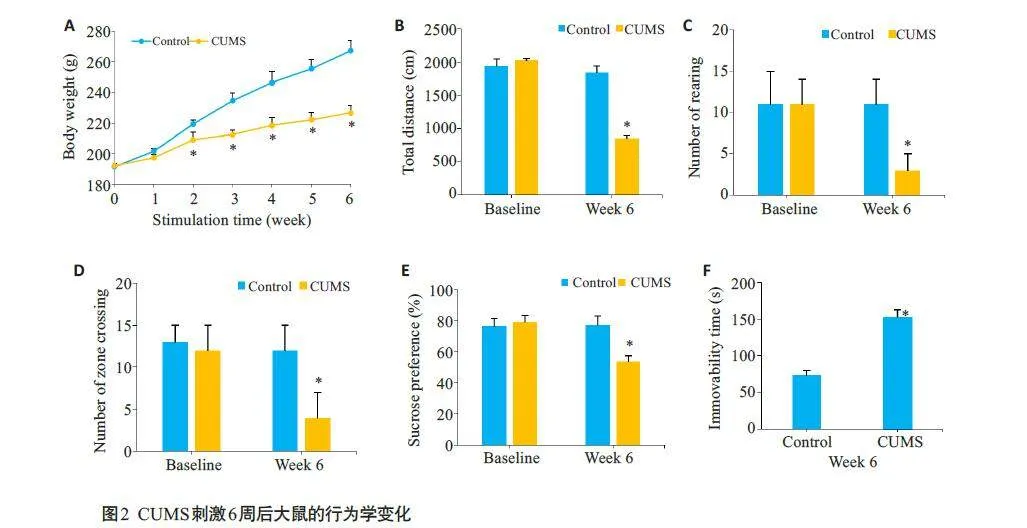
建立为期6周CUMS大鼠抑郁模型。CUMS刺激期间对照组和CUMS组的大鼠体质量均有所增加,第2~6 周对照组大鼠的体质量一直高于CUMS 组大鼠(Plt;0.05,图2A)。OFT与SPT实验显示,在基线期间,Control组和CUMS组大鼠的总距离、站立次数、穿越格子数和蔗糖偏嗜度之间的差异无统计学意义(Pgt;0.05);而6周的刺激后,CUMS组大鼠OFT与SPT实验各项指标与Control 组大鼠相比均有所下降(Plt;0.05,图2B~E)。基线期间,两组大鼠不动时间差异无统计学意义(Pgt;0.05);6周刺激后,CUMS组大鼠的不动时间比Control组大鼠显著延长(Plt;0.05,图2F)。CUMS 大鼠表现出与抑郁大鼠一致的行为特征,即CUMS大鼠抑郁模型的成功建立。
2.2 过表达Rab10对CUMS大鼠抑郁样行为的影响
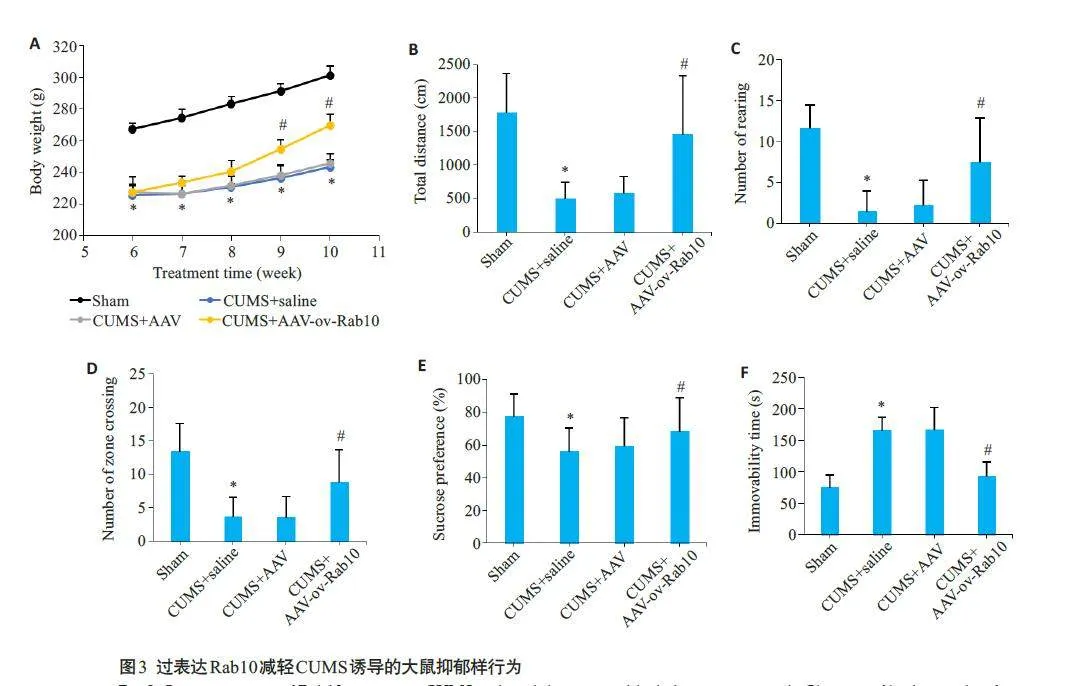
通过侧脑室注射将AAV-Rab10过表达载体注射到大鼠体内并测量大鼠抑郁样行为的变化。4 周后,与CUMS+AAV组大鼠相比,CUMS+AAV-oe-Rab10组大鼠的体质量(图3A)、总距离(图3B)、站立次数(图3C)、穿越格子数(图3D)和蔗糖偏嗜度(图3E)均增加(Plt;0.05);而不动时间缩短(图3F,Plt;0.05)。
2.3 CUMS大鼠体内Rab10 表达水平的验证即体外模型的构建
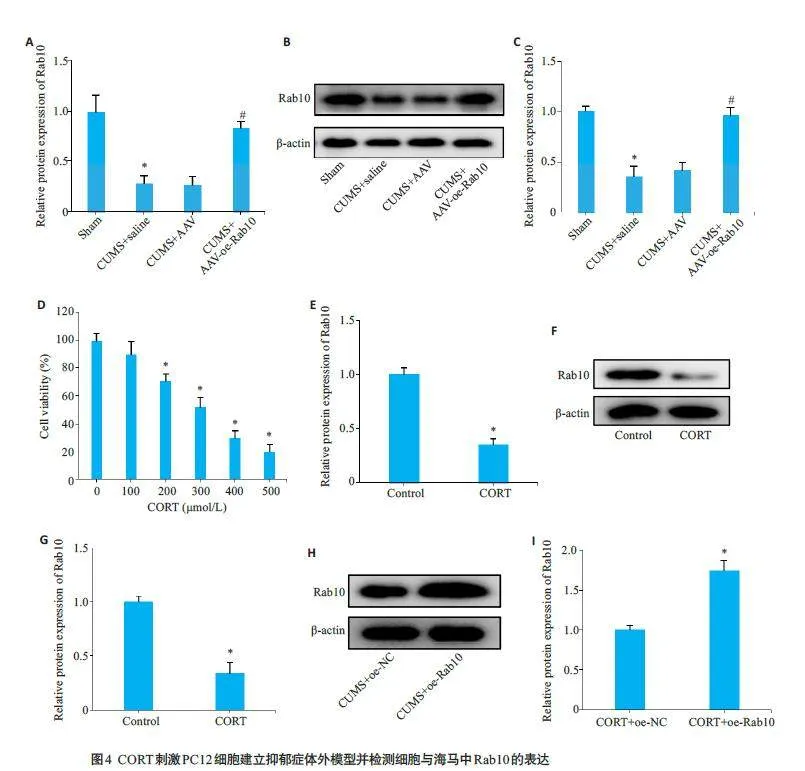
qRT-PCR与Western blotting 实验结果显示,与对照组大鼠相比,CUMS 大鼠海马中Rab10 表达显著下调(Plt;0.05);而与CUMS+AAV 组大鼠相比,CUMS+AAV-oe-Rab10组大鼠海马中Rab10表达水平明显上升(Plt;0.05,图4A)。同样,Western blotting 实验结果与qRT-PCR结果一致(图4B、C)。使用CORT刺激PC12细胞建立抑郁症体外模型。CCK-8检测结果显示,不同浓度的CORT与细胞孵育24 h后可不同程度地降低细胞的活力(Plt;0.05)。其中300 μmol/L CORT 刺激使PC12细胞的存活率下降至50%(Plt;0.05)。在后续的实验中均使用300 μmol/L CORT 进行实验(图4D)。同样,在PC12细胞中,qRT-PCR结果发现CORT刺激显著降低了Rab10 的mRNA 表达水平(Plt;0.05,图4E)。Western blotting 结果显示,与对照组细胞相比,CORT刺激显著降低了Rab10蛋白的表达(Plt;0.05,图4F、G)。将Rab10过表达质粒转染到CORT刺激的PC12细胞中。Western blotting结果显示,CORT+oe-Rab10组的Rab10蛋白表达显著高于CORT+oe-NC组(Plt;0.05,图4H、I)。
2.4 过表达Rab10对CORT诱导的PC12细胞中神经可塑性和自噬相关蛋白表达的影响
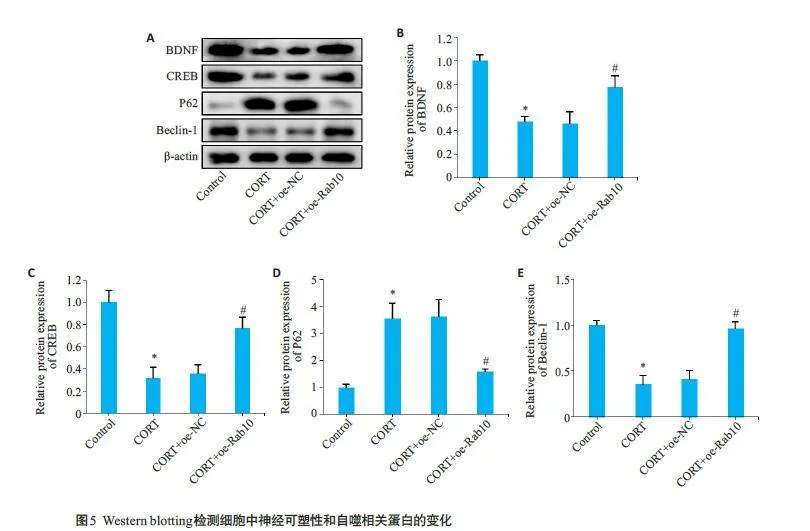
Western blotting结果显示,与Control组细胞相比,CORT 组细胞中BDNF 和CREB 蛋白表达明显下降(Plt;0.05);而与CORT+oe-NC组细胞相比,CORT+oe-Rab10 组细胞中BDNF 和CREB 蛋白含量明显上升(Plt;0.05)。同样采用Western blotting检测自噬相关蛋白的变化时,发现与Control组细胞相比,CORT组细胞中P62蛋白表达上升,Beclin-1蛋白表达下降(Plt;0.05);而与CORT+oe-NC组细胞相比,CORT+oe-Rab10组细胞中P62蛋白表达下降,Beclin-1蛋白表达上升(Plt;0.05,图5)。
2.5 过表达Rab10 对细胞中Wnt/β-catenin 信号通路的影响
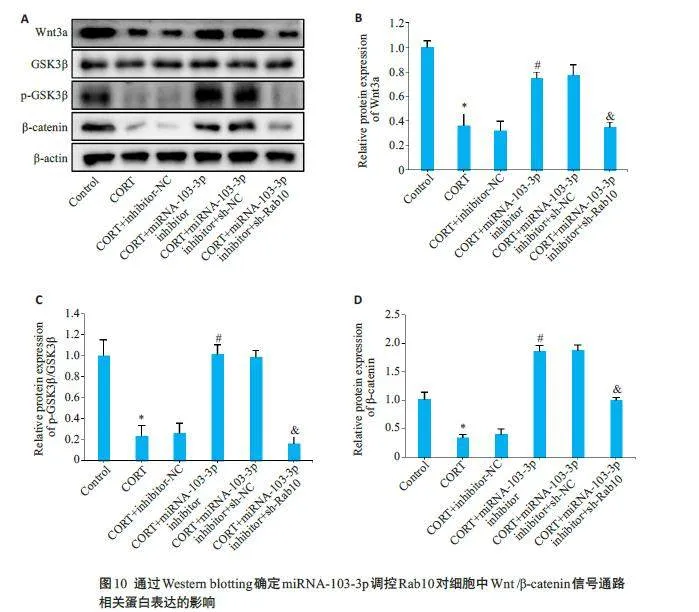
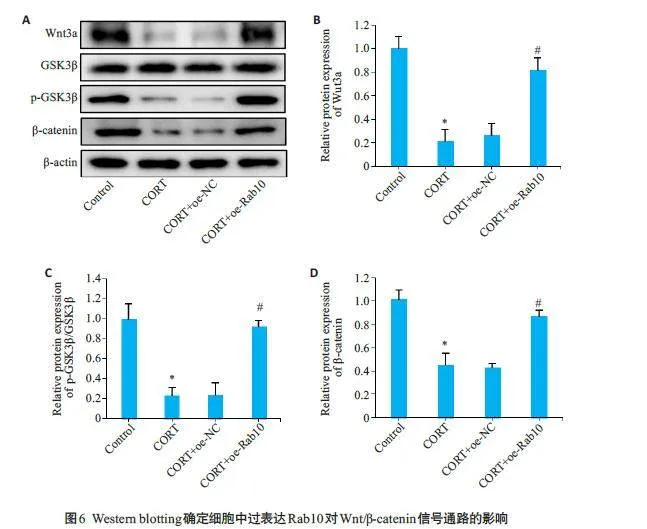
Western blotting结果显示,与Control组细胞相比,CORT组细胞中Wnt3a、p-GSK3β和β-catenin蛋白的表达明显下调(Plt;0.05);与CORT+oe-NC组相比,CORT+oe-Rab10 组细胞中Wnt3a、p-GSK3β和β-catenin 的蛋白表达明显上升(Plt;0.05,图6)。
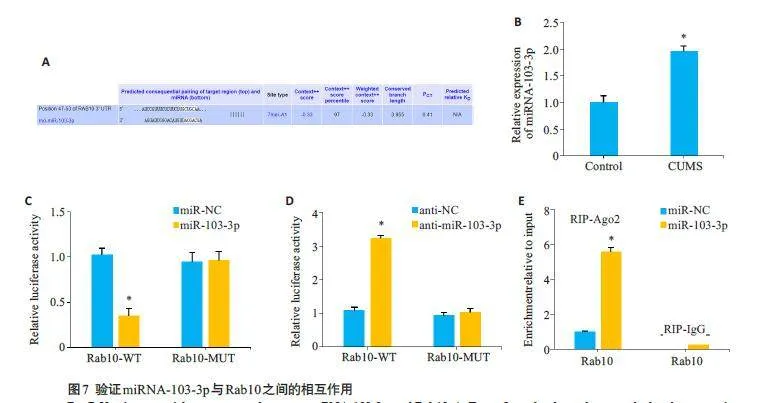
2.6 靶向Rab10的miRNA-103-3p的相互作用
生物信息学分析发现,Rab10可能是miRNA-103-3p的潜在靶点(图7A)。qRT-PCR验证发现,与对照组大鼠相比,CUMS组大鼠海马中miRNA-103-3p表达显著上调(Plt;0.05,图7B);双荧光素酶报告基因实验和Ago2 RIP 试验证实Rab10 是miRNA-103-3p 的直接靶点(Plt;0.05,图7C~E)。
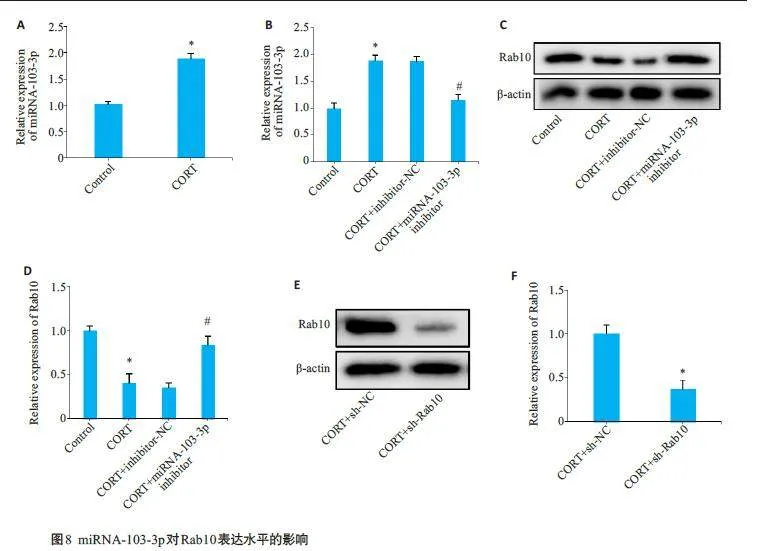
2.7 细胞中沉默MiRNA-103-3p 对Rab10 表达水平的影响
qRT-PCR结果发现,CORT刺激显著上调PC12细胞中miRNA-103-3p 的表达(Plt;0.05,图8A);qRT-PCR结果显示,与CORT+inhibitor-NC 组相比,CORT+miRNA-103-3p inhibitor组细胞中miRNA-103-3p表达显著下调(Plt;0.05,图8B);同样,Western blotting 结果显示,与CORT+inhibitor-NC 组相比,CORT+miRNA-103-3p inhibitor组细胞中Rab10表达显著上调(Plt;0.05,图8C-D);将sh-Rab10 沉默片段转染至CORT 诱导的PC12 细胞中,Western blotting 结果显示,与CORT+sh-NC组相比,CORT+sh-Rab10组细胞中Rab10蛋白表达显著下调(Plt;0.05,图8E、F)。
2.8 miRNA-103-3p 调节Rab10 对PC12 细胞中CORT诱导的神经可塑性和自噬相关蛋白表达的影响
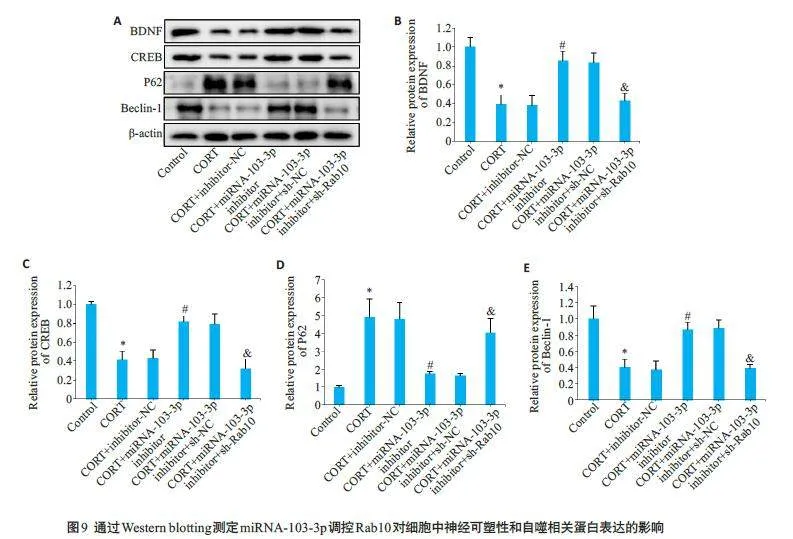
Western blotting结果显示,与CORT+inhibitor-NC组相比,CORT+miRNA-103-3p inhibitor 组细胞中BDNF 和CREB 的蛋白表达显著增加(Plt;0.05);与CORT+miRNA-103-3p inhibitor+sh-NC 组相比,CORT+miRNA-103-3p inhibitor+sh-Rab10 组细胞中BDNF 和CREB 蛋白表达显著下调(Plt;0.05)。通过Western blotting检测细胞中自噬相关蛋白表达的变化时,结果显示与CORT+inhibitor-NC 组相比,CORT+miRNA-103-3p inhibitor 组细胞中P62 蛋白表达下降,而Beclin-1蛋白表达上升(Plt;0.05);与CORT+miRNA-103-3p inhibitor+sh-NC 组相比,CORT+miRNA-103-3p inhibitor+sh-Rab10 组细胞中P62 蛋白表达上调,而Beclin-1蛋白表达下降(Plt;0.05,图9)。
2.9 miRNA-103-3p 调控Rab10 对CORT 诱导的PC12细胞中Wnt/β-catenin信号通路的影响
通过Western blotting检测Wnt/β-catenin信号通路相关蛋白的表达,结果显示CORT+miRNA-103-3pinhibitor组细胞中的Wnt3a、p-GSK3β和β-catenin蛋白表达水平显著高于CORT+inhibitor-NC组(Plt;0.05);与CORT+miRNA-103-3p inhibitor+sh-NC 组相比,CORT+miRNA-103-3p inhibitor+sh-Rab10 组细胞中Wnt3a、p-GSK3β和β-catenin蛋白的表达水平明显下降(Plt;0.05,图10)。
3 讨论
研究结果表明,与对照组大鼠相比,CUMS组大鼠海马中Rab10基因表达下调。且在CUMS组大鼠海马中过表达Rab10 明显改善CUMS 大鼠的抑郁样行为。在CORT诱导的PC12细胞中过表达Rab10显著提高了神经可塑性与自噬相关蛋白表达水平,改善细胞损伤。生物信息学结合双荧光素酶和RIP 实验结果表明miRNA-103-3p 靶向Rab10,并且miRNA-103-3p 调节Rab10 激活Wnt/β-catenin 信号通路以改善了CORT诱导的PC12细胞损伤。
CUMS 模型是建立抑郁症模型的方法之一,被认为是最接近于日常生活中人们长期遇到的压力和挫折后导致的抑郁症的动物模型。广泛用于筛选抗抑郁药物和研究抑郁症发病的病理生理学等[18]。抑郁症伴随多种行为表型,应激后的抑郁大鼠会出现食欲下降,快感缺失,畏惧探索新环境,以及绝望程度增加等。行为学评价的实验广泛用于检测动物模型的有效性,所以我们通过测量大鼠体质量,蔗糖偏嗜度实验,旷场实验以及强迫游泳实验来评价大鼠的抑郁状态[19,20]。本次实验中,与正常大鼠相比,CUMS大鼠的行为学指标明显发生变化,提示 CUMS大鼠抑郁模型成功建立。大鼠海马区Rab10表达水平在CUMS大鼠中相对于对照组大鼠明显下降,而过表达Rab10 显著提升CUMS大鼠的体质量、蔗糖偏适度、旷场实验中行为学等指标,缩短强迫游泳中不动时间,提示大鼠的抑郁症状得到明显改善。
高度分化的PC12 细胞在形态和功能上具有典型神经内分泌细胞的特征,因此被广泛用于抑郁症的研究。例如高浓度CORT刺激PC12细胞模拟神经细胞损伤模型已被广泛使用[21]。且不同类型的抗抑郁药对受损的PC12 细胞具有保护作用[22]。本实验采用CCK-8 法证明不同浓度的CORT对PC12细胞的活性产生抑制作用,即300 μmol/L的CORT刺激PC12细胞24 h后,细胞存活率下降50%,且明显下调了细胞中Rab10蛋白的表达水平。提示CORT诱导的PC12细胞模型可用于模拟抑郁症的体外模型。研究发现,AD患者血浆中Aβ 42/Aβ 40的比例下降,这与Rab10含量的下降具有显著的相关性,提示Rab10有望成为神经系统疾病的潜在治疗靶点[23]。有研究证实了抑制miR-103-3p可减少缺血性脑卒中患者的脑损伤并改善患者的神经功能损坏[12,13]。
神经可塑性是指与大脑功能有关的对各种内外刺激的适应性变化,涉及神经元结构和功能的多种变化。其作用机制包括突触形态的变化和相关基因表达量的增加[24, 25]。本研究结果显示CORT 刺激显著下调了PC12 细胞中BDNF 和CREB的表达,而在CORT刺激的基础上过表达Rab10 或沉默miRNA-103-3p 显著逆转了BDNF和CREB的表达水平;但在miRNA-103-3pinhibitor干预的基础上沉默Rab10显著逆转了miRNA-103-3p对细胞中神经可塑性相关蛋白的影响。神经营养因子假说表明BDNF表达和功能的下调容易导致情绪抑郁的发生[26]。BDNF是中枢神经系统中一种重要的神经营养因子,对神经元的生长和存活至关重要。研究发现,自杀的抑郁症患者海马体中BDNF的水平明显低于正常人体内水平;而接受抗抑郁治疗的患者大脑区域中BDNF的表达明显高于未接受抗抑郁治疗的患者[27]。因此我们可以推断miRNA-103-3p 通过调节CORT诱导的PC12 细胞中Rab10 的表达从而增加BDNF 和CREB的蛋白含量改善了PC12细胞的神经可塑性功能。
近年来,许多研究发现自噬参与了抑郁症的发病和治疗[28]。例如,自噬选择性地靶向受损的细胞器和毒性蛋白。如在线粒体自噬中,细胞通过自噬选择性清除受损的线粒体,从而抑制细胞凋亡[29]。本研究发现CORT刺激显著降低了PC12 细胞中自噬水平;Rab10 的过表达或miRNA-103-3p 的沉默显著下调细胞中P62 蛋白的含量并上调Beclin-1蛋白的含量,从而促进细胞自噬水平;然而,在沉默miRNA-103-3p inhibitor 的基础上下调Rab10 的表达显著逆转了miRNA-103-3p 对细胞自噬水平的影响。与此相一致的是,一些研究表明,某些抗抑郁药是通过上调细胞自噬水平发挥治疗作用,例如三环类抗抑郁药阿米替林和选择性5-HT再摄取抑制剂西酞普兰可增加抑郁大鼠星形胶质细胞和神经元的自噬水平,并抑制神经元凋亡[30]。
Wnt信号转导通路几乎控制着所有动物发育和形成过程中的各种生物现象[31]。Wnt信号在神经元突触形成和重塑、树突生长和分支形成、神经传递、神经可塑性、神经发生和神经保护中发挥重要作用[32]。结合转录组和前期实验结果,Wnt/β-catenin信号通路在抑郁症中受Rab10 调控。本研究发现,过表达Rab10 或沉默miRNA-103-3p可显著上调PC12细胞Wnt3a、p-GSK3β和β-catenin 蛋白的表达,从而激活Wnt/β-catenin 信号通路,改善CORT 对PC12 细胞的损伤;通过抑制miRNA-103-3p 的基础上沉默Rab10 可显著逆转miRNA-103-3p对Wnt/β-catenin信号通路的影响。糖原合成酶激酶3β(GSK3β)是一种丝氨酸/苏氨酸蛋白激酶,在无Wnt信号时,GSK3β能将磷酸基团结合至β-cateninN 端的丝氨酸/苏氨酸残基上,磷酸化的β-catenin 经β-TRCP泛素化共价修饰后,被蛋白酶体降解。β-catenin是一种多功能蛋白,它与E-Cadherin在细胞交界处相互作用,参与细胞与细胞间附着的粘附分子的形成,而游离的β-catenin 可以进入细胞核调节基因表达,其异常表达或激活可导致抑郁疾病的发生[33,34]。
综上所述,本研究发现过表达Rab10可改善CUMS大鼠的抑郁样行为;miRNA-103-3p靶向Rab10的并激活了Wnt/β-catenin 信号通路,抑制了CORT 诱导的PC12细胞损伤。此外,Rab10的过表达或miRNA-103-3p的沉默显著改善了CORT诱导的PC12细胞的神经可塑性并促进了细胞自噬水平。而基于抑制miRNA-103-3p的基础上沉默Rab10 逆转了miRNA-103-3p 的上述作用。该研究提示靶向Rab10 的miRNA-103-3p 可能是抑郁症中发挥神经保护作用的潜在治疗靶点。
参考文献:
[1] Noetel M, Sanders T, Gallardo-Gómez D, et al. Effect of exercise fordepression: systematic review and network meta-analysis ofrandomised controlled trials[J]. BMJ, 2024, 384: e075847.
[2] Steffens DC. Treatment-resistant depression in older adults[J]. NEngl J Med, 2024, 390(7): 630-9.
[3] Zhang K, Wang F, Zhai MY, et al. Hyperactive neuronal autophagydepletes BDNF and impairs adult hippocampal neurogenesis in acorticosterone-induced mouse model of depression[J].Theranostics, 2023, 13(3): 1059-75.
[4] Kallergi E, Daskalaki AD, Kolaxi A, et al. Dendritic autophagydegrades postsynaptic proteins and is required for long-termsynaptic depression in mice[J]. Nat Commun, 2022, 13(1): 680.
[5] Abdulghani A, Poghosyan M, Mehren A, et al. Neuroplasticity toautophagy cross-talk in a therapeutic effect of physical exercises andirisin in ADHD[J]. Front Mol Neurosci, 2022, 15: 997054.
[6] Hwang JY, Yan J, Zukin RS. Autophagy and synaptic plasticity:epigenetic regulation[J]. Curr Opin Neurobiol, 2019, 59: 207-12.
[7] Fleming A, Rubinsztein DC. Autophagy in neuronal developmentand plasticity[J]. Trends Neurosci, 2020, 43(10): 767-79.
[8] Jaldin-Fincati JR, Pavarotti M, Frendo-Cumbo S, et al. Update onGLUT4 vesicle traffic: a cornerstone of insulin action[J]. TrendsEndocrinol Metab, 2017, 28(8): 597-611.
[9] Tavana JP, Rosene M, Jensen NO, et al. RAB10: an Alzheimer'sdisease resilience locus and potential drug target[J]. Clin IntervAging, 2019, 14: 73-9.
[10]Vieira OV. Rab3a and Rab10 are regulators of lysosome exocytosisand plasma membrane repair[J]. Small GTPases, 2018, 9(4): 349-51.
[11] Lu TX, Rothenberg ME. MicroRNA[J]. J Allergy Clin Immunol,2018, 141(4): 1202-7.
[12]Wang LM, Zhao Y, Gang SC, et al. Inhibition of miR-103-3ppreserves neurovascular integrity through caveolin-1 inexperimental subarachnoid hemorrhage[J]. Neuroscience, 2021,461: 91-101.
[13]Li W, Wang SS, Shan BQ, et al. MiR-103-3p targets Ndel1 toregulate neural stem cell proliferation and differentiation[J]. NeuralRegen Res, 2022, 17(2): 401-8.
[14]Als TD, Kurki MI, Grove J, et al. Depression pathophysiology, riskprediction of recurrence and comorbid psychiatric disorders usinggenome-wide analyses[J]. Nat Med, 2023, 29(7): 1832-44.
[15]童九翠. 豆腐果苷抗抑郁作用的分子机制研究[D]. 芜湖: 安徽师范大学, 2019.
[16]Singh V, Menard MA, Serrano GE, et al. Cellular and subcellularlocalization of Rab10 and phospho-T73 Rab10 in the mouse andhuman brain[J]. Acta Neuropathol Commun, 2023, 11(1): 201.
[17]Zhang YX, Zhang XT, Li HJ, et al. Antidepressant-like effects ofhelicid on a chronic unpredictable mild stress-induced depression ratmodel: Inhibiting the IKK/IκBα/NF-κB pathway through NCALD toreduce inflammation[J]. Int Immunopharmacol, 2021, 93: 107165.
[18]Lages YVM, Rossi AD, Krahe TE, et al. Effect of chronicunpredictable mild stress on the expression profile of serotoninreceptors in rats and mice: a meta-analysis[J]. Neurosci BiobehavRev, 2021, 124: 78-88.
[19]Markov DD, Novosadova EV. Chronic unpredictable mild stressmodel of depression: possible sources of poor reproducibility andlatent variables[J]. Biology, 2022, 11(11): 1621.
[20]Markov DD. Sucrose preference test as a measure of anhedonicbehavior in a chronic unpredictable mild stress model of depression:outstanding issues[J]. Brain Sci, 2022, 12(10): 1287.
[21]Lin RH, Liu LL, Silva M, et al. Hederagenin protects PC12 cellsagainst corticosterone-induced injury by the activation of the PI3K/AKT pathway[J]. Front Pharmacol, 2021, 12: 712876.
[22]Chai YH, Cai YW, Fu Y, et al. Salidroside ameliorates depression bysuppressing NLRP3-mediated pyroptosis via P2X7/NF- κB/NLRP3signaling pathway[J]. Front Pharmacol, 2022, 13: 812362.
[23]Yan TX, Wang LW, Gao J, et al. Rab10 phosphorylation is aprominent pathological feature in Alzheimer's disease[J]. JAlzheimers Dis, 2018, 63(1): 157-65.
[24]Price RB, Duman R. Neuroplasticity in cognitive and psychologicalmechanisms of depression: an integrative model[J]. Mol Psychiatry,2020, 25: 530-43.
[25]Tartt AN, Mariani MB, Hen RE, et al. Dysregulation of adulthippocampal neuroplasticity in major depression: pathogenesis andtherapeutic implications[J]. Mol Psychiatry, 2022, 27(6): 2689-99.
[26]Colucci-D'Amato L, Speranza L, Volpicelli F. Neurotrophic factorBDNF, physiological functions and therapeutic potential indepression, neurodegeneration and brain cancer[J]. Int J Mol Sci,2020, 21(20): 7777.
[27]Björkholm C, Monteggia LM. BDNF-a key transducer ofantidepressant effects[J]. Neuropharmacology, 2016, 102: 72-9.
[28]Tang MM, Liu T, Jiang P, et al. The interaction between autophagyand neuroinflammation in major depressive disorder: frompathophysiology to therapeutic implications[J]. Pharmacol Res,2021, 168: 105586.
[29] Jung S, Choe S, Woo H, et al. Autophagic death of neural stem cellsmediates chronic stress-induced decline of adult hippocampalneurogenesis and cognitive deficits[J]. Autophagy, 2020, 16(3):512-30.
[30]Rein T. Is autophagy involved in the diverse effects ofantidepressants[J]? Cells, 2019, 8(1): 44.
[31]Reya T, Clevers H. Wnt signalling in stem cells and cancer[J].Nature, 2005, 434(7035): 843-50.
[32] Ji RR, Xu ZZ, Gao YJ. Emerging targets in neuroinflammationdrivenchronic pain[J]. Nat Rev Drug Discov, 2014, 13: 533-48.
[33]Lorzadeh S, Kohan L, Ghavami S, et al. Autophagy and the Wntsignaling pathway: a focus on Wnt/β-catenin signaling[J]. BiochimBiophys Acta Mol Cell Res, 2021, 1868(3): 118926.
[34]Narvaes RF, Furini CRG. Role of Wnt signaling in synapticplasticity and memory[J]. Neurobiol Learn Mem, 2022, 187: 107558.
(编辑:余诗诗)
基金项目:安徽省高等学校自然科学重点研究项目(KJ2021A0858,2022AH051220)

