腐败希瓦氏菌4H铬还原机制的探究
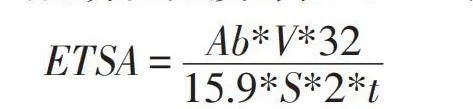

摘要:本文为探究腐败希瓦氏菌4H还原Cr(VI)的机制,采用扫描电镜(SEM)、傅里叶红外光谱(FTIR)、X射线光电子能谱(XPS)、电化学测试等方法进行表征。结果表明腐败希瓦氏菌4H还原Cr(VI)的机制主要与微生物的代谢和电子传递能力有关。通过XPS分析发现细菌在对Cr(VI)的还原过程中,菌体表面有Cr(VI)和Cr(III)两种形态存在,进一步证明该菌通过还原方法去除六价铬;扫描电镜结果显示,在六价铬胁迫下细菌表面无明显破损,菌体形态由短杆型变成了长杆型,说明该菌对Cr(VI)具有很强的耐受性;傅里叶红外光谱结果显示随着初始Cr(VI)浓度的增加,羟基、羧基、酰胺和磷酸基团所代表的特征峰强度也有明显的增强;细菌电子传递性能测试以及电化学测试结果显示该菌具有很强的电子传递能力。本文通过对腐败希瓦氏菌4H还原Cr(VI)的机制的探究为微生物还原环境中Cr(VI)提供了理论基础。
关键词:腐败希瓦氏菌;铬还原机制;电子传递;生物代谢
中图分类号:Q939.98文献标志码:A文章编号:2095-414X(2024)05-0054-06
0引言
铬是一种常见的重金属,其天然存在于岩石、动物、植物、土壤以及火山灰中[1],一般以两种稳定的氧化态存于水体中:六价铬[Cr(VI)]和三价铬[Cr(Ⅲ)][2]。其中Cr(VI)对人体有剧毒,且会引发细胞癌变、畸形以及DNA损伤并造成遗传性的疾病,在水体中Cr(VI)往往以Cr2O72−、CrO42−、HCrO4−的形式存在,在溶液中的相对分布取决于溶液的pH值、Cr(VI)的浓度和氧化还原电位等[3],难以形成不溶性沉淀,而Cr(Ⅲ)毒性较小,容易以Cr(OH)3的形式从溶液中析出。因此探寻将游离的、毒性较大的Cr(VI)还原为稳定的、毒性较小的Cr(Ⅲ)的技术方法已成为当务之急。
希瓦氏菌属作为一类重要的异化铁还原菌,其拥有独特的呼吸系统,不仅能显著促进自然条件下有毒有机化合物[4]以及染料的降解[5],还能够利用多种有毒重金属和放射性元素作为电子受体,从而实现这些重金属的还原解毒或固定[6]。因此,在重金属污染水体及土壤修复方面,希瓦氏菌有着极大的应用潜力和优势。但目前对希瓦氏菌去除Cr(VI)的探究大多基于奥奈达希瓦氏菌MR-1[7],对于腐败希瓦氏菌去除Cr(VI)的机理研究较少,为深入挖掘希瓦氏菌属中具有去除六价铬能力的优势菌株,本研究以经过长时间六价铬驯化的Cr(VI)还原菌腐败希瓦氏菌4H菌株为研究对象,初步揭示了腐败希瓦氏菌4H对Cr(VI)的还原机制,为希瓦氏菌属在铬污染环境修复方面的应用提供了理论依据。
1材料与方法
1.1实验材料
腐败希瓦氏菌4H由课题组分离所得,是一株染料高效脱色菌[8],菌株于-80℃超低温冰箱冷冻保藏。
LB培养基(每升含10 g蛋白胨,5 g酵母粉,10 g NaCl,固体培养基另添加2%琼脂)。
蔗糖、三羟甲基氨基甲烷(Tris)、Nafion试剂、重铬酸钾、甲醛、甲醇购自上海国药试剂集团,溶菌酶购自BIOSHARP公司。
1.2外膜和周质细胞色素c的测定
挑平板上的单菌落至LB培养基中,待养至对数中期,分别取2%接种量的菌液于终浓度为0、100、300 mg/L Cr(VI)的LB培养基中,120 rpm,30℃培养24 h。利用低温离心机8000 rpm,4℃下离心5 min收集细胞。将收集的细胞重悬于50 mM PBS缓冲液(pH 7.4)后再次离心,重复三次以洗涤细胞。将洗涤后的细胞重悬于2 mL SL溶液(l mg/mL溶菌酶,20%(w/v)蔗糖,0.01 M Tris,pH 8.40)中并在恒温培养摇床中于30℃和120 rpm的条件培养1 h,再以8000 rpm低温离心10 min收集细胞,再将细胞重悬于Tris-Mg2+溶液中,并于30℃培养0.5 h后8000 rpm离心5 min收集上清液,上清液中包含外膜和周质细胞色素c。使用紫外可见分光光度计在520 nm处的吸光度测量细胞色素c的浓度[9]。
1.3电子传递系统活性(ETSA)的测定
实验通过将2-(对-碘苯基)-3-(对-硝基苯基)-5-苯基氯化四氮唑(INT)还原为三苯基甲攒的方法对不同初始Cr(VI)胁迫下细菌的电子传递活性进行测定。挑选平板上的单菌落至LB培养基中,待养至对数中期,分别取2%接种量的菌液于终浓度为0、100、300 mg/L Cr(VI)的LB培养基中,120 rpm,30℃培养24 h。利用低温冷冻离心机(8000 rpm,4℃,5 min)收集细胞。将收集的细胞重悬于50 mM PBS缓冲液(pH 7.4)中,之后再次离心,反复冲洗三次。取5 mL细胞悬液与1 mL 0.2%INT混合于恒温摇床中120 rpm,30℃培养0.5 h后,添加l mL 37%甲醛终止酶反应。然后将混合物以8000 rpm离心5 min,弃去上清液,再加入5 mL甲醇重悬收集的细胞,将其在恒温摇床中120 rpm,30℃培养10 min。离心(8000 rpm,5 min)后获得的上清液通过紫外可见分光光度计在485 nm处读取吸光度[10]。
其中Ab为485 nm处的吸光度,V为重悬沉淀物甲醇体积,t为反应时间,S为样品体积。
1.4扫描电镜分析
将处于对数期的菌悬液分别接种至含Cr(VI)终浓度分别为0、300 mg/L的LB培养基中,于30℃,120 rpm条件下振荡培养24 h后离心(6000 rpm,4℃,10 min)收集菌体。菌体洗涤后加入2.5%戊二醛溶液固定12 h。将固定后的菌体进一步处理后在临界点进行干燥,喷金,进行扫描电镜的观察[11]。
1.5傅立叶红外表面官能团测定
采用傅立叶红外光谱仪(FT-IR)对菌体表面官能团进行表征。将处于对数期的菌悬液分别接种至含Cr(VI)终浓度分别为0、100、300 mg/L的LB培养基中,于30℃,120 rpm条件下振荡培养24 h后,4℃,6000 rpm条件下离心10 min收集菌体沉淀,并用50 mM的PBS缓冲溶液反复重悬清洗三次后,离心取菌体沉淀,然后进行冷冻干燥。冷冻干燥后的菌体和溴化钾混合(体积比1:100),用玛瑙研钵研磨至粉末状,然后用压片模具压片后进行FT-IR分析[12]。
1.6还原产物的XPS分析
将处于对数期的菌悬液接种至初始Cr(VI)浓度为300 mg/L的LB培养基中,于30℃,120 rpm条件下振荡培养24 h,离心(5000 rpm,4℃,10 min)收集沉淀,离心沉淀用无菌水冲洗后再次离心重复3遍,所得沉淀经冷冻干燥后用于XPS分析。
1.7希瓦氏菌还原Cr(Ⅵ)的电化学表征
采用辰华电化学工作站中循环伏安法(CV)、电化学阻抗谱(EIS)和Tafel曲线探究Cr(VI)对细菌表面电化学性能的影响。检测采用传统三电极系统,其中工作电极为玻璃碳电极、参比电极为Ag/AgCl电极和对电极为铂丝电极,电解液采用50 mM PBS(pH 7.0)缓冲液。玻璃碳电极使用前采用Al2O3抛光打磨并用纯水超声清洗。吸取10 μl不同铬浓度培养下的菌体至工作电极表面(已加入适量1%Nafion溶液固定),待自然晾干固定后进行测试。CV的扫描速率为0.01 V/s,扫描电压范围为-0.80—0.80 V[13]。EIS测试的频率范围为1至106 Hz,测试结果采用Zview2.0软件模拟等效电路,Tafel曲线的扫描速率为10 mV/s[9]。
2结果
2.1希瓦氏菌还原Cr(Ⅵ)电子传递性能的影响
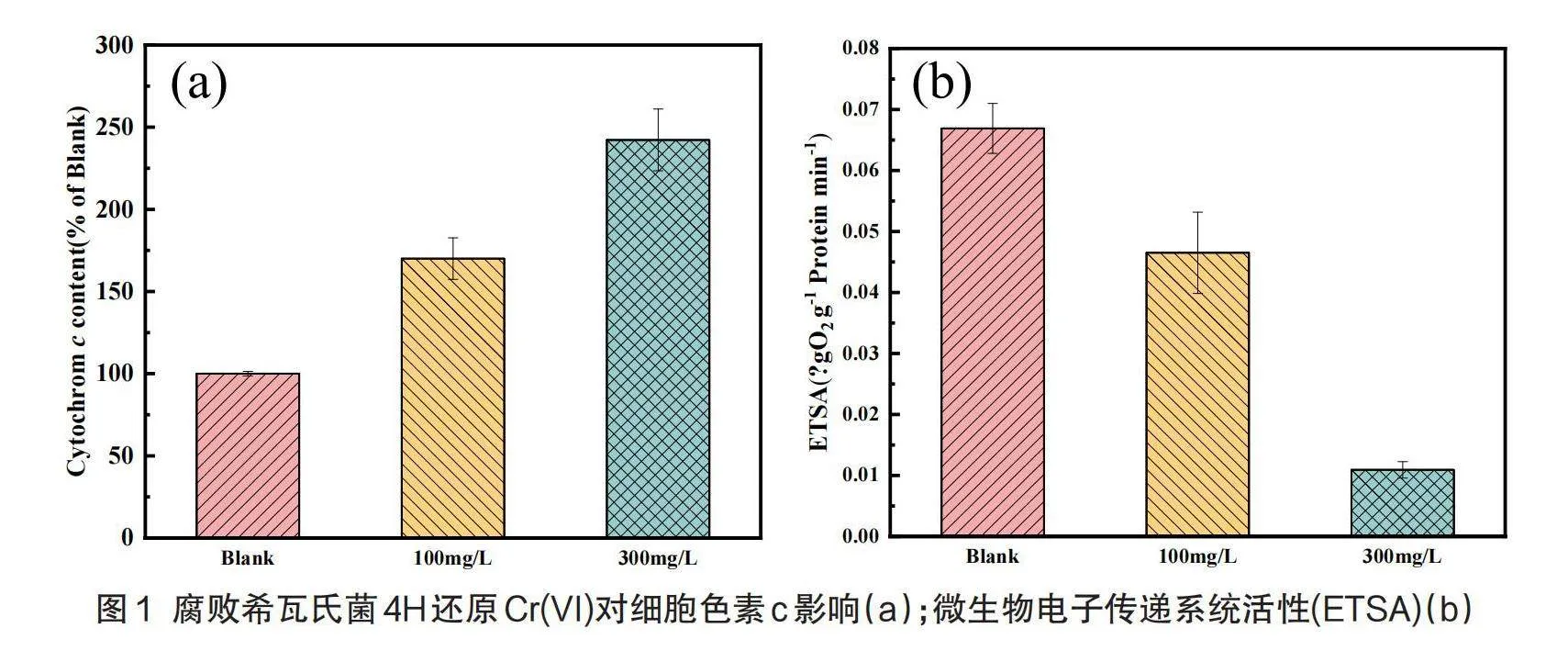
电子传递是细胞代谢的基础,细胞色素c在电子传递系统中起着重要作用[14]。由图1可知100 mg/L铬胁迫环境下生长的细菌细胞色素c的含量是对照组含量的170.03%,300 mg/L铬胁迫环境下生长的细菌细胞色素c的含量是对照组含量的242.25%。结果表明随着铬浓度的增加,细胞色素c的含量有着显著的增长,这可能是由于细胞色素c可以加速Cr(VI)的还原,细菌为了抵抗铬酸盐的胁迫,通过代谢将Cr(VI)的还原为Cr(Ⅲ)以此来减少铬对细胞的损害。
此外,以往研究表明,电子传递系统活性(ETSA)对微生物的电子传递过程起着重要作用,通常用于评估细胞电子传递中关键酶的活性。由图1可知细菌于正常环境生长24 h时ETSA为0.067 μgO2 g-1 min-1,而100 mg/L初始Cr(VI)浓度下的ETSA为0.047 μgO2 g-1 min-1,300 mg/L初始Cr(VI)浓度下的ETSA为0.011 μgO2 g-1 min-1,表明随着初始铬浓度的增加,反应体系的ETSA降低。这可能是由于Cr(VI)对菌株的毒害作用,当菌株被Cr(VI)毒害时,酶的活性会受到影响,从而直接影响电子传递的效率[10]。
2.2扫描电镜分析
为了深入探究Cr(VI)对细胞膜是否存在破坏,以及观察铬胁迫条件下微生物生长形态变化,通过扫描电镜观察不同初始Cr(VI)浓度胁迫下腐败希瓦氏菌4H生长状态。从图2(a)和(b)可以观察到,正常生长的细菌呈现短杆状,菌体表面光滑平整,生长状态良好,个体形态明显。图2(c)和(d)展示的是在300 mg/L Cr(VI)胁迫浓度下生长24小时后的微生物菌体形态,从图中可以看出菌体形态变得很长,但表面无明显破损,细菌整体呈现团聚状,这可能是由于长期Cr(VI)胁迫干扰了外膜合成,导致异常细胞形态的产生[13],细菌通过形态的改变实现对Cr(VI)胁迫环境下生存的调控。扫描电镜结果证明了Cr(VI)对细胞膜没有产生明显的损坏,腐败希瓦氏菌4H具有良好的Cr(VI)耐受能力,能够在高浓度Cr(VI)长时间胁迫条件下生长。
2.3傅里叶红外光谱分析
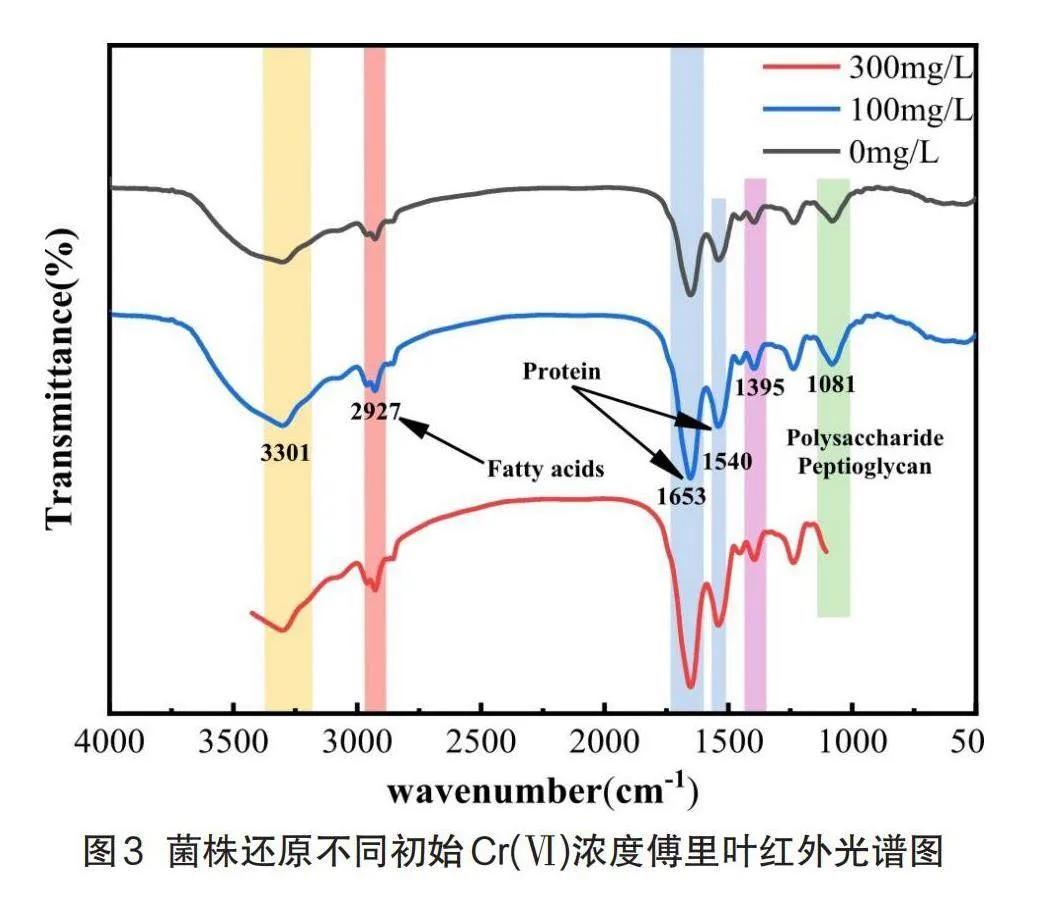
通过对比腐败希瓦氏菌4H在不同初始Cr(VI)浓度生长24 h后的红外光谱图,分析菌体表面官能团对Cr(VI)的作用及影响。如图3所示3301 cm-1处的所出现的吸收峰是-OH和-NH伸缩振动共同引起的;2927 cm-1处的吸收峰对应细胞膜上拉伸的脂肪链(-CH2和-CH3);1653 cm-1处的吸收峰是由酰胺I带的C=O伸缩振动引起,其所对应的官能团与蛋白质有关,1540cm-1处所出现的峰是由酰胺II带C-N的伸缩振动和N-H的弯曲振动引起的[15],其对应的官能团也与蛋白质有关,1395 cm-1处出现的峰由C-N伸缩振动产生,其基团主要也来源于蛋白质;1081cm-1处的吸收峰与微生物细胞表面的多糖、脂多糖和肽聚糖等复杂官能团的物质有关。
上述吸收峰在0、100、300 mg/L初始Cr(VI)浓度的谱图中出峰情况大致相同,说明这些样品在官能团的种类上差异不是很大,但是在部分特征峰处出现峰强度变大等变化。例如位于3301 cm-1、1653 cm-1、1395 cm-1和1081 cm-1处的吸收峰随着初始铬浓度的增加其峰面积发生了明显的增大[16],表明这些峰所代表的羟基(-OH),酰胺(-CO-NH-)、羧基(-COOH)和磷酸(P=O或P-O)官能团的含量随着铬浓度升高而变大[10],说明菌株还原Cr(VI)反应的结合位点主要为羟基、羧基、酰胺和磷酸基团等,而这些大多与细菌的生物大分子的构成、代谢途径、细胞结构和功能以及细胞信号传导等方面密切相关,进一步验证了该菌具有很强的电子传递性能以及重金属代谢能力,对于细菌的生存、环境适应都具有重要意义。
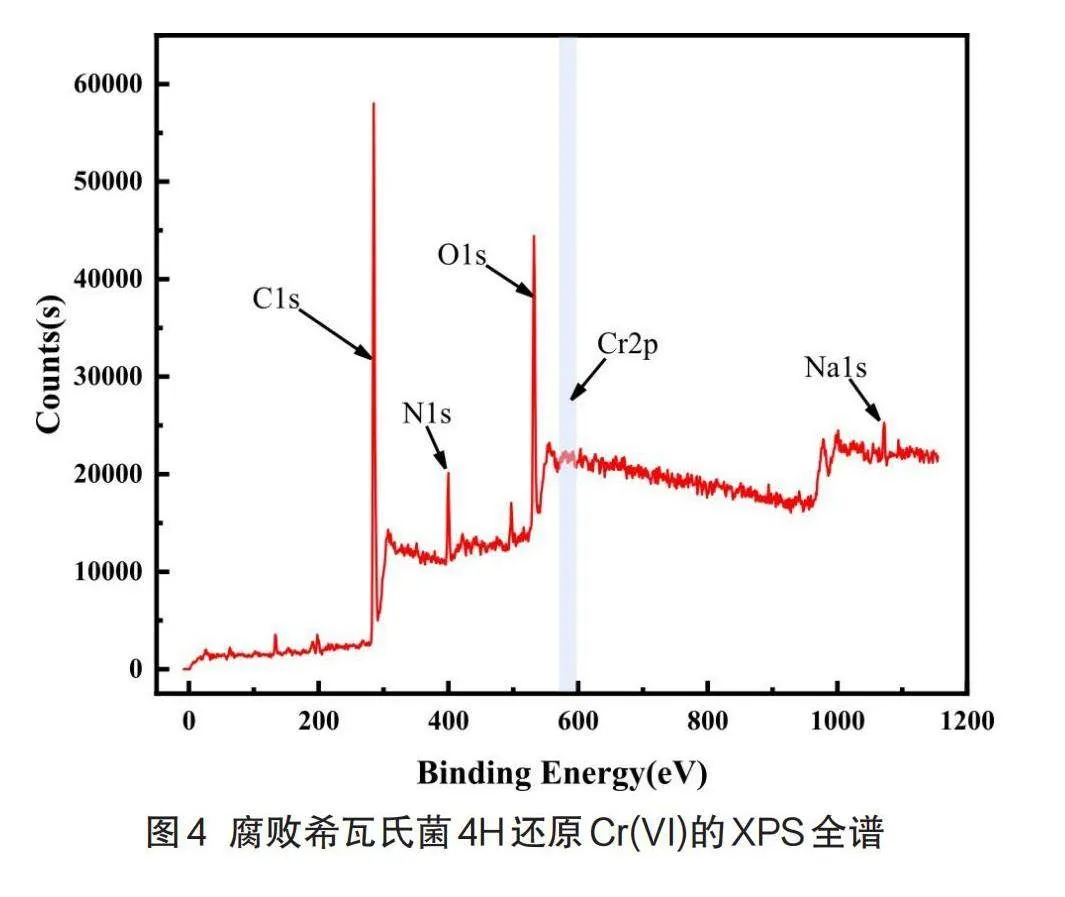
2.4铬分子形态XPS分析
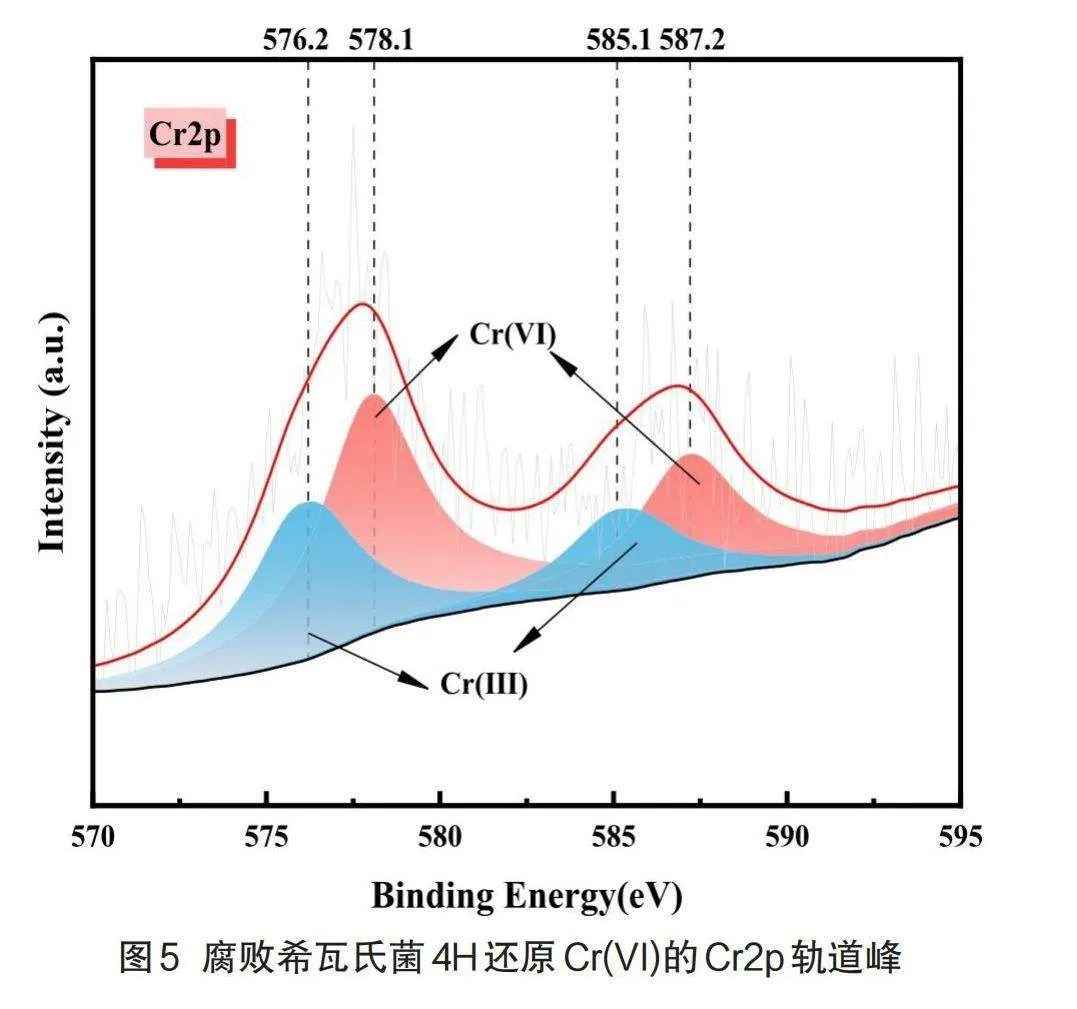
为分析微生物体系Cr(VI)还原的产物,以及菌体表面及内部铬的形态特征,本研究采用高性能X射线光电子能谱仪对腐败希瓦氏菌4H还原Cr(VI)的分子形态进行表征,结果见图4。从图中可以明显看出C、N、O、Cr、Na五种元素,其中C、N、O是菌体蛋白质、氨基酸等重要组成元素[17]。
图5显示了还原产物的Cr2p光谱图,结合能576.2 eV(Cr2p3/2)和585.1 eV(Cr2p1/2)的峰值归因于Cr(III)的(氢)氧化物[18],而结合能578.1 eV(Cr2p3/2)和587.2 eV(Cr2p1/2)的峰值归因于Cr(VI)的氧化物[19],这说明细菌还原Cr(VI)的过程中可能发生了少量的吸附与氧化还原反应[20],但由于300 mg/L Cr(VI)浓度过高,菌体不能完全将自身表面的Cr(VI)完全还原为Cr(III),所以此时细胞内的Cr(VI)含量高于Cr(III)。
2.5电化学特性分析
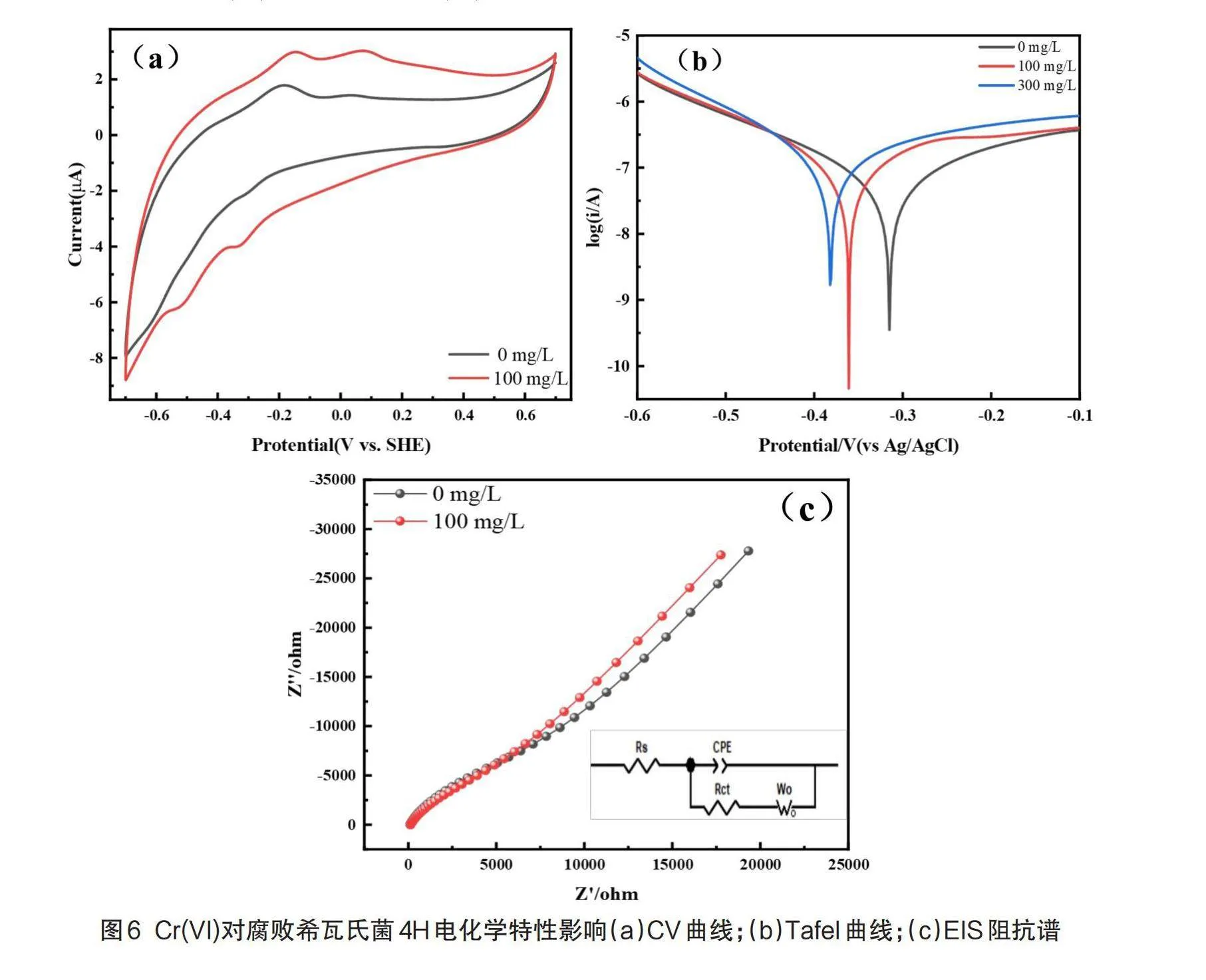
电化学特性是研究细胞电子传递特性的重要指标,为了探究腐败希瓦氏菌4H还原Cr(VI)过程中的电化学特性,对不同初始Cr(VI)浓度条件下生长24 h后的菌体进行CV、EIS和Tafel曲线测试,结果见图6。
CV常被用来表征物质的电子转移能力和评估氧化还原电位[21]。由图6 CV结果可知,相较于正常环境下生长的菌株,100 mg/L初始Cr(VI)条件下生长的菌株在-0.33 V附近的还原峰可能为细菌OmcA/MtrC复合物与黄素类物质协同作用产生的氧化还原峰[22-23],-0.5 V附近的还原峰可能代表核黄素的氧化还原峰[24]。
如图6所示,根据外推法计算出0、100、300 mg/L初始Cr(VI)浓度细菌的电流交换密度值分别为6.973×10-8 A/cm-2、1.354×10-7 A/cm-2、1.456×10-7 A/cm-2,交换电流密度是评估氧化还原反应速率的重要指标,电流交换密度越大,电子传递速率越快,反应越容易进行[25]。
为了更好地揭示电子传递效率的变化,使用等效电路对EIS测试结果进行了拟合。其中,Rct值代表电荷传递阻抗,其值越低,电荷转移电阻越小[26]。0 mg/L以及100 mg/L初始Cr(VI)条件下生长的菌株Rct值分别为3700Ω和2240Ω,表明菌体表面Cr(VI)的存在降低了电子传递电阻,从而导致更高的电子传递效率。
综上所述,CV、EIS和Tafel曲线分析结果表明,Cr(VI)的胁迫促使了细胞表面的电子传递,从而使Cr(VI)的价态发生了转变,且与细菌的黄素蛋白以及色素细胞c的氧化还原有着必然的联系。
3结论
本文通过扫描电镜(SEM)、傅里叶红外、XPS、电化学表征等方法研究了腐败希瓦氏菌4H去除Cr(VI)的作用机理,结果表明:通过检测不同六价铬浓度下细菌外膜细胞色素c含量、电子传递系统活性(ETSA)证明该菌具有很强的电子传递性能。通过检测不同浓度下细菌膜通透性以及SEM分析得出Cr(VI)对该菌细胞膜的损害情况较小,细菌主要通过改变自身形态的方法抵抗Cr(VI)的毒害。通过傅里叶红外探究发现随着初始Cr(VI)浓度的增,羟基、羧基、酰胺和磷酸基团所代表的特征峰强度也有明显的增强,这些基团主要生物大分子的构成、代谢途径、细胞结构和功能以及细胞信号传导等方面,进一步验证了该菌具有很强的电子传递性能以及重金属代谢能力。通过XPS分析细菌还原Cr(VI)的产物,发现腐败希瓦氏菌4H对Cr(VI)的还原过程中存在Cr(III)的(氢)氧化物,进一步验证了该菌主要是通过还原的方法去除Cr(VI)。通过检测CV、EIS、Tafel等化学表征发现菌体表面Cr(VI)的存在促使了细菌自身的电子传递,细菌为减少Cr(VI)的毒害,推测该菌可能将Cr(VI)作为电子传递受体进行还原作用,其中黄素蛋白与色素细胞c的氧化还原起着重要作用。本研究初步揭示了腐败希瓦氏菌4H还原Cr(VI)机理,为将微生物应用于Cr(VI)污染的治理提供了理论依据。
参考文献:
[1]Joutey NT,Sayel H,Bahafid W,et al.Mechanisms of Hexavalent Chromium Resistance and Removal by Micro⁃organisms[J].Reviews of Environmental Contamination and Toxicology,2015,233:45-69.
[2]Barrera-Díaz C,Lugo-Lugo V,Bilyeu B.A review of chemical,electrochemical and biological methods for aque⁃ous Cr(VI)reduction[J].Journal of Hazardous Materials,2012,223:1-12.
[3]Bingbing Pang,Hongling Yu,Jin Zhang,et al.Identifica⁃tion of differentially expressed genes for Pseudomonas sp.Cr13 stimulated by hexavalent chromium[J].PLOS ONE,2022,17(8):e0272528.
[4]Brown SD,Thompson MR,Verberkmoes NC,et al.Mo⁃lecular Dynamics of the Shewanella oneidensis Response to Chromate Stress[J].Molecular&Cellular Proteomics,2006,5(6):1054-1071.
[5]江莹,桂震,齐杭杭,等.一株腐败希瓦氏菌的筛选鉴定及其染料脱色研究[J].安徽农业科学,2015,43(23):224-228.
[6]Bencheikh-Latmani R,Williams SM,Haucke L,et al.Global transcriptional profiling of Shewanella oneidensis MR-1 during Cr(VI)and U(VI)reduction.[J].Applied and Environmental Microbiology,2005,71(11):7453-7460.
[7]Wang J,Wu M,Lu G,et al.Biotransformation and biometh⁃ylation of arsenic by Shewanella oneidensis MR-1[J].Che⁃mosphere,2016,145:329-335.
[8]江莹.一株腐败希瓦氏菌对活性艳红X-3B和活性艳蓝KN-R的脱色研究[D].武汉纺织大学,2016.
[9]何月.Fe(Ⅲ)调控及硫自养工艺对Te(Ⅳ)生物还原性能与机理研究[D].天津城建大学,2021.
[10]Zheng Y,Li H,Yang Y,et al.Goethite and riboflavin syn⁃ergistically enhance Cr(VI)reduction by Shewanella oneidensis MR-1[J].Biodegradation,2023,34(2):155-167.
[11]杜艳影.Shewanella oneidensis MR-1对Cr(Ⅵ)的还原及其机理研究[D].安徽农业大学,2019.
[12]Zhu Y,Yan J,Xia L,et al.Mechanisms of Cr(VI)reduction by Bacillus sp.CRB-1,anovel Cr(VI)-reducing bacterium isolated from tannery activated sludge[J].Ecotoxicology and Environmental Safety,2019,186:109792.
[13]冮海银.蛋白质组学揭示希瓦氏菌MR-1在长期六价铬驯化中的还原和耐受机制[D].湖南大学,2019.
[14]He Y,Guo J,Song Y,et al.Acceleration mechanism of bio⁃available Fe(Ⅲ)on Te(IV)bioreduction of Shewanella oneidensis MR-1:Promotion of electron generation,elec⁃tron transfer and energy level[J].Journal of Hazardous Ma⁃terials,2021,403:123728.
[15]戴幼芬.微生物胞外聚合物的提取表征及其与Cr(Ⅵ)相互作用研究[D].福建师范大学,2016.
[16]Hui An,Tian T,Ziting Wang,et al.Role of extracellular polymeric substances in the immobilization of hexavalent chromium by Shewanella putrefaciens CN32 unsaturated biofilms.[J].Science of The Total Environment,2021:151184.
[17]徐文强.腐败希瓦氏菌对水中Cr(Ⅵ)还原能力强化方法的研究[D].中南民族大学,2020.
[18]邹龙,朱菲,唐洁,等.细菌介导水铁矿合成铁硫矿物去除水体铬污染[J].中国环境科学,2023,43(2):610-619.
[19]Biesinger MC,Payne BP,Grosvenor AP,et al.Resolving surface chemical states in XPS analysis of first row transi⁃tion metals,oxides and hydroxides:Cr,Mn,Fe,Co and Ni[J].Applied Surface Science,2011,257(7):2717-2730.
[20]杜文涛.克雷伯氏菌Klebsiella Z3对Cr(Ⅵ)的还原性能及机理研究[D].河南农业大学,2017.
[21]Guo H,Chen Z,Chen Z,et al.Enhanced denitrification performance and biocatalysis mechanisms of polyoxometa⁃lates as environmentally-friendly inorganic redox media⁃tors[J].Bioresource Technology,2019,291:121816-121816.
[22]韩俊成.希瓦氏菌胞外电子传递机制的解析和应用[D].中国科学技术大学,2017.
[23]Marsili E,Baron DB,Shikhare ID,et al.Shewanella se⁃cretes flavins that mediate extracellular electron transfer[J].Proceedings of the National Academy of Sciences,2008,105(10):3968-3973.
[24]陈缘缘.人工构建胞外电活性基质强化微生物胞外电子传递及其重金属还原性能研究[D].江苏大学,2022.
[25]Tu J,Guo J,Lu C,et al.Effect and mechanism of cyclodex⁃trins on nitrate reduction and bio-activity by S.oneidensis.MR-1.[J].Bioresource Technology,2020,317:124002.
[26]Sandil D,Kumar S,Arora K,et al.Biofunctionalized nano⁃structured tungsten trioxide based sensor for cardiac bio⁃marker detection[J].Materials Letters,2017,186:202-205.
Corruption Shewanella putrefaciens 4H ChromiumlgjvLekMfMP42xqpmiPjpA== Reduction Mechanism of Exploration
CHEN Xu1,GAO Jun1,BU Fantong1,CAI Yajun1,2
(a.School of Environmental Engineering,b.Engineering Research Center for Clean Production of Textile Dyeing and Printing)
Abstract:In order to investigate the mechanism of Cr(VI)reduction by S.putrefaciens 4H,scanning electron microscopy(SEM),Fourier-transform infrared spectroscopy(FTIR),X-ray photoelectron spectroscopy(XPS)and electrochemical testing were used to characterize it.The results indicate that the mechanism of Cr(VI)reduction by S.putrefaciens 4H was mainly related to the metabolism and electron trans-port capacity of microorganisms.XPS analysis revealed that there were two forms of Cr(VI)and Cr(III)on the surface of bacteria during the reduction of Cr(VI),which further proved that the bacteria removed hexavalent chromium by reduction method.SEM results showed that there was no obvious damage on the surface of the bacteria under chromium hexavalent stress,and the morphology of the bacteria changed from short rod type to long rod type,indicating that the bacteria had strong tolerance to Cr(VI).FTIR results show that with the increase of initial Cr(VI)concentration,the characteristic peaks represented by hydroxyl,carboxyl,amide and phosphate groups also increase signifi-cantly.The results of electron transfer performance test and electrochemical test show that the bacterium has strong electron transfer ability.This study provides atheoretical basis for the microbial treatment of Cr(VI)in reduction environments by investigating the mechanism of Cr(VI)reduction by S.putrefaciens 4H.
Keywords:shewanella putrefaciens;chromium reduction mechanism;electron transport;biological metabolism
(责任编辑:李强)

