实时三维超声心动图评估三尖瓣下移畸形解剖矫治术后右室重构的临床价值

摘" " 要" " 目的" " 探讨实时三维超声心动图(RT-3DE)评估三尖瓣下移畸形(EA)解剖矫治术后右室重构的临床应用价值。方法" " 选取在我院行外科解剖矫治术的22例EA患者,根据Carpentier分型分为A-B型组(10例)、C型组(6例)和D型组(6例),比较各组术前和术后6个月RT-3DE及心脏磁共振(CMR)检查结果的差异。采用Pearson相关分析法分析RT-3DE与CMR所测右室舒张末容积指数(RVEDVi)及右室射血分数(RVEF)的相关性。结果" " RT-3DE检查显示,各组术前左室射血分数、RVEF及术后6个月RVEF比较差异均有统计学意义(均Plt;0.05);22例EA患者术后6个月三尖瓣反流程度较术前减轻,RVEF和RVEDVi均减小,差异均有统计学意义(均 Plt;0.05)。CMR检查显示,22例EA患者术后6个月RVEDVi较术前减小,差异有统计学意义(Plt;0.05)。相关性分析显示,术前RT-3DE与CMR所测RVEDVi呈高度正相关(r=0.908,P=0.012),两种方法所测术后RVEDVi无相关性(r=0.522,P=0.184) ;RT-3DE与CMR所测术前和术后RVEF分别呈高度、中度正相关(r=0.818、0.564,均 Plt;0.05)。结论" " RT-3DE可准确评估EA患者右室容积和功能,在术后右室重构评估中具有重要的临床应用价值。
关键词" " 超声心动描记术,三维,实时;三尖瓣下移畸形;心脏磁共振;右室重构
[中图法分类号]R540.45" " " [文献标识码]A
Clinical value of real-time three-dimensional echocardiography in evaluating right ventricular remodeling after
correction of Ebstein anomaly
LIU Qianqian,GE Bin,LI Jinghui,WAN Linyuan,WANG Jingjin,MENG Hong
Department of Echocardiography,Fuwai Hospital,National Center for Cardiovascular Diseases,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100037,China
ABSTRACT" " Objective" " To investigate the clinical application value of real-time three-dimensional echocardiography(RT-3DE) in the evaluation of right ventricular remodeling after correction of Ebstein anomaly(EA).Methods" " A total of EA patients who underwent surgical anatomical correction in our hospital were selected,according to the Carpentier classification,they were divided into type A-B group(10 cases),type C group(6 cases) and type D group(6 cases).The differences of RT-3DE and cardiac magnetic resonance(CMR) findings among groups before operation and 6 months after operation were compared.Pearson correlation analysis was used to analyze the relationship between right ventricular diastolic end volume index(RVEDVi) and right ventricular ejection fraction(RVEF) measured by RT-3DE and CMR.Results" " "RT-3DE show that there were statistically significant differences in left ventricular ejection fraction(LVEF) and RVEF before operation and RVEF at 6 months after operation among groups(all Plt;0.05).Compared with the preoperative results,the degree of tricuspid regurgitation,RVEF and" RVEDVi were decreased in 22 EA patients 6 months after operation,and the differences were statistically significant(all Plt;0.05).CMR showed that the RVEDVi was decreased in 22 EA patients 6 months after operation compared with the preoperative results,there was statistically significant difference(Plt;0.05).The correlation analysis showed that the RT-3DE value of preoperative RVEDVi was highly positively correlated with the CMR value(r=0.908,P=0.012),but there was no correlation between the two methods of postoperative RVEDVi(r=0.522,P=0.184),the RT-3DE value of preoperative and postoperative RVEF were highly and moderately positively correlated with the CMR value(r=0.818,0.564,both Plt;0.05).Conclusion" " RT-3DE could accurately evaluate the right ventricular volume and function in EA patients,and has important clinical application value in the evaluation of postoperative right ventricular remodeling.
KEY WORDS" " Echocardiography,three-dimensional,real-time;Ebstein anomaly;Cardiac magnetic resonance;Right ventricular remodeling
三尖瓣下移畸形(Ebstein anomaly,EA)是一种罕见的先天性心脏畸形,占所有先天性心脏病的0.5%,其可影响三尖瓣和右心发育,从而引起心脏解剖结构和功能改变[1] 。胚胎学机制认为,三尖瓣小叶分层失败,导致三尖瓣隔叶和后叶均会不同程度地向心尖移位,且有效三尖瓣环相对于主动脉根部发生了旋转[2],以上改变会使右室流入部发生房化,右室被划分为功能右室和房化右室,有效容积减少,右室功能呈渐进性损害,且合并不同程度三尖瓣反流。目前EA解剖矫治术使用较多的术式为锥形重建术[3-5],术后右室重构对预后的影响显著,因此全面评估EA术后右室重构至关重要。既往研究[6-8]多聚焦于实时三维超声心动图(real-time three-dimensional echocardiography,RT-3DE)对三尖瓣及右心解剖结构的评估,关于EA解剖矫治术后右室重构的研究较少。本研究旨在探讨RT-3DE在EA解剖矫治术后右室重构评估中的临床价值,分析其检查结果与心脏磁共振(cardiac magnetic resonance,CMR)的相关性。
资料与方法
一、研究对象
选取2015年10月至2022年8月在我院行外科解剖矫治术的EA患者22例,其中男12例,女10例,年龄1~66岁,中位年龄30.7(14.1,38.4)岁,中位体质量58.0(40.0,67.0) kg。纽约心脏病学会(NYHA)心功能分级Ⅰ级10例,Ⅱ级8例,Ⅲ级4例;三尖瓣反流程度≥中度20例,合并房间隔缺损和室间隔缺损各5例;其中18例采用锥形重建术,4例采用Carpentier法,3例因快速心律失常术中行射频消融术。根据Carpentier分型[9]将22例EA患者分为3组,包括A-B型组10例,C型组6例,D型组6例。纳入标准:①常规经胸超声心动图诊断为EA,下移隔叶附着点与二尖瓣前叶附着点之间的距离≥8 mm/m2;②符合外科解剖矫治术的适应证;③术前及术后6个月均行常规经胸超声心动图、RT-3DE、CMR,以及体格检查、12导联心电图、X线等检查,超声心动图与CMR检查间隔时间不超过48 h;④术后每年门诊随访。排除标准:①既往有心脏手术史;②合并其他心脏复杂畸形(如大动脉转位、瓣膜病变);③图像质量欠佳或未能完成本研究相关检查;④严重心肾功能不全、呼吸功能不全、重度贫血等。本研究经我院医学伦理委员会批准(批准号:2017-977),所有患者或其家属均签署知情同意书。
二、仪器与方法
1.仪器:使用Philips EPIQ 7C彩色多普勒超声诊断仪,X5-1探头,频率1~5 MHz;配备QLab 15.0图像分析软件和三维自动右室定量软件。
2.超声心动图检查及图像分析:患者取左侧卧位,同步连接心电图。根据美国超声心动图协会操作指南[10]应用常规经胸超声心动图获取清晰的心尖四腔心切面、短轴切面及右室流入道切面图像,测量右房及右室内径、三尖瓣瓣叶长度、下移距离,观察三尖瓣反流情况;根据Zoghbi等[11]方法将三尖瓣反流程度分为少量、中量及大量,并结合临床实际情况进一步细化分级,具体为:微量记为0.5级,少量记为1.0级,少至中量记为1.5级,中量记为2.0级,中至大量记为3.0级,大量记为4.0级。应用动态心脏模型成像模式采集连续3个心动周期的超声数据,帧频≥20帧/s。所有图像均以 DICOM格式储存,应用 QLab 15.0图像分析软件进行后处理,自动获取左室舒张末容积指数(LVEDVi)及左室射血分数(LVEF)。选择聚焦右室的心尖四腔心三维全容积超声图像,三维自动右室定量软件自动识别舒张末期和收缩末期右室心内膜面,对自动描记不准确的位置进行手动调整,使乳头肌、肌小梁及调节束均包含在右室腔内,生成右室三维模型,测量右室舒张末容积指数(RVEDVi)及右室射血分数(RVEF),以3个心动周期的平均值为最终测值。根据梅奥诊所的标准[12],描记右室容积时需包含房化右室。图像采集及后处理均由两名经验丰富的超声医师独立完成,意见不一致时协商统一。
3.CMR检查:使用Philips Ingnia 3.0T磁共振扫描仪,参考文献[13]的方法进行检查,采用Philips 3.0T后处理工作站(Medis Suite 2.1.1.2.2)分析图像并处理数据,获取LVEDVi、LVEF、RVEDVi及RVEF。上述操作均由两名经验丰富的影像医师独立完成,意见不一致时协商统一。
4.随访情况:所有患者均于术后6个月门诊随访,以后每年随访1次,随访时间截至2023年6月;随访项目包括临床一般情况评估和CMR、RT-3DE、心电图、X线检查。
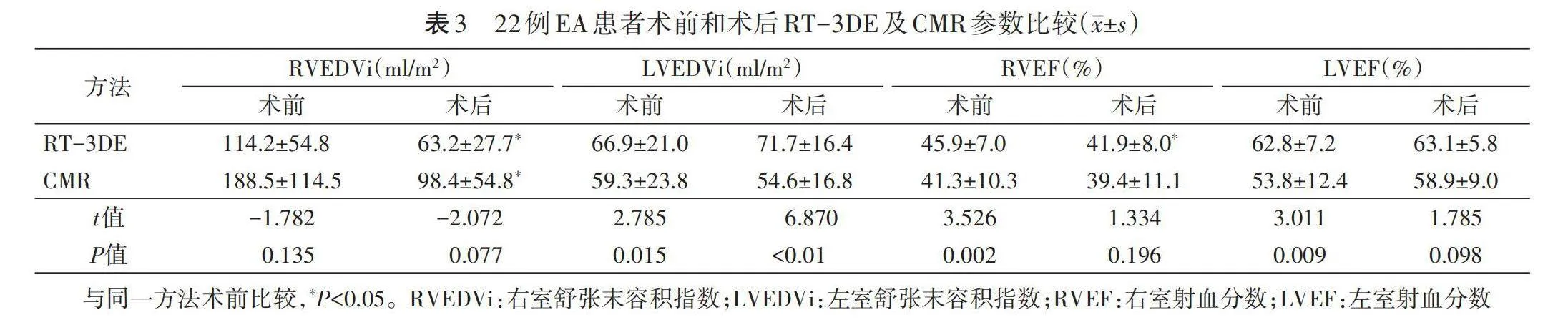
5.一般资料获取:查阅电子病历获取两组年龄、性别、体质量指数、机械辅助通气时间、术后特护时间及术中体外循环时间、主动脉阻断时间。
三、统计学处理
应用SPSS 22.0统计软件,符合正态分布的计量资料以x±s表示,多组比较采用单因素方差分析,两组比较采用配对样本t检验;非正态分布的计量资料以M(Q1,Q3)表示,采用Kruskal-Wallis H检验。计数资料以频数或率表示,采用χ2检验。等级资料采用Kruskal-Wallis H检验。相关性分析采用Pearson相关分析法,r值≥0.8~1.0为高度相关,0.5~0.8为中度相关。Plt;0.05为差异有统计学意义。
结" 果
一、各组一般资料比较
各组术后特护时间比较差异有统计学意义(P=0.031),年龄、性别、体质量指数、机械辅助通气时间及术中体外循环时间、主动脉阻断时间比较差异均无统计学意义。见表1。
二、RT-3DE检查结果
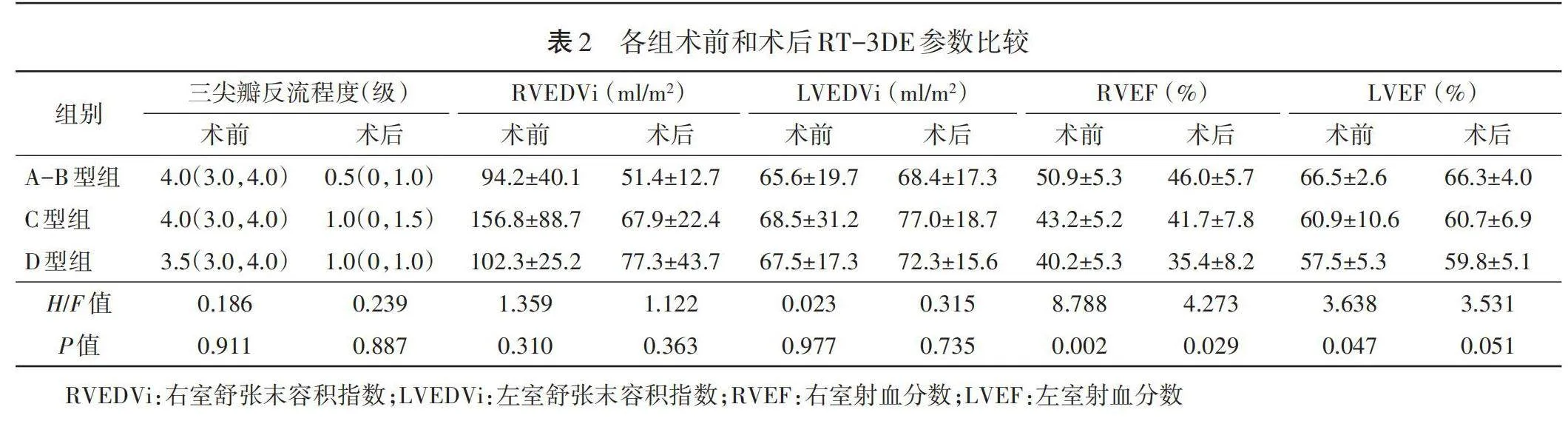
各组术前LVEF、RVEF及术后RVEF比较差异均有统计学意义(均Plt;0.05)。各组术前和术后三尖瓣反流程度、RVEDVi、LVEDVi及术后LVEF比较差异均无统计学意义。见表2和图1。
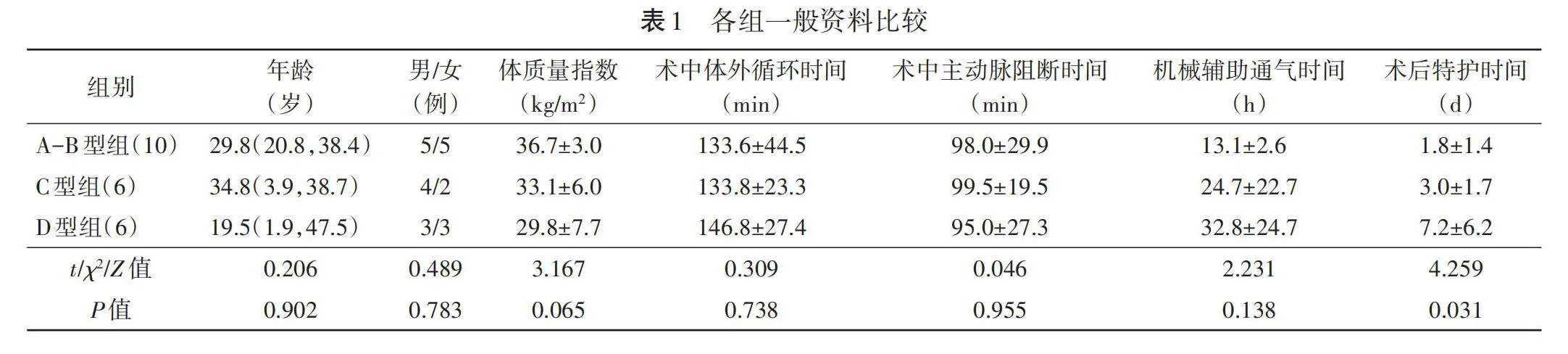
22例EA患者术后三尖瓣反流程度较术前减轻(术前反流程度≥中度者20例,术后反流程度≥中度者3例),RVEF和RVEDVi均减小,差异均有统计学意义(均Plt;0.05)。术前与术后LVEDVi、LVEF比较差异均无统计学意义。见表3。
三、CMR检查结果
CMR检查显示,22例EA患者术后RVEDVi较术前减小,差异有统计学意义(Plt;0.05),术前和术后LVEDVi、RVEF及LVEF比较差异均无统计学意义。见表3。
四、RT-3DE与CMR测值的相关性分析
相关性分析显示,RT-3DE与CMR所测术前RVEDVi呈高度正相关(r=0.908,P=0.012),两种方法所测术后RVEDVi无相关性(r=0.522,P=0.184) ;RT-3DE与CMR所测术前和术后RVEF分别呈高度、中度正相关(r=0.818、0.564,均 Plt;0.05)。
五、随访情况
术后中位随访时间为22.9(6.5,35.9)个月,无患者死亡,1例患者出现少量心包积液,经对症处理后心包积液消失;1例患者发生Ⅰ度房室传导阻滞,临床予以静脉滴注异丙肾上腺素后恢复正常;其余患者均未见严重并发症。
讨" 论
EA于1866年由德国病理学家Wilhelm Ebstein首次以病例形式报道,其发病机制可能为三尖瓣隔叶和后叶均不同程度地向心尖移位,右室流入部发生房化,右室被划分为功能右室和房化右室,有效容积减少,右室功能呈渐进性损害,且合并三尖瓣反流[1] 。EA患者三尖瓣发育、房化右室大小、右室发育情况及是否合并心律失常、其他心内畸形等情况复杂,病情严重程度不同,若未及时治疗预后较差,2岁前确诊者存活率仅68%[14] 。既往研究[15-16]主要关注RT-3DE对EA异常三尖瓣解剖结构的评估,而忽略对右室整体解剖和功能的影响,不利于术式选择和预后评估。目前关于EA患者术前及术后心室结构及功能变化特点的研究较少。尽管既往研究[17] 报道CMR可提供EA患者术前心室解剖结构和功能方面的信息,但其临床应用有一定局限;RT-3DE具有实时、便捷、可重复性好等优点,通过评估EA患者术后心室重构能够为临床治疗决策、手术时机及手术方式的选择提供参考,提高手术成功率,改善患者预后。本研究旨在探讨RT-3DE在EA患者右室重构评估中的临床应用价值。
本研究结果显示各组术后特护时间、术前及术后RVEF比较差异均有统计学意义(均Plt;0.05)。表明病变程度越重的EA患者右室整体收缩功能越差,术后需要更长的特护时间。各组术前LVEF比较差异有统计学意义(P=0.047),与既往研究[18] 结果相似。分析其机制:EA血流动力学损伤主要是由于三尖瓣反流导致的右心容量超负荷,但右心与左心之间复杂的骨架结构和血流动力学会相互作用,也可能导致左室收缩功能障碍,且左心功能可间接反映疾病的严重程度。
文献[19] 报道,RVEDVilt;58 ml/m2为右室缩小,58~114 ml/m2为右室正常,gt;114~170 ml/m2为右室扩张,gt;170 ml/m2 为右室显著扩张。本研究RT-3DE检查结果显示,EA患者RVEDVi由术前的(114.2±54.8)ml/m2下降至术后(63.2±27.7)ml/m2,差异有统计学意义(Plt;0.05),提示右室扩张改善。分析原因可能为解剖矫治术减轻了三尖瓣反流程度,使右室容积缩小,增加了右室每搏输出量,改善了右室整体运动同步性,并恢复了右室几何形状,对右室功能有显著改善[20-21] 。既往研究[22] 报道,C型及D型EA患者术后RVEF均较术前出现一定程度降低,但随之会恢复。本研究中C型组和D型组患者术后RVEF较术前下降,与上述研究结果相似。分析原因可能为三尖瓣反流程度减轻降低了右室代偿性强收缩的需求,房化右室尤其室间隔基底区域由于下移畸形导致固有心肌层变薄甚至为纤维组织替代,从而使心肌收缩功能减低[23] 。
CMR是目前临床评估右室容积和功能的“金标准”,但由于成像时间及伪影等因素影响,其对瓣膜的评估价值欠佳,需探寻一种更便捷的方法以评估患者右室功能。本研究结果发现RT-3DE与CMR所测RVEDVi和RVEF均有较好的相关性,尤其两种方法所测术前RVEDVi呈高度正相关(r=0.908,P=0.012),提示RT-3DE可准确评估EA患者房化右室、功能右室、三尖瓣空间结构及左心结构、功能等,且具有便捷、实时等优点,可作为EA患者围术期评估和预后预测的重要方法,为术式选择及术后随访提供依据。本研究还发现RT-3DE与CMR所测术后RVEDVi无相关性(r=0.522,P=0.184),分析原因可能为术后早期超声图像质量欠佳,可能在一定程度上影响RT-3DE测值的准确性。
本研究的局限性:①为单中心、小样本研究,今后需扩大样本量,并进行多中心研究;②缺乏超声新技术的应用,应变技术可准确反映术后室壁运动改变,今后可将其应用于EA患者围术期室壁节段运动方面的评估;③由于样本量的限制,未对不同Carpentier分型患者进行右室解剖结构及功能变化的比较,今后可扩大样本量分组研究不同Carpentier分型EA患者右心重构及其与预后的关系。
综上所述,RT-3DE可准确评估EA患者术后右室重构,与CMR具有较高的相关性,在病情评估和术后随访方面具有重要的临床应用价值。
参考文献
[1] Ramcharan T,Goff DA,Greenleaf CE,et al.Ebstein’s anomaly:from fetus to adult-literature review and pathway for patient care[J].Pediatr Cardiol,2022,43(7):1409-1428.
[2] Lamers WH,Virágh S,Wessels A,et al.Formation of the tricuspid valve in the human heart[J].Circulation,1995,91(1):111-121.
[3] Fuchs MM,Connolly HM.Ebstein anomaly in the adult patient[J].Cardiol Clin,2020,38(3):353-363.
[4] Da SJ,Baumgratz JF,Da FL,et al.The cone reconstruction of the tricuspid valve in Ebstein’s anomaly.The operation:early and midterm results[J].J Thorac Cardiovasc Surg,2007,133(1):215-223.
[5] 李论,杨学勇,景小勇,等.三尖瓣下移畸形的外科治疗策略和中远期随访[J].中华胸心血管外科杂志,2020,36(6):321-325.
[6] Utsunomiya H,Itabashi Y,Mihara H,et al.Usefulness of 3D echocardiographic parameters of tricuspid valve morphology to predict residual tricuspid regurgitation after tricuspid annuloplasty[J].Eur Heart J Cardiovasc Imaging,2017,18(7):809-817.
[7] Chen Y,Liu YX,Yu YJ,et al.Prognostic value of tricuspid valve geometry and leaflet coaptation status in patients undergoing tricuspid annuloplasty:a three-dimensional echocardiography study[J].J Am Soc Echocardiogr,2019,32(12):1516-1525.
[8] Kawase T,Takahashi Y,Ito A,et al.Three-dimensional transesophageal echocardiographic morphological evaluation of the tricuspid valve[J].Interact Cardiovasc Thorac Surg,2022,35(2):145.
[9] Carpentier A,Chauvaud S,Macé L,et al.A new reconstructive operation for Ebstein’s anomaly of the tricuspid valve[J].J Thorac Cardiovasc Surg,1988,96(1):92-101.
[10] Zoghbi WA,Adams D,Bonow RO,et al.Recommendations for noninvasive evaluation of native valvular regurgitation:a Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance[J].J Am Soc Echocardiogr,2017,30(4):303-371.
[11] Zoghbi WA,Enriquez-Sarano M,Foster E,et al.Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography[J].J Am Soc Echocardiogr,2003,16(7):777-802.
[12] Qureshi MY,O’Leary PW,Connolly HM.Cardiac imaging in Ebstein anomaly[J].Trends Cardiovasc Med,2018,28(6):403-409.
[13] Hösch O,Sohns JM,Nguyen TT,et al.The total right/left-volume index:a new and simplified cardiac magnetic" resonance measure to evaluate the severity of Ebstein anomaly of the tricuspid valve:a comparison with heart failure markers from various modalities[J].Circ Cardiovasc Imaging,2014,7(4):601-609.
[14] Pasqualin G,Boccellino A,Chessa M,et al.Ebstein’s anomaly in children and adults:multidisciplinary insights into imaging and therapy[J].Heart,2024,110(4):235-244.
[15] Vettukattil JJ,Bharucha T,Anderson RH.Defining Ebstein’s malformation using three-dimensional echocardiography[J].Interact Cardiovasc Thorac Surg,2007,6(6):685-690.
[16] 武玉多,谷孝艳,张宏家,等.三尖瓣下移畸形研究进展[J].医学研究杂志,2019,48(9):184-187.
[17] Yu S,Yang K,Chen X,et al.Cardiac remodeling after tricuspid valve repair in Ebstein’s anomaly:a magnetic resonance study[J].Eur Radiol,2023,33(3):2052-2061.
[18] Egbe AC,Miranda WR,Dearani JA,et al.Hemodynamics and clinical implications of occult left ventricular dysfunction in adults undergoing Ebstein anomaly repair[J].Circ Cardiovasc Imaging,2021,14(2):e011739.
[19] Kawel-Boehm N,Maceira A,Valsangiacomo-Buechel ER,et al.Normal values for cardiovascular magnetic resonance in adults and children[J].J Cardiovasc Magn Reson,2015,17(1):29.
[20 Lange R,Burri M,Eschenbach LK,et al.Da Silva’s cone repair for Ebstein’s anomaly:effect on right ventricular size and function[J].Eur J Cardiothorac Surg,2015,48(2):316-320,320-321.
[21] Brown ML,Dearani JA,Danielson GK,et al.Functional status after operation for Ebstein anomaly:the Mayo clinic experience[J].J Am Coll Cardiol,2008,52(6):460-466.
[22] Perdreau E,Tsang V,Hughes ML,et al.Change in biventricular function after cone reconstruction of Ebstein’s anomaly:an echocardiographic study[J].Eur Heart J Cardiovasc Imaging,2018,19(7):808-815.
[23] Yang D,Li X,Sun JY,et al.Cardiovascular magnetic resonance evidence of myocardial fibrosis and its clinical significance in adolescent and adult patients with Ebstein’s anomaly[J]. J Cardiovasc Magn Reson,2018,20(1):69.
(收稿日期:2024-01-30)

