低频低强度超声辐照微泡对三阴性乳腺癌MDA-MB-231/DOX细胞耐药性的影响



摘" " 要" " 目的" " 探讨低频低强度超声辐照微泡(LILFU-MB)对三阴性乳腺癌MDA-MB-231/DOX细胞耐药性的影响。方法" " 筛选LILFU-MB最佳非毒性辐照时间,计算细胞存活率;将MDA-MB-231/DOX细胞分为LILFU-MB辐照组和非LILFU-MB辐照组,绘制药物抑制拟合曲线图获得两组药物的半抑制浓度(IC50),并筛选阿霉素最佳剂量。根据不同处理方式将细胞分为对照组、阿霉素组、LILFU-MB组、LILFU-MB+阿霉素组,观察细胞增殖活性,并计算细胞迁移率。使用倒置荧光显微镜观察细胞形态,并记录细胞核荧光强度及细胞核型;使用流式细胞仪检测细胞凋亡率;Western blot检测细胞蛋白表达情况。结果" " LILFU-MB最佳非毒性辐照时间为30 s,该条件下细胞存活率为(92.33±2.58)%,故后续实验中LILFU-MB辐照时间均采用此条件。LILFU-MB辐照组中阿霉素对耐药细胞的IC50低于非LILFU-MB辐照组(7.51 µmol/L vs. 35.40 µmol/L),后续实验采用35.40 µmol/L为阿霉素最佳剂量。阿霉素组和LILFU-MB+阿霉素组细胞增殖活性均受到明显抑制,增殖速度减慢,其中LILFU-MB+阿霉素组抑制效果最明显。对照组、阿霉素组、LILFU-MB组、LILFU-MB+阿霉素组细胞迁移率分别为(56.79±1.11)%、(51.34±4.66)%、(46.09±9.42)%、(22.01±6.02)%,其中LILFU-MB+阿霉素组细胞迁移率低于其余各组,差异均有统计学意义(均Plt;0.01)。倒置荧光显微镜观察显示,LILFU-MB+阿霉素组中大部分细胞核明显皱缩和碎裂,胞核蓝染高亮,染色质呈浓缩和边缘化,表现出较强的细胞凋亡核型改变。流式细胞仪检测结果显示,对照组、阿霉素组、LILFU-MB组、LILFU-MB+阿霉素组细胞凋亡率分别为(13.30±0.66)%、(22.68±2.85)%、(20.60±3.72)%、(31.84±2.87)%,其中LILFU-MB+阿霉素组细胞凋亡率高于其余各组,差异均有统计学意义(均Plt;0.05)。LILFU-MB+阿霉素组P-gp、Bcl-2蛋白表达均显著下调,Cyt-c、Cl-caspase3蛋白表达均显著上调,与其余各组比较差异均有统计学意义(均Plt;0.05)。结论" " LILFU-MB能够显著抑制MDA-MB-231/DOX细胞增殖、迁移,并促进细胞凋亡,进而逆转三阴性乳腺癌MDA-MB-231/DOX细胞耐药性。
关键词" " 超声辐照,低频,低强度;微泡;三阴性乳腺癌;多药耐药性;阿霉素
[中图法分类号]R445.1" " " [文献标识码]A
Effect of low-frequency and low-intensity ultrasound irradiation microbubbles on drug resistance of triple-negative breast
cancer MDA-MB-231/DOX cells
WU Zhihui,QU Ni’na,CHEN Huangzhuonan,WANG Guoyun,BI Menglu,LIU Hexiu,CAO Xiaoli
School of Medical Imaging,Binzhou Medical University,Shandong 264003,China
ABSTRACT" " Objective" " To investigate the effect of low-frequency and low-intensity ultrasound irradiation microbubbles(LILFU-MB) on drug resistance of triple-negative breast cancer MDA-MB-231/DOX cells.Methods" " The best non-toxic irradiation time of LILFU-MB was screened and the cell survival rate was calculated.The MDA-MB-231/DOX cells were divided into LILFU-MB irradiation group and non LILFU-MB irradiation group.The drug inhibition fitting curve was drawn to obtain the half inhibitory concentration (IC50) of the two groups of drugs,the best dose of doxorubicin was screened.According to different treatment methods,the cells were divided into control group,doxorubicin group,LILFU-MB group,LILFU-MB+doxorubicin group,the cell proliferation activity was observed,and the cell migration rate was calculated.The morphology of the cells were observed by inverted fluorescence microscope,and the fluorescence intensity and karyotype of the cells were recorded.The apoptosis rate was detected by flow cytometry.The protein expression was detected by Western blot.Results" " "The best non-toxic irradiation time of LILFU-MB was 30 s,and the cell survival rate was (92.33±2.58)% under this condition.This condition was used for the duration of LILFU-MB irradiation in subsequent experiments.The IC50 of doxorubicin on drug-resistant cells in the LILFU-MB irradiation group was lower than that in the non LILFU-MB irradiation group(7.51 µmol/L vs. 35.40 µmol/L).The best dose of doxorubicine was 35.40 µmol/L.The cell proliferation activity of doxorubicin group and LILFU-MB+doxorubicin group was significantly inhibited,and the proliferation rate was slowed down,and the inhibition effect of LILFU-MB+doxorubicin group was the most obvious.The cell migration rates of the control group,doxorubicin group,LILFU-MB group,LILFU-MB+doxorubicin group were (56.79±1.11)%,(51.34±4.66)%,(46.09±9.42)%,(22.01±6.02)%,respectively,and the cell migration rates of LILFU-MB+doxorubicin group were significantly different from that of other groups(all Plt;0.01).Inverted fluorescence microscope revealed that most of the nuclei in the LILFU-MB+doxorubicin group were obviously shrunk and fragmented,the blue staining of the nuclei was highlighted,the chromatin was concentrated and marginalized,and the strong apoptotic karyotype change was showed.The results of flow cytometry showed that the apoptosis rates of the control group,doxorubicin group,LILFU-MB group and LILFU-MB+doxorubicin group were (13.30±0.66)%,(22.68±2.85)%,(20.60±3.72)%,(31.84±2.87)%,respectively.The apoptosis rate of LILFU-MB+doxorubicin group was higher than that of the other groups,and the differences were statistically significant(all Plt;0.05).The expressions of P-gp protein and Bcl-2 in LILFU-MB+doxorubicin group were significantly down-regulated,while the expressions of Cyt-c and Cl-caspase3 protein were significantly up-regulated,and the differences were statistically significant compared with that of other groups(all Plt;0.05).Conclusion" " LILFU-MB can significantly inhibit the proliferation and migration of MDA-MB-231/DOX cells,promote cell apoptosis,and reverse the drug resistance of triple negative breast cancer MDA-MB-231/DOX cells.
KEY WORDS" " Ultrasound irradiation,low-frequency,low-intensity;Microbubbles;Triple-negative breast cancer;Multidrug resistance;Doxorubicin
目前,乳腺癌已成为全球发病率最高的恶性肿瘤,死亡率居全球女性恶性肿瘤首位,其在我国的发病率和死亡率亦均呈逐年上升趋势[1]。三阴性乳腺癌(triple-negative breast cancer,TNBC)占乳腺癌总体的10%~20%,作为一种特殊病理亚型的乳腺癌,极易出现早期复发和转移,在转移性乳腺癌中的占比约50%[2]。化疗是临床治疗TNBC的主要方法,蒽环类药物如阿霉素已广泛应用,短期内对癌细胞杀伤作用强,能够有效控制和杀灭癌细胞,但其缺乏靶向特异性,产生的全身毒副作用和获得性多药耐药会影响化疗效果[3]。因此,寻找副作用小且靶向性强的化疗药物一直是临床的研究热点。近年来低频低强度超声辐照微泡(low-intensity low-frequency ultrasound-microbubbles,LILFU-MB)在诱导肿瘤细胞凋亡、增加细胞膜通透性、开放生物屏障等方面均取得了较好的效果[4-5],但其对TNBC耐药细胞的相关作用尚未阐明。本实验通过探讨LILFU-MB对TNBC MDA-MB-231/DOX细胞耐药性的影响,旨在为TNBC的精准治疗提供参考。
材料与方法
一、主要实验材料
TNBC MDA-MB-231/DOX细胞株(中国科学院上海细胞与生物研究所);阿霉素化疗药物,纯度gt;98.0%(美国Sigma公司);SonoVue造影剂(意大利 Bracco公司);胎牛血清(德国 PAN公司);Annexin V-FITC/PI细胞凋亡检测试剂盒(武汉普诺赛生命科技有限公司);Hoechst 33342活细胞染色液、抗兔P-gp多抗(上海碧云天生物技术股份有限公司);抗兔Bcl-2单抗、抗兔Cyt-c单抗、抗兔Cl-caspase3单抗(武汉艾博泰克生物科技有限公司);GAPDH、HRP标记山羊抗兔二抗(上海BBI生命科学有限公司);CCK-8试剂盒(安徽兰杰科技有限公司);PBS缓冲液、RPMI 1640细胞培养基及Western blot实验所需相关试剂(山东思科捷生物技术有限公司)。
二、主要实验仪器
超声波治疗仪(WED-100,深圳威尔德医疗电子有限公司);移液器(Research Plus,德国Eppendorf公司);酶标仪(Multiskan FC,赛默飞世尔科技有限公司);倒置荧光显微镜(IX51,奥林巴斯有限公司);流式细胞仪(Moflo XDP,贝克曼库尔特商贸有限公司);化学发光成像分析系统(Chemi Scope 6200 Touch,上海勤翔科学仪器有限公司)。
三、实验方法
1.细胞培养:将TNBC MDA-MB-231/DOX细胞解冻后以1000 r/min的速度离心5 min,接种于含10%胎牛血清和1%青霉素-链霉素双抗的RPMI 1640细胞培养基(以下简称完全培养基)中,置于37℃、5% CO2的培养箱中复苏培养,至细胞恢复正常生长状态后加入5 µmol/L阿霉素以维持细胞耐药性,每2~3 d传代1次。收集对数生长期的细胞进行后续实验。
2.LILFU-MB最佳非毒性辐照时间筛选:取对数生长期的细胞制成浓度为5×105个/ml的单细胞悬液,加入20%体积的微泡(用5 ml 0.9%氯化钠溶液稀释SonoVue造影剂,充分振荡摇匀制成混悬液)混匀,分别接种于6个35 mm培养皿中。在培养皿底部均匀涂上耦合剂,然后使用超声探头垂直进行辐照,6个培养皿分别辐照0 s、10 s、30 s、60 s、90 s、120 s(LILFU-MB组);超声辐照条件:频率1 MHz,声强1.0 W/cm2,效率60%。然后用完全培养基将每个培养皿中的细胞密度均调整为1×104个/ml,并接种于96孔板,每孔100 µl,每组6个复孔,同时设置空白组和正常组,无菌培养箱中培养24 h后每孔加入10 µl CCK-8溶液,继续培养2 h;使用酶标仪测量各孔细胞在450 nm处的吸光度(optical density,OD)值,计算细胞存活率,公式为:细胞存活率=[(LILFU-MB组OD值-空白组OD值)/(正常组OD值-空白组OD值)]×100%。筛选LILFU-MB最佳非毒性辐照时间用于后续实验。
3.阿霉素最佳剂量筛选:取对数生长期的细胞制成浓度为5×105个/ml的单细胞悬液,然后分为LILFU-MB辐照组和非LILFU-MB辐照组,按照实验条件分别处理后收集细胞并制成1×104个/ml的混悬液,接种于96孔板,每孔100 µl,后续实验步骤同方法2,测量细胞OD值并计算细胞存活率。绘制药物抑制拟合曲线图获得药物的半抑制浓度(IC50),以此作为阿霉素最佳剂量;计算耐药逆转指数,公式为:耐药逆转指数=非LILFU-MB辐照组IC50/LILFU-MB辐照组IC50。
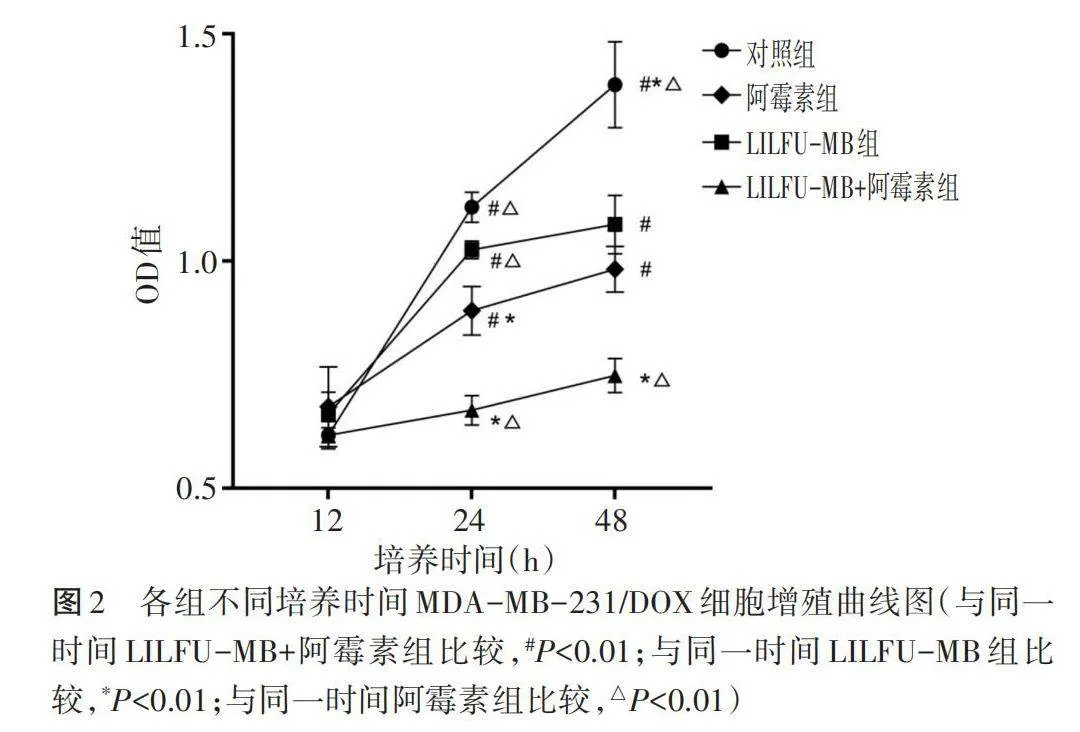
4.分组及增殖情况检测:按不同处理方法将细胞分为4组:对照组(0.8 ml单细胞悬液+0.2 ml PBS缓冲液)、阿霉素组(0.8 ml单细胞悬液+0.2 ml PBS缓冲液+最佳剂量的阿霉素)、LILFU-MB组(0.8 ml单细胞悬液+0.2 ml 微泡,辐照时间为方法2筛选结果)、LILFU-MB+阿霉素组(0.8 ml单细胞悬液+最佳剂量的阿霉素+0.2 ml微泡,辐照时间为方法2筛选结果),分别培养12 h、24 h、48 h,根据OD值绘制细胞增殖曲线,观察细胞增殖活性。
5.划痕实验检测细胞迁移情况:将各组细胞分别接种于6孔板中,待细胞融合度达80%~90%时使用无菌200 µl移液器枪头在板底部划等宽的直线。PBS缓冲液洗去漂浮细胞,分别于即刻和48 h后使用倒置荧光显微镜观察同一视野下的划痕宽度,并拍照记录。使用ImageJ软件获得对照组、阿霉素组、LILFU-MB组、LILFU-MB+阿霉素组在上述时间点的细胞划痕面积,计算各组细胞迁移率,公式为:细胞迁移率=(即刻空白面积-48 h空白面积)/即刻空白面积×100%。
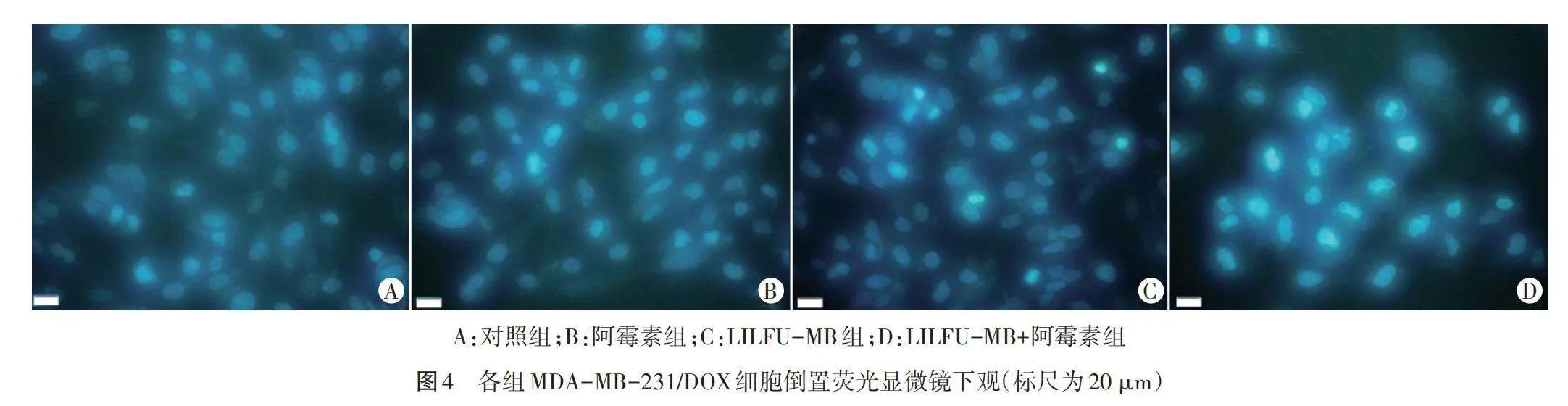
6.Hoechst染色法检测细胞形态:将各组细胞分别接种于12孔板中,每孔1 ml,均匀分布,24 h后将旧培养基吸出,PBS缓冲液洗涤2次,每孔加入10 µl Hoechst 33342活细胞染色液,无菌培养箱中继续培养10 min,然后用PBS缓冲液洗涤2~3次,于倒置荧光显微镜下观察细胞形态,并记录细胞核荧光强度及细胞核型。
7.Annexin V-FITC/PI检测细胞凋亡情况:将各组细胞分别接种于6孔板中,24 h后经胰酶消化,调整细胞浓度为5×105个/ml,加入500 µl Binding Buffer工作液重悬细胞,依次加入5 µl Annexin V-FITC和5 µl PI混匀后避光孵育15 min,使用流式细胞仪检测各组细胞凋亡率。
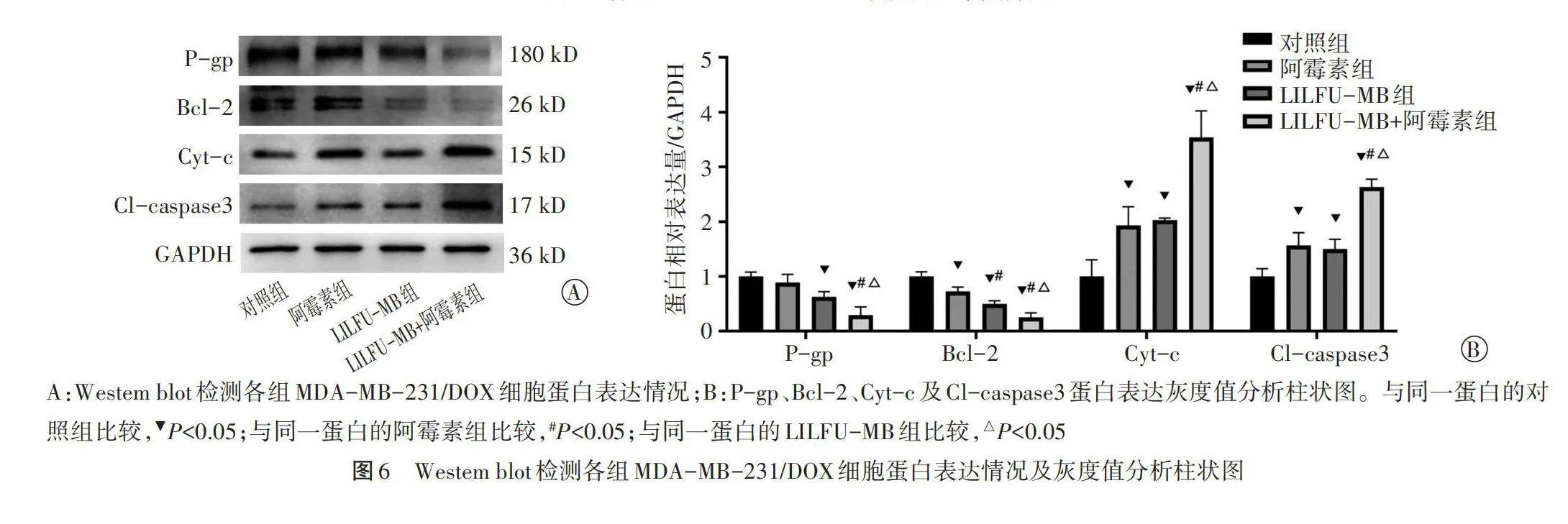
8.Western blot检测细胞蛋白表达情况:将各组细胞加入含PMSF的裂解液提取总蛋白,蛋白变性后进行SDS-PAGE电泳、转膜、封闭;将抗兔P-gp多抗(1∶1000)、抗兔Bcl-2单抗(1∶1000)、抗兔Cyt-c单抗(1∶1000)、抗兔Cl-caspase3单抗(1∶1000)、GAPDH(1∶4000)一抗在4℃孵育过夜,洗膜后加入HRP标记山羊抗兔二抗(1∶5000) 摇床孵育1 h,再次洗膜后加入ECL发光液显影拍照,应用化学发光成像分析系统获取各组P-gp、Bcl-2、Cyt-c及Cl-caspase3蛋白表达。
四、统计学处理
应用Graphpad Prism 9.0统计软件,计量资料以x±s表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析,组间多重比较采用Tukey-t检验。Plt;0.05为差异有统计学意义。
结" 果
一、LILFU-MB最佳非毒性辐照时间筛选结果
超声辐照0 s、10 s、30 s、60 s、90 s、120 s后MDA-MB-231/DOX细胞存活率分别为(97.35±0.69)%、(94.04±3.27)%、(92.33±2.58)%、(85.90±3.32)%、(65.41±4.03)%、(47.87±4.79)%。与辐照0 s比较,辐照60 s、90 s和120 s时细胞存活率均降低,差异均有统计学意义(均Plt;0.001);辐照10 s与辐照30 s时细胞存活率比较差异无统计学意义,故后续实验采用LILFU-MB辐照30 s进行研究。见图1。
二、阿霉素最佳剂量筛选结果
LILFU-MB辐照组细胞的IC50低于非LILFU-MB辐照组(7.51 µmol/L vs. 35.40 µmol/L),耐药逆转指数为4.71。后续实验采用35.40 µmol/L为阿霉素最佳剂量进行研究。
三、各组不同培养时间MDA-MB-231/DOX细胞增殖情况
细胞增殖曲线显示,培养24 h后阿霉素组和LILFU-MB+阿霉素组细胞OD值分别为0.89±0.05、0.67±0.03,均低于对照组和LILFU-MB组细胞OD值[(1.12±0.03、1.02±0.02)],差异均有统计学意义(均Plt;0.01);两组细胞增殖活性均受到明显抑制,增殖速度减慢,其中LILFU-MB+阿霉素组受抑制效果最明显。培养48 h后对照组、阿霉素组、LILFU-MB组、LILFU-MB+阿霉素组细胞OD值分别为1.39±0.09、0.98±0.05、1.08±0.06、0.75±0.04,均较各组培养24 h后稍有增高,但差异均无统计学意义。见图2。
四、LILFU-MB对MDA-MB-231/DOX细胞迁移能力的影响
划痕实验结果显示,对照组、阿霉素组、LILFU-MB组、LILFU-MB+阿霉素组细胞迁移率分别为(56.79±1.11)%、(51.34±4.66)%、(46.09±9.42)%、(22.01±6.02)%;其中LILFU-MB+阿霉素组细胞迁移率低于其余各组,差异均有统计学意义(均Plt;0.01);对照组、阿霉素组及LILFU-MB组细胞迁移率比较差异无统计学意义。 见图3。
五、LILFU-MB对MDA-MB-231/DOX细胞形态的影响
Hoechst染色结果显示,对照组细胞分布均匀,正常细胞核呈低强度荧光;阿霉素组和LILFU-MB组中仅见数个细胞核呈固缩状态,显示为致密浓染的高强度荧光;LILFU-MB+阿霉素组中大部分细胞核明显皱缩和碎裂,胞核蓝染高亮,染色质呈浓缩和边缘化,表现为较强的细胞凋亡核型改变。见图4。
六、LILFU-MB对MDA-MB-231/DOX细胞凋亡的影响
流式细胞仪检测显示,对照组、阿霉素组、LILFU-MB组、LILFU-MB+阿霉素组细胞凋亡率分别为(13.30±0.66)%、(22.68±2.85)%、(20.60±3.72)%、(31.84±2.87)%;与对照组比较,阿霉素组、LILFU-MB组及LILFU-MB+阿霉素组细胞凋亡率均升高,差异均有统计学意义(均Plt;0.05);阿霉素组与LILFU-MB组比较差异无统计学意义;LILFU-MB+阿霉素组细胞凋亡率高于其余各组,差异均有统计学意义(均Plt;0.05)。见图5。
七、LILFU-MB对MDA-MB-231/DOX细胞蛋白表达的影响
Western blot检测结果显示,与对照组比较,LILFU-MB组P-gp、Bcl-2蛋白表达均下调,Cyt-c、Cl-caspase3蛋白表达均上调,差异均有统计学意义(均Plt;0.05)。阿霉素组Bcl-2蛋白表达较对照组下调,Cyt-c、Cl-caspase3蛋白表达较对照组上调,差异均有统计学意义(均Plt;0.05);P-gp蛋白表达与对照组比较差异无统计学意义。LILFU-MB+阿霉素组P-gp、Bcl-2蛋白表达均显著下调,Cyt-c、Cl-caspase3蛋白表达均显著上调,与其余各组比较差异均有统计学意义(均Plt;0.05)。见图6。
讨" 论
TNBC作为乳腺癌中最具侵袭性的分子亚型,具有发病年龄早、临床分期晚、组织学级别高、极易局部复发和转移等特点[2]。TNBC对内分泌治疗及分子靶向治疗均不敏感,目前临床多采用蒽环类药物与紫杉醇、顺铂等药物联合化疗的治疗方案[6]。阿霉素作为蒽环类的一线化疗药物,极易使肿瘤细胞产生多药耐药性,从而导致化疗失败。因此,寻找逆转TNBC耐药性的分子靶点和治疗方法成为当前的研究热点。目前,LILFU-MB以其靶向特异性和非侵入性的特点在肿瘤治疗中受到广泛关注。LILFU是指频率20 kHz~1 MHz、声强lt;3.0 W/cm2的超声波,主要通过非热效应(机械效应和空化效应)实现无创调控,而微泡在LILFU作用下破裂可增强非热效应,以及血管和细胞膜的通透性,提高药物的转染率[7-8]。文献[9-11]报道LILFU-MB能够靶向传递抗癌药物,改善细胞对药物的摄取,使胰腺癌细胞、肺癌细胞、肝癌细胞等多种肿瘤细胞死亡,抑制癌细胞生长,但目前关于LILFU-MB逆转肿瘤细胞多药耐药性的相关报道较少。为明确LILFU-MB的逆转作用,本实验探讨了其对TNBC MDA-MB-231/DOX细胞耐药性的影响。
本实验采用LILFU-MB辐照TNBC MDA-MB-231/DOX细胞,结果显示与辐照0 s比较,辐照60 s、90 s和120 s时细胞存活率均降低,差异均有统计学意义(均Plt;0.001)。随着辐照时间的延长,细胞存活率下降,表明LILFU-MB能够以时间依赖方式显著抑制耐药细胞活力。辐照30 s时,细胞存活率与0 s比较差异无统计学意义,故本实验以LILFU-MB辐照30 s为最佳非毒性辐照时间。本实验结果显示,与非LILFU-MB辐照组比较,LILFU-MB辐照组中阿霉素对MDA-MB-231/DOX细胞的IC50明显降低,其耐药逆转指数为4.71,并筛选出后续实验中阿霉素的最佳剂量为35.40 μmol/L,提示LILFU-MB能够有效增强细胞对阿霉素的化疗敏感性。本实验细胞增殖实验和划痕实验结果显示,LILFU-MB+阿霉素组细胞增殖活性和迁移率均低于其余各组,差异均有统计学意义(Plt;0.01),提示LILFU-MB能使肿瘤细胞增殖能力显著降低且迁移能力减弱。本实验Hoechst染色实验结果显示,LILFU-MB+阿霉素组细胞出现明显凋亡特征,表现为核固缩、染色体凝集、形成凋亡小体;流式细胞仪检测结果显示LILFU-MB+阿霉素组细胞凋亡率高于其余各组,差异均有统计学意义(均Plt;0.05)。表明LILFU-MB增强了细胞毒性作用,能够明显抑制耐药细胞生长,诱导其死亡。分析原因可能为LILFU-MB使肿瘤细胞膜表面产生大量微小孔隙,改变了细胞膜表面酶的活性,使阿霉素快速大量进入细胞内,致使细胞凋亡增加[12]。
肿瘤细胞的耐药性涉及多种复杂的细胞内机制,除药物摄入减少外,还有药物流出增加。跨膜蛋白P-gp是ABC转运蛋白家族的一员,作为一种具有“药泵”功能的外排转运体,能与多种化疗药物结合并将其泵出肿瘤细胞,显著增加肿瘤细胞中药物的流出量,导致肿瘤细胞产生多药耐药性[13]。Qiu等[14]研究表明,LILFU能够下调 P-gp蛋白表达,增强吉西他滨对胰腺癌耐药ASPC-1细胞的化疗敏感性。另有研究[15]表明,Bcl-2蛋白触发Cyt-c从线粒体释放,随后激活caspase3,导致染色质凝聚和核酸酶激活,诱导细胞凋亡。本实验Western blot检测结果显示,LILFU-MB+阿霉素组P-gp、Bcl-2蛋白表达均显著下调,Cyt-c、Cl-caspase3蛋白表达均显著上调,与其余各组比较差异均有统计学意义(均Plt;0.05),表明LILFU-MB下调P-gp、Bcl-2蛋白表达是克服TNBC多药耐药的有效治疗策略,而上调Cyt-c和Cl-caspase3蛋白表达可实现耐药细胞凋亡。
综上所述,LILFU-MB对TNBC MDA-MB-231/DOX细胞具有毒性增效作用,能够抑制细胞的增殖、迁移,诱发细胞凋亡。其机制可能与下调P-gp、Bcl-2蛋白表达,上调Cyt-C、Cl-caspase3蛋白表达,进而逆转TNBC细胞耐药并增加细胞凋亡易感性有关。然而其中涉及的具体通路尚需今后深入研究,以期为临床肿瘤治疗提供新的研究思路。
参考文献
[1] 何思怡,李贺,曹毛毛,等.全球及我国女性乳腺癌疾病负担年龄分布及变化趋势[J].中国肿瘤,2023,32(1):1-7.
[2] Huang M,Haiderali A,Fox GE,et al.Economic and humanistic burden of triple-negative breast cancer:a systematic literature review[J].Pharmacoeconomics,2022,40(5):519-558.
[3] Yuan SJ,Xu YH,Wang C,et al.Doxorubicin-polyglycerol-nanodiamond conjugate is a cytostatic agent that evades chemoresistance and reverses cancer-induced immunosuppression in triple-negative breast cancer[J].J Nanobiotechnology,2019,17(1):110.
[4] Wanigasekara J,de Carvalho AMA,Cullen PJ,et al.Converging technologies:targeting the hallmarks of cancer using ultrasound and microbubbles[J].Trends Cancer,2021,7(10):886-890.
[5] Zhang DY,Dmello C,Chen L,et al.Ultrasound-mediated delivery of paclitaxel for glioma:a comparative study of distribution,toxicity,and efficacy of albumin-bound versus cremophor formulations[J].Clin Cancer Res,2020,26(2):477-486.
[6] Yin L,Duan JJ,Bian XW,et al.Triple-negative breast cancer molecular subtyping and treatment progress[J].Breast Cancer Res,2020,22(1):61.
[7] 金婷婷,蒋天安,郑树森,等.惰性气体微泡联合低频低强度超声辐照对人胰腺癌PANC-1细胞抑癌作用的实验研究[J].临床超声医学杂志,2022,24(7):481-484.
[8] 王婕,朱吉妮,马新欣,等.低强度超声在脑神经疾病治疗中的应用进展[J].临床超声医学杂志,2021,23(3):220-222.
[9] Zhang L,Sun L,Tang Q,et al.Cascade drug delivery through tumor barriers of pancreatic cancer via ultrasound in combination with functional microbubbles[J].ACS Biomater Sci Eng,2022,8(4):1583-1595.
[10] 李玥,蒋帅,杨希,等.超声联合微泡对卡铂化疗A549肺癌细胞凋亡影响的实验研究[J].临床超声医学杂志,2023,25(2):81-84.
[11] Luo H,Li J,Lin Q,et al.Ultrasonic irradiation and SonoVue microbubbles-mediated RNA interference targeting PRR11 inhibits breast cancer cells proliferation and metastasis,but promotes apoptosis[J].Biosci Rep,2020,40(11):BSR20201854.
[12] He J,Liu Z,Zhu X,et al.Ultrasonic microbubble cavitation enhanced tissue permeability and drug diffusion in solid tumor therapy[J].Pharmaceutics,2022,14(8):1642.
[13] 林慧,吉丽银,符策岗.乳腺癌化疗耐药的分子机制[J].中国组织化学与细胞化学杂志,2022,31(2):194-201.
[14] Qiu F,Chen J,Cao J,et al.Low‑intensity low‑frequency ultrasound enhances the chemosensitivity of gemcitabine‑resistant ASPC-1 cells via PI3K/AKT/NF-κB pathway‑mediated ABC transporters[J].Oncol Rep,2020,44(3):1158-1168.
[15] Lin KN,Zhao W,Huang SY,et al.Grape seed proanthocyanidin extract induces apoptosis of HL-60/ADR cells via the Bax/Bcl-2 caspase-3/9 signaling pathway[J].Transl Cancer Res,2021,10(9):3939-3947.
(收稿日期:2023-10-06)

