对比培门冬酶与门冬酰胺酶对急性淋巴细胞白血病化疗患儿血液指标的影响
【摘要】目的 探讨采用培门冬酶与门冬酰胺酶治疗急性淋巴细胞白血病对患儿凝血功能及炎症因子水平的影响,为临床治疗该疾病提供参考依据。方法 回顾性分析北京高博博仁医院2022年1月至2023年10月收治的急性淋巴细胞白血病患儿131例的临床资料,按照治疗方法不同将其分为两组,A组[66例,化疗联合门冬酰胺酶治疗]和B组(65例,化疗联合培门冬酶治疗)。28 d为1个疗程,两组患儿均治疗1个疗程。比较两组患儿治疗后临床疗效,治疗前后凝血功能、炎症因子水平,以及治疗期间不良反应发生情况。结果 与治疗前比,治疗后两组患儿凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)水平均延长,且B组均长于A组;纤维蛋白原(FIB)及血清铁蛋白(SF)、超敏-C反应蛋白(hs-CRP)、白细胞介素-6(IL-6)水平均降低,且B组均低于A组;B组患儿过敏、血糖升高发生率低于A组(均P<0.05);两组患儿治疗后临床疗效、肝损害、胰腺炎、胃肠道反应发生率比较,差异无统计学意义(P>0.05)。结论 与化疗联合门冬酰胺酶的治疗方案相比,急性淋巴细胞白血病患儿采用化疗联合培门冬酶治疗的临床疗效相当,但其可有效降低血清炎症因子水平,且安全性良好,但应注意可能导致凝血功能障碍,临床治疗过程中应密切监测患儿凝血功能。
【关键词】急性淋巴细胞白血病 ; 门冬酰胺酶 ; 培门冬酶 ; 凝血功能 ; 炎症因子
【中图分类号】R733.71 【文献标识码】A 【文章编号】2096-3718.2024.18.0095.03
DOI:10.3969/j.issn.2096-3718.2024.18.031
急性淋巴细胞白血病是一种常见的急性白血病类型,主要特征是骨髓中异常淋巴细胞的大量增殖和正常造血功能的抑制,患儿常表现为贫血、出血、发热、肝脾及淋巴结肿大、骨关节疼痛和头痛等,其发病原因与生物因素、物理因素、化学因素、遗传因素等均有一定关系。门冬酰胺酶是一种提取自欧文菌属的酶制剂类抗肿瘤药物,其作为急性淋巴细胞白血病治疗领域的主要药物,通过促进门冬酰胺酶的水解作用,可以使肿瘤细胞蛋白质合成障碍,增殖受到抑制,也可干扰脱氧核苷酸(DNA)和核糖核苷酸(RNA)的合成[1]。然而,在临床应用中,为确保治疗效果的持续性,需要反复且持续地进行注射治疗,一旦中断治疗,患儿将面临较高的疾病复发风险,这在一定程度上限制了该药物在实际应用中的广泛性和长期治疗效果。培门冬酶是一种新型长效门冬酰胺酶类抗肿瘤药物,属于人工合成的酶类,可以选择性消耗血浆中的门冬酰胺酶,而白血病细胞自身无法合成门冬酰胺,因此,这一过程影响了蛋白质的合成,从而能够杀灭白血病细胞,最终促使白血病细胞凋亡,以达到治疗目的,由于正常细胞能够合成门冬酰胺酶,因此对正常细胞影响较小[2]。基于此,本研究旨在探究培门冬酶与门冬酰胺酶两种药物对急性淋巴细胞白血病患儿的血液指标的影响,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析北京高博博仁医院2022年1月至2023年10月收治的急性淋巴细胞白血病患儿131例的临床资料,按照治疗方法不同将其分为两组,A组(66例)和B组(65例)。A组(66例)中男性患儿38例,女性患儿28例;年龄5~13岁,平均(9.01±0.92)岁;危险度分层[3]:低危26例,中危30例,高危10例。B组(65例)中男性患儿39例,女性患儿26例;年龄4~13岁,平均(8.98±1.01)岁;危险度分层:低危23例,中危34例,高危8例。两组患儿一般资料比较,差异无统计学意义(P>0.05),组间可比。纳入标准:⑴符合《中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2018年版)》 [4]中急性淋巴细胞白血病的诊断标准;⑵首次确诊;⑶可耐受化疗。排除标准:⑴合并其他严重基础疾病;⑵合并先天性精神疾病;⑶有其他抗肿瘤治疗史。本研究经北京高博博仁医院医学伦理委员会审核批准。
1.2 治疗方法 两组患儿均进行常规化疗治疗,:注射用硫酸长春新碱(广州白云山制药有限公司,国药准字H44022399,规格:1 mg/支)于治疗开始后第7、14、21、28天(共4次)静脉滴注,用药剂量:1.5 mg/(m2·d),最大剂量不得超过2.0 mg/(m2·d);注射用盐酸柔红霉素(瀚晖制药有限公司,国药准字H33020925,规格:20 mg/支)于治疗开始后第8、15天(共2次)静脉滴注,用药剂量:25 mg/(m2·d);口服醋酸泼尼松片(天津力生制药股份有限公司,国药准字H12020123,规格:5 mg/片)60 mg/(m2·d),连续用药21 d后减停。A组患儿联合门冬酰胺酶进行治疗,于治疗开始后第19~28天采用注射用门冬酰胺酶(广州白云山制药有限公司,国药准字H19993914,规格:10 000 U/支)肌肉注射进行治疗,5 000 U/(m2·d)。B组患儿联合培门冬酶进行治疗,于治疗开始后第9、23天肌肉注射培门冬酶注射液(江苏恒瑞医药股份有限公司,国药准字H20090015,规格:5 mL∶3 750 IU),用药剂量:2 500 IU/(m2·d)。28 d为1个疗程,两组患儿均治疗1个疗程。
1.3 观察指标 ⑴临床疗效。于治疗后评估两组患儿临床疗效,治疗后贫血、感染、出血等相关临床症状消失,且血红蛋白恢复至≥90 g/L为完全缓解;治疗后贫血、感染、出血等相关临床症状改善明显,70g/L<血红蛋白含量<90 g/L为部分缓解;治疗后贫血、感染、出血等相关临床症状无改善甚至加重,血红蛋白含量≤70 g/L为无效[4]。总有效率=完全缓解率+部分缓解率。⑵凝血功能。分别于治疗前后采集两组患儿空腹静脉血3 mL,抗凝处理后,采用全自动凝血分析仪(希森美康株式会社,型号:CS-5100)检测凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)水平。⑶血清学指标。分别于治疗前后采集两组患儿空腹静脉血5 mL,离心处理(3 000 r/min,10 min),取上层血清,采用全自动免疫分析仪(美国雅培公司,型号:ARCHITECT i 1 000 sr)检测铁蛋白(SF)、超敏-C反应蛋白(hs-CRP)、白细胞介素-6(IL-6)水平。⑷不良反应。观察统计治疗期间两组患儿过敏、肝损害、胰腺炎、血糖升高、胃肠道反应的发生情况。不良反应总发生率等于各项不良反应发生率之和。
1.4 统计学方法 采用SPSS 22.0统计学软件分析数据,计数资料以[例(%)]表示,采用χ2检验,等级资料采用秩和检验;计量资料经S-W法检验证实符合正态分布,以( x ±s)表示,组间比较采用独立样本t检验,治疗前后比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
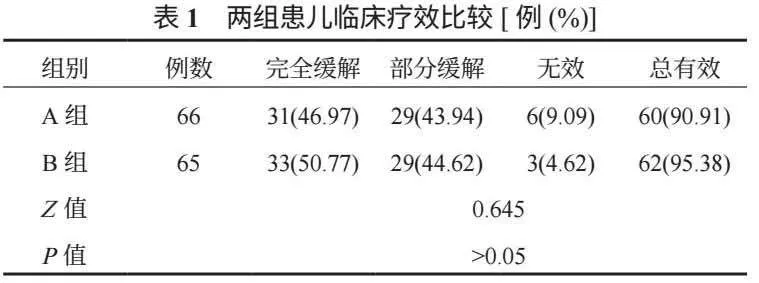
2.1 两组患儿临床疗效比较 两组患儿治疗后临床疗效比较,差异无统计学意义(P>0.05),见表1。
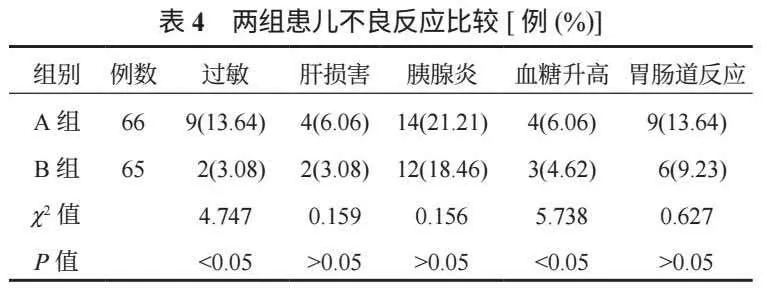
2.2 两组患儿凝血功能比较 与治疗前比,治疗后两组患儿PT、APPT水平均延长,且B组均长于A组,FIB水平均降低,且B组低于A组,差异均有统计学意义(均P<0.05),见表2。
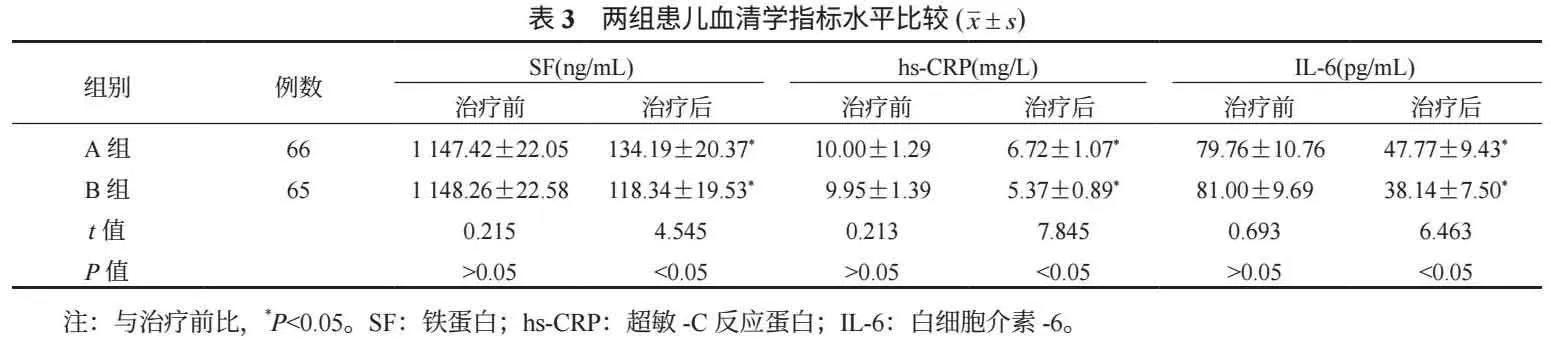
2.3 两组患儿炎症因子比较 与治疗前比,治疗后两组患儿血清SF、hs-CRP、IL-6水平均降低,且B组均低于A组,差异均有统计学意义(均P<0.05),见表3。
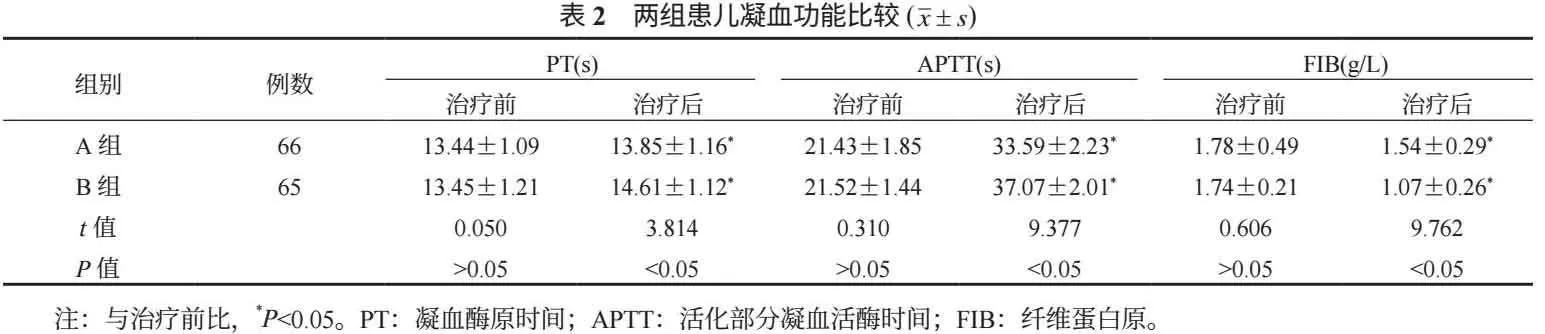
2.4 两组患儿不良反应比较 B组患儿过敏、血糖升高发生率低于A组,差异均有统计学意义(均P<0.05);两组患儿肝损害、胰腺炎、胃肠道反应发生率比较,差异均无统计学意义(均P>0.05),见表4。
3 讨论
门冬酰胺是蛋白质合成的重要氨基酸之一,人体正常细胞能够自行合成门冬酰胺,满足细胞蛋白质合成需要,而肿瘤细胞因缺乏门冬酰胺合成酶,自身并无法合成生长必需的门冬酰胺,主要依赖于宿主供给;门冬酰胺酶为取自欧文菌的酶制剂类抗肿瘤药物,可抑制肿瘤细胞中蛋白质的合成和增殖,并干扰DNA与RNA的合成,其药物疗效已得到了临床广泛认可,但由于其高度的免疫原性,在治疗过程中易引发超敏反应,在影响治疗效果的同时亦会影响药物的再次使用[5]。培门冬酶为门冬酰胺酶与聚乙二醇5 000的轭合物,其能够降解血清中天门冬酰胺,消耗血液中门冬酰胺,使肿瘤细胞缺乏合成蛋白质的必要氨基酸,以阻碍蛋白质合成,抑制肿瘤细胞增殖,而正常组织细胞自身具有合成门冬酰胺能力,并不会受到药物影响[6]。
本研究结果显示,治疗后B组患儿PT、APPT水平均较A组延长,FIB水平较A组低,两组患儿临床疗效比较,差异无统计学意义,这表明两种药物用于急性淋巴细胞白血病患儿的临床治疗均具有理想疗效,但采用化疗联合培门冬酶治疗急性淋巴细胞白血病对凝血功能影响较大。分析其原因可能是,培门冬酶可抑制急性白血病患者蛋白质的合成,使肿瘤细胞的增殖受到抑制,且培门冬酶通过消耗机体门冬酰胺,影响了蛋白质的合成,而蛋白质合成异常时,可导致凝血因子和抗凝血因子的合成减少或功能异常,从而影响凝血功能的平衡[7]。在临床中使用该药物时,应定期监测患儿凝血功能,及时进行对应的治疗。
SF主要存在于骨髓中,在骨髓内前体B或T淋巴细胞克隆增殖中发挥重要作用;急性淋巴细胞白血病作为造血干细胞的恶性克隆性疾病,由于造血干细胞分化受阻、增殖失控、凋亡受阻等机制在骨髓中大量增殖,同时会分泌造血负调控因子,导致白细胞、红细胞等全血细胞减少,引起炎症反应[8-9]。本研究结果显示,治疗后B组患儿血清SF、hs-CRP、IL-6水平及过敏、血糖升高发生率均低于A组,这提示急性淋巴细胞白血病患儿以培门冬酶治疗能够有效改善炎症反应,安全性较高。分析其原因可能是,培门冬酶通过与多聚乙二醇化合物结合,延长了其半衰期,从而使药物在体内停留时间更长,且可抵抗疾病及化疗所引起的炎症因子,进而减轻炎症反应;还可使药物到达肿瘤组织前保持脂质形态,减少了蛋白质酶解及肾脏排泄,使其能够进一步加强白血病细胞增殖抑制,达到杀灭肿瘤细胞的效果;且因肿瘤细胞对门冬酰胺的依赖性,正常机体内细胞能够自行合成门冬酰胺,因此对正常机体的影响较小,减少化疗药物对正常细胞损伤,安全性较高[10]。
综上,与化疗联合门冬酰胺酶的治疗方案相比,急性淋巴细胞白血病患儿采用化疗联合门冬酰胺酶治疗的临床疗效相当,但其可有效降低血清炎症因子水平,且安全性良好,但应注意可能导致凝血功能障碍,临床治疗过程中应密切监测患儿凝血功能。
参考文献
温大科, 徐旭, 张琳. 左旋门冬酰胺酶、培门冬酶对急性淋巴细胞白血病患儿的治疗效果比较[J]. 中国妇幼健康研究, 2024, 35(4): 67-73.
郝杰, 楚小鸽, 李超, 等. 培门冬酶治疗成人Ph/BCR-ABL1阴性急性淋巴细胞白血病药物活性与疗效[J]. 内科理论与实践, 2019, 14(6): 355-360.
侯芳, 李志瑶, 刘瀚翔, 等. 急性淋巴细胞白血病患儿血清PGRN、XCL1与危险度分层和预后的关系[J]. 现代生物医学进展, 2023(23): 4537-4541.
中华医学会血液学分会白血病淋巴瘤学组, 中国抗癌协会血液肿瘤专业委员会, 中国慢性淋巴细胞白血病工作组.中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2018年版)[J]. 中华血液学杂志, 2018, 39(5): 353-358.
梁石明, 文飞球. 培门冬酶静默失活在儿童急性淋巴细胞白血病治疗中的新进展[J]. 国际输血及血液学杂志, 2020, 43(5): 418-422.
赵学勤, 王政委, 庄艳, 等. 左旋门冬酰胺酶及培门冬酶治疗小儿急性淋巴细胞白血病的疗效及实验室指标比较[J]. 儿科药学杂志, 2020, 26(10): 17-20.
李敖龙, 王铁锋, 张琪. VDPAP方案对急性淋巴细胞白血病患儿凝血功能及血常规指标的影响[J]. 癌症进展, 2023, 21(19): 2193-2196, 2200.
侯小瑞, 靳瑞霞, 谢意茹, 等. 培门冬酶对急性淋巴细胞白血病患儿的治疗效果及对凝血功能的影响[J]. 癌症进展, 2020, 18(17): 1813-1816, 1835.
陈娜, 宋春兰, 景钰, 等. 两种门冬酰胺酶治疗儿童急性淋巴细胞白血病的近期效果及对患儿血清LDH、SF和ESR的影响[J]. 实用癌症杂志, 2021, 36(2): 337-340.
王长爽. 培门冬酶与左旋门冬酰胺酶治疗儿童急性淋巴细胞白血病的疗效及安全性观察[J]. 中国药物与临床, 2021, 21(23): 3871-3873.
作者简介:吕长俊,大学本科,主管技师,研究方向:血液检测。

