二维相关红外光谱技术解析牛肉热加工过程中蛋白质二级结构变化








摘 要:利用傅里叶变换红外光谱和近红外(near-infrared,NIR)光谱技术,对60~120 ℃下加热0~15 min的66 个牛肉样品进行光谱分析,并通过二维相关光谱技术揭示蛋白质结构的动态演变过程。结果显示,随着加热温度的上升,酰胺A带和酰胺I带的吸收峰发生位移,N—H和C—N的振动增强。β-折叠相对含量增加,β-转角相对含量降低,蛋白质二级结构的变化时序为β-转角、β-折叠、α-螺旋、无规卷曲。此外,基于NIR光谱数据构建的牛肉蛋白二级结构(α-螺旋、β-折叠、β-转角和无规卷曲)含量预测模型具有高精度的预测能力(校正相关
系数>0.9)。本研究基于大量样本揭示了牛肉加热过程中蛋白质二级结构的变化规律,而且为实现快速、无需复杂预处理的肉类产品蛋白质结构分析提供了有效的技术路径。
关键词:牛肉;加热;二级结构;二维相关光谱;近红外光谱
Analysis of Changes in Protein Secondary Structure during Thermal Beef Processing by
Two-Dimensional Correlated Infrared Spectroscopy
XIE Anguo1, WANG Tingmin2, ZHANG Qinhua1, LI Chao1, WANG Mansheng3,*
(1. Zhang Zhongjing School of Chinese Medicine, Nanyang Institute of Technology, Nanyang 473004, China;
2. Sichuan Manwei Longchu Biotechnology Co. Ltd., Meishan 620000, China;
3. Institute of Bast Fiber Crops, Chinese Academy of Agricultural Sciences, Changsha 410205, China)
Abstract: This study used Fourier transform infrared (FTIR) spectroscopy and near-infrared (NIR) spectroscopy to analyze 66 beef samples heated for 0–15 min at 60 to 120 ℃, and revealed the dynamic evolution of protein structure by two-dimensional correlation spectroscopy (2D-CoS). The results showed that as the heating temperature increased, the absorption peaks of amide A and amide I bands shifted, and the N–H and C–N vibrations increased. Moreover, the relative content of β-sheet increased and the relative content of β-turn decreased. The sequence of changes in the secondary structure of proteins was β-turn, β-sheet, α-helix and random coil. In addition, a predictive model for protein secondary structure (α-helix, β-sheet, β-turn and random coil) contents was constructed based on NIR spectroscopy data, which was demonstrated to have high predictive ability (corrected correlation coefficient gt; 0.9). In conclusion, this study provides an effective technical approach for fast structural analysis of proteins in meat products without the need for complex sample pretreatment.
Keywords: beef; heating; secondary structure; two-dimensional correlation spectroscopy; near infrared spectroscopy
DOI:10.7506/rlyj1001-8123-20240527-127
中图分类号:TS251.1" " " " " " " " " " " " " " " " " " " " " "文献标志码:A 文章编号:1001-8123(2024)08-0001-07
引文格式:
谢安国, 王廷敏, 张芹华, 等. 二维相关红外光谱技术解析牛肉热加工过程中蛋白质二级结构变化[J]. 肉类研究, 2024, 38(8): 1-7. DOI:10.7506/rlyj1001-8123-20240527-127." "http://www.rlyj.net.cn
XIE Anguo, WANG Tingmin, ZHANG Qinhua, et al. Analysis of changes in protein secondary structure during thermal beef processing by two-dimensional correlated infrared spectroscopy[J]. Meat Research, 2024, 38(8): 1-7. DOI:10.7506/rlyj1001-8123-20240527-127." "http://www.rlyj.net.cn
在全球肉类消费市场中,牛肉以其较高的蛋白质含量、全面的营养价值、较高的消化吸收率及较低的胆固醇和脂肪含量[1-2],成为备受青睐的3大主要肉类之一。随着社会经济的持续发展和居民生活水平的逐步提高,消费者的饮食习惯和健康意识不断升级,对肉制品的质量安全和营养价值提出了更为精细化的要求[3]。在此背景下,牛肉加工业面临新的技术挑战,尤其是在热加工工艺中,不恰当的处理方法可能导致牛肉中的营养成分不可逆流失,同时伴随脂质和蛋白质的氧化[4],这些生物化学变化对牛肉产品的最终品质特性造成了实质性的影响。
牛肉中的蛋白质不仅是肌肉组织的主要构成成分,而且其二级结构的稳定性对产品的品质至关重要。在热处理过程中,牛肉蛋白质往往会经历不同程度的变性或降解[5]。当蛋白质的空间结构遭受破坏时,其二级结构的含量也会随之发生变化。研究表明,部分蛋白质变性会影响蛋白质的溶解性和胶体性质[6]。这种结构变化不仅影响肉品的保水性能[7],还会影响肉品的色泽,如肌红蛋白的α-螺旋含量减少、β-折叠结构变化和无规卷曲含量的增加[8]。类似的研究也揭示了蛋白质二级结构与肉品营养品质之间的密切联系[9]。例如,大豆蛋白中α-螺旋和无规卷曲含量的增加与蛋白质体外消化率的提升呈正相关,而β-折叠含量的增加则与之呈负相关。因此,快速且准确地监测热加工过程中蛋白质二级结构的变化,对于实时掌握肉品品质的变化具有重要意义。
目前用于肉品蛋白质结构分析检测的方法有X射线衍射法、荧光法、紫外法、圆二色谱法[10-11]、核磁共振法、傅里叶变换红外(Fourier transform infrared,FTIR)光谱及近红外(near infrared,NIR)光谱技术等,但这些方法均存在一定的局限性。相较而言,FTIR光谱法具有操作简单、灵敏度高、分辨率好、扫描速率快、信噪比高、能检测蛋白质结构微小变化、可得到几乎所有生物蛋白质的红外光谱图及样品用量较少等优点,被广泛应用于肉制品检测中[12]。然而,峰的严重重叠限制了中红外和NIR光谱对蛋白结构识别及其氢键形成机理研究。二维光谱相关分析是将一维的光谱在二维上展开,可将很多重叠峰简单视觉化,从而提高光谱的分辨率及重叠峰的分离度[13],此外,由于可以得到二级结构和氢键变化的先后顺序,有利于研究蛋白二级结构及氢键的形成,也可直观反映蛋白质反应的动力学性质。
尽管二维相关红外光谱技术在众多领域已展现出其独特的分析潜力,但在肉品科学领域,特别是在牛肉蛋白质热加工过程中的应用仍较少。本研究选取经不同热处理的牛肉样品作为实验对象,通过大量样本系统性探索牛肉加热过程中的光谱与蛋白质结构的动态变化,并构建NIR光谱与蛋白质二级结构含量的回归模型。为进一步提升光谱数据的分析精度,本研究采用多种预处理算法,包括移动窗口平滑(moving average,MA)、savitzky-golay(SG)卷积平滑、多元散射校正(multiplicative scatter correction,MSC)及标准正态变量变换(standard normal variate,SNV),对原始光谱数据进行精细化预处理。基于经预处理的光谱数据,构建偏最小二乘(partial least squares,PLS)回归模型,用于预测牛肉蛋白质二级结构的含量,并通过比较不同预处理方法的效果,筛选出最优的光谱预处理策略。旨在为实现快速、无损的牛肉蛋白质二级结构分析提供创新的方法论基础,为肉品加工行业的质量控制和产品研发提供科学依据和技术支持。
1 材料与方法
1.1 材料与试剂
新鲜牛里脊肉购自当地生鲜超市。
KBr(分析纯) 上海捷世凯生物科技有限公司。
1.2 仪器与设备
Vector 33型FTIR光谱仪 德国Brucker公司;MINI20-015V-I型低场核磁共振成像分析仪 上海纽迈电子科技有限公司;JA5003B型电子分析天平 上海精科仪器有限公司;DHG9425A型鼓风干燥箱 上海一
恒科学仪器有限公司;DF-101S型集热式恒温加热磁力搅拌器 河南省予华仪器有限公司;Pilot3-6M型真空冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 牛肉加热处理
将新鲜牛里脊肉剥去表面的筋膜和脂肪,肉样切割为4 cm×4 cm×2 cm的块状,分装于食品级锡箔袋中,并将样品置于不同加热温度(60、65、70、75、80、85、90、95、100、105、110、115、120 ℃)的油浴锅中分别加热3、6、9、12、15 min,共产生65 项加热实验组合,1 组未加热的鲜肉作为对照样品。热加工处理后的牛肉样品室温冷却后置于4 ℃冰箱待测。
1.3.2 NIR光谱采集
通过FTIR光谱仪采集牛肉热加工后的NIR光谱[14]。采集光谱范围:10 000~4 000 cm-1(780~2 500 nm);扫描次数:64 次;分辨率:8 cm-1。采用漫反射的方式采集光谱,每个样品采集光谱3 次,取平均值为样本光谱。共扫描66 份样本,其中校正集和预测集样本分别为44、22 个。
1.3.3 中远红外光谱采集
将经不同加热处理的牛肉样品放置于真空冷冻干燥机中干燥48 h,取出后磨成牛肉粉备用。准确称取1 mg牛肉粉,加入100 mg KBr,混匀研磨成细小粉末,然后用压片机将其压制成透明薄片。在4 000~400 cm-1的波数范围内,用FTIR光谱仪扫描牛肉样品,扫描信号累积64 次。通过使用Peakfit 4.1软件对酰胺I带进行去卷积并结合曲线拟合估算牛肉蛋白的二级结构相对含量[15]。计算α-螺旋相对含量的波数范围为1 650~1 660 cm-1,β-折叠为1 600~1 640 cm-1,β-转角为1 660~1 695 cm-1,无规卷曲为1 640~1 650 cm-1。
1.3.4 光谱预处理
采集全波段的光谱数据,使用MA、SG、MSC和SNV方法在采集区间780~2 500 nm对所采集原始光谱数据进行预处理,考察不同预处理方法所得的训练集建模决定系数(Rc2)及校正均方根误差(root mean square error of calibration,RMSEC)。最后,使用PLS分别对牛肉的品质特性进行建模研究。
1.3.5 预测模型构建
采用Unscramb分析软件对NIR原始光谱数据进行预处理,在建立模型的过程中,根据预测集建模决定系数(Rp2)及预测均方根误差(root mean square error of prediction,RMSEP)等指标对模型进行评价[16]及优化完善,选取最佳模型。
1.4 数据处理
采用SPSS软件分析数据的差异显著性,2D-shige软件进行光谱的二维相关分析。
2 结果与分析
2.1 牛肉加热过程中的中远红外光谱分析
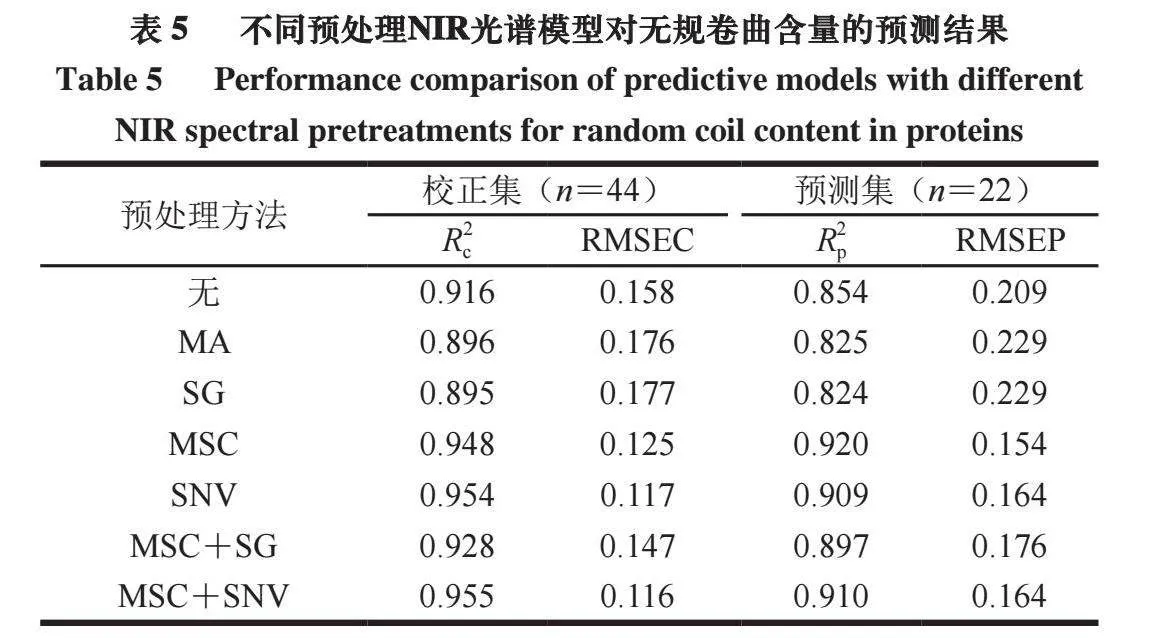
在热加工过程中,牛肉的红外光谱图见图1(4 000~400 cm-1),各谱带的归属[17]见表1。
由图1d可知,经不同温度加热处理后,与鲜样相比,热处理12 min牛肉蛋白的酰胺A带从3 290 cm-1红移至3 281 cm-1附近,这可能是因为酰胺A带的N—H伸缩振动与氢键形成缔合体,从而向低波数位移,表示氢键发生变化,此结果与化学法测定氢键含量的结果相吻合[18]。与鲜样相比,热处理9 min后1 656 cm-1处α-螺旋的特征吸收峰红移至1 652 cm-1(图1c),且随温度的增加,吸收峰继续红移。加热15 min后1 543 cm-1的酰胺II带特征吸收峰随着加热温度的升高而逐渐变宽,表明在酰胺II带中发生N—H弯曲和C—N伸缩振动。而在1 245 cm-1的酰胺III带,随着加热时间的延长,谱带均发生红移,接近1 233 cm-1处(图1e)。这与邓丽等[19]研究鲍鱼腹肌蛋白热加工过程中的红外光谱变化结果一致,表明酰胺III带也在热加工中发生了结构变化。
2.2 加热温度与时间对牛肉蛋白二级结构相对含量的影响
通过使用Peakfit 4.1软件对酰胺I带进行去卷积并结合曲线拟合计算牛肉蛋白α-螺旋、β-折叠、β-转角和无规卷曲等二级结构相对含量[20]。对照组α-螺旋、β-折叠、β-转角和无规卷曲的相对含量分别为14%、28%、45%和13%,这表明β-转角是牛肉主要的二级结构。由
图2可知,在加热处理下,牛肉蛋白中的β-折叠和β-转角相对含量变化明显,α-螺旋和无规卷曲的相对含量变化不明显。观察加热温度对牛肉蛋白二级结构相对含量的影响,由图2a可知,随热处理温度升高,α-螺旋和无规卷曲相对含量缓慢增加,β-折叠相对含量明显升高,当加热温度达到120 ℃时,与对照组相比,其相对含量从28%升至41%,而β-转角相对含量下降至30%,下降约1/3。二级结构相对含量的变化说明热处理使牛肉蛋白的β-转角
向β-折叠转化。对比加热时间对二级结构相对含量的影响,整体趋势为加热时间的延长使β-折叠的相对含量先增加后减小;β-转角先减小后增加,以100 ℃组为例,加热15 min后β-转角相对含量又增至34%(图2e)。可看出加热温度对二级结构相对含量的影响大于加热时间。
随着加热温度的升高和时间的延长,由于氢键的变化,α-螺旋的一部分被打开[21]。加热处理初期形成的未折叠和变性蛋白质可能会发生某种重新结合或聚集,这是由于蛋白质分子之间的氢键逐渐减少,分子之间的相互作用逐渐减弱。在60、80 ℃低温加热初期由于体积减小,疏水结合和离子结合被切断,导致蛋白分子的展开和非极性基团的暴露,最终使得β-折叠相对含量逐步增加,
β-转角相对含量略微降低。在加热后期β-折叠相对含量迅速升高,β-转角相对含量直线下降,这尤其体现在80 ℃加热样品中。而牛肉在高温(100、120 ℃)加热初期二级结构相对含量就发生较大变化。结合牛肉的结构可推知,60~80 ℃时对热敏感的分子受到影响,如水溶性蛋白质开始变性失活,半结合水发生迁移;但依然有大量基团保持稳定。蛋白质空间结构直到100~120 ℃的高温才被进一步破坏,大量氢键断裂及疏水基团暴露[22]。
在相同温度下,随加热处理时间的延长,无规卷曲相对含量由13%缓慢增大至14%~15%。这可能是由于超高压处理下溶剂分子和氨基酸残基的各种分子电离,以及基团间溶剂化作用的增加。此外,离子键的断裂也会引起电致伸缩,并减小蛋白质分子的体积,导致牛肉蛋白结构的改变。
2.3 牛肉加热过程中的二维中远红外相关光谱分析
为研究加热过程不同官能团及其对应有机物的变化规律,以加热温度为外界扰动,利用2D-shige软件分析不同加热条件下牛肉样品的红外光谱,得到图3所示的二维相关光谱。
在同步图中,以加热温度为变量,正峰代表红外光谱中与官能团的变化方向一致的行为,而负峰代表红外光谱中与官能团的方向变化相反的行为[23]。根据Noda法则[24],在异步谱图中,坐标(x,y)处的正峰意味着波数x处的光强变化早于y处。如果在(x,y)处有1 个负峰,意味着波数x处的光强变化慢于y处。图3a为牛肉热加工过程中红外光谱经二维相关分析所得的同步图,主要在1 610/1 610、1 645/1 645、1 655/1 655、1 680/1 680 cm-1附近出现4 个自相关峰,其峰强度依次为1 610/1 610>1 645/1 645>1 680/1 680>1 655/1 655 cm-1。其中1 610/1 610 cm-1处归属于β-折叠,且是正峰,说明官能团与牛肉加热过程的变化方向相同[25]。1 645/1 645、1 655/1 655、1 680/1 680 cm-1处均为负峰,它们分别归属于无规卷曲、α-螺旋和β-转角,且变化方向与牛肉加热过程相反。在异步图中,1 690~1 700/1 600~1 620、1 690~1 700/1 600~1 650、1 690~1 700/1 640~1 645、1 600~1 620/1 650~1 660、1650~1660/1640~1645 cm-1处均为正交叉峰,显示1 690~1 700、1 600~1 620、1 650~1 660 cm-1处的吸收峰随加热温度的变化早于1 600~1 620、1 600~1 650、1 640~1 645 cm-1处的吸收峰(图3b)。根据Noda法则[26],可以推断出肌肉蛋白在受热过程中特征峰的变化时序为1 680 cm-1>1 610 cm-1>1 655 cm-1>1 645 cm-1,即二级结构的变化时序为β-转角、β-折叠、α-螺旋、无规卷曲。
2.4 牛肉加热过程中NIR光谱与中远红外的异质二维相关光谱分析
二维异质相关光谱常被用于检测2 种不同光谱的共变特征,正相关说明2 种不同光谱强度变化一致或存在相似来源[27-28]。NIR和FTIR光谱之间的异质二维相关光谱图能够进一步体现牛肉加热过程中有机质官能团与有机碳结构的关联。图4a中横坐标NIR光谱1 430、1 685 nm波长附近可观察到6 个较明显的正相关峰,说明这2 处光谱与C—H面外弯曲振动(900 cm-1)、酰胺I带C=O的伸缩振动(1 650 cm-1)、炔烃伸缩振动(2 150 cm-1)及酰胺A带N—H的伸缩振动(3 280 cm-1)存在相似来源。在图4b中,NIR光谱的945 nm附近的正相关峰表明4 倍频O—H(945 nm)变化早于C—H面外弯曲振动(900 cm-1)和酰胺I带C=O的伸缩振动(1 650 cm-1)。需特别注意的是,NIR光谱技术用于检测含水状态下的牛肉样本,而FTIR光谱则应用于冷冻干燥后的牛肉样品。通过二维异质相关光谱分析,可以确认O—H(945 nm)的变化发生在蛋白质结构变化之前,这一发现有力地支持了本团队前期研究成果[29],即在受热条件下,肉类产品中的半结合水会迅速发生变化。
2.5 牛肉蛋白二级结构含量的预测模型构建
在780~2 526 nm波长范围内观察到很多噪音,这些噪音不仅包含无用的信息,而且还影响预测模型的准确性和精度。因此,需要对收集到的原始NIR光谱进行预处理,以改善光谱特性,消除光谱中包含的无用信息,从而提高模型的性能。为确定最佳预处理方法,将不同预处理后的NIR光谱数据作为输入变量,牛肉蛋白二级结构(α-螺旋、β-折叠、β-转角和无规卷曲)含量作为响应变量建立PLS模型。建模决定系数越接近1,说明该模型的预测精度越高[30];RMSEC和RMSEP越小,说明该模型的预测结果越准确[31]。
2.5.1 α-螺旋含量NIR光谱预测模型
由表2可知,当采用SNV对光谱进行预处理时,可建立Rc2为0.983、Rp2为0.944的最优预测模型。
2.5.2 β-折叠含量NIR光谱预测模型
由表3可知,当采用MSC对光谱进行预处理时,可建立Rc2为0.989、Rp2为0.980的最优预测模型。
2.5.3 β-转角含量NIR光谱预测模型
由表4可知,当采用MSC对光谱进行预处理时,可建立Rc2为0.993、Rp2为0.983的最优预测模型。
2.5.4 无规卷曲含量NIR光谱预测模型
由表5可知,当采用MSC+SNV对光谱进行预处理时,可建立Rc2为0.955、Rp2为0.910的最优预测模型。
通过对蛋白质4 种二级结构含量的光谱检测,可知β-折叠和β-转角含量的模型预测准确率高,对α-螺旋和无规卷曲含量的预测准确率稍低,这与β-折叠和β-转角含量在牛肉蛋白质中的含量较高且在热加工过程中含量变化较大有关。
3 结 论
本研究运用FTIR和NIR光谱技术对牛肉在不同温度下的红外吸收光谱进行解析,以捕捉其特征波谱信息。随后,引入二维相关光谱技术,深入探究牛肉加热过程中官能团随时间的变化规律。结果表明:1)在牛肉热加工过程中,β-折叠相对含量增加,β-转角相对含量降低,α-螺旋和无规卷曲相对含量变化不明显,推断蛋白质中一部分β-转角结构受热时转变为β-折叠;2)二维相关光谱技术解析出水分结构(O—H)的变化发生在蛋白质结构变化之前,此后蛋白质二级结构的变化时序为β-转角→
β-折叠→α-螺旋→无规卷曲,这一新的研究成果能够加深对肉类产品在热处理过程中水分和蛋白质结构变化机制的理解;3)NIR光谱技术能够对含水的肉块蛋白质二级结构进行快速、无需预处理的检测。未来研究将关注蛋白质结构变化与肉制品品质的关系,旨在通过光谱技术优化肉类加工和提升消费体验,为肉品科学与产业应用带来新进展。
参考文献:
[1] JUAREZ M M, LAM S, BOHRER B M, et al. Enhancing the nutritional value of red meats through genetic and feeding strategies[J]. Journal of Animal Science, 2020, 98: 82. DOI:10.1093/jas/skaa278.150.
[2] RIBAS-AGUSTÍ A, DÍAZ I, SÁRRAGA C, et al. Nutritional properties of organic and conventional beef meat at retail[J]. Journal of the Science of Food and Agriculture, 2019, 99(9): 4218-4225. DOI:10.1002/jsfa.9652.
[3] SARDI L, GASTALDO A, BORCIANI M, et al. Identification of possible pre-slaughter indicators to predict stress and meat quality: a study on heavy pigs[J]. Animals, 2020, 10(6): 945. DOI:10.3390/ani10060945.
[4] 袁凯, 张龙, 谷东陈, 等. 肉品中的蛋白质氧化机制及其影响因素[J]."食品科学, 2018, 39(5): 329-335. DOI:10.7506/spkx1002-6630-201805048.
[5] 童今柱. 加热方式对鸭肉肌原纤维蛋白结构和功能性质及肉品质形成的影响研究[D]. 合肥: 合肥工业大学, 2019.
[6] 刘昊天, 殷小钰, 汪海棠, 等. 基于蛋白氧化行为的肉及肉制品品质提升及劣变机制研究进展[J]. 食品科学, 2020, 41(21): 230-237. DOI:10.7506/spkx1002-6630-20191017-174.
[7] 薛美芳. 牛肉脯加工过程中品质变化规律的研究[D]. 银川: 宁夏大学, 2021. DOI:10.27257/d.cnki.gnxhc.2021.000138.
[8] 张同刚, 罗瑞明, 李亚蕾, 等. 拉曼光谱分析牛肉贮藏过程中肌红蛋白结构的变化[J]. 食品科学, 2019, 40(7): 15-19. DOI:10.7506/spkx1002-6630-20180408-083.
[9] 白明昧, 孙泽威, 龙国徽, 等. 热处理对全脂大豆蛋白质分子结构特征、溶解度和体外消化率的影响[J]. 西北农林科技大学学报(自然科学版), 2016, 44(11): 31-38. DOI:10.13207/j.cnki.jnwafu.2016.11.005.
[10] ABROSIMOVA K V, SHULENINA O V, PASTON S V. FTIR study of secondary structure of bovine serum albumin and ovalbumin[J]. Journal of Physics: Conference Series, 2016, 769: 012016. DOI:10.1088/1742-6596/769/1/012016.
[11] PELTON J T, MCLEAN L R. Spectroscopic methods for analysis of protein secondary structure[J]. Analytical Biochemistry, 2000, 277(2): 167-176. DOI:10.1006/abio.1999.4320.
[12] FEVZIOGLU M, OZTURK O K, HAMAKER B R, et al. Quantitative approach to study secondary structure of proteins by FT-IR spectroscopy, using a model wheat gluten system[J]. International Journal of Biological Macromolecules, 2020, 164: 2753-2760. DOI:10.1016/j.ijbiomac.2020.07.299.
[13] LEE Y K, HUR J. Using two-dimensional correlation size exclusion chromatography (2D-CoSEC) to explore the size-dependent heterogeneity of humic substances for copper binding[J]. Environmental Pollution, 2017, 227: 490-497. DOI:10.1016/j.envpol.2017.04.099.
[14] PRIETO N, PAWLUCZYK O, DUGAN M E R, et al. A review of the principles and applications of near-infrared spectroscopy to characterize meat, fat, and meat products[J]. Applied Spectroscopy, 2017, 71(7): 1403-1426. DOI:10.1177/0003702817709299.
[15] XUE H, ZHANG G, HAN T, et al. Improvement of gel properties and digestibility of the water-soluble polymer of tea polyphenol-egg white under thermal treatment[J]. Food Chemistry, 2021, 372(5): 131319. DOI:10.1016/j.foodchem.2021.131319.
[16] XIE A G, SUN J, WANG T M, et al. Visualized detection of quality change of cooked beef with condiments by hyperspectral imaging technique[J]. Food Science and Biotechnology, 2022, 31(10): 1257-1266. DOI:10.1007/s10068-022-01115-x.
[17] WORKMAN J J, WEYER L. Practical guide to interpretive near-infrared spectroscopy[M]. Boca Raton: CRC Press, 2007: 4620-4629. DOI:10.1201/9781420018318.
[18] MENSINK M A, ŠIBÍK J, FRIJLINK H W, et al. Thermal gradient mid- and far-infrared spectroscopy as tools for characterization of protein carbohydrate lyophilizates[J]. Molecular Pharmaceutics, 2017, 14(10): 3550-3557. DOI:10.1021/acs.molpharmaceut.7b00568.
[19] 邓丽, 李岩, 董秀萍, 等. 热加工过程中鲍鱼腹足蛋白间作用力及其质构特性[J]. 农业工程学报, 2014, 30(18): 307-316. DOI:10.3969/j.issn.1002-6819.2014.18.038.
[20] YANG S N, ZHANG Q L, YANG H Y, et al. Progress in infrared spectroscopy as an efficient tool for predicting protein secondary structure[J]. International Journal of Biological Macromolecules, 2022, 206: 175-187. DOI:10.1016/j.ijbiomac.2022.02.104.
[21] YE M P, ZHOU R, SHI Y R, et al. Effects of heating on the secondary structure of proteins in milk powders using mid-infrared spectroscopy[J]. Journal of Dairy Science, 2017, 100(1): 89-95. DOI:10.3168/jds.2016-11443.
[22] 康怀彬, 邹良亮, 张慧芸, 等. 高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J]. 食品科学, 2018, 39(23): 80-86. DOI:10.7506/spkx1002-6630-201823013.
[23] LIU Y, YAO L Y, XIA Z Z, et al. Geographical discrimination and adulteration analysis for edible oils using two-dimensional correlation spectroscopy and convolutional neural networks (CNNs)[J].
Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2021, 246: 118973. DOI:10.1016/j.saa.2020.118973.
[24] SUN Y H, CAI H Z, JIA X L, et al. Fluorescence spectroscopy characteristics of rapeseed oil during thermal oxidation[J]. Chinese Journal of Analytical Chemistry, 2013, 41(9): 1373-1377. DOI:10.3724/sp.j.1096.2013.30294.
[25] MEENU M, COZZOLINO D, XU B J. Non-destructive prediction of total phenolics and antioxidants in hulled and naked oat genotypes with near-infrared spectroscopy[J]. Journal of Food Measurement and Characterization, 2023, 17(5): 4893-4904. DOI:10.1007/s11694-023-02009-0.
[26] YU G H, TANG Z, XU Y C. Multiple fluorescence labeling and two dimensional FTIR-13C NMR heterospectral correlation spectroscopy to characterize extracellular polymeric substances in biofilms produced during composting[J]. Environmental Science amp; Technology, 2011, 45(21): 9224-9231. DOI:10.1021/es201483f.
[27] YANG R J, LIU C Y, YANG Y R, et al. Two-trace two-dimensional (2T2D) correlation spectroscopy application in food safety: a review[J]. Journal of Molecular Structure, 2020, 1214: 128219. DOI:10.1016/j.molstruc.2020.128219.
[28] XIE A G, SUN D W, ZHU Z W, et al. Nondestructive measurements of freezing parameters of frozen porcine meat by NIR hyperspectral imaging[J]. Food and Bioprocess Technology, 2016, 9(9): 1444-1454. DOI:10.1007/s11947-016-1766-2.
[29] 王廷敏, 谢安国, 付淑亚, 等. 基于低场核磁-近红外二维相关光谱技术研究加热温度对牛肉水分的影响[J]. 食品与发酵工业, 2023, 49(20): 288-293. DOI:10.13995/j.cnki.11-1802/ts.032552.
[30] TOIVONEN P, BATISTA A, LANNARD B. Development of a predictive model for ‘Lapins’ sweet cherry dry matter content using a visible/near-infrared spectrometer and its potential application to other cultivars[J]. Canadian Journal of Plant Science, 2017, 97(6): 1030-1035. DOI:10.1139/cjps-2017-0013.
[31] RABBANI N S, MIYASHITA K, ARAKI T. Development of non-contact strawberry quality evaluation system using visible-near infrared spectroscopy: optimization of texture qualities prediction model[J]. Food Science and Technology Research, 2022, 28(6): 441-452. DOI:10.3136/fstr.fstr-d-22-00083.

