低共熔溶剂提取绿茶中茶多酚工艺优化及茶多酚提取液的抗氧化活性分析



摘要:低共熔溶剂(Deep eutectic solvents,DES)作为一种绿色环保、高效无毒溶剂而被广泛应用在生物提取和化学制备领域。本研究拟采用DES提取绿茶中多酚类物质,首先合成5种不同类型的DES,进行傅里叶变换红外光谱(FT-IR)与黏度值的物理表征,并与以传统水溶液、70%甲醇作为溶剂所得茶多酚提取率进行比较,获得最佳DES类型。然后,通过单因素试验、响应面Box-Behnken设计试验优化用DES提取绿茶中茶多酚的工艺,并对提取前后的绿茶粉进行结构分析。结果显示,在提取过程中,当氯化胆碱与乳酸(DES-2)的含水率为30%、提取温度为75 ℃、提取时间29 min、料液比为1 g∶35 mL时,茶多酚提取率达25.16%,与模型预测结果相符。扫描电子显微镜(SEM)和X射线衍射(XRD)结果显示,在提取过程中茶粉的晶体结构无明显变化,但DES使茶粉表面形貌发生改变,使褶皱面增多,从而使茶粉与溶剂有更多接触面积,有利于多酚类物质的溶出。此外,将DES提取法与常用的超声波乙醇提取法、微波水提取法、热回流水提取法的结果进行比较发现,DES提取法在茶多酚提取率、部分儿茶素组分提取率上均具有显著优势(P<0.05)。用不同提取方法所得茶多酚提取液进行体外还原能力、1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除活性试验,发现不同方法所得茶多酚提取液均表现出抗氧化活性并且其抗氧化活性呈现剂量依赖关系,以DES法获得的茶多酚提取液的抗氧化性最强,研究结果可为茶多酚提取及开发利用提供理论依据。
关键词:低共熔溶剂;茶多酚;提取工艺;响应面法;抗氧化活性
中图分类号:S571.1文献标识码:A文章编号:1000-4440(2024)07-1330-13Process optimization of tea polyphenols extraction from green tea by deep eutectic solvents and analysis of antioxidant activityGAO Ziwen,JIA Zhitong,WANG Lihui,LIU Yuyan,XIE Zijing,LIU Yang,TENG Jie
(School of Agricultural Sciences, Jiangxi Agricultural University, Nanchang 330045, China)
Abstract:Deep eutectic solvents (DES) are widely used in biological and chemical fields as green, environmentally friendly, non-toxic and highly efficient solvents. In this study, deep eutectic solvents were used to extract polyphenols from green tea. Firstly, five different types of natural deep eutectic solvents were synthesized, and physical properties such as Fourier transform infrared spectroscopy (FT-IR) and viscosity values were characterized. Compared with extraction rates of tea polyphenols obtaining by using traditional water solution and 70% methanol organic solvent, the best DES type was acquired. Then, the single factor test and response surface Box-Behnken design test were used to optimize the extraction of green tea polyphenols based on DES, and the structure of green tea powder before and after extraction was analyzed. The results showed that when the moisture content of choline chloride and lactic acid (DES-2) was 30%, extraction temperature was 75 ℃, extraction time was 29 min, and solid-liquid ratio was 1∶35 (g/mL), the extraction rate of tea polyphenols was 25.16%, which was consistent with the prediction of the model. The results of scanning electron microscopy (SEM) and X-ray diffraction (XRD) showed that the crystal structure of tea powder did not change significantly during the extraction process, but WC9IeqOsw1EQVT1x9L7MIDQToGL996BbCBvGrMHrwlw=the surface morphology of tea powder was changed greatly by DES, and more folds were formed on the surface of the tea powder, so that the tea powder had a larger contact area with the solvent, which was conducive to the dissolution of polyphenols. In addition, the DES extraction method was compared with the commonly used ultrasonic ethanol extraction method, microwave water extraction method, and hot reflux water extraction method. It was found that the DES extraction method had significant advantages in the extraction rates of tea polyphenols and some catechin components (P<0.05). The tea polyphenol extracts obtained by different extraction methods were tested for in vitro reducing power and 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radical scavenging activity. It was found that the tea polyphenol extracts obtained by different methods showed antioxidant activity and the antioxidant activity was dose-dependent. The tea polyphenol extract obtained by DES method had the strongest antioxidant activity. The results of this study can provide a theoretical basis for the extraction and development of tea polyphenols.
Key words:deep eutectic solvents (DES);tea polyphenols;extraction technology;response surface methodology;antioxidant activity
绿茶中富含茶多酚、茶氨酸、黄酮类、生物碱等活性成分及其他微量元素,其中茶多酚是一种天然的抗氧化剂,具有抗氧化、抗辐射、抗菌、清除自由基等多种生物活性[1-2],可用于果蔬保鲜[3]、调节人体肠道菌群、抑制肥胖[4]、消炎[5]、抗肿瘤[6]、干预阿尔兹海默病的发生[7]等。儿茶素类化合物(Catechins)作为茶多酚的主体成分,占其总量的50%~70%,包括儿茶素(C)、表儿茶素(EC)、没食子儿茶素(GC)、儿茶素没食子酸酯(CG)、表没食子儿茶素(EGC)、没食子儿茶素没食子酸酯(GCG)、表儿茶素没食子酸酯(ECG)和表没食子儿茶素没食子酸酯(EGCG)等,但是不同儿茶素组分之间的生物活性存在差异[8]。将茶多酚运用到食品添加、医疗保健、日化用品等领域是当前解决茶叶资源利用率低的问题及提高茶叶附加价值的重要方式之一。
目前,茶多酚的提取方法主要是有机溶剂提取法、离子沉淀法、超声波提取法等。溶剂提取法主要利用茶多酚易溶于水和醇类、酚类、酮类及酯类等的特性,可分为水浸提法和有机溶剂萃取法[9]。离子沉淀法主要利用茶多酚能够与无机碱、盐中的离子形成沉淀的特性[10]。超声波提取法利用的是机械效应、空化效应及热效应,通过提高细胞内物质的释放量、扩散速度及溶解性,从而高效提取绿茶中的多酚类物质[11]。
低共熔溶剂(Deep eutectic solvents,DES)是由糖类、有机酸、氨基酸和胆碱衍生物等天然化合物按一定摩尔配比后在特定条件下形成的低熔点液态混合物[12],具有低毒、提取目标性明确、极性范围广、环境友好等特点,可作为许多天然活性成分的绿色萃取溶剂[13-14]。例如,王晓艺等[15]使用氯化胆碱-乳酸作为DES试剂,采用超声辅助低共熔溶剂法提取玫瑰中的多酚,结果显示,最佳多酚提取量为(136.20±1.23) mg/g,与乙醇提取法相比,多酚提取率提高了24%。古丽菲热·伊力哈木等[16]采用氯化胆碱-苹果酸提取新疆大果沙枣中的多酚类化合物,提取率为63.378 mg/g;倪玉娇等[17]用氯化胆碱-草酸提取沙棘籽中的多酚类物质,提取率为3.310%±0.008%;汪涛等[18]用氯化胆碱-草酸提取核桃青皮多酚,提取量为50.87 mg/g,比水溶液提取法、乙醇溶液提取法的效果好。在现阶段低端茶尤其是绿茶产量相对过剩的情况下,为推动茶叶深加工及茶多酚的开发利用、减少资源浪费,本研究拟利用DES替代传统方法提取绿茶中的茶多酚,以获得较佳提取工艺,同时拟通过比较常用茶多酚提取方法的提取率及儿茶素的稳定性,为茶多酚的开发利用提供技术参考。
1材料与方法
1.1材料与仪器
本研究所用绿茶于2022年6月产自江西省婺源县正稀茗茶有限公司,原料为一芽二叶。
福林酚、没食子酸、氯化胆碱、甜菜碱、乙二醇、L-(+)-乳酸、甘油、柠檬酸、甲醇、三氯化铁、铁氰化钾等,购自生工生物工程(上海)股份有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),购自上海麦克林生化科技有限公司;8个儿茶素组分原料(>99%),购自上海源叶生物科技有限公司。
Nicolet iS50型傅里叶变换红外光谱仪,购自美国Thermo公司;SmartLab型X射线衍射仪(XRD),购自日本Rigaku公司;JSM-6010LA扫描电子显微镜,购自日本电子株式会社;LC-16高效液相色谱仪,购自日本岛津公司;UV1901PCS紫外可见分光光度计,购自上海佑科仪器仪表有限公司。
1.2试验方法
1.2.1DES体系的制备在DES体系中,氢键的受体、供体组合如下:氯化胆碱(ChCl)为氢键受体,乙二醇、乳酸、甘油为氢键供体;甜菜碱(Bet)为氢键受体,柠檬酸、乳酸为氢键供体。按照上述组合合成5种体系的DES。将经过真空干燥的各组分按照氢键受体∶氢键供体=1∶2的摩尔比混合,在加热条件下用磁力搅拌至形成均匀的混合液,将混合液在干燥器中储存备用,具体配制体系及常温下的熔融状态见表1。
1.2.2DES的表征(1)傅里叶变换红外光谱(FT-IR)的测定。将 DES 用少许无水乙醇稀释,然后滴加适量稀释液于溴化钾压片上,干燥后用傅里叶变换红外光谱仪在400~4 000 cm-1 范围内进行扫描,以溴化钾作为空白对照。
(2)黏度的测定。用黏度计测定黏度,首先选择合适的转子,将待测低共熔溶剂在不同温度(80 ℃、70 ℃、60 ℃、50 ℃、40 ℃、30 ℃)的水浴锅中放置10 min后,趁热倒入样品器中,确保溶剂完全浸没转子后进行测试并读取数值,测量重复3次。
1.2.3DES类型的筛选称取0.5 g绿茶粉置于试管中,分别加入15 mL制备的5种含水率为30%的低共熔溶剂,混匀后置于水浴锅中进行提取。提取条件如下:温度70 ℃,时间60 min,料液比1 g∶30 mL,将提取液于4 500 r/min离心10 min后取上清液。
1.2.4单因素试验称取0.25 g绿茶粉加入方法1.2.3筛选到的最佳类型DES中,分别考察单因素试验的含水率(10%、20%、30%、40%、50%)、提取温度(40 ℃、50 ℃、60 ℃、70 ℃、80 ℃)、提取时间(20 min、40 min、60 min、80 min、100 min)、料液比(1 g∶20 mL、1 g∶30 mL、1 g∶40 mL、1 g∶50 mL)对绿茶中茶多酚提取率的影响。
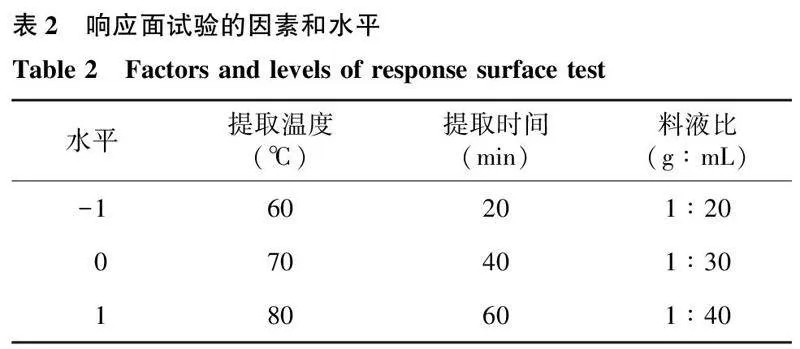
1.2.5响应面优化茶多酚提取工艺以单因素试验为基础,根据Box-Behnken中心组合试验设计原理,选取影响较大的提取温度(A)、提取时间(B)、料液比(C)为响应因子,用Design-Expert 8.0软件进行拟合,以优化绿茶中茶多酚的提取工艺,因素和水平的设计见表2。
1.2.6不同茶多酚提取方法的比较参照绿茶中茶多酚的不同提取方法,使用微波水浸提法[19]、超声波乙醇提取法[20]和热回流水提取法[21]中的最佳提取工艺参数,比较绿茶粉中茶多酚、儿茶素的组分含量。
1.2.7茶多酚、儿茶素组分含量的测定方法茶多酚含量的测定使用福林酚比色法,以没食子酸作为标准品[22]。儿茶素组分含量使用高效液相色谱法(HPLC)测定,流动相A为含0.5%三氟乙酸的水溶液,B相为甲醇。采用梯度洗脱,B相参数:8.00%,0~8.00 min;8.01%~13.00%,8.01~20.00 min;13.01%~34.99%,20.01~40.00 min;35.00%,40.01~45.00 min。柱温为35 ℃,上样量为10 μL,于278 nm进行检测。根据保留时间、标准品的峰面积计算各儿茶素组分的含量。
1.2.8茶多酚提取液抗氧化活性的测定
1.2.8.1还原能力的测定配制10~120 μg/mL系列质量浓度的茶多酚提取物,分别用0.1 mL pH值为6.5、浓度为0.2 mol/L的磷酸盐缓冲液和0.1 mL 1% K3Fe(CN)6。将反应液于50 ℃孵育20 min后加入0.1 mL三氯乙酸中,于4 500 r/min离心10 min。取0.1 mL上清液,用0.1 mL纯水稀释,再向稀释液中添加25 μL 0.1% FeCl3。以维生素C溶液作为阳性对照,记录700 nm处的吸光度[23]。
1.2.8.2清除DPPH自由基活性的测定配制10~120 μg/mL系列质量浓度的茶多酚提取溶液,分别添加到2.9 mL DPPH自由基溶液中。将反应混合物于室温避光孵育30 min后在517 nm处测定吸光度。以等质量浓度的维生素C溶液作为阳性对照,按照如下公式计算茶多酚提取溶液对DPPH自由基的清除活性[24]:
DPPH自由基清除率=(1-A)/A×100% (1)
式中:A表示DPPH自由基溶液在乙醇中的吸光度;A表示DPPH自由基溶液在测试样品中的吸光度。
2结果与分析
2.1低共熔溶剂(DES)的表征
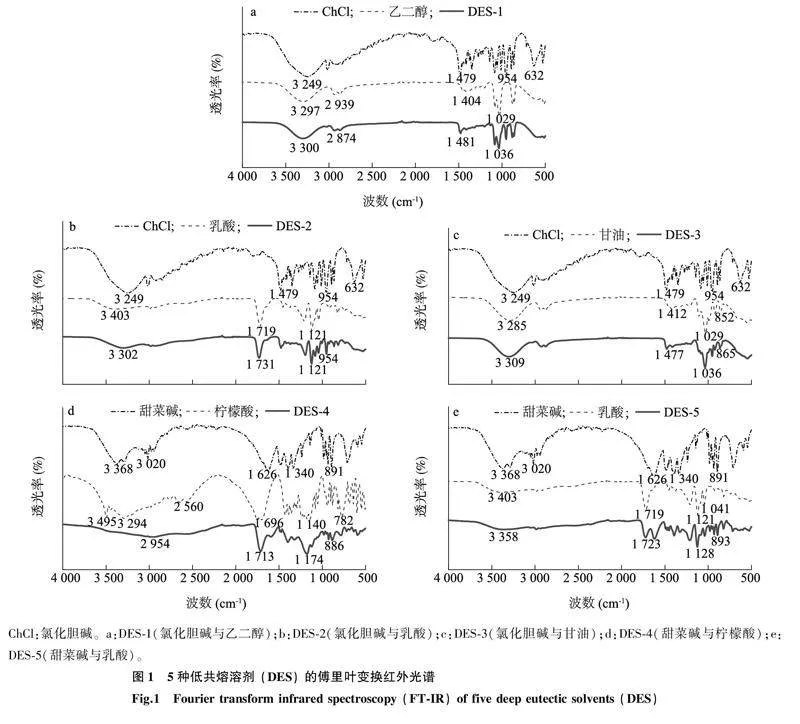
2.1.1傅里叶变换红外光谱(FT-IR)分析如图1a所示,氯化胆碱、乙二醇分别在FT-IR图谱的3 249 cm-1、3 297 cm-1处有吸收谷,这些吸收谷主要是由羟基振动产生的,DES-1中由O-H振动产生的吸收谷移动至3 300 cm-1处,表明氯化胆碱与乙二醇之间形成了O-H…O(羟基…氧离子)、O-H…Cl(羟基…氯离子)等氢键结构。如图1b所示,乳酸在3 403 cm-1处出现较弱的O-H 伸缩振动吸收带,在1 719 cm-1处出现C=O(羰基)的伸缩振动吸收谷,在DES-2中上述吸收谷分别红移至3 302 cm-1、1 731 cm-1处,说明ChCl和乳酸之间有氢键缔合作用。如图1c所示,甘油在3 285 cm-1处存在由O-H振动产生的吸收谷,在DES-3中此峰移至3 309 cm-1处,说明在DES-3中氯化胆碱与甘油之间存在氢键缔合作用。如图1d所示,甜菜碱、柠檬酸分别在3 368 cm-1、3 495 cm-1处存在O-H伸缩振动吸收带,柠檬酸在1 696 cm-1处有1个较强烈的羰基伸缩振动区;此外,柠檬酸在3 294 cm-1、2 560 cm-1处各有1个较宽的吸收谷,可能由于柠檬酸形成二聚体后,羟基的伸缩振动向低波数方向位移;在DES-4中,O-H的伸缩振动吸收带红移至2 954 cm-1处,且吸收谷变弱,羰基伸缩振动带红移至1 713 cm-1处,表明在DES-4中甜菜碱与柠檬酸之间有氢键缔合作用。如图1e所示,乳酸在3 403 cm-1附近有较弱的O-H 伸缩振动吸收带,在1 719 cm-1处有C=O(羰基)的伸缩振动吸收谷,而在DES-5中上述吸收区及吸收谷分别红移至3 358 cm-1、1 723 cm-1处,说明甜菜碱和乳酸之间形成了氢键。上述结果表明,本试验选取的5种DES均制备成功。
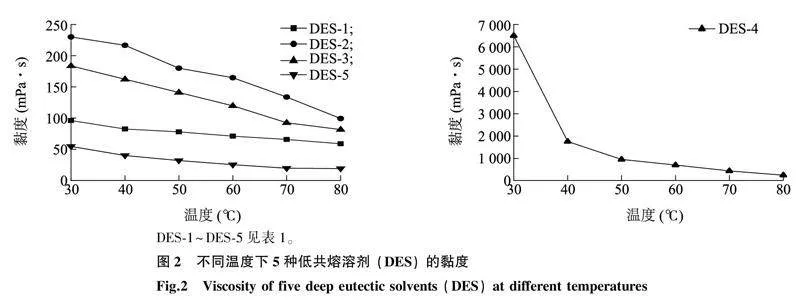
2.1.2黏度DES具有很高黏度,主要由于DES体系中各组分间存在较大的氢键作用力、范德华力及静电作用力,因此其流动性差,黏度较高[25]。DES的黏度与温度、含水量有很大关系,一般离子液体黏度与温度间存在指数关系,即黏度随着温度的升高呈指数性下降趋势[26]。由于本研究已在单因素试验中讨论了含水率对DES提取绿茶粉中茶多酚效果的影响,因此本试验仅在不同温度下测定各低共熔溶剂的黏度。如图 2所示,DES的黏度随温度的增高而下降,除DES-4外的所有类型DES的黏度均在250 mPa·s以下,且黏度随温度的变化较平缓、均匀。不同黏度值的排序为DES-2>DES-3>DES-1>DES-5,且DES-2与DES-3的黏度随温度下降的曲线相对于DES-1、DES-5的黏度随温度下降的曲线更陡峭,表明DES-2与DES-3的黏度受温度影响较大。DES-4具有高黏度,其黏度与温度间存在明显的指数关系;在接近30 ℃的条件下,其黏度达到6 500 mPa·s,似黏稠胶水状;当温度为40 ℃时,其黏度急剧下降至1 757 mPa·s,随后随着温度的升高,其黏度的变化趋于平缓。尽管如此,在80 ℃条件下,DES-4的黏度也高达253 mPa·s,超过30 ℃时其他4种类型溶剂的黏度。
另外,DES溶剂的黏度随温度的变化符合Arrhenius方程:
lnη=lnη-E/RT (2)
式中,η为黏度(mPa·s),η为指前因子(mPa·s),E为活化能(kJ/mol),R为摩尔气体常量,T为热力学温度(K)。
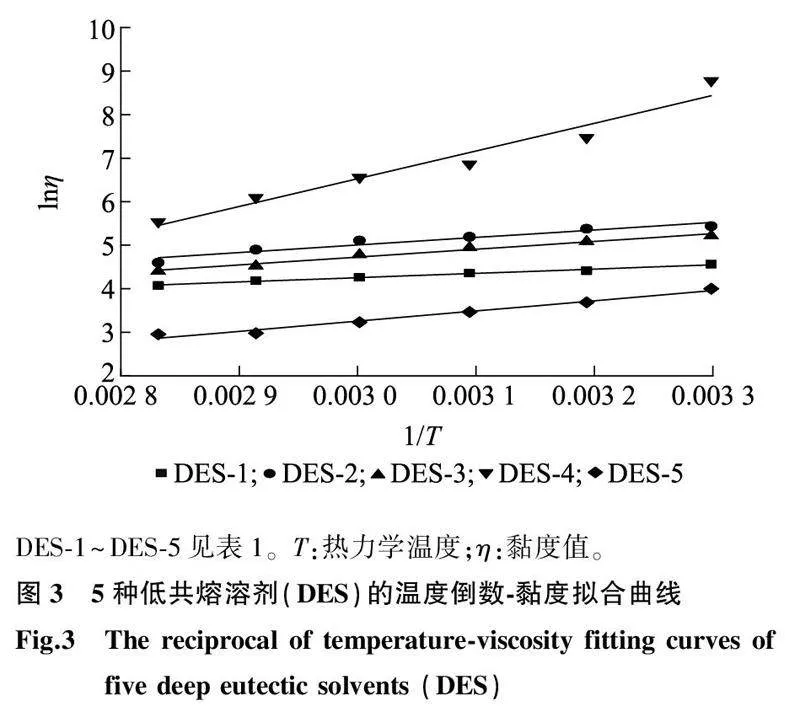
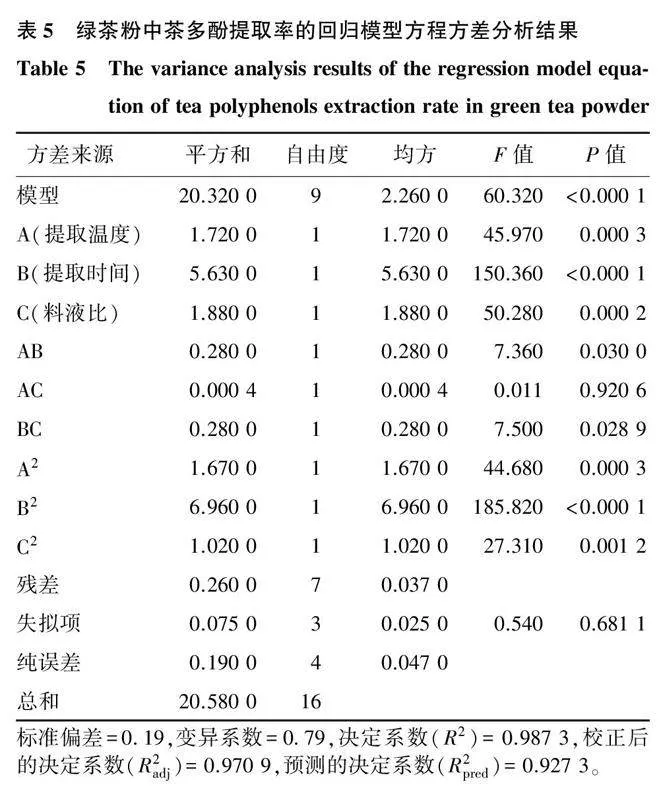
由公式(2)可以得到如图3所示温度的倒数与黏度的拟合曲线。由图3、表3可以看出,lnη与1/T呈明显的线性相关,DES的黏度符合阿伦尼乌斯方程,且5种DES对温度的依赖程度排序为DES-4>DES-2>DES-3>DES-1>DES-5。
2.2DES溶剂的筛选
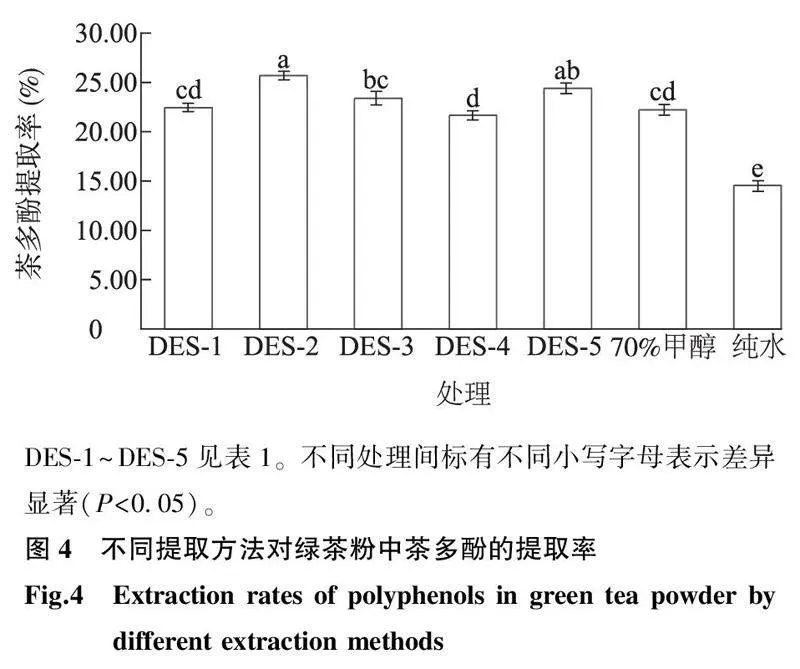
以茶多酚提取率为指标,筛选出对绿茶粉中茶多酚提取效果最好的DES。在相同提取条件(提取温度为70 ℃,提取时间为60 min,料液比为1 g∶30 mL,含水率为30%)下,5种DES对绿茶粉中茶多酚的提取效果均优于纯水;DES-2、DES-5对绿茶粉中茶多酚的提取效果均优于70%甲醇溶液且具有显著差异(P<0.05),其中DES-2(氯化胆碱与乳酸构成的低共熔溶剂体系)对绿茶粉中茶多酚的提取率最高,为25.70%,DES-2、DES-5体系对绿茶粉中茶多酚的提取率无显著差异(图4)。考虑到经济效益,氯化胆碱较甜菜碱的价格更具优势,且在常温下就可储藏,因此在后续试验中选择氯化胆碱-乳酸体系(DES-2)作为提取绿茶粉中茶多酚的溶剂。
2.3单因素试验结果
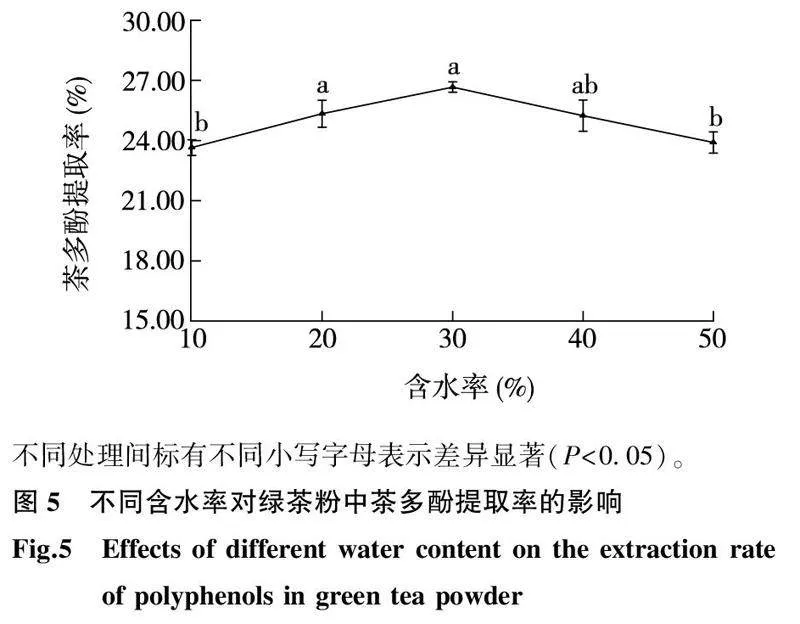
2.3.1DES-2含水率的影响由图5可以看出,随着DES-2含水率的提高,绿茶粉中茶多酚的提取率呈现先上升后下降的趋势。当DES-2含水率为30%时,绿茶粉中茶多酚的提取率为26.67%;当DES-2含水率分别为20%、40%时,绿茶粉中茶多酚的提取率分别为25.34%、25.24%,上述3个茶多酚提取率之间无显著差异(P>0.05)。当DES-2含水率为10%、50%时,绿茶粉中的茶多酚提取率无显著差异(P>0.05),且DES-2含水率为10%、50%时的茶多酚提取率与DES-2含水率为30%时的茶多酚提取率之间无显著差异(P>0.05)。当DES-2含水率超过30%并上升至50%时,绿茶粉中茶多酚的提取率反而下降,可能由于水中的H+、OH-离子氢键过多,使得低共熔溶剂间的氢键作用逐渐减弱甚至完全消失[27],从而导致绿茶粉中茶多酚从固体到液体之间的传质速率降低。上述结果表明,当DES-2含水率为30%时,用于提取绿茶粉中茶多酚的效果最佳。
不同处理间标有不同小写字母表示差异显著(P<0.05)。
2.3.2提取温度的影响如图6所示,当提取温度为50~70 ℃时,绿茶粉中茶多酚的提取率随提取温度的升高而上升;随着提取温度继续升高至80 ℃,绿茶粉中茶多酚的提取率下降,可能由于当提取温度过高时,使多酚类物质的氧化加剧。当提取温度为70 ℃时,绿茶粉中茶多酚提取率最高(25.95%),并与其他提取温度所得茶多酚提取率之间存在显著差异(P<0.05);当提取温度为40~50 ℃时,绿茶粉中茶多酚提取率随温度的变化不显著(P>0.05);当提取温度为80 ℃时,绿茶粉中茶多酚的提取率下降至21.80%,但仍高于提取温度为60 ℃时的20.30%提取率(P<0.05)。综上,以70 ℃作为DES提取绿茶粉中茶多酚的最适温度。
不同处理间标有不同小写字母表示差异显著(P<0.05)。
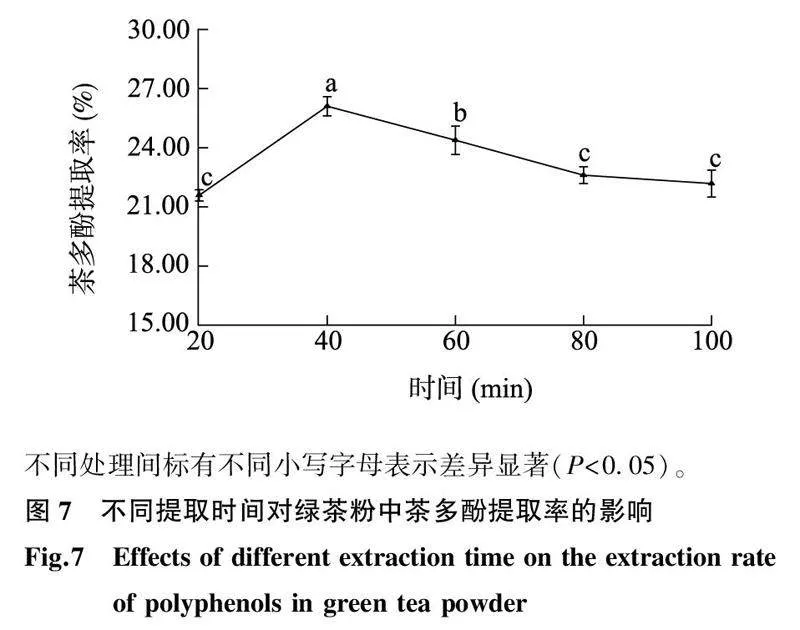
2.3.3提取时间的影响如图7所示,随着提取时间的增加,绿茶粉中茶多酚的提取率呈现先显著升高后缓慢降低的趋势。当提取时间为40 min时,绿茶粉中的茶多酚提取率达到最高值26.10%;当提取时间为20 min时,绿茶粉中茶多酚的提取率最低,为21.58%,但是当提取时间延长至80 min、100 min时,绿茶粉中茶多酚的提取率与提取时间为20 min相比并无显著变化(P>0.05)。上述结果表明,延长提取时间对提高绿茶粉中茶多酚的提取率并不能起到显著的促进作用,综合比较后选择40 min作为绿茶粉中茶多酚的最适提取时间。
不同处理间标有不同小写字母表示差异显著(P<0.05)。
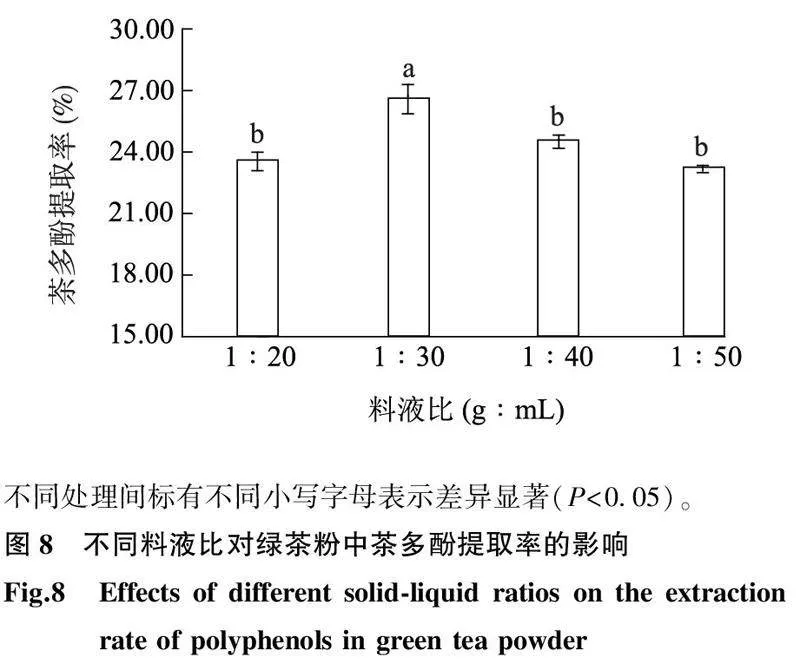
2.3.4料液比的影响由图8可知,当料液比为1 g∶30 mL时,绿茶粉中茶多酚的提取率最高,达26.57%(P<0.05);随着料液比由1 g∶30 mL减小至1 g∶40 mL,提取率显著下降;当料液比为1 g∶50 mL时,绿茶粉中的茶多酚提取率最低(23.17%),但与料液比为1 g∶20 mL、1 g∶40 mL时的提取率相比无显著差异,可能由于当料液比减小时,绿茶粉未得到完全浸提,但当料液比较高时,绿茶粉中的茶多酚提取率较低是由于DES对绿茶粉中茶多酚的提取达到饱和状态,继续提高料液比会导致从绿茶粉中提取的茶多酚从DES中凝聚到待提取物中[28]。综上,料液比1 g∶30 mL最合适。不同处理间标有不同小写字母表示差异显著(P<0.05)。
2.4响应面模型的建立与分析
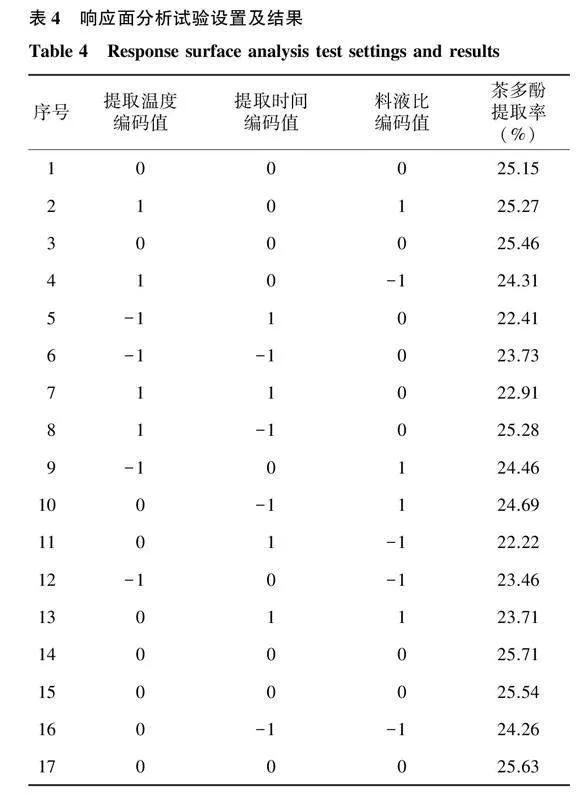
根据Box-Benhnken的中心组合原理研究提取温度、提取时间、料液比等独立变量对绿茶粉中茶多酚提取率的影响。为了验证试验结果的准确性,对试验数据进行统计分析。完整的试验设计由17个试验点组成,包括5组中心点的验证,并按随机顺序对所有设计点进行3次重复试验后取均值。绿茶粉中的茶多酚提取率用二阶多项式表达如下:
Y=β+ΣβX+ΣβX2+ΣΣβXX (3)
式中:Y为绿茶粉中茶多酚提取率的预测值;β为常数;β为线性系数;β为二次系数;β为交互式术语系数;X、X表示2个独立变量。试验运行结果如表4所示。
对试验数据进行二次多项式回归拟合,得到绿茶粉中茶多酚提取率与各试验因子编码值的回归模型方程为:
Y=25.50+0.46A-0.84B+0.49C-0.26AB-0.01AC+0.27BC-0.63A2-1.29B2-0.49C2 (4)
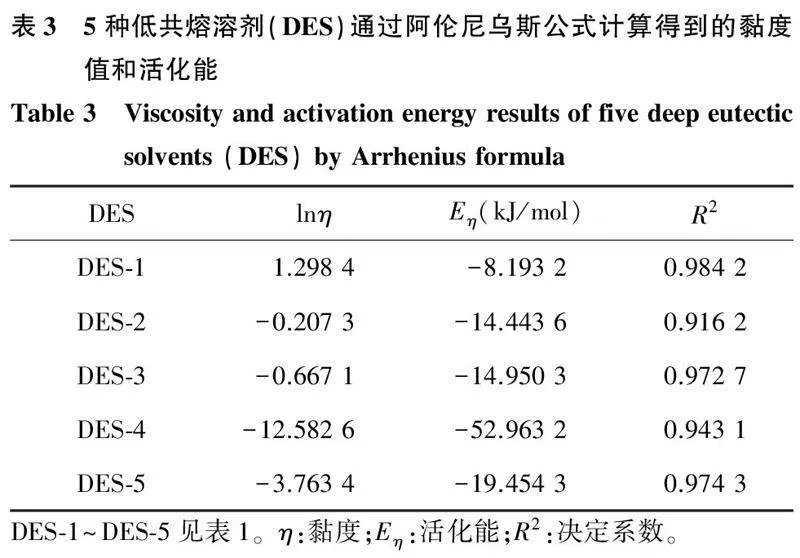
式中:Y为茶多酚提取率;A为提取温度编码值;B为提取时间编码值;C为料液比编码值。方差分析结果见表5。
如表5所示,该试验模型的P<0.000 1,具有极显著影响;失拟项的P=0.681 1>0.050 0,影响不显著,说明该模型具有很高的可信度[29]。所有响应变量的模型的决定系数(R2)均超过0.900 0,表明模型的拟合性良好[30]。本试验中选择的3个因子对绿茶粉中茶多酚提取率的影响程度排序为:B(提取时间)>C(料液比)>A(提取温度)。一次项(A、B、C)在统计学上表现出极显著影响;二次项(A2、B2、C2)也表现出极显著影响;交互项AB、BC之间呈显著影响。决定系数(R2)为0.987 3,表明响应值的变化98.73%来源于所选取的变量。校正后的决定系数(R2adj)为0.970 9,表明97.09%的响应值变化可以用该模型解释;变异系数为0.79>0.05,表明本试验设计无显著性差异,其精确性、重复性均较好。上述结论均表明,本试验模型的拟合程度高,可用于分析并预测DES-2提取绿茶粉中茶多酚的提取率。
2.5响应面图分析与回归模型的验证
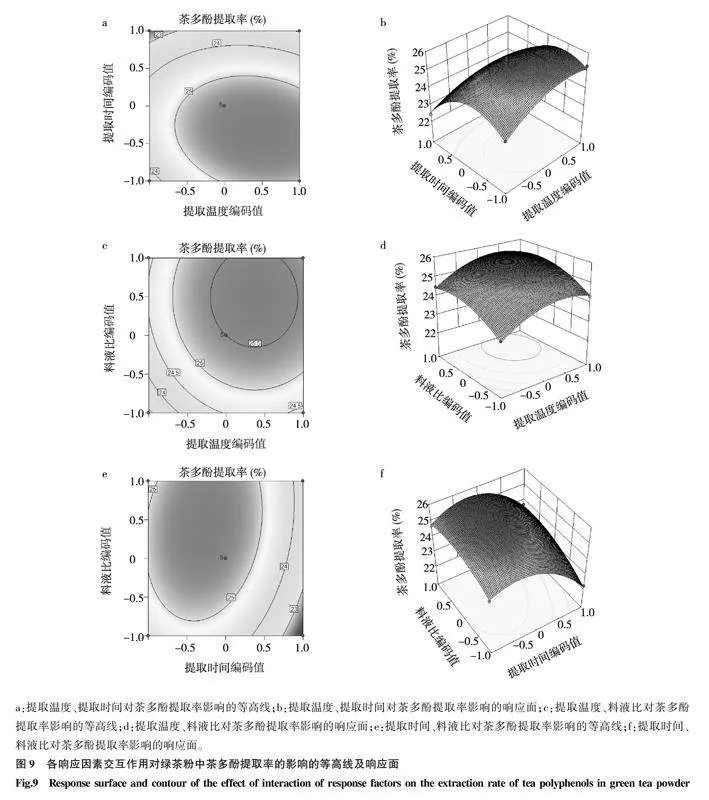
2.5.1响应面图分析响应面的等高线形状能显示2个交互因素之间的相互作用情况。若等高线呈椭圆形或马鞍形,说明2个因素间的交互作用明显;若等高线呈圆形,说明2个因素之间的交互作用不明显[31]。由图9a可知,提取温度、提取时间对绿茶粉中茶多酚提取率影响的响应面表现为曲度陡峭度大,且等高线呈椭圆形,说明二者间交互作用明显,提取温度的曲面陡峭度比提取时间的曲面陡峭度大,说明提取温度对绿茶粉中茶多酚提取率的影响更大。由图9b可知,提取温度与料液比间的等高线近似圆形,表明二者之间的交互作用并不明显。由图9c可知,提取时间、料液比对绿茶粉中茶多酚提取率影响的响应面表现为曲面陡峭度大,且等高线呈椭圆形,说明二者的交互作用明显,并且料液比曲面更陡峭,表明料液比对绿茶粉中茶多酚提取率的影响较提取时间明显。
2.5.2回归模型的验证通过Box-Behnken响应面优化试验得到DES提取绿茶粉中茶多酚的最佳工艺参数如下:提取温度74.64 ℃,提取时间 28.775 min,料液比1 g∶34.85 mL。在最佳工艺参数条件下,绿茶粉中茶多酚的提取率为25.498%。为了便于实际操作,优化后的工艺技术参数如下:提取温度75.00 ℃,提取时间29.000 min,料液比1 g∶35.00 mL,在此参数下进行3次重复验证,得到绿茶粉中茶多酚的平均提取率为25.160%,与理论值接近,表明基于Box-Behnken响应面优化低共熔溶剂提取绿茶粉中茶多酚的工艺可靠。
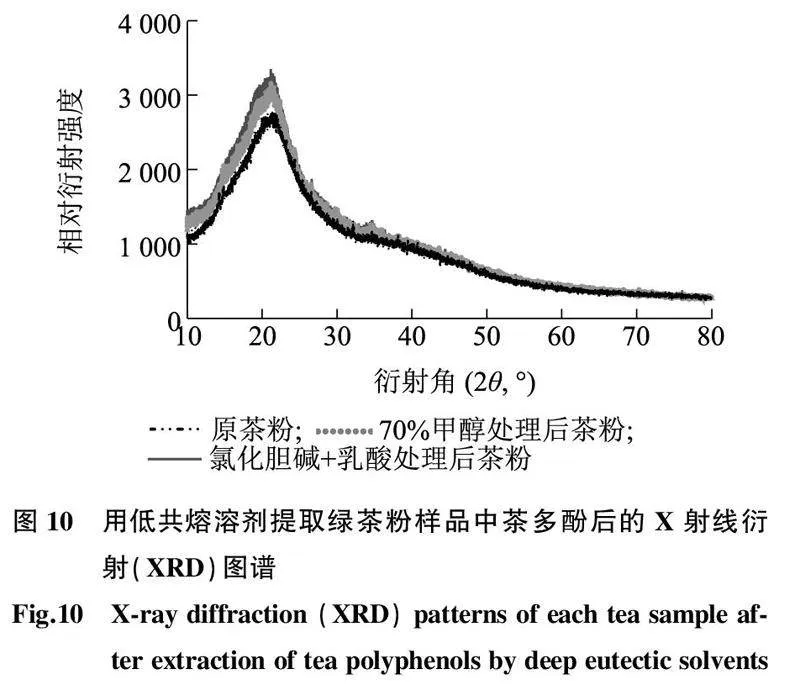
2.6用DES提取茶多酚前后绿茶粉样品的结构分析2.6.1XRD分析如图10所示,用70%甲醇溶液、DES-2处理绿茶粉后,各晶体的XRD结构与原茶粉基本相同,表明在提取过程中绿茶粉的晶体结构未发生明显变化。但是研究发现,用70%甲醇溶液、DES-2处理后,绿茶粉的结晶度略高于未处理的绿茶粉,且用DES-2处理的绿茶粉的结晶度高于用70%甲醇溶液处理的绿茶粉的结晶度,原因可能是DES对绿茶粉有一定的凝结作用[32]。
2.6.2SEM分析用SEM对用70%甲醇溶液及用DES-2提取后的绿茶粉样品进行表征分析,观察提取前后绿茶粉外形结构的变化。如图11所示,在未经处理的条件下,绿茶粉呈现团粒结构且表面光滑;用70%甲醇溶液处理后,绿茶粉的团聚程度降低,表面松散粘连;用DES-2处理后,绿茶粉的团粒结构几乎消失且颗粒表面有类似肠壁的褶皱,该结构可增加茶样与DES间的接触面积,有利于绿茶粉中茶多酚被浸提溶出。
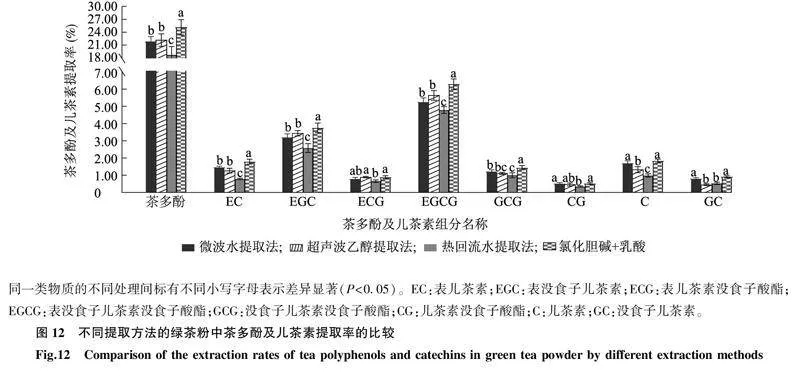
2.7不同提取方法所得绿茶粉中茶多酚、儿茶素组分提取率在DES提取法与其他提取方法均采用最佳参数的条件下,用相同绿茶原料进行试验并对试验结果进行比较。如图12所示,不同提取方法所得绿茶粉中茶多酚提取率的整体排序如下:氯化胆碱+乳酸(DES-2)提取法>超声波乙醇提取法>微波水提取法>热回流水提取法。用DES-2提取法所得绿茶粉中茶多酚的提取率最高,为25.16%,而用热回流水提取法所得绿茶粉中茶多酚的提取率最低,为18.74%。在各提取方法中,以DES-2提取法对有效成分儿茶素的提取量最多,可为有效成分的溶出提供良好的溶剂体系。此外研究发现,在高温长时间提取条件下,茶多酚尤其是儿茶素类容易被氧化,并可能产生咖啡因和蛋白质的络合物,从而降低茶多酚的得率、生物活性。
2.8绿茶中茶多酚的抗氧化活性
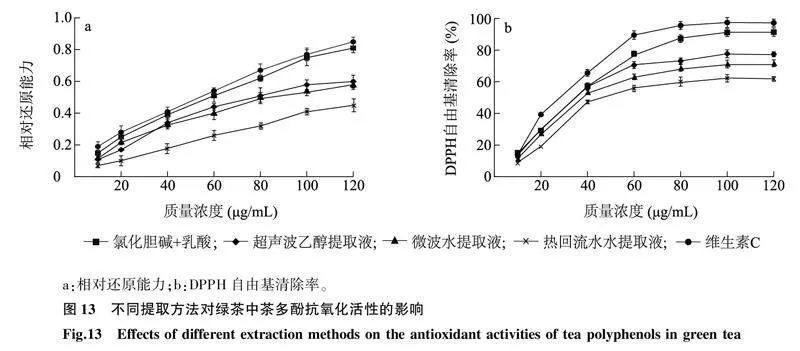
2.8.1相对还原能力如图13a所示,各提取方法所得绿茶中茶多酚提取液和维生素C的相对还原力(OD700)与测试质量浓度之间遵循剂量依赖关系,且相对还原能力随着绿茶中茶多酚提取物质量浓度的增加而递增,但以DES提取方法所得绿茶中茶多酚的相对还原能力最强,接近对照(维生素C)的相对还原能力。
同一类物质的不同处理间标有不同小写字母表示差异显著(P<0.05)。EC:表儿茶素;EGC:表没食子儿茶素;ECG:表儿茶素没食子酸酯;EGCG:表没食子儿茶素没食子酸酯;GCG:没食子儿茶素没食子酸酯;CG:儿茶素没食子酸酯;C:儿茶素;GC:没食子儿茶素。
2.8.2对DPPH自由基的清除活性如图13b所示,茶多酚对DPPH自由基的清除率先随样品质量浓度的增加而增大,随后趋于平衡。茶多酚质量浓度与对DPPH自由基的清除率间呈现明显的量效关系。当茶多酚质量浓度为120 μg/mL时,DES提取液、超声波乙醇提取液、微波水提取液和热回流水提取液对DPPH自由基的清除活性分别为94.03%、79.63%、73.66%、63.58%。IC50 值表示对DPPH自由基的清除率达到一半时抗氧化剂的质量浓度,其值越小,表明其抗氧化能力越强,在本研究中,IC50 值的排序如下:维生素C<DES<超声波乙醇提取法<微波水提取法<热回流水提取法,可见以DES提取法得到的绿茶中茶多酚提取液的活性最强。
3讨论
目前,常用的茶多酚提取方法有溶剂提取法、超声波提取法、离子沉淀法等,其中溶剂提取法工艺简便、成本低廉,但茶多酚的萃取率较低。尽管利用有机溶剂萃取可以提高茶多酚的提取率,但提纯程度不高,需要进行多次分离,且步骤较繁琐,存在一定的安全隐患[9]。离子沉淀法具有操作简便、成本低廉等优点,但在生产过程中容易残留金属离子,提取出的茶多酚制成品易造成安全隐患[10]。超声波提取法具有快速、高效等优点,但多酚类物质结构容易在浸提过程中被破坏[11]。相比于传统的有机溶剂,DES可与酚类物质形成氢键,从而获得更高提取量,并能保持酚类物质的稳定性[33]。
DES含水率对提取效果影响的原理主要是离子水之间可以形成氢键,从而降低溶剂的黏度,进而提高茶多酚从茶样中到低共熔溶液中的传质速率[34]。此外,多酚类物质具有多个羟基,属于极性物质,水可增加DES的极性,从而促进生物资源中极性化合物的溶解[16]。提取条件对提取率的影响也很大,提高提取温度可以促进物质的热运动,使多酚类物质更快、更多地析出,但是温度过高会使茶多酚的提取率下降,因为高温会使多酚类物质氧化加剧,从而使其失去活性。料液比也对提取率有影响,合适的料液比不仅能够提高茶多酚的有效提取率,还能促进溶剂的最大化利用。XRD分析、SEM分析结果均表明,DES-2对茶粉表面结构产生了一定影响,使绿茶粉更易与溶剂接触,从而使其有效成分能够更好地浸提析出。此外,在抗氧化活性方面,利用DES提取所得茶多酚的还原能力较好且对DPPH自由基的清除活性也很高,具有Qk6+dsalZvmb75SWKuRL5g==很强的抗氧化性,原因是由于DES内产生的氢键对茶多酚具有保护作用,使其在提取过程中不被氧化破坏,从而保持较高的生物活性。
4结论
本研究建立了一种从绿茶中高效提取茶多酚的工艺方法。制备的5种DES经过FT-IR分析证实被成功合成。通过比较用纯水、70%甲醇溶液和不同DES提取绿茶中茶多酚的提取率发现,由ChCl-乳酸合成的DES的提取效果较好,在含水率为30%、提取温度为75 ℃、提取时间为29 min、料液比为1 g∶35 mL的条件下,茶多酚的提取率为25.16%。提取前后绿茶粉的XRD图、SEM图结果表明,与传统溶剂相比,DES作为溶剂提取绿茶中的多酚类化合物时,茶粉的晶体结构没有发生明显变化,但表面形貌特征发生褶皱,表面积增大,从而有利于茶多酚类物质的溶出,提高提取率。同时,与常用的超声波提取法、微波提取法、热回流提取法相比,DES提取法在茶多酚提取率、儿茶素组分稳定性上均具有显著优势,且该提取法获得的茶多酚体外还原能力、对DPPH自由基的清除活性均较好。由研究结果可知,DES提取法避免了使用传统有毒有害溶剂,且提取效果远优于常用提取方法,具有绿色、便捷、高效等优点,可为DES代替传统有机溶剂进行天然产物的提取研究提供可行性依据。
参考文献:
[1]旷春桃,李湘洲,汪玉霞,等. 大叶冬青叶中总黄酮测定方法和提取工艺研究[J]. 食品科学,2009,30(6):49-51.
[2]HONG M Y, YU J, WANG X P, et al. Tea polyphenols as prospective natural attenuators of brain aging[J]. Nutrients,2022,14(15):3012.
[3]李振,张秀玲,张文涛,等. 1-甲基环丙烯熏蒸结合茶多酚涂膜处理对蕨菜保鲜效果的影响[J]. 食品科学,2021,42(19):218-225.
[4]张志勇,李婷,朱慧芳,等. 茶多酚调节肠道菌群及抗肥胖作用研究进展[J]. 食品安全质量检测学报,2023,14(2):161-167.
[5]林德,吴宁俊,刘五高,等. 亚抑菌浓度茶多酚对肺炎克雷伯菌的影响[J]. 中国消毒学杂志,2023,40(1):18-20.
[6]李光达,王婧,许晶,等. 基于免疫调节探讨茶多酚及表没食子儿茶素没食子酸酯的抗肿瘤机制[J]. 中国药房,2022,33(24):3067-3072.
[7]WANG M, YANG X T, GAO Y L, et al. Computer-aided screening and revealing action mechanism of green tea polyphenols intervention in Alzheimer’s disease[J]. Foods,2023,12(3):635.
[8]ZHANG X N, LI J, LI Y H, et al. Anti-melanogenic effects of epigallocatechin-3-gallate (EGCG),epicatechin-3-gallate (ECG) and gallocatechin-3-gallate (GCG) via down-regulation of cAMP/CREB/MITF signaling pathway in B16F10 melanoma cells[J]. Fitoterapia,2020,145:104634.
[9]王玉春. 茶多酚的提取方法及应用研究进展[J]. 甘肃联合大学学报(自然科学版),2008,22(3):51-55.
[10]胡玲玲,张超霞,韩丽丽,等. 沉淀法提取茶叶废料中茶多酚的工艺研究[J]. 广州化工,2011,39(11):64-65.
[11]宋传奎,肖斌,王艳丽,等. 超声波辅助提取茶多酚工艺条件的优化[J]. 西北农林科技大学学报(自然科学版),2011,39(5):133-139,146.
[12]宣婧婧,武喜营,戚建平,等. 天然低共熔溶剂在药剂学中的应用[J]. 药学学报,2021,56(1):146-157.
[13]屠羽佳,李林楠,范文翔,等. 基于机械化学辅助-低共熔溶剂的人参皂苷绿色提取新方法研究[J]. 中国中药杂志,2022,47(23):6409-6416.
[14]冯智翱,杨丹,薄彧坤,等. 天然低共熔溶剂提取栀子中活性成分的工艺研究[J]. 现代化工,2022,42(增刊2):258-262,268.
[15]王晓艺,李培坤,李锦红,等. 超声辅助低共熔溶剂提取玫瑰多酚及其抗氧化活性[J]. 食品研究与开发,2022,43(8):98-105.
[16]古丽菲热·伊力哈木,马梦亚,艾斯卡尔·吐尔逊,等. 超声辅助低共熔溶剂法提取新疆大果沙枣多酚类化合物及其抗氧化活性研究[J]. 食品与发酵工业,2023,49(18):186-194.
[17]倪玉娇,赵春建,李春英,等. 超声辅助低共熔溶剂提取沙棘籽粕多酚的工艺优化[J]. 植物研究,2017,37(3):474-480.
[18]汪涛,梁亮,李旭锐,等. 低共熔溶剂提取核桃青皮多酚工艺优化及其抑菌活性[J]. 农业工程学报,2021,37(5):317-323.
[19]NKHILI E, TOMAO V, EL HAJJI H, et al. Microwave-assisted water extraction of green tea polyphenols[J]. Phytochemical Analysis,2009,20(5):408-415.
[20]都昌乐,杨紫雨,陈贝言,等. 超声波辅助乙醇提取茶多酚工艺的正交优化研究[J]. 安徽理工大学学报(自然科学版),2022,42(4):29-34.
[21]蒋丽,王雪梅,全学军,等. 不同提取方法对茶多酚理化性质的影响[J]. 食品科学,2010,31(14):136-139.
[22]杨春妹,李志明,范先婷,等. 福林酚比色法测定海藻多酚的反应条件优化[J]. 江苏农业学报,2023,39(1):238-245.
[23]程爽,贺斐,付龙洋,等. 冬凌草硒多糖的制备及其抗氧化活性分析[J]. 精细化工,2021,38(10):2064-2071.
[24]阮怿航,吴亮宇,鲁静,等. 低共熔溶液提取铁观音茶多酚工艺的响应面法优化[J]. 福建农业学报,2020,35(2):217-225.
[25]唐超凡. 氯化胆碱低共熔溶剂理化性质及其在预处理纤维素和黄酮提取应用中的研究[D]. 镇江:江苏大学,2021.
[26]张欢欢,刘玉婷,李戎,等. 新型低共熔溶剂的制备、表征及物性研究[J]. 化学通报,2015,78(1):73-79.
[27]DAI Y T, WITKAMP G J, VERPOORTE R, et al. Tailoring properties of natural deep eutectic solvents with water to facilitate their applications[J]. Food Chemistry,2015,187:14-19.
[28]FU X Z, BELWAL T, HE Y H, et al. UPLC-Triple-TOF/MS characterization of phenolic constituents and the influence of natural deep eutectic solvents on extraction of Carya cathayensis Sarg. peels:composition,extraction mechanism and in vitro biological activities[J]. Food Chemistry,2022,370:131042.
[29]ZHANG G W, HU M M, HE L, et al. Optimization of microwave-assisted enzymatic extraction of polyphenols from waste peanut shells and evaluation of its antioxidant and antibacterial activities in vitro[J]. Food and Bioproducts Processing,2013,91(2):158-168.
[30]MANSUR A R, SONG N E, JANG H W, et al. Optimizing the ultrasound-assisted deep eutectic solvent extraction of flavonoids in common buckwheat sprouts[J]. Food Chemistry,2019,293:438-445.
[31]赵敏,战祥,徐茜,等. 响应面法优化五倍子多酚的提取工艺[J]. 湖北大学学报(自然科学版),2023,45(2):294-300.
[32]黄文睿,唐超凡,陶雨峰,等. 绿色低共熔溶剂提取野菊花中黄酮类化合物[J]. 精细化工,2022,39(3):569-576.
[33]FU X Z, WANG D, BELWAL T, et al. Natural deep eutectic solvent enhanced pulse-ultrasonication assisted extraction as a multi-stability protective and efficient green strategy to extract anthocyanin from blueberry pomace[J]. LWT,2021,144:111220.
[34]李海飞,杨毅,亓雨芮,等. 超声波辅助酸性天然低共熔溶剂提取黑果腺肋花楸花青素及其稳定性和抗氧化活性分析[J]. 食品工业科技,2023,44(8):259-269.(责任编辑:徐艳)

