甘蓝型油菜BnWSD家族基因鉴定及其在干旱胁迫下的表达特征








摘要:干旱胁迫能诱导作物蜡酯合成酶/二酰甘油酰基转移酶基因WSD(wax synthase/diacylglycerol acyltransferase)的表达。为明确甘蓝型油菜BnWSD家族基因的理化性质及其对干旱胁迫的响应特征,本研究基于甘蓝型油菜转录组数据库,利用生物信息学方法从甘蓝型油菜基因组中筛选BnWSD家族基因并对其结构、染色体定位、系统进化树及其编码蛋白质的理化性质、结构、保守基序、顺式作用元件等进行分析,并以陇油10号为试验材料,通过干旱胁迫处理明确BnWSD家族基因成员的表达特性。结果表明,甘蓝型油菜基因组中共鉴定到36个BnWSD家族基因,可分为3个亚家族,其编码蛋白质的氨基酸数量为105~538个,等电点为6.32~9.63;36个BnWSD家族基因共有8个保守基序,每个基因含有2~8个保守基序,motif 2是该家族共有的功能基序,在进化上较为保守;甘蓝型油菜BnWSD基因启动子区域存在11个与光响应、激素应答、干旱胁迫应答等相关的顺式作用元件。甘蓝型油菜不同器官中BnWSD基因的相对表达量存在差异,叶和茎中相对表达量较高,而根和花中的相对表达量较低或不表达。随着干旱程度加深,甘蓝型油菜叶片中BnWSD1-1、BnWSD2、BnWSD8、BnWSD9、BnWSD12、BnWSD18-1、BnWSD20-1、BnWSD24-1等基因的相对表达量呈增加趋势。综上,BnWSD基因与甘蓝型油菜抗旱性能密切相关,本研究结果为进一步解析甘蓝型油菜抗旱机制、明确BnWSD基因家族在表皮蜡质累积中的作用及甘蓝型油菜抗旱性品种选育提供了依据。
关键词:甘蓝型油菜;WSD基因家族;鉴定;干旱胁迫
中图分类号:S634.301文献标识码:A文章编号:1000-4440(2024)07-1170-12Identification of BnWSD family genes in Brassica napus L. and their expression characteristics under drought stressWAN Junbin WANG Wangtian SUN Wancang MA Li WU Junyan LIU Lijun PU Yuanyuan ZHANG Yan LI Zhizhong ZHOU Rong
(1.College of Life Science and Technology of Gansu Agricultural University/Key Laboratory of Arid Habitat Crop Science of Gansu Province, Lanzhou 730070, China;2.Gansu Rape Engineering Technology Research Center, Lanzhou 730070, China)
Abstract:Drought stress can induce the expression of crop wax synthase/diacylglycerol acyltransferase (WSD) gene. In order to clarify the physical and chemical properties of BnWSD family genes in Brassica napus and their response characteristics to drought stress, this study used bioinformatics methods to screen BnWSD family genes from the B. napus genome and analyzed their structure, chromosome location, phylogenetic tree and the physical and chemical properties, structure, conserved motifs and cis-acting elements of their encoding proteins, based on the B. napus transcriptome database. The expression characteristics of BnWSD family genes were determined by drought stress treatment with Longyou 10 as the experimental material. The results showed that a total of 36 BnWSD family genes were identified in the genome of B.napus, of which could be divided into three subfamilies. The number of amino acids of encoded proteins of 36 BnWSD family genes ranged from 105 to 538, and the isoelectric point ranged from 6.32 to 9.63. There were eight conserved motifs in 36 BnWSD family genes, and each gene contained two to eight conserved motifs, and motif 2 was a common functional motif in the BnWSD family genes, which was relatively conserved in evolution. There were 11 cis-acting elements related to light response, hormone response and drought stress response in the promoter region of BnWSD gene in B. napus. The relative expression levels of BnWSD gene in different organs of B.napus were different. The relative expression levels in leaves and stems were relatively higher, while the relative expression levels in roots and flowers were relatively lower or not expressed. With the deepening of drought, the relative expression levels of BnWSD1-1, BnWSD2, BnWSD8, BnWSD9, BnWSD12, BnWSD18-1, BnWSD20-1 and BnWSD24-1 in leaves of B.napus showed an increasing trend. In summary, the BnWSD gene was closely related to the drought resistance of B.napus. The results of this study provide a basis for further analysis of the drought resistance mechanism of B.napus and clarifying the role of the BnWSD gene family in epidermal wax accumulation and the breeding of drought-resistant B.napus varieties.
Key words:Brassica napus;WSD gene family;identification;drought stress
甘蓝型油菜(Brassica napus L)是十字花科芸薹属一年生或二年生作物。中国的油菜种植面积约6.67×106 hm2,油菜籽年均总产量约1.40×107 t,每年可以提供5.2×106 t的优质菜油[1-2]。菜油含有丰富的不饱和脂肪酸,油脂结构稳定、不易被氧化,是居民生活常用的健康食用植物油之一[3-6]。由于中国人口基数大,国产食用油无法满足居民的生活需求,每年需要进口大量食用油,因此提高中国的油料作物产业发展水平势在必行[7]。
油菜生长的土壤适宜相对含水量约为60%[8]。不同时期的干旱胁迫都会影响油菜的生长发育,导致油菜产量和品质下降。20世纪80年代以来,全球气候变暖给中高纬度地区的农业生产带来了更为充足的热量资源,但同时亦增加了中高纬度地区干旱发生的频率和强度,给作物生长带来了一定的气候风险[9-10]。中国西北地区的冬油菜是中国油菜种植的重要组成部分,在气候变暖的大背景下,该地区的冬油菜种植面积呈增加趋势。但西北地区冬油菜生长常面临冬寒和冬春旱的交替胁迫,因此培育抗旱性油菜新品种已成为西北地区油菜产业健康发展的重要支撑。干旱胁迫下,作物会调控特定基因表达,改变植株形态和相关生理代谢以减少水分损失[11]。表皮蜡质是覆盖在植物表层的第一层防失水屏障,在植物适应干旱环境、减少失水方面起重要作用[12]。植物表层蜡质的积累与C16或C18脂肪酸合成、长链脂肪酸合成、蜡质物质形成等3个代谢过程相关。首先是乙酰辅酶A在植物表皮细胞质体中,在脂肪酸合成酶复合体(FAS)催化下,以2C的形式循环延伸形成C16或C18脂肪酸[13-14];其次在内质网中,C16或C18脂肪酸辅酶A在脂肪酸延长酶(FAE)合成、还原、脱水等作用下,以丙二酰辅酶A为原料,以2C的形式继续循环延伸生成蜡质合成的基础物质长链脂肪酸(VLCFA)[15-18];最后,长链脂肪酸经过酰基还原途径生成烷基酯,经脱羰途径生成醛类、烷烃类、二级醇和酮类等物质,烷基脂和酮类物质形成蜡质混合物,经ABC转运蛋白运输,穿过质膜与细胞壁形成角质层[19-22]。在上述酰基还原途径中,初级醇经蜡质合成酶(WSD1)催化调控形成烷基酯[23]。
WSD1基因在酵母细胞中过量表达会造成拟南芥茎秆蜡酯的积累,若将WSD1基因沉默后蜡酯的含量会显著减少[24],这说明蜡酯的积累受到WSD1基因调控。蜡酯是表皮蜡质合成过程中最重要的成分。Jetter等[13]研究发现,拟南芥WSD基因编码蜡酯合成酶,主要作用于酰基还原途径。鉴于目前油菜中WSD基因的功能尚未见报道,本研究以甘蓝型油菜转录组数据库为基础,利用生物信息学方法筛选与鉴定甘蓝型油菜BnWSD家族基因,并分析该基因家族在干旱胁迫下的表达特征,旨在揭示BnWSD家族基因的生物学功能,为油菜抗旱性育种提供新思路。
1材料与方法
1.1植物材料与处理
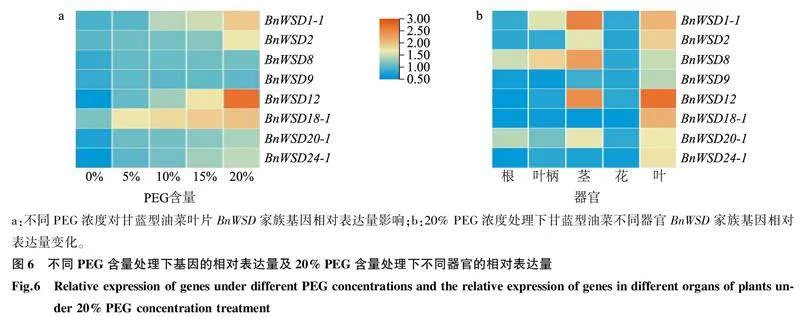
试验材料为甘蓝型油菜品种陇油10号,油菜种子经0.3%硝酸钾溶液催芽处理3 h后播种于花盆中直至萌发,幼苗在温室培养,室温24 ℃,土壤相对含水量60%左右,光照时间12 h/d。待甘蓝型油菜成长到盛花期使用不同含量(0%、5%、10%、15%、20%)的聚乙二醇(PEG)进行灌根处理,灌根3 d后,采集不同PEG含量处理的油菜叶片以及20%PEG处理的油菜根、茎、叶、花、叶柄等组织各0.5 g,共3个生物学重复,用液氮速冻后于-80 ℃冰箱保存待用。
1.2甘蓝型油菜BnWSD基因检索及鉴定
首先在拟南芥数据库(https://www.arabidopsis.org)中检索蜡质合成酶基因(WSD),基于隐马尔科夫模型和甘蓝型油菜转录组数据库(https://yanglab.hzau.edu.cn/bntir),利用BLAST软件比对获得甘蓝型油菜WSD家族候选基因,删除重复与冗余的序列,获得甘蓝型油菜WSD基因家族成员。
1.3甘蓝型油菜BnWSD基因编码蛋白质的理化性质及结构分析利用在线软件ExPASy(http://web.expasy.org/)及WOLF PSORT(http//www.genscript.com/wolf-psort.html)预测BnWSD家族基因编码蛋白质的理化性质,包括氨基酸长度、等电点、脂肪系数、亲水性与亚细胞定位。为了解BnWSD家族基因编码蛋白质的结构及功能,使用在线软件SOPMA(http://www.prabi.fr/)预测蛋白质二结构,利用在线软件SWISS-MODEL(https://www.swissmodel.expasy.org/)预测蛋白质的三级结构。
1.4甘蓝型油菜BnWSD基因结构及保守基序分析
整理甘蓝型油菜的基因组文件,从中单独提取出BnWSD基因家族的序列信息,利用在线软件MEME(https://meme-suite.org/meme/tools/meme)预测其保守结构域,然后利用TBtools软件分析基因结构及保守基序。
1.5甘蓝型油菜BnWSD基因染色体定位分析
根据甘蓝型油菜转录组数据库(BnTIR)中的ZS11.V2基因组文件(gff格式)中的注释信息,利用TBtools软件提取甘蓝型油菜WSD家族基因在染色体上的位置信息,并对其进行可视化分析。
1.6甘蓝型油菜BnWSD基因家族蛋白质系统发育树构建在美国国家生物技术信息中心(NCBI)数据库中选择模式生物拟南芥、白菜型油菜、番茄、冬瓜及本研究鉴定得到的甘蓝型油菜WSD家族基因,利用MEGA7.0软件,采用最大似然法,重复次数1 000次,构建进化树。
1.7甘蓝型油菜BnWSD家族基因启动子顺式作用元件分析利用TBtools软件提取BnWSD家族基因编码序列(CDS)上游2 000 bp的序列,利用Plant CARE(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线网站进行启动子顺式作用元件分析,利用TBtools软件对结果进行可视化。
1.8不同干旱处理下WSD家族基因的表达分析
利用植物组织RNA快速提取试剂盒提取不同处理样品的总RNA,利用FastKing gDNA Dispelling RT SuperMIX逆转录试剂盒进行cDNA合成。研究中选取分布于不同染色体上的8个代表性基因进行干旱胁迫的表达量变化分析,基因特异性扩增引物(表1)采用NCBI-Primer软件设计。以肌动蛋白编码基因(Actin)作为内参基因,采用FasyReal qPCR PreMIX(SYBR Green)试剂盒和美国Applied Biosystems公司的Abi-vivia 7实时PCR系统进行实时荧光定量PCR扩增,检测各基因循环阈值(Ct值),使用2-△△Ct方法计算基因的相对表达量,各测定3个重复。本研究中所有试剂均购自天根生化科技(北京)有限公司。
2结果与分析
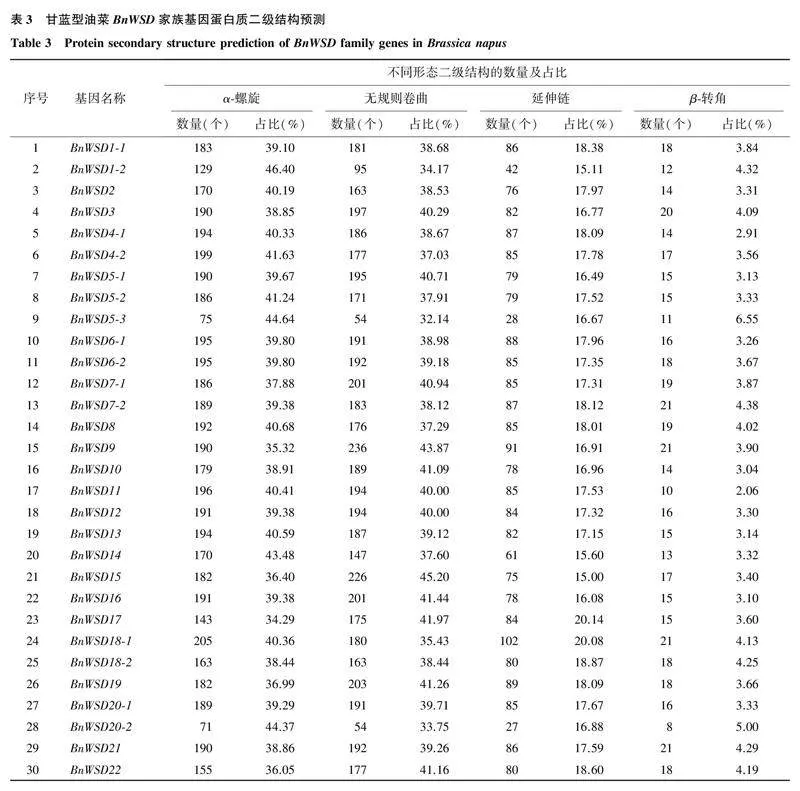
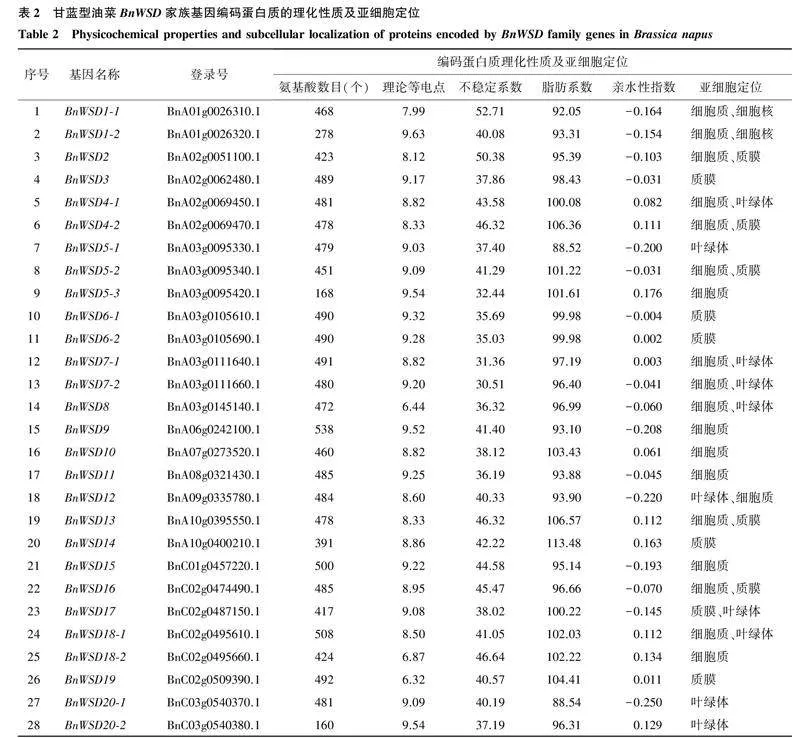
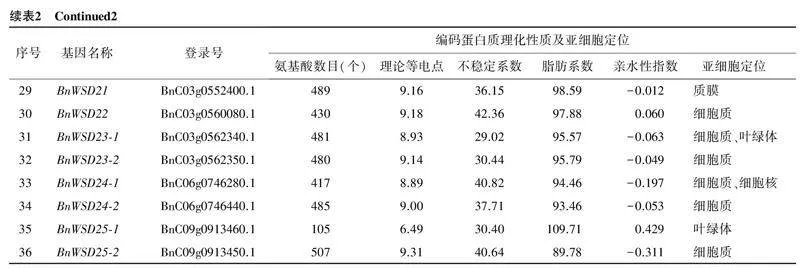
2.1甘蓝型油菜BnWSD家族基因的鉴定及其编码蛋白质的理化性质及结构通过同源比对,在甘蓝型油菜中共鉴定到36个WSD家族基因,按照其在染色体上的位置依次命名为BnWSD1-1~BnWSD25-2。36个WSD家族基因编码蛋白质的理化性质如表2所示。从表2可以看出,甘蓝型油菜36个WSD家族基因编码蛋白质的氨基酸数量为105~538个,理论等电点为6.32~9.63,说明该家族基因编码蛋白质中既有碱性蛋白质,又有酸性蛋白质,不稳定指数为29.02~52.71,其中,19个编码蛋白质的不稳定指数大于40.00,属于不稳定蛋白质,其余为稳定性蛋白质;脂肪系数为88.52~109.71,亲水性系数为-0.311~0.429,均为两性蛋白(亲水性系数为-0.500~0.500);亚细胞定位预测发现该家族基因大部分位于质膜和细胞质中,部分位于叶绿体和细胞核内。甘蓝型油菜36个BnWSD家族基因编码蛋白质的二级结构以α-螺旋与无规则卷曲为主,占比分别为35.11%~46.40%和29.52%~45.20%;延伸链与β-转角占比相对较低,分别为15.00%~26.67%和2.06%~6.55%(表3)。36个BnWSD家族基因编码蛋白质的三级结构(图1)以α-螺旋与无规则卷曲为主,与二级结构预测结果一致。
2.2甘蓝型油菜BnWSD家族基因染色体定位
36个甘蓝型油菜BnWSD基因分布在13条染色体上,A03号染色体上分布得最多,有8个BnWSD基因,A06号、A07号、A08号、A09号、C01号染色体上均各有1个BnWSD基因,A01号、A10号、C06号、C09号染色体上各有2个BnWSD基因,A02号、C02号和C03号染色体上分别有4个、5个和6个BnWSD基因(图2)。
2.3甘蓝型油菜BnWSD家族基因结构及保守基序
甘蓝型油菜BnWSD家族基因共有8个保守基序,每个基序编码的氨基酸长度均不相同,具体如表4所示。甘蓝型油菜BnWSD基因家族共分为3个亚族,每个亚族所含的主要保守基序均不相同(图3A)。亚族Ⅰ有17个成员,其中BnWSD25-1只有Motif 2和Motif 4,BnWSD22没有Motif 2,但有2个Motif 3,BnWSD14只有6个Motif,其他成员均含有8个Motif;亚族Ⅱ有7个成员,BnWSD5-3与BnWSD20-2只有3个Motif,而BnWSD5-2和BnWSD2分别缺失Motif 7和Motif 3,其他3个成员均含8个Motif;亚族Ⅲ有12个成员,其中,BnWSD1-2有5个Motif,BnWSD24-1有7个motif,BnWSD25-2有6个Motif,其他成员均含8个Motif。除BnWSD22基因外,其他成员均具有Motif 2,推测Motif 2是该家族共有的功能基序。甘蓝型油菜BnWSD家族基因均含有外显子结构,且外显子数目为3~8个,80%的家族成员含有6~7个外显子。亚族Ⅰ中BnWSD25-1、亚族Ⅱ中BnWSD5-3与BnWSD20-2,亚族Ⅲ中BnWSD1-2基因外显子较少,其他基因均含6~7个外显子,说明该家族基因在进化过程中较为保守(图3B)。
2.4甘蓝型油菜BnWSD家族基因系统发育树
对甘蓝型油菜、白菜型油菜、拟南芥、番茄和冬瓜5个物种99个WSD蛋白进行多重比对后,构建的发育进化树如图4所示。99个WSD蛋白可分为11个分支(Ⅰ~Ⅺ),分别含有2个、5个、3个、5个、17个、4个、7个、18个、4个、16个和18个WSD蛋白。甘蓝型油菜BnWSD蛋白散乱分布于分支Ⅲ~Ⅺ。Ⅰ和Ⅱ两个分支以冬瓜WSD蛋白为主,所以冬瓜与甘蓝型油菜亲缘关系较远;在分支Ⅷ与Ⅺ中BnWSD蛋白较多,分别有6个和7个,这2个分支以白菜型油菜与番茄WSD蛋白为主,因此甘蓝型油菜亲缘关系上与同属的白菜型油菜最为接近,其次为番茄。
2.5甘蓝型油菜BnWSD家族基因顺式作用元件
甘蓝型油菜BnWSD家族基因转录起始位点上游的顺式作用元件大致分可为3类,第1类是光响应元件,如AE-box、G-box、GT1-motif等;第2类是激素应答元件,如ABRE、CGTCA-motif、TCA-element、TGA-element、GARE-motif等;第3类是逆境应答性元件,如ARE、MBS、MRE等(图5)。ARE、TCA-element、CGTCA-motif等元件在大部分基因上都有分布,ABRE和P-box元件在所有基因上均有分布,且在部分基因上存在多个同等元件,这些元件均与植物抗旱性相关,因此,可以认为该家族基因与植物抗旱有关。
2.6甘蓝型油菜BnWSD家族基因表达分析
随着PEG含量的升高,油菜叶片中BnWSD1-1、BnWSD2、BnWSD8、BnWSD9、BnWSD12、BnWSD18-1、BnWSD20-1、BnWSD24-1 8个代表性基因的相对表达量均呈增加的趋势,其中,BnWSD12相对表达量增加得最为明显(图6a),这说明BnWSD家族基因与抗旱相关。20% PEG处理下,叶片中8个BnWSD代表性基因的相对表达量最高,茎中相对表达量其次,根和花中相对表达量较低,或者不表达。BnWSD12、BnWSD18-1、BnWSD24-1 3个基因在根中没有表达,花中8个BnWSD代表性基因的相对表达量均不超过0.50(图6b)。上述结果说明,BnWSD基因家族主要在叶片和茎中表达,而这些器官是作物失水的主要部位,这进一步证实该家族基因与植物失水调控有关。
3讨论
干旱是当前全球最具危害性的的自然灾害之一。干旱不仅抑制作物生长发育,还能降低作物抵御病虫害的能力,导致作物的产量和品质下降[25-31]。为了适应干旱环境,作物感受到干旱信号时,会调控相关基因的表达而改变植株形态结构和相关生理过程来减少水分损失,如关闭气孔以减少蒸腾作用,分泌表皮蜡质防止非气孔性失水等[12]。WSD基因能调控蜡酯合酶/二酰甘油酰基转移酶的合成。本研究通过生物信息学分析发现,甘蓝型油菜BnWSD基因家族共36个成员,而拟南芥中仅有12个WSD基因,造成这种结果的原因是芸薹属植物在进化过程中进行了全基因组的三倍化,所以甘蓝型油菜WSD家族基因的数量是拟南芥的3倍[26]。36个BnWSD基因分布在13条不同的染色体上,并且各染色体上WSD基因的分布并不均匀,存在较多的串联基因,这些串联基因在基因的复制和重组中具有重要作用[27]。亚细胞定位显示大部分基因定位于细胞质和质膜上。编码的36个蛋白质均为两性蛋白,二级结构以α-螺旋与无规则卷曲为主。BnWSD家族基因的外显子数量大多数保持一致,仅有极少数发生较大差异,这可能是该家族基因在进化过程中受到压力,基因结构发生缺失或增加导致的。除BnWSD22基因外,其他BnWSD基因均具有Motif2,推测该基序是BnWSD家族基因保守的motif。系统进化树显示甘蓝型油菜与白菜型油菜WSD基因家族成员同时分布在相同的分支上,说明2者WSD家族基因具有同源性,亲缘关系较近。分析顺式作用元件发现BnWSD家族基因中大部分成员都具有与抗旱性相关的元件;随着干旱胁迫程度的增加,8个BnWSD代表性基因的相对表达量呈增加趋势,说明该基因家族在油菜干旱胁迫调控中起重要作用。8个BnWSD代表性基因的表达量在油菜植株器官间存在较大差异,叶片和茎中相对表达量较高,根和花中相对表达量较低或无表达。BnWSD基因这种器官表达特异性在拟南芥[24]和矮牵牛[28]中亦有发现。
周彬[29]研究证实,苹果的MdWSD蛋白具有WES-acyltranf结构域和DUF1298未知结构域。本研究中发现甘蓝型油菜BnWSD编码蛋白质亦有类似的结构域,Tomiyama等[30]研究证实该结构域所形成的空间是该类酶进行催化反应的区域。WSD是DGAT基因家族的新成员,Kalscheuer等[31]在醋酸钙不动杆菌中克隆了WSD基因,发现该基因能催化蜡酯、合成TCA。WSD家族基因能调控蜡质合成酶和甘油二酰基转移酶,在植物抗逆研究中尤为重要,值得深入分析[32]。与表皮蜡质合成过程相关的酶形成和调控一般较为复杂,Zhang等[33]分析了高粱β-酮脂酰辅酶A合成酶(KCS)的功能,但WSD基因家族的特性和功能研究相对较少,有待更广泛的分析。
参考文献:
[1]刘成,冯中朝,肖唐华,等. 我国油菜产业发展现状、潜力及对策[J]. 中国油料作物学报,2019,41(4):485-489.
[2]YILDIZ M, AKALI N, TERZI H. Proteomic and biochemical responses of canola (Brassica napus L.) exposed to salinity stress and exogenous lipoic acid[J]. Journal of Plant Physiology,2015,179:90-99.
[3]李加纳,邱厥,唐章林,等. 甘蓝型油菜主要产量和品质性状的相关分析[J].中国油料,1990(1):11-16.
[4]ZHANG Y F, WU Y Q, CHEN S R, et al. Flavor of rapeseed oil:an overview of odorants, analytical techniques, and impact oftreatment[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(4):3983-4018.
[5]熊秋芳,张效明,文静,等. 菜籽油与不同食用植物油营养品质的比较——兼论油菜品质的遗传改良[J]. 中国粮油学报,2014,29(6):122-128.
[6]SAEID N, YOUSEF S, PARVIZ M. Effects of exogenous application of 24-epibrassinolide on photosynthesis parameters, grain yield, and protein of dragon’s head (Lallemantia iberica) under drought stress conditions[J]. Journal of Plant Growth Regulation,2023,42(7):4453-4465.
[7]王骏,蒋荣兵. 全球三大植物油期货市场国际关联性研究[J]. 南京农业大学学报(社会科学版),2008,8(3):30-37.
[8]JABBARI H, AKBARI G A, SIMA N A K K, et al. Relationships between seedling establishment and soil moisture content for winter and spring rapeseed genotypes[J]. Industrial Crops & Products,2013,49:177-187.
[9]BIJAY S, ANJU P, SAMIKSHYA A. The impact of climate change on insect pest biology and ecology:implications for pest management strategies, crop production, and food security[J]. Journal of Agriculture and Food Research,2023,14:10733-10750.
[10]SHANMUGAM G. 200 Years of fossil fuels and climate change (1900-2100)[J]. Journal of the Geological Society of India,2023,99(8):1043-1062.
[11]武军艳,方彦,刘翠平,等. 旱寒区冬油菜苗期抗寒性与抗旱性相关性分析[J]. 干旱地区农业研究,2014,32(2):142-146.
[12]KUNST L, SAMUELS L. Plant cuticles shine: advances in wax biosynthesis and export[J]. Current Opinion in Plant Biology,2009,12(6):721-727.
[13]JETTER R, KUNST L. Plant surface lipid biosynthetic pathways and their utility for metabolic engineering of waxes and hydrocarbon biofuels[J]. The Plant Journal,2008,54(4):670-683.
[14]OHLROGGE J, BROWSE J. Lipid biosynthesis[J]. Plant Cell,1995,7(7):957-970.
[15]WETTSTEIN-KNOWLES P V. Biosynthesis of epicuticular lipids as analyzed with the aid of gene mutations in barley[M]. WINTERMANS J F G M, KUIPER P J C. Biochemistry and Metabolism of Plant Lipids. Amsterdam:Elsevier Biomedical Press,1982.
[16]KUNST L, SAMUELS A L. Biosynthesis and secretion of plant cuticular wax[J]. Progress in Lipid Research,2003,42(1):51-80.
[17]ZHENG H Q, ROWLAND O, KUNST L. Disruptions of the Arabidopsis Enoyl-CoA reductase gene reveal an essential role for very-long-chain fatty acid synthesis in cell expansion during plant morphogenesis[J]. The Plant Cell,2005,17(5):1467-1481.
[18]SAMUELS L, KUNST L, JETTER R. Sealing plant surfaces:cuticular wax formation by epidermal cells[J]. Annual Review of Plant Biology,2008,59(1):683-707.
[19]胡晓君,张正斌,刘文,等. 植物表皮蜡质及极长链脂肪酸类物质的研究进展[J]. 安徽农业科学,2013,41(12):5176-5185.
[20]MCNEVIN J P, WOODWARD W, HANNOUFA A, et al. Isolation and characterization of eceriferum (cer) mutants induced by T-DNA insertions in Arabidopsis thaliana[J]. Genome,1993,36(3):610-618.
[21]HANNOUFA A, MCNEVIN J, LEMIEUX B. Epicuticular waxes of eceriferum mutants of Arabidopsis thaliana[J]. Phytochemistry,1993,33(4):851-855.
[22]BERNARD A, JOUBS J M. Arabidopsis cuticular waxes: advances in synthesis, export and regulation[J]. Progress in Lipid Research,2013,52(1):110-129.
[23]BERNARD A, DOMERGUE F, PASCAL S, et al. Reconstitution of plant alkane biosynthesis in yeast demonstrates that Arabidopsis ECERIFERUM1 and ECERIFERUM3 are core components of a very-long-chain alkane synthesis complex[J]. Plant Cell,2012,24(7):3106-3118.
[24]LI F, WU X, LAM P, et al. Identification of the wax ester synthase/acyl-coenzyme A: diacylglycerol acyltransferase WSD1 required for stem wax ester biosynthesis in Arabidopsis[J]. Plant Physiology,2008,148(1):97-107.
[25]赵鸿,蔡迪花,王鹤龄,等. 干旱灾害对粮食安全的影响及其应对技术研究进展与展望[J]. 干旱气象,2023,41(2):187-206.
[26]李佳,刘涛,马菊莲,等. 烟草响应干旱胁迫与抗旱遗传育种研究进展[J]. 江苏农业科学,2023,51(8):34-43.
[27]吕婧妤,徐超,刘昱君,等. 基于模拟优化模型的干旱风沙草原区水-粮食-能源关系[J]. 排灌机械工程学报,2023,41(3):296-304.
[28]樊玉春,李玥,魏霖静,等. 三种胡麻生长模型对现蕾期和青果期干旱胁迫响应能力的比较[J]. 江苏农业学报,2023,39(2):423-433.
[29]徐存东,胡小萌,刘子金,等. 干旱区人工绿洲水土资源承载状态演变分析[J]. 排灌机械工程学报,2023,41(1):62-69.
[30]周旭旭,刘金洋,陈新,等. 绿豆Alfin1-like基因家族的鉴定与干旱胁迫下的表达分析[J]. 江苏农业学报,2022,38(5):1179-1187.
[31]周苗,景秀,蔡嘉鑫,等. 灌浆前期高温干旱复合胁迫对优质食味粳稻产量与穗后物质生产特征的影响[J]. 南方农业学报,2022,53(12):3357-3368.
[32]MUN J H, KWON S J, YANG T J, et al. Genome-wide comparative analysis of the Brassica rapa gene space reveals genome shrinkage and differential loss of duplicated genes after whole genome triplication[J]. Genome Biology,2009,10(10):R111.
[33]XU Z, PU X, GAO R, et al. Tandem gene duplications drive divergent evolution of caffeine and crocin biosynthetic pathways in plants[J]. BMC Biology,2020,18(1):63-77.
[34]KING A, NAM J W, HAN J, et al. Cuticular wax biosynthesis in petunia petals: cloning and characterization of an alcohol-acyltransferase that synthesizes wax-esters[J]. Planta,2007,226(2):381-394.
[35]周彬. 苹果蜡酯合酶MdWSDs基因家族的鉴定及表达特性研究[D]. 杨凌:西北农林科技大学,2018.
[36]TOMIYAMA T, KURIHARA K, OGAWA T, et al. Wax ester synthase/diacylglycerol acyltransferase isoenzymes play a pivotal role in wax ester biosynthesis in Euglena gracilis[J]. Scientific Reports,2017,7:13504.
[37]KALSCHEUER R, STEINBCHEL A. A novel bifunctional wax ester synthase/acyl-CoA:diacylglycerol acyltransferase mediates wax ester and triacylglycerol biosynthesis in Acinetobacter calcoaceticus ADP1[J]. Journal of Biological Chemistry,2003,278(10):8075-8082.
[38]MA H Y, ZHENG J, LI Y H, et al. A novel bifunctional wax ester synthase involved in early triacylglycerol accumulation in unicellular green microalga Haematococcus pluvialis under high light stress[J]. Frontiers in Bioengineering and Biotechnology,2022,9:794714.
[39]ZHANG A, XU J J, XU X, et al. Genome-wide identification and characterization of the KCS gene family in sorghum (Sorghum bicolor (L.) Moench)[J]. PeerJ,2022,10:e14156.(责任编辑:石春林)

