百香果SPL转录因子家族成员鉴定及其对低温胁迫的响应





摘要:SPL(SQUAMOSA启动子结合类蛋白质)是一类特异存在于植物中的转录因子,参与植物生长发育的多个过程。为明确百香果SPL转录因子家族成员特征及其对低温胁迫的响应,本研究利用生物信息学方法和百香果基因组数据,对百香果SPL家族基因的结构、染色体分布、共线性关系及其编码蛋白质理化性质、进化关系进行分析,并通过低温和常温处理明确了百香果幼苗叶片SPL家族基因的相对表达量差异。结果表明,从百香果基因组中鉴定出19个SPL家族成员,分布于7条染色体上,其中包含3对共线性基因对。系统进化分析结果显示该家族分为9个亚族。百香果PeSPL基因启动子区域存在大量激素响应元件和逆境胁迫响应元件。低温胁迫下,百香果PeSPL2、 PeSPL3、 PeSPL6、 PeSPL7、PeSPL8和PeSPL9 6个基因的相对表达量极显著上升,PeSPL13和PeSPL18 2个基因的相对表达量显著下降。本研究结果可为进一步揭示百香果SPL基因对低温胁迫的响应机制提供依据。
关键词:百香果;SPL基因家族;低温胁迫;表达分析
中图分类号:S667.9文献标识码:A文章编号:1000-4440(2024)07-1320-10Identification of SPL transcription factor gene family members and their response to cold stress in passion fruitREN Rui,ZHANG Han,JIANG Wenjie,PAN Jiayi,FANG Ting
(College of Horticulture, Fujian Agriculture and Forestry University/Institute of Horticultural Plant Genetics and Breeding, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
Abstract:SPL (SQUAMOSA promoter-binding protein-like) is a plant-specific transcription factor that participates in many processes of plant growth and development. In order to clarify the characteristics of SPL transcription factor family members and their response to low temperature stress in passion fruit, bioinformatics methods and genome data of passion fruit were used to analyze the structure, chromosome distribution, collinear relationship of SPL family genes in passion fruit, as well as the physicochemical properties and evolutionary relationship of SPL family genes encoded proteins. The relative expression differences of SPL family genes in the leaves of passion fruit seedlings were clarified by low temperature treatment and normal temperature treatment. The results showed that 19 SPL family members were identified from the genome of passion fruit, which were distributed on seven chromosomes, including three pairs of collinear gene pairs. SPL gene family of passion fruit was divided into nine branches according to results of phylogenetic tree. There were many cis-acting elements in the promoter region of PeSPL genes of passion fruit, which responsed to hormones and stress. Under low temperature stress, the relative expression levels of PeSPL2, PeSPL3, PeSPL6, PeSPL7, PeSPL8 and PeSPL9 were extremely significantly increased, and the relative expression levels of PeSPL13 and PeSPL18 were significantly decreased. The results of this study can provide a basis for further revealing the response mechanism of passion fruit SPL gene to low temperature stress.
Key words:passion fruit;SPL gene family;cold stress;expression analysis
SPL(SQUAMOSA启动子结合类蛋白质)又称为SBP-box蛋白 (SQUAMOSA promoter binding protein),是绿色植物特有的一类转录因子,在植物生长发育、激素响应、光信号转导等方面发挥重要作用[1-2]。1996年,Klein等[3]从金鱼草中发现并首先分离出SPL基因AmSBP1和AmSBP2,因其编码蛋白质可与花发育基因SQUAMOSA的启动子结合,因此被命名为SQUAMOSA启动子结合类蛋白质(SBP)[4]。
目前,拟南芥[5]、水稻[6]、马尾松[7]、番茄[8]、苹果[9]、草莓[10]和甜橙[11]等植物中SPL家族基因的成员已经得到鉴定,并分别鉴定出17个、19个、11个、15个、27个、14个、15个SPL成员。SPL基因在植物生长发育中起重要的调控作用[12-18]。AtSPL8通过影响赤霉素(GA)合成和花药发育来调节拟南芥生长发育过程[16]。AtSPL3基因的组成型表达会导致拟南芥植株的花期提前[5]。AtSPL2和AtSPL11基因能调控拟南芥的开花过程[19]。Stone等[18]研究发现,AtSPL14不仅能调控植物对伏马菌素B1的抗性,还能影响到拟南芥的株型结构。此外,SPL基因在植物响应非生物胁迫方面也发挥着重要作用。在拟南芥中过表达中国野生葡萄资源的VpSBP16基因可提高其耐盐和抗干旱能力[20];拟南芥中miR156-SPL9-DFR通路协同调控植物生长与非生物胁迫响应之间的关系[19];茶树中多个SBP基因的表达量在低温处理后呈现显著上调[21]。
百香果(Passiflora edulis Sims)是西番莲科西番莲属藤本植物,又被称作鸡蛋果和西番莲等,其果实香气浓郁且富含多酚类化合物、生物碱以及黄酮类化合物等多种对人体有益的活性成分,具有较高的食用价值和药用价值[22-24]。由于百香果原产于南美洲的热带地区,抗寒能力较差,低温冷害已成为世界各国百香果产业发展的重要限制因子[25-26]。因此,对百香果SPL基因家族成员进行鉴定及对其低温胁迫下的表达特征进行分析,可为百香果SPL基因的抗寒功能研究及耐低温百香果品种选育提供理论依据。
1材料和方法
1.1植物材料
2023年5月20日在福建农林大学园艺植物遗传育种实验室选取6株长势基本一致的3个月苗龄台农百香果幼苗作为试验材料,其中3株放入人工气候箱进行4 ℃低温胁迫处理8 h,另外3株置于25 ℃环境下培养,其他条件与低温处理组一致,8 h后取各植株中上部叶片,迅速置于液氮中冷冻,于-80 ℃冰箱保存,用于基因表达模式分析。
1.2百香果SPL基因家族成员的鉴定
拟南芥SPL蛋白序列下载自拟南芥基因组数据库TAIR(https ://www.arabidopsis.org/),百香果基因组序列下载自国家基因库生命大数据平台(CNGBdb)[24]。以模式植物拟南芥的SPL基因的编码蛋白序列为模板,利用Tbtools软件设定E值<1×10-5,在百香果的蛋白质数据库[24]中进行同源对比,得到百香果SPL基因家族候选序列,进一步利用NCBI-CCD和Pfam数据库对候选序列进行SBP-box结构域完整性的鉴定。
1.3百香果SPL家族基因编码蛋白质理化性质及亚细胞定位利用TBtools软件进行百香果SPL家族基因编码蛋白质的理化性质预测。利用在线网站WoLFPSORT(https://wolfpsort.hgc.jp)进行百香果SPL家族基因编码蛋白质的亚细胞定位。
1.4百香果SPL基因家族成员基因结构及蛋白质保守基序分析利用在线网站GSDS2.0(http://gsds.gao-lab.org/)分析百香果SPL家族基因的结构。利用MEME网站(https://meme-suite.org/meme/tools/meme)分析百香果SPL家族成员编码蛋白质的保守基序,并利用TBtools软件进行结果的可视化表达。
1.5百香果SPL家族系统进化树构建及分析
设置自展系数(Booststrap)为1 000次,利用MEGA7软件采用邻近法(Neighbor-joining method)进行百香果和拟南芥的SPL家族成员系统进化树构建。
1.6百香果SPL家族基因染色体定位及共线性分析
利用TBtools软件进行百香果SPL基因的染色体定位和基因共线性分析。
1.7百香果SPL家族基因启动子顺式作用元件分析
提取百香果SPL基因起始密码子前2 000 bp片段作为启动子序列,利用PlantCARE在线网站 (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺式作用元件预测分析,并利用TBtools软件进行数据可视化表达。
1.8百香果SPL家族基因低温胁迫响应分析
参照Redzol试剂盒[赛百盛(北京)基因技术有限公司]说明书提取台农百香果叶片的总RNA,并用1%琼脂糖凝胶电泳检测RNA的质量。使用Code AH341-01反转录试剂盒(北京全式金生物技术股份有限公司产品)将台农百香果RNA反转录为cDNA,于-80 ℃保存备用。以Pe60S基因[27]为内参基因,SYBR Green I Master Mix 为PCR扩增预混液[宝日医生物技术(北京)有限公司产品],利用LightCycler 96 实时定量PCR 系统(瑞士Hoffmann-La Roche 有限公司产品)检测常温和低温处理下百香果叶SPL基因的表达水平,所用引物序列见表1。使用2-△△Ct方法[28]计算SPL基因的相对表达量,利用SPSS软件中的Duncan’s新复极差法进行不同处理SPL基因相对表达量的差异显著性分析。
2结果与分析
2.1百香果SPL基因家族成员的鉴定
在百香果基因组中共筛选得到19个SPL家族基因,根据其在染色体上的排列顺序分别命名为PeSPL1~PeSPL19(表2)。百香果SPL家族基因编码蛋白质的氨基酸数量为141~1 078个,相对分子量和等电点分别为1.613×104~11.971×104和5.32~9.40,不稳定系数为41.03~66.19,脂溶指数和亲水性指数分别为40.14~89.89和-1.211~-0.046。除PeSPL10蛋白定位于细胞质,PeSPL12蛋白定位于叶绿体,其他百香果SPL家族蛋白均定位于细胞核。
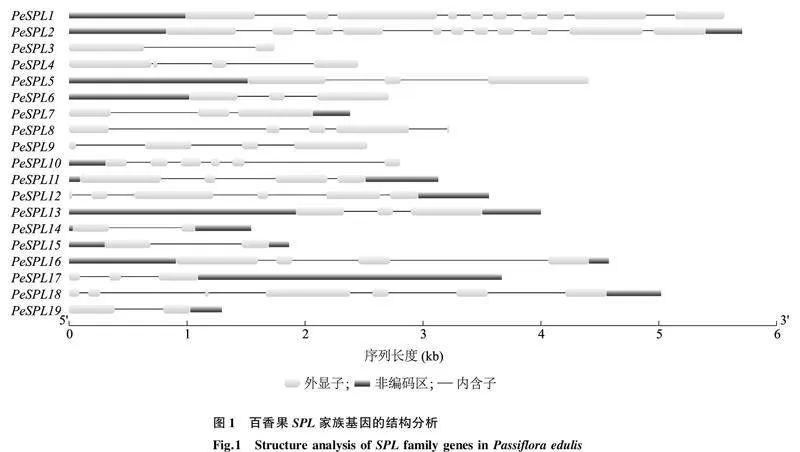
2.2百香果SPL家族基因结构和保守基序(Motif)分析PeSPL家族基因的结构如图1所示。从图中可以看出,PeSPL所有成员均含有内含子和外显子,但内含子和外显子数量存在较大的差异。PeSPL3、PeSPL14、PeSPL15、PeSPL19基因各有1个内含子,PeSPL5、PeSPL6、PeSPL7、PeSPL13、PeSPL17基因各有2个内含子,PeSPL4、PeSPL9、PeSPL11、PeSPL16基因各有3个内含子,PeSPL10、PeSPL12基因各有5个内含子,PeSPL8、PeSPL18、PeSPL1、PeSPL2基因分别有4个、6个、9个和10个内含子。PeSPL1和PeSPL2基因分别含有10个和11个外显子,PeSPL8、PeSPL10、PeSPL12和PeSPL18基因含有5~7个外显子,其他13个基因含有2~4个外显子。PeSPL基因编码蛋白质含有2~10个保守基序(Motif1~Motif10),其中PeSPL11和PeSPL12含有全部10个保守基序,而PeSPL17蛋白仅有2个保守基序(Motif1和Motif3),所有基因编码蛋白质均包含保守基序Motif1和Motif3(图2)。
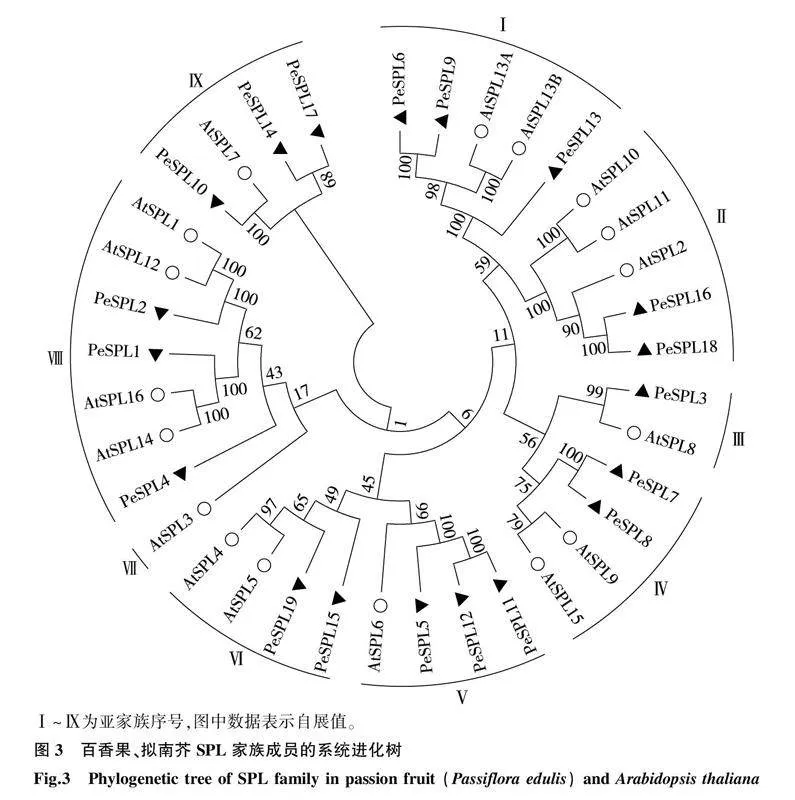
2.3百香果SPL家族成员系统进化树构建及分析
拟南芥和百香果SPL家族基因编码蛋白质的系统进化树如图3所示。从图中可以看出,整个进化树被分为9个亚族。除Ⅶ亚族之外,其余8个亚族都含有百香果SPL家族成员。其中,Ⅰ、Ⅴ、Ⅷ和Ⅸ亚族中均含有3个百香果SPL家族成员,数量最多;其次是Ⅱ、Ⅳ和Ⅵ亚族,均含有2个百香果SPL家族成员;Ⅲ亚族中仅含有1个百香果SPL家族成员。
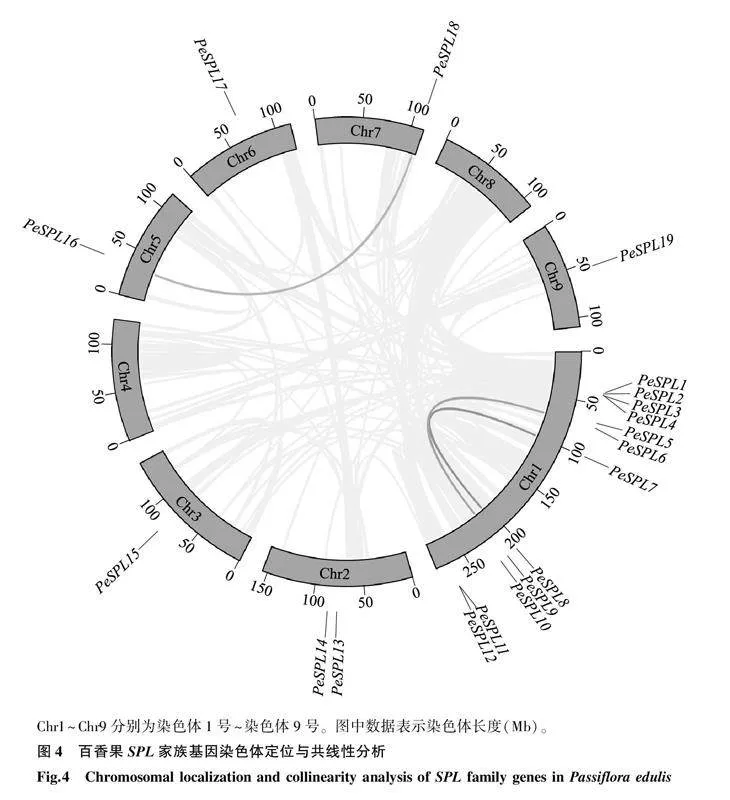
2.4百香果SPL家族基因的染色体定位与共线性分析百香果SPL家族基因的染色体定位和共线性关系如图4所示。19个PeSPL基因定位在百香果的7条染色体上。其中,1号染色体上分布得最多,有12个成员,2号染色体上有2个成员,3号、5号、6号、7号和9号染色体上各有1个成员。19个PeSPL基因间存在3对共线性基因对(PeSPL16与PeSPL18、PeSPL6与PeSPL9、PeSPL7与PeSPL8)。上述共线性关系说明百香果SPL基因家族在进化过程中发生了基因复制,从而导致百香果SPL家族基因的多样性。
2.5百香果SPL家族基因启动子顺式作用元件分析百香果SPL家族基因启动子顺式作用元件如图5所示。从图中可以看出,19个PeSPL基因启动子均具有光响应元件。大多数PeSPL基因启动子具有激素响应元件,如生长素响应元件、茉莉酸甲酯响应元件、脱落酸(ABA)响应元件等,PeSPL10基因启动子具有5个生长素响应元件和12个茉莉酸甲酯响应元件,PeSPL11基因启动子上含有7个脱落酸响应元件。百香果SPL基因的启动子中,还存在大量与逆境胁迫响应相关的元件,如低温响应元件、干旱诱导响应元件等。除PeSPL14基因外,其他PeSPL基因启动子均具有厌氧诱导元件,PeSPL4基因启动子中有4个低温响应元件,PeSPL8基因启动子中有3个干旱诱导响应元件。
2.6百香果SPL基因家族在低温胁迫条件下的表达分析低温胁迫下,百香果SPL家族基因的相对表达量如图6所示。从图中可以看出,8个PeSPL基因的相对表达量在低温处理后呈现显著或极显著变化,其中PeSPL2、 PeSPL3、 PeSPL6、 PeSPL7、 PeSPL8 和PeSPL9 6个基因的相对表达量极显著上升,PeSPL13 和PeSPL18 2个基因的相对表达量显著下降,说明这些基因可能参与了百香果响应低温的过程。*和**分别表示处理间差异显著(P<0.05)和差异极显著(P<0.01)。
3结论与讨论
SPL基因家族已经被证明在植物胚胎发育[29]、果实成熟[30]以及逆境胁迫响应[19-21]中发挥重要作用。本研究利用同源比对与结构域筛选相结合的方法从百香果基因组中鉴定出19个PeSPL家族基因。19个PeSPL的外显子数目为2~11个,差异较大,这与苹果[9]和甜橙[11]等作物中SPL家族成员外显子数目差异大的特征一致。本研究还发现部分同属于一个进化亚族的PeSPL基因的结构亦存在差异,例如PeSPL2和PeSPL4、PeSPL10和PeSPL14、PeSPL16和PeSPL18,原因可能是同一亚族内的不同基因在进化过程中出现了外显子的丢失或增加。此外,PeSPL蛋白的氨基酸长度差异也较大,这可能会导致该基因家族成员的功能多样性。
系统发育分析结果显示百香果和拟南芥SPL家族成员可以分为9个亚族,与甜橙一致[11]。部分百香果SPL成员与拟南芥SPL成员亲缘关系较近,例如PeSPL5、PeSPL11和PeSPL12与AtSPL6聚为1类。Padmanabhan等[31]的研究结果表明,拟南芥AtSPL7基因在植物抗病过程中发挥重要作用,推测与AtSPL7位于进化树同一亚族的PeSPL10也有类似功能。对百香果SPL家族成员的染色体定位发现,除4号和8号染色体外,其余7条染色体上均有PeSPL基因,其中1号染色体上最多,共有12个。进一步的共线性分析结果表明,PeSPL家族基因存在3对共线性基因,表明该家族在物种进化中存在基因复制现象。本研究结果可为深入理解百香果SPL家族基因的进化过程提供理论参考。
SPL基因家族在响应植物逆境胁迫过程中发挥重要功能。如水稻的OsSPL3基因通过正向调控OsWRKY71基因的表达进而响应低温胁迫[32],SPL9基因的过表达可提高CBF2基因的表达量进而增强拟南芥植株的抗寒性[33]。本研究发现,百香果SPL家族基因启动子上存在大量低温、干旱等逆境响应相关的顺式作用元件;实时定量PCR分析亦发现低温胁迫下有8个基因的相对表达量发生了显著或极显著变化,推测这些基因可能参与了百香果低温响应过程。本研究结果可为进一步解析百香果SPL基因的功能和作用机制、明确百香果SPL基因对低温胁迫的响应机制提供基础和依据。
参考文献:
[1]汪先菊,张绍宇,徐泽,等. 桃SPL基因家族成员鉴定及基因表达与果实发育的相关性分析[J]. 农业生物技术学报,2020,28(9):1521-1534.
[2]FENG X, WANG Y, ZHANG N, et al. Systematic identification,evolution and expression analysis of the SPL gene family in sugarcane (Saccharum spontaneum)[J]. Tropical Plant Biology,2021,14(3):313-328.
[3]KLEIN J, SAEDLER H, HUIJSER P. A new family of DNA binding proteins includes putative transcriptional regulators of the Antirrhinum majus floral meristem identity gene SQUAMOSA[J].Molecular and General Genetics,1996,250:7-16.
[4]BIRKENBIHL R P, JACH G, SAEDLER H, et al. Functional dissection of the plant-specific SBP-domain: overlap of the DNA-binding and nuclear localization domains[J]. Journal of Molecular Biology,2005,352(3):585-596.
[5]CARDON G H, HOHMANN S, NETTESHEIM K, et al. Functional analysis of the Arabidopsis thaliana SBP-box gene SPL3:a novel gene involved in the floral transition[J]. The Plant Journal,1997,12(2):367-377.
[6]XIE K B, WU C Q, XIONG L Z. Genomic organization, differential expression, and interaction of SQUAMOSA promoter-binding-like transcription factors and microRNA156 in rice[J]. Plant Physiology,2006,142(1):280-293.
[7]王春昱,范付华. 马尾松SPL基因家族鉴定及其响应低磷胁迫的表达分析[J]. 农业生物技术学报,2023,31(3):509-517.
[8]SALINAS M, XING S, HOHMANN S, et al. Genomic organization, phylogenetic comparison and differential expression of the SBP-box family of transcription factors in tomato[J]. Planta,2012,235(6):1171-1184.
[9]LI J, HOU H, LI X, et al. Genome-wide identification and analysis of the SBP-box family genes in apple (Malus×domestica Borkh.)[J]. Plant Physiol Biochem,2013,70:100-114.
[10]XIONG J S, ZHENG D, ZHU H Y, et al. Genome-wide identification and expression analysis of the SPL gene family in woodland strawberry Fragaria vesca[J]. Genome,2018,61(9):675-683.
[11]杨杰,陈蓉,胡文娟,等. 甜橙SPL基因家族的鉴定及其在成花诱导中的表达分析[J]. 西北植物学报,2022,42(1):48-56.
[12]YU N, CAI W J, WANG S, et al. Temporal control of trichome distribution by microRNA156-targeted SPL genes in Arabidopsis thaliana[J]. Plant Cell,2010,22(7):2322-2335.
[13]WU G, POETHIG R S. Temporal regulation of shoot development in Arabidopsis thaliana by miR156 and its target SPL3[J]. Development,2006,133(18):3539-3547.
[14]WANG H, NUSSBAUM-WAGLER T, LI B, et al. The origin of the naked grains of maize[J]. Nature,2005,436(7051):714-719.
[15]ZHANG Y, SCHWARZ S, SAEDLER H, et al. SPL8, a local regulator in a subset of gibberellin-mediated developmental processes in Arabidopsis[J]. Plant Mol Biol,2007,63(3):429-439.
[16]UNTE U S, SORENSEN A M, PESARESI P, et al. SPL8, an SBP-box gene that affects pollen sac development in Arabidopsis[J]. Plant Cell,2003,15(4):1009-1019.
[17]ERIKSSON M,MOSELEY JL,TOTTEY S, et al. Genetic dissection of nutritional copper signaling in chlamydomonas distinguishes regulatory and target genes[J]. Genetics,2004,168(2):795-807.
[18]STONE J M, LIANG X, NEKL E R,et al. Arabidopsis AtSPL14, a plant-specific SBP-domain transcription factor, participates in plant development and sensitivity to fumonisin B1[J]. The Plant Journal,2005,41(5):744-754.
[19]CUI L, SHAN J, SHI M, et al. The miR156-SPL9-DFR pathway coordinates the relationship between development and abiotic stress tolerance in plants[J]. Plant Journal,2014,80(6):1108-1117.
[20]HOU H, JIA H, YAN Q, et al. Overexpression of a SBP-Box gene (VpSBP16) from Chinese wild vitis species in Arabidopsis improves salinity and drought stress tolerance[J]. International Journal of Molecular Sciences,2018,19(4):940.
[21]ZHANG D, HAN Z, LI J, et al. Genome-wide analysis of the SBP-box gene family transcription factors and their responses to abiotic stresses in tea (Camellia sinensis)[J]. Genomics,2020,112(3):2194-2202.
[22]陈媚,刘迪发,徐丽,等. 西番莲研究进展[J]. 中国南方果树,2020,49(6):182-189.
[23]徐青,安松,李玉娇,等. 不同产地紫果百香果主要功能成分含量及抗氧化活性研究[J]. 中国果树,2023(5):76-83.
[24]MA D, DONG S, ZHANG S, et al. Chromosome-level reference genome assembly provides insights into aroma biosynthesis in passion fruit (Passiflora edulis)[J]. Molecular Ecology Resources,2021,21(3):955-968.
[25]韦晓霞,王小安,陈瑾,等. 百香果低温胁迫转录组及茉莉酸代谢基因分析[J]. 核农学报,2021,35(4):815-825.
[26]LIANG J, FANG Y, AN C, et al. Genome-wide identification and expression analysis of the bHLH gene family in passion fruit (Passiflora edulis) and its response to abiotic stress[J]. International Journal of Biological Macromolecules,2022,225:389-403.
[27]MUNHOZ C F, SANTOS A A, ARENHART R A, et al. Analysis of plant gene expression during passion fruit-Xanthomonas axonopodis interaction implicates lipoxygenase 2 in host defence[J]. Annals of Applied Biology,2015,167(1):135-155.
[28]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods,2001,25:402-408.
[29]NODINE M D, BARTEL D P. MicroRNAs prevent precocious gene expression and enable pattern formation during plant embryogenesis[J]. Genes & Development,2010,24(23):2678-2692.
[30]MANNING K, TR M, POOLE M, et al. A naturally occurring epigenetic mutation in a gene encoding an SBP-box transcription factor inhibits tomato fruit ripening[J].Nature Genetics,2006,38(8):948-952.
[31]PADMANABHAN M S, MA S, BURCH-SMITH T M, et al. Novel positive regulatory role for the SPL6 transcription factor in the N TIR-NB-LRR receptor-mediated plant innate immunity[J]. PLoS Pathogens,2013,9(3):e1003235.
[32]ZHOU M Q, TANG W. MicroRNA156 amplifies transcription factor-associated cold stress tolerance in plant cells[J]. Molecular Genetics and Genomics,2019,294(2):379-393.
[33]ZHAO J L, SHI M, YU J, et al. SPL9 mediates freezing tolerance by directly regulating the expression of CBF2 in Arabidopsis thaliana[J]. BMC Plant Biology,2022,22:59.
(责任编辑:石春林)

