温度对大蒜花形态建成和花粉活力的影响
摘要:为探究温度对大蒜不育机制的影响,本研究以2个薹蒜品种成县汉中蒜及荷兰大蒜NL-3为试验材料,利用压片法和亚历山大染色法,比较常温(平均温度23 ℃)和低温(平均温度17 ℃)下2个大蒜品种花芽分化过程、花粉母细胞减数分裂过程中染色体变异和花粉活力的差异。结果表明,低温处理下,2个大蒜品种的花芽分化进程比常温处理延长9~10 d。不同温度下,2个大蒜品种花粉母细胞减数分裂过程中染色体行为异常比例和成熟花粉活力存在较大差异;低温下,NL-3花粉母细胞减数分裂过程中染色体行为正常的比例和成熟花粉的活力分别由常温下的5.47%和4.01%提升为29.65%和26.17%,差异显著;而低温处理不能显著提升成县汉中蒜花粉母细胞减数分裂过程中染色体行为正常的比例和成熟花粉的活力。总之,不同大蒜品种雄配子体对温度的响应具有显著差异,荷兰大蒜NL-3雄配子体对温度更为敏感,是育性保持和恢复的潜力品种。
关键词:大蒜;温度;花芽分化;减数分裂;雄配子体
中图分类号:Q942.4;S633.4文献标识码:A文章编号:1000-4440(2024)07-1297-08Effect of temperature on flower morphogenesis and pollen viability of garlicGE Jie,YANG Feng,LU Xinjuan,ZHAO Yongqiang,LIU Canyu,ZHANG Biwei,YANG Qingqing,FAN Jide
(Xuzhou Institute of Agricultural Sciences in Xuhuai District of Jiangsu Province,Xuzhou 221121, China)
Abstract:In order to explore the effect of temperature on the mechanism of garlic sterility, two garlic cultivars, Chengxianhanzhong garlic and Dutch garlic NL-3, were used as experimental materials in this study. Differences of chromosome variation and pollen viability in the processes of flower bud differentiation and pollen mother cell meiosis of two garlic cultivars under room temperature (average temperature of 23 ℃) and low temperature (average temperature of 17 ℃) were compared by squash technique and Alexander staining method. The results showed that the flower bud differentiation process of the two garlic varieties under low temperature treatment was 9-10 days longer than that under room temperature treatment. At different temperatures, there were significant differences in the proportion of abnormal chromosome behavior and mature pollen viability during the meiosis of pollen mother cells in the two varieties. At low temperature, the proportion of normal chromosome behavior and the activity of mature pollen during meiosis of NL-3 pollen mother cells increased from 5.47% and 4.01% at room temperature to 29.65% and 26.17% respectively, with significant differences. However, low temperature treatment could not significantly increase the proportion of normal chromosome behavior and the activity of mature pollen during meiosis of pollen mother cells in Chengxianhanzhong garlic. In conclusion, the response of male gametophytes of different garlic varieties to temperature is significantly different. The male gametophyte of Dutch garlic NL-3 is more sensitive to temperature and is a potential variety for fertility maintenance and recovery.
Key words:Allium sativum Linn.;temperature;flower bud differentiation;meiosis;male gametophyte
大蒜(Allium sativum Linn.)隶属于百合科(Liliaceae)葱属(Allium Linn.),为2年生草本植物。中国大蒜年种植面积约8.0×105 hm2,产量约2.2×107 t。生产中,大蒜品种通常利用鳞茎进行无性繁殖,这一现状导致大蒜新品种选育常局限于组织培养、体细胞无性繁殖、鳞茎诱导等措施。由于常规的大蒜栽培品种难以使用有性杂交手段,导致优质大蒜种质资源含有的优质基因得不到充分利用,种质创新缓慢。因此,恢复大蒜的育性是选育优良性状大蒜的重要途径。
花形态建成是植物由营养生长转变为生殖生长的重要标志。影响植物花芽分化的因素有2个,一是植物营养物质的积累、花形态建成相关基因的转录、表达等内部因素,二是刺激诱导植物内部因素变化的生态因子等外部因素。大蒜和洋葱等2年生鳞茎植物中,温度是控制植物从营养生长向生殖生长转变的主要环境因素,也是重要的成花诱导因素之一[1-2]。在开花和配子体发生的后期,大多数鳞茎植物适应较温暖的生长环境,但温度过高同样会影响作物的发育,如抑制开花、花粉质量下降、结实率降低等[3-4]。接近于大蒜原产地(中亚和地中海地区)的自然环境有利于大蒜花药育性的保持[5-6]。探究温度对大蒜生长发育和开花的影响,有助于揭示大蒜不育机理,为大蒜花粉育性保持提供有利的环境条件,使大蒜育性恢复成为可能[7]。
鉴于目前温度对大蒜花芽分化、花粉母细胞减数分裂等过程和花粉活力的影响、环境改变诱导花粉育性恢复的遗传机制、不同品种花粉育性对温度的响应差异缺乏研究的现状,本研究以成县汉中蒜和荷兰大蒜NL-3 2个薹蒜品种为试验材料,分析常温和低温处理下花芽分化、花粉母细胞减数分裂过程中染色体行为和花粉粒育性的差异,旨在明确温度对大蒜花形态建成和配子体发育的影响,为低温诱导大蒜花粉活性、实现有性繁殖提供依据。
1材料与方法
1.1材料及其处理
试验于江苏徐淮地区徐州农业科学研究所农业示范基地进行。供试材料为抽薹性好的薹蒜品种成县汉中蒜和荷兰大蒜NL-3。种植前利用蛭石和珍珠岩按质量比6∶4配制营养土,装入高20 cm、直径15 cm的塑料盆,营养土装载高度为盆高的4/5,共80盆。考虑到鳞茎的低温春化对大蒜抽薹、开花等生殖发育过程具有促进作用[8-9],2021年8月将供试大蒜鳞茎贮藏于4 ℃冷库,2021年10月5日种植。每盆栽 3 株大蒜,整个发育期浇灌Hoagland营养液培养。
2022年3月中旬,当2个品种大蒜花原基分化时,将植株移入人工气候室进行温度处理。参照徐州同期环境温度,设置常温处理26 ℃/21 ℃(白天/夜间)和低温处理20 ℃/15 ℃(白天/夜间),平均温度分别为23 ℃和17 ℃;每天光照10 h,光照度20 000 lx;相对湿度为70%。每个处理20盆,60株,处理时间75 d。
1.2花芽形态解剖结构观察
3月中旬,2个大蒜品种进入花原基分化期,此后每5 d取样1次,直至叶片不再抽生、蒜薹总苞叶尖露出叶鞘为止。每处理每次取3株。解剖后,利用S6D体视显微镜(德国Leica Microsystems公司产品)观察植株生长点分化状态。
1.3花序形态及花发育特征观察
大蒜植株进入抽薹期后,每5 d采集4个处理各3支蒜薹,剥去总苞后取花序轴,利用S6D体视显微镜(德国Leica Microsystems公司产品)观察花序形态及花发育特征。
1.4花粉母细胞减数分裂过程观察及染色体结构分析抽薹期取花瓣为绿色的大蒜花蕾(直径1.5~3.0 mm)置于卡诺固定液(无水乙醇和冰醋酸按3∶1的体积比混合)中固定,在体视显微镜下解剖出花药,在37 ℃酶解液(含1.4% β-葡聚糖醛酸苷酶、0.3%纤维素酶、0.3%果胶酶)中酶解3 h后,用60%冰醋酸对花粉母细胞进行透明化处理,拇指压片,经DAPI(4,6-二氨基-2-苯基吲哚二盐酸盐)染色后在DM4000B 荧光显微镜(德国Leica Microsystems公司产品)下进行花粉母细胞减数分裂过程观察,并统计染色体结构异常细胞比例。
1.5成熟花粉粒活性检测
植物配子体育性直接关系到果实和种子的形成。花粉成熟期(5月下旬),用镊子将不同处理大蒜花粉粒从花药中挤出,置于载玻片上,利用Alexander染色法[10]进行花粉活力评估。统计被染成紫红色的可育花粉粒数量和无色的、皱缩的不育花粉粒数量。每处理3次重复,每张玻片统计10个视野,每个视野花粉粒约10~15粒。
2结果与分析
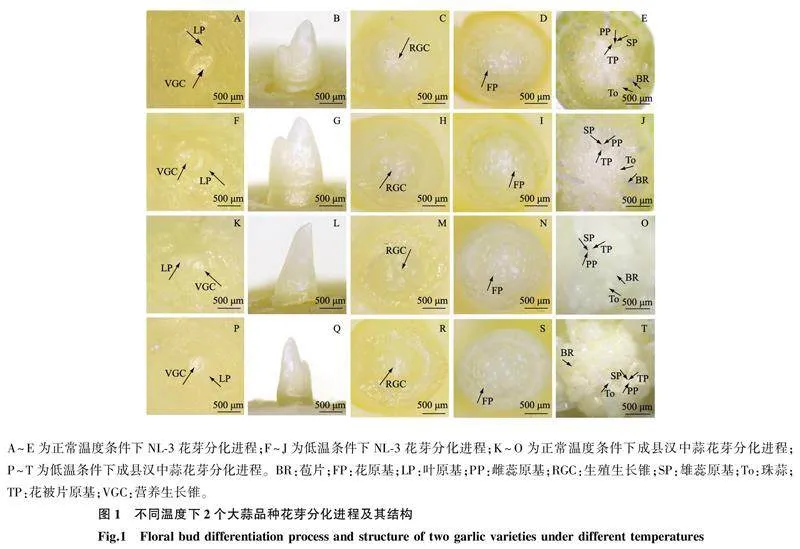
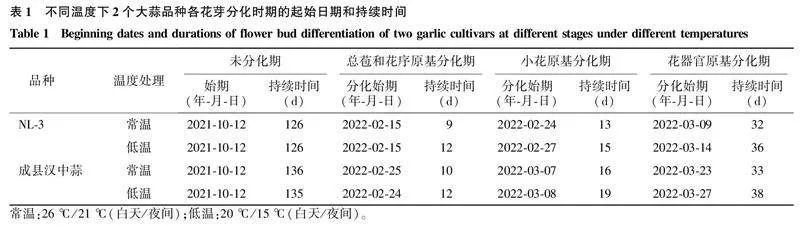
2.1不同温度处理对大蒜花芽分化及花发育过程的影响大蒜花芽分化是植株从营养生长到生殖生长的重要转变,其过程可分为总苞和花序原基分化期、小花原基分化期以及花器官原基分化期[11]。花芽分化前营养生长锥具有典型的原套-原体结构,生长锥顶部呈半球形,叶原基分化出互生幼叶,被外部老叶所包裹(图1A、图1F、图1K、图1P)。营养生长结束后,叶原基停止分化,大蒜总苞迅速发育,包裹顶端分生组织(图1B、图1G、图1L、图1Q)。蒜薹伸长后形成表面有突起的生殖生长锥(图1C、图1H、图1M、图1R),进而发育为花序原基。花序原基进一步分化出球形的小花原基(图1D、图1I、图1N、图1S),同时还伴随着气生鳞茎与苞片的分化。花器官原基分化期,小花原基外轮分化出花被片原基,内部分化出雄蕊原基和雌蕊原基(图1E、图1J、图1O、图1T),最终发育为完整小花。荷兰大蒜NL-3和成县汉中蒜花芽分化过程中形态特征在不同温度处理下无明显差异,即外界温度的改变对花芽形态无显著影响。但不同温度处理下,2个大蒜品种进入花芽分化各期的初始时间及持续时间有所不同。
不同温度下2个大蒜品种花芽分化各时期的起始日期和持续时间如表1所示。与常温条件相比,低温条件下,2个大蒜品种(NL-3和成县汉中蒜)的花芽分化进程的各个时期均有延后。对比正常温度条件,NL-3和成县汉中蒜的总苞和花序原基分化期分别延长3 d和2 d,小花原基分化期持续时间分别延长2 d和3 d,花器官原基分化期持续时间分别延长4 d和5 d。NL-3和成县汉中蒜在低温条件下分别延后9 d和10 d结束花芽分化进程。
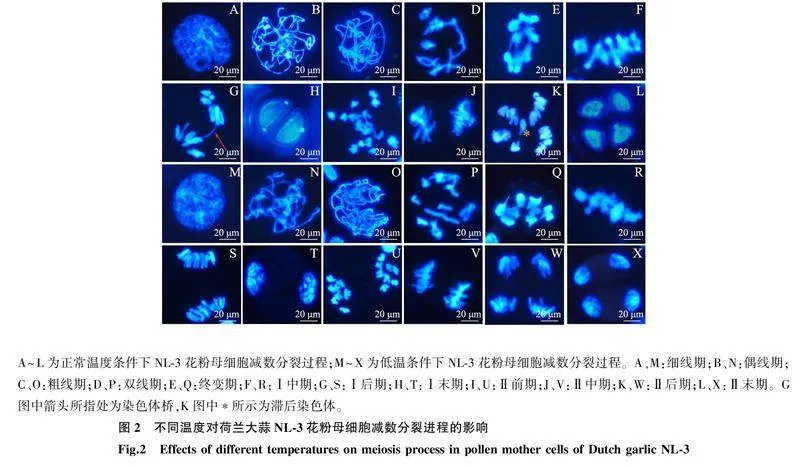
2.2不同温度处理对2个品种大蒜花粉母细胞减数分裂进程的影响2.2.1荷兰大蒜NL-3在不同温度处理下的减数分裂过程花粉母细胞中的减数分裂是保证植物生育力的基本过程[12-13]。减数分裂包括1轮DNA复制和2轮染色体分离,在减数分裂Ⅰ期同源染色体分离,在减数分裂Ⅱ期姐妹染色单体分离。在减数分裂期间,染色体的异常行为,包括滞后染色体、染色体桥、微核变异等,常导致细胞分裂时染色体分配不均,细胞内部分遗传信息丢失,从而造成雌配子体和雄配子体败育[14]。
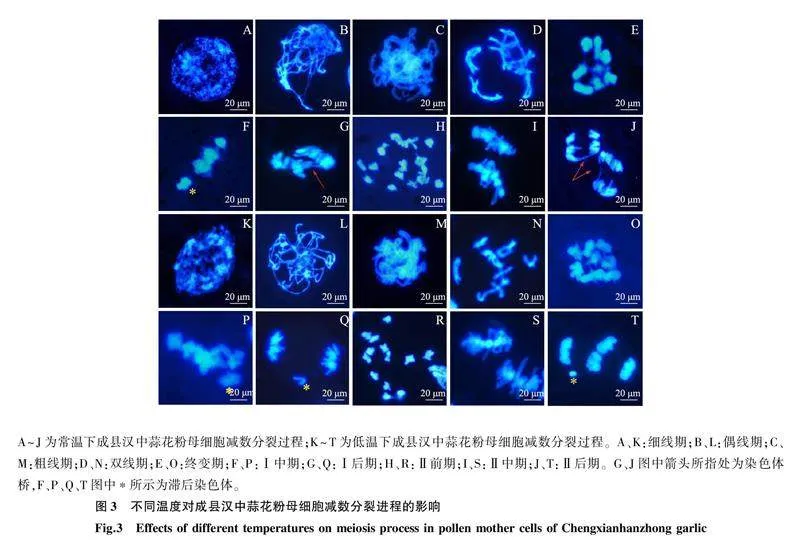
常温条件下生长的NL-3减数分裂期间染色体出现多种变异(图2A~图2L)。细线期、偶线期和粗线期染色体行为是否正常难以判断。双线期细胞中染色体呈现出1个十价体链和3个二价体(图2D),这个时期几乎所有花粉母细胞的染色体都不能正常联会和缩聚,常出现环状或链状的八价体和十价体构型。Ⅰ后期出现染色体桥(图2G),导致遗传物质在细胞分离时丢失。滞后染色体和染色体断片导致Ⅰ末期出现微核结构(图2H)。Ⅱ前期重新螺旋缩短的染色体没有移向两极,而是排列在细胞中央(图2I),Ⅱ后期出现滞后染色体(图2K),导致Ⅱ末期出现微核结构(图2L)。NL-3减数分裂期染色体高比例的结构变异常导致配子体败育。低温条件下,NL-3部分花粉母细胞在减数分裂过程中染色体行为回归正常。在双线期形成8个二价体(图2P),Ⅰ中期染色体浓缩排列在赤道板上(图2R),Ⅰ后期染色体均匀地分向两极(图2S),到达Ⅰ末期核膜组成2个细胞包裹住两极的染色体(图2T)。Ⅱ前期染色体重新螺旋缩聚(图 2U),进入Ⅱ中期2组染色体分别排列在赤道板上(图2V),随后在Ⅱ后期,姐妹染色单体分离形成4个新染色体簇(图2W)。在Ⅱ末期生成4个单倍体细胞(图 2X),经发育形成4个单核小孢子。
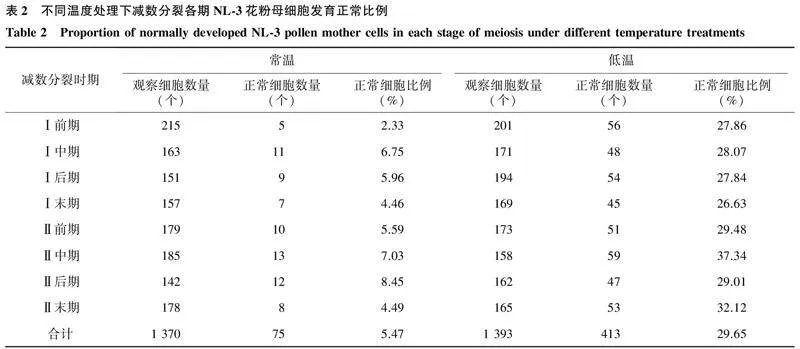
不同温度处理下,减数分裂各期NL-3花粉母细胞异常发育比例如表2所示。从表中可以看出,常温下,NL-3花粉母细胞发育异常比例高达94.53%,正常发育细胞比例仅为5.47%,而低温处理下,NL-3花粉母细胞发育异常比例为70.35%,正常发育细胞比例提高至29.65%。上述结果说明配子体发育期间较低的环境温度有利于NL-3花粉母细胞育性的保持。
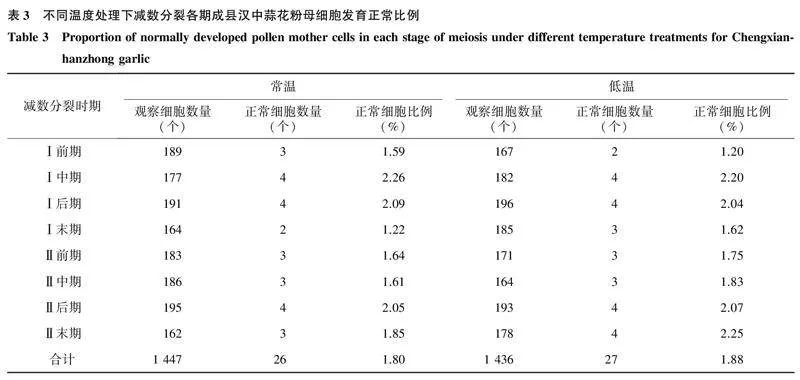
2.2.2不同温度处理下成县汉中蒜的减数分裂过程常温处理下,成县汉中蒜花粉母细胞减数分裂期染色体同样会出现多价体环状结构、染色体桥、滞后染色体等变异,花粉母细胞发育正常的比例仅1.80%(表3、图3A~图3J)。低温条件下,花粉母细胞依旧存在很高比例的染色体变异,在双线期观察到八价体链结构(图3N),Ⅰ后期和Ⅱ后期有滞后染色体出现(图3Q、图3T),Ⅱ前期染色体缩聚但不能均匀地向两极分配(图3R),这些异常行为造成单核小孢子遗传信息的缺失,导致配子体败育,花粉母细胞发育正常的比例较常温条件略有提高(1.88%)(表3)。上述结果说明低温处理不能显著影响成县汉中蒜花粉母细胞减数分裂过程,染色体变异程度和细胞异常比例无明显改善。
2.3成熟花粉粒活性
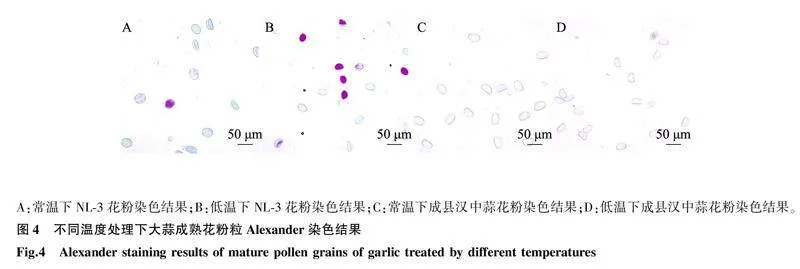
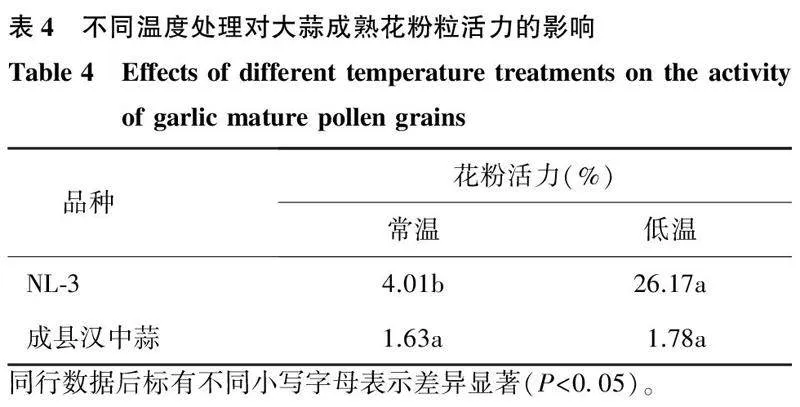
不同温度处理下,成县汉中蒜和NL-3成熟花粉粒经Alexander染色法染色后的结果如图4所示。从图中可以看出,NL-3低温处理下被染成紫红色的成熟花粉粒明显多于其他处理。常温处理下NL-3花粉活力仅为4.01%,低温诱导后,花粉活力提升为26.17%,差异显著。而成县汉中蒜在常温和低温处理下的花粉活力分别为1.63%和1.78%,差异不大(表4)。由此可见,成县汉中蒜雄性不育的遗传特征无法通过低温诱导进行恢复,而低温处理可以显著提升NL-3花粉的育性。
3讨论与结论
大蒜具有较高的营养价值和药用价值,在中国蔬菜贸易中占主导地位[15]。目前常用的大蒜繁殖方式均为无性繁殖,育种技术与手段缺乏。长期使用营养体无性繁殖不仅难以实现种质资源的创新,还导致品种退化和抗病能力的减弱,从而降低大蒜的品质和产量,制约大蒜产业的发展。大蒜花粉育性的保持有利于通过杂交育种的手段实现种质资源的改良,为大蒜良种繁育创造新途径。本研究结果表明,低温(平均温度17 ℃)条件能延长大蒜花芽分化历期,对荷兰大蒜 NL-3雄配子体育性保持具有显著作用。
植物开花过程受多种因素调控,如光周期、温度(春化)、品种基因型、激素调节等[16-17]。光周期、温度等是通过改变外界环境条件来调控生殖器官的发育,品种类型主要受内在基因的表达调控[18]。在葱属作物和许多鳞茎植物中,花的发育主要取决于环境条件[19-22]。大蒜在温度高、日照短的热带地区产量较低,而在温度低、日照长的温带地区产量较高,说明低温和长日照有利于大蒜小花分化与发育[23]。大蒜营养生长期的低温环境有利于叶片发育和花芽分化,当春季温度上升到15~20 ℃时,花芽分化开始[8]。花朵发育的最适温度为16~18 ℃[24]。而高温环境下,大蒜植株碳同化能力减弱、呼吸作用增强会导致花物质积累量减少和开花进程的推迟[3]。此外,高温还影响配子体发育和受精过程,导致花粉不育、结实率下降、果实变小和产量降低[25]。本研究结果表明,较低的温度会推迟不同基因型大蒜的花芽分化时间、延长分化历期,即温度会影响花芽分化的速率和进程及花序的生长发育[26-27]。
类似于其他葱属植物[19-20,28],不同基因型大蒜的花发育过程对环境条件的响应具有一定的差异。常温(平均温度23 ℃)下生长的荷兰大蒜NL-3减数分裂期染色体会出现多价体、染色体桥、滞后染色体、微核等结构变异,异常比例高达94.53%,花粉活力仅为4.01%。低温(平均温度17 ℃)下,29.65%的荷兰大蒜NL-3花粉母细胞减数分裂过程中染色体行为回归正常,花粉育性得到保持,花粉活力提高至26.17%,与常温处理相比差异显著。而低温处理对成县汉中蒜花粉母细胞染色体变异比例和花粉活力没有显著影响。因此,低温对大蒜配子体发育有特异性影响,大蒜花发育既受外界环境的影响,又受内部基因的调控[5]。荷兰大蒜NL-3是育性保持和恢复的理想品种。
植物在配子体发育时期最易受到环境变化的影响。相较于雌配子,雄配子体大多暴露在自然环境中,因而其对环境条件的变化更为敏感[29]。本研究结果表明,温度条件对雄配子体的发育具有较大的影响,但雌配子体的发育对种子的育性同样重要。由于大蒜胚囊包裹在珠被组织里,雌配子体发育对外界环境的敏感度低于雄配子体[30]。因此,进一步加强大蒜胚珠内功能大孢子的产生和雌配子体的形成机制研究有助于大蒜杂交育种。
参考文献:
[1]NARD M L, HERTOGH A A D. Bulb growth and development and flowering[M]//HERTOGH A A D, NARD M L. The physiology of flowering bulbs. Amsterdam:Elsevier,1993.
[2]KHODOROVA N V, BOITEL-CONTI M. The role of temperature in the growth and flowering of geophytes[J]. Plants,2013,2(4):699-711.
[3]ERWIN J. Factors affecting flowering in ornamental plants[M]//ANDERSON N O. Flower breeding and genetics-issues, challenges and opportunities for the 21st century. Berlin:Springer Netherlands,2006.
[4]PRASAD P V V, DJANAGUIRAMAN M. Response of floret fertility and individual grain weight of wheat to high temperature stress: sensitive stages and thresholds for temperature and duration[J]. Functional Plant Biology,2014,41(12):1261-1269.
[5]SHEMESH-MAYER E, BEN-MICHAEL T, KIMHI S, et al. Effects of different temperature regimes on flower development, microsporogenesis and fertility in bolting garlic (Allium sativum)[J]. Functional Plant Biology,2015,42(6):514-526.
[6]HANELT P. Taxonomy, evolution, and history[M]//RABINOWITCH H D, BREWSTER J L. Onions and allied crops, volume I: Botany, Physiology and Genetics. Boca Raton:CRC Press,1990.
[7]MATHEW D, FORER Y, RABINOWITCH H D, et al. Effect of long photoperiod on the reproductive and bulbing processes in garlic (Allium sativum L.) genotypes[J]. Environmental & Experimental Botany,2011,71(2):166-173.
[8]KAMENETSKY R, SHAFIR I L, ZEMAH H, et al. Environmental control of garlic growth and florogenesis[J]. Journal of the American Society for Horticultural Science,2004,129(2):144-151.
[9]BEN-MICHAEL T, SHEMESH-MAYER E, KIMHI S, et al. Temporal and spatial effect of low pre-planting temperatures on plant architecture and flowering in bolting garlic[J]. Scientia Horticulturae,2018,242(2018):69-75.
[10]ALEXANDER M P. A versatile stain for pollen fungi, yeast and bacteria[J]. Stain Technology,1980,55(1):13-18.
[11]吴泽秀,蒋芳玲,刘敏,等. 大蒜花芽分化进程及其解剖结构和形态特征变化[J]. 植物资源与环境学报,2019,28(1):25-33.
[12]MA H. Molecular genetic analyses of microsporogenesis and microgametogenesis in flowering plants[J]. Annual Review of Plant Biology,2005,56(1):393-434.
[13]GRANDONT L, JENCZEWSKI E, LLOYD A. Meiosis and its deviations in polyploid plants[J]. Cytogenetic & Genome Research,2013,140(2/3/4):171-184.
[14]奚晓军,査倩,蒋爱丽,等. 三倍体葡萄‘夏黑’的花粉母细胞减数分裂行为观察及其育性研究[J].西北植物学报,2015,35(12):2422-2427.
[15]王德娟,禹香兰,公静. 我国大蒜出口贸易现状及发展趋势[J]. 安徽农业科学,2006,34(22):6030,6067.
[16]徐鹏,贺一哲,尤翠翠,等. 高温胁迫导致水稻颖花败育的机理及其防御措施研究进展[J]. 江苏农业学报,2023,39(1):255-265.
[17]韩东伟,何建宁,李浩然,等. 灌水时期对冬小麦个体、群体结构和冠层光合作用的影响[J]. 江苏农业学报,2022,38(3):577-586.
[18]娄虎. 大蒜花器官发育相关MADS-box基因的功能分析[D].哈尔滨:东北林业大学,2019.
[19]RABINOWITCH H D. Physiology of flowering[M]//RABINOWITCH H D, BREWSTER J L. Onions and allied crops, volume I:Botany, Physiology and Genetics. Boca Raton:CRC Press,1990.
[20]KAMENETSKY R, RABINOWITCH H D. Florogenesis[M]//RABINOWITCH H D, CURRAH L. Allium crop sciences: recent advances. Wallingford:CABI,2002.
[21]KHOKHAR K M, HADLEY P, PEARSON S. Effect of photoperiod and temperature on inflorescence appearance and subsequent development towards flowering in onion raised from sets[J]. Scientia Horticulturae,2007,112(1):9-15.
[22]BENSCHOP M, KAMENETSKY R, LE NARD M, et al. The global flower bulb industry: production, utilization, research[M]// JANICK J. Horticultural reviews. New York:John Wiley & Sons Inc,2010.
[23]BREWSTER J L. Onions and other vegetable alliums[M]//FORDHAM R. Scientia horticulturae. Amsterdam: International Society for Horticultural Science,2008.
[24]DE HERTOGH A. Principles for forcing tulips, hyacinths, daffodils, Easter lilies and Dutch irises[J]. Scientia Horticulturae,1974,2(4):313-355.
[25]KAMENETSKY R, ZACCAI M, FLAISHMAN M. Florogenesis[M]//KAMENETSKY R, OKUBO H. Ornamental geophytes-from basic science to sustainable production. Boca Raton:CRC Press,2012.
[26]张宁,敖妍,苏淑钗,等. 文冠果花性别分化过程中形态与解剖结构特征和气象因子分析[J]. 西北植物学报,2018,38(10):1846-1857.
[27]郗荣庭. 果树栽培学总论[M]. 北京:中国农业出版社,2000.
[28]RABINOWITCH H D. Onions and other edible Alliums[M]//HALEVY A H. Handbook of Flowering. Boca Raton:CRC Press,1985.
[29]HEDHLY A. Sensitivity of flowering plant gametophytes to temperature fluctuations[J]. Environmental and Experimental Botany,2011,74(12):9-16.
[30]WINIARCZYK K, KOSMALA A. Development of the female gametophyte in the sterile ecotype of the bolting Allium sativum L.[J]. Scientia Horticulturae,2009,121(3):353-360.
(责任编辑:石春林)

