水芹SSR分子标记开发与遗传多样性分析




摘要:水芹是伞形科水芹属多年生草本植物,是一种重要的药食两用蔬菜作物。在中国,水芹的种植区域十分广泛,然而目前对其种质资源的鉴定、培育及遗传信息的研究较少。本研究利用溧阳白芹基因组开发水芹简单重复序列(SSR)分子标记,分析55份水芹的遗传多样性并用非加权组平均法(UPGMA)构建系统进化树,同时用SSR扩增条带数据构建DNA指纹图谱。结果显示,共鉴定到325 699个SSR位点,其中单核苷酸SSR重复单元、二核苷酸SSR重复单元、三核苷酸SSR重复单元、四核苷酸SSR重复单元、五核苷酸SSR重复单元、六核苷酸SSR重复单元的出现频率分别为33.94%、54.62%、9.31%、1.66%、0.17%、0.29%,其中二核苷酸SSR重复单元数最多,有177 887个,且A/T(占比为29.98%)和AT/AT(占比为35.70%)是较丰富的重复类型。UPGMA分析结果表明,33对高多态性引物[多态信息含量(PIC)>0.25]可将55份水芹材料分为4组。利用筛选出的4对引物(Oj-084、Oj-110、Oj-112、Oj-156)可以将55份水芹材料完全区分开,并且可构建指纹图谱。研究结果可为水芹种质资源鉴定、保护及分子遗传育种提供有力依据。
关键词:水芹;简单重复序列(SSR)分子标记;聚类分析;遗传多样性
中图分类号:S645.901文献标识码:A文章编号:1000-4440(2024)07-1285-12Development of SSR molecular markers and genetic diversity analysis of Oenanthe javanicaXING Xiaolin1,CHEN Dan1,KUANG Yong1,XU Wenjuan1,HUANG Ran2,GAN Defang1
(1.School of Horticulture, Anhui Agricultural University, Hefei 230036, China;2.Anhui Zhengze Ecological Agriculture Science and Technology Development Co., Ltd., Dingyuan 233230, China)
Abstract:Dropwort is a perennial herbaceous plant of Oenanthe genus in the Apiaceae family, which is an important vegetable crop for both food and medicine. In China, the planting area of dropwort is very extensive. However, there are few studies on the identification and cultivation of its germplasm resources and the genetic information. In this study, we used the genome of Liyang Baiqin to develop simple sequence repeat (SSR) molecular markers for dropwort, and analyzed the genetic diversity of 55 samples. The phylogenetic tree was constructed by unweighted pair group method with arithmetic means (UPGMA), and the DNA fingerprint was constructed with SSR amplified band data. The results showed that a total of 325 699 SSR loci were identified. The frequencies of single nucleotide SSR repeat units, dinucleotide SSR repeat units, trinucleotide SSR repeat units, tetranucleotide SSR repeat units, pentanucleotide SSR repeat units and hexanucleotide SSR repeat units were 33.94%, 54.62%, 9.31%, 1.66%, 0.17% and 0.29%, respectively. Among them, the number of dinucleotide SSR repeat units was the largest (177 887), and A/T (29.98%) and AT/AT (35.70%) were the more abundant repeat types. The results of UPGMA analysis indicated that 55 Oenanthe javanica materials could be divided into four groups by 33 pairs of highly polymorphic primers (polymorphic information content>0.25). Four pairs of primers (Oj-084, Oj-110, Oj-112, Oj-156) were used to completely distinguish 55 Oenanthe javanica materials, and the fingerprint could be constructed. The results can provide a strong basis for the identification, protection and molecular genetic breeding of Oenanthe javanica germplasm resources.
Key words:dropwort;simple sequence repeat (SSR) molecular markers;cluster analysis;genetic diversity
水芹[Oenanthe javanica (Bl.) DC.]别称水芹菜、水英、蜀芹、野芹菜等,是伞形科水芹属多年生湿生草本蔬菜[1]。长期以来,水芹一直被视为药食同源的保健蔬菜,其富含蛋白质、维生素、纤维素等营养物质及钾、钙、硒等多种矿质元素[2-3],并且含有类黄酮、多酚、香豆素等功能活性物质[4-5],具有清热、利尿、降血脂和血压、抗炎、抗氧化等功效[6-7],深受人们的喜爱。近年来,随着人们生活水平的不断提高,对水芹的需求量也不断增加。水芹的种植方式多种多样,有深水栽培、浅水栽培、湿润栽培等,其软化方式也呈现多样化,有培土软化、深栽软化、深水软化、覆盖软化等。近年来,研究者培育出一些耐高温的水芹品种,配合夏季遮阳网进行覆盖栽培,可以实现水芹的周年生产和均衡供应[8]。
水芹种质资源十分丰富,在世界各地均有种植,目前主要分布于中国长江流域、日本北海道、印度尼西亚爪畦岛及菲律宾等地区,多分布在沼泽地带[9-10]。目前,有关水芹的研究主要集中在栽培技术[11]、净化水体的作用[12-13]、药理活性及功能研究等方面[14-16]。近年来,科研工作者也开始对水芹进行基因组学及功能基因的研究[17-18],而有关水芹种质资源分类的研究较少[1,19-20]。目前,水芹资源大多以产地命名,如江苏的常熟白芹、玉祁红芹、宜兴圆叶芹、溧阳白芹、丹阳水芹,安徽的桐城水芹、庐江的高梗水芹等。由于品种间的形态差异较大,加上各地间的互相引种,使得水芹品种的命名比较混乱,亟需一种快速准确鉴定水芹品种的方法,用于水芹资源的遗传多样性分析,对于水芹种质资源的鉴定保护、有效利用和创新具有十分重要的意义。赵书花[19]利用随机扩增多态性DNA标记(RAPD)技术对中国的20份水芹种质资源进行了亲缘关系分析,认为地理因素对水芹品种的影响较大,但也有来自不同地区的材料的遗传距离相近,说明遗传距离相近的材料可能具有相同的起源或相近的环境条件亦或受到相似的人工选择。傅劭[20]采用DNA测序技术及光学显微镜及扫描电镜对170份东亚水芹野生种质资源进行了分子系统学、微形态及孢粉学等研究,认为东亚水芹野生种质资源的物种分类与传统菜用水芹资源的物种认定结果不相符。此外有研究者认为,同一物种内不同区域的水芹品种的孢粉学形态差别很大。王月等[21]利用低拷贝核基因AOX1、MCM5对太湖地区6个水芹地方品种进行了遗传多样性分析,并结合简单重复序列区间和特定序列扩增(ISSR-SCAR)技术,开发了玉祁水芹特异性分子标记,为水芹的遗传育种提供了分子基础。
简单重复序列(SSR)是一类以1~6个核苷酸为基本单元的1段DNA序列,在基因组中串联重复出现,如(CA)n、(AT)n、(GGC)n等重复[22-24]。由于SSR分子标记具有数量多、多态性好、使用成本低及操作简单等特点,已经在植物遗传图谱构建、遗传多样性分析、基因定位与克隆等方面得到广泛应用[25-26],也是目前常用的分子标记之一。
本研究拟利用溧阳白芹基因组开发SSR多态性分子标记,借助琼脂糖凝胶电泳检测技术,对55份来源不同的水芹自然材料进行遗传多样性分析,分析其遗传差异及亲缘关系,以期为水芹种质资源鉴定、图谱构建及分子标记辅助育种等研究提供理论支持。
1材料与方法
1.1试验材料
以收集的55份水芹资源为试验材料,其中13份由扬州大学李良俊教授课题组提供。已知水芹品种为玉祁红芹(编号为SQ008,序号为1)、春晖(编号为SQ024,序号为10)、秋芹1号(编号为SQ026,序号为11)、伏芹1号(编号为FQ1H,序号为12)、扬州长白芹(编号为YZCBQ,序号为13)、鄂水芹1号(编号为ESQ1H,序号为20),其余材料为从不同地区采集的自然材料(表1)。
1.2DNA的提取
用十六烷基三甲基溴化铵(CTAB)法[27]提取55份水芹叶片的基因组DNA,用Nanodrop 2000检测DNA的质量和浓度,并将DNA原液质量浓度稀释到50 ng/μL,再将稀释液于-20 ℃冰箱保存。
1.3SSR分子标记的开发
本研究所用溧阳白芹基因组序列由南京农业大学熊爱生教授课题组提供。用TBtools[28]中的SSRminer对水芹全基因组序列进行SSR位点搜索。用TBtools中的插件Batch Target Region Primer Design进行引物的批量设计,再用TBtools中的插件Primer Check进行引物的特异性检测,最后对特异性引物进行筛选。随机选取160对筛选到的引物,引物由生工生物工程(上海)股份有限公司合成。PCR扩增体系如下:10 μL 2×PCR Mix,1 μL正向引物,1 μL反向引物,1 μL稀释的DNA工作液,7 μL ddHO,总体积为20 μL。PCR反应程序如下:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸6 s,30个循环;72 ℃延伸10 min,4 ℃保存。用2%琼脂糖凝胶电泳对扩增产物进行有效性验证。
1.4数据统计与处理
对凝胶电泳检测结果进行带型统计,根据扩增条带的大小,从上往下读取条带,有条带的记为1,无条带的记为0,缺失条带的记为9,用Excel 2019对获得的数据进行统计分析和作图。用Power Marker、GenAlEx软件分析SSR扩增数据,计算多态性信息含量(PIC)、次等位基因频率(MAF)、等位基因数(Na)、有效等位基因数(Ne)、遗传多样性系数(GD)、期望杂合度(He)等数据;用NTsys-pc计算供试材料之间的遗传距离、遗传相似系数,用非加权组平均法(UPGMA)构建系统进化树。
1.5SSR指纹图谱的构建
根据扩增条带的位置,从上往下读取条带,有条带的记为1,无条带的记为0,缺失条带的记为9,再根据引物多态性信息含量从大到小进行排序,用十进制数字对材料进行编码,构建55份水芹材料的SSR指纹图谱。
2结果与分析
2.1水芹基因组SSR位点的鉴定与分析
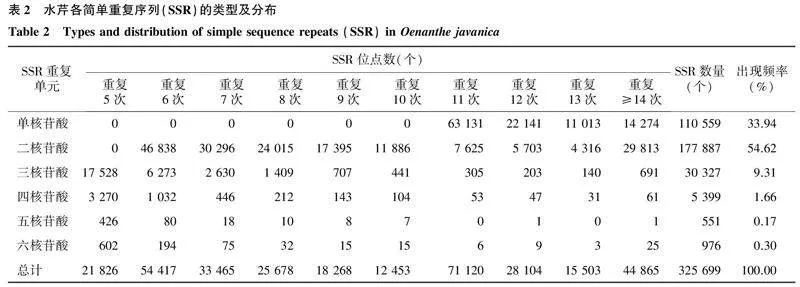
在Linux服务器上对溧阳白芹的基因组数据进行统计,发现基因组数据大小为1.23 Gb,共有199 035条Scaffolds(序列总长度为1 325 692 593 bp)。用TBtools软件在溧阳白芹基因组序列中鉴定到325 699个SSR位点,平均每3.97 kb就有1个SSR位点。统计单核苷酸、二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸重复序列的分布状况和数量特征发现,各类型SSR出现的频率依次如下:单核苷酸为33.94%,二核苷酸为54.62%,三核苷酸为9.31%,四核苷酸为1.66%,五核苷酸为0.17%,六核苷酸为0.29%。其中,二核苷酸SSR重复单元数量最多,有177 887个(表2)。另外,重复次数为5次、6次、7次、8次、9次、10次、11次、12次、13次、≥14次的SSR出现频率分别为6.70%、16.71%、10.27%、7.88%、5.61%、3.82%、21.84%、8.63%、4.76%、13.78%。
2.2不同类型SSR重复出现的频率及分布特征
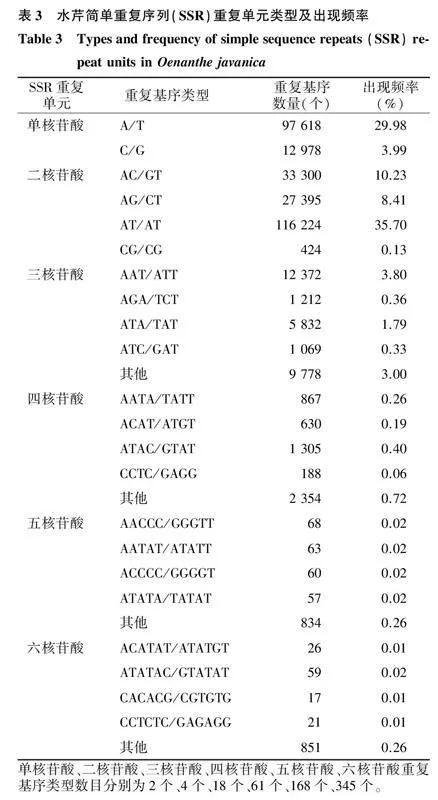
溧阳白芹基因组统计数据显示,SSR位点的重复基序类型有1 112种。在考虑序列互补的情况下,SSR重复基序类型有598种,其中(AT/AT)n重复基序类型最丰富,约占总SSR位点数的35.70%;其次是A/T重复基序,约占总SSR位点数的29.98%;(AC/GT)n约占总SSR位点数的10.23%,(AG/CT)n约占总SSR位点数的8.41%,C/G约占总SSR位点数的3.99%,(AAT/ATT)n约占总SSR位点数的3.80%,其他各类型SSR占总SSR位点数的比例大多低于1.00%(表3)。
2.3SSR引物筛选
选择二碱基重复10次、三碱基重复6次的SSR位点,用TBtools中的插件Batch Target Region Primer Design进行引物的批量设计,再用TBtools中的插件Primer Check进行引物的特异性检测,最后对特异性引物进筛选,筛选条件如下:PCR产物预期大小为100~350 bp,引物退火温度(Tm)为58~61 ℃,且正向引物(F)和反向引物(R)的Tm相差1 ℃;引物长度为18~22 bp,引物5’端最好是G/C,3’端最好避免出现A;引物序列中的碱基重复次数少于4次,G/C的单碱基重复次数少于3次。为了保证引物的特异性,用于设计引物的保守侧翼序列与SSR位点间至少间隔20~23个碱基。从筛选后的引物中随机选取160对引物进行合成。用6份不同来源地、性状差异较大的样品进行PCR扩增,根据条带清晰、多态性丰富的原则,最终筛选到33对多态性SSR引物(表4)。
2.4SSR引物多态性分析
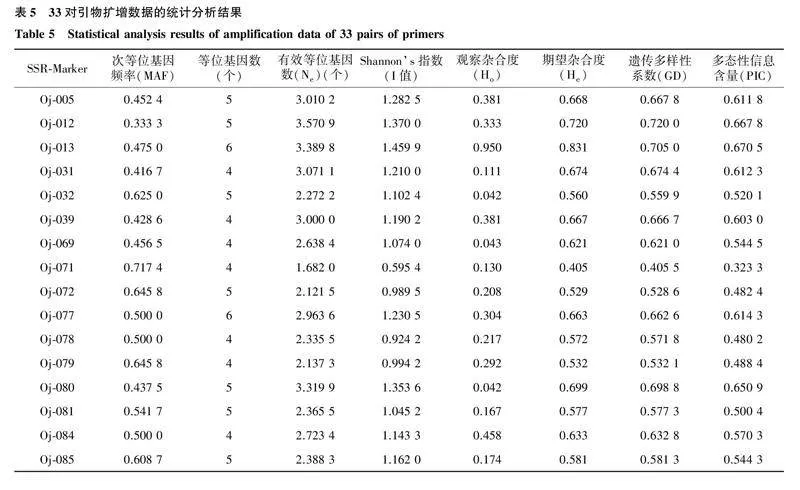
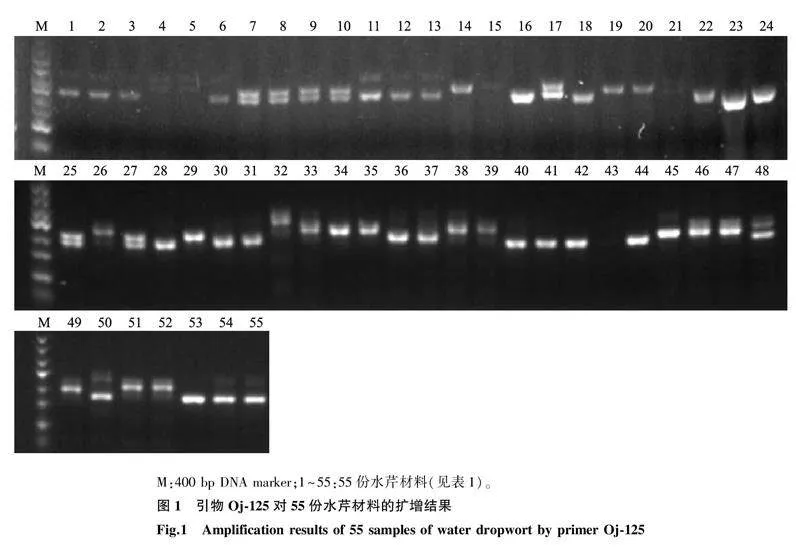
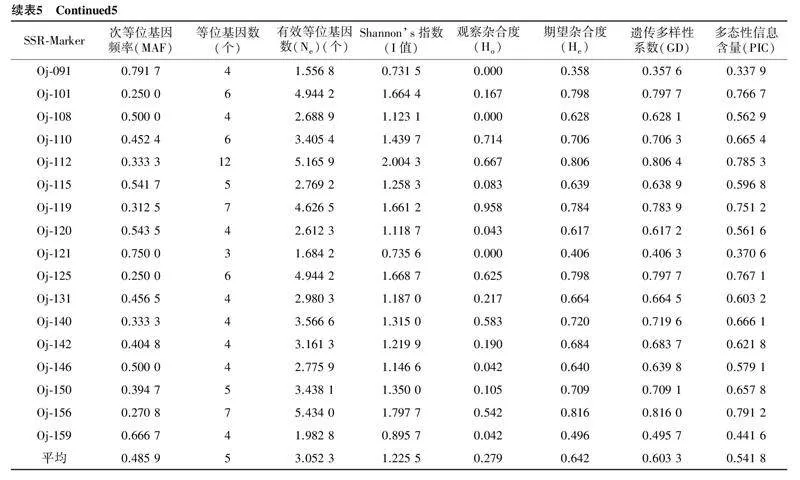
用筛选到的33对SSR引物对55份水芹材料进行PCR扩增,共检测出164个等位基因,平均每对引物扩增得到的等位基因数为5个;有效等位基因数为1.556 8~5.434 0个,平均每个位点的有效等位基因数为3.052 3个;Shannon’s指数为0.595 4~2.004 3,平均值为1.225 5;多态性信息含量(PIC)为0.323 3~0.791 2,平均值为0.541 8,33对引物均具有较高的多态性信息含量(PIC>0.250 0)(表5),且扩增条带清晰,图1为引物Oj-125对55份水芹材料的扩增结果。上述结果说明,本研究所用引物的多态性较高,可用于水芹品种的鉴定和遗传多样性分析等。
2.5水芹材料聚类分析
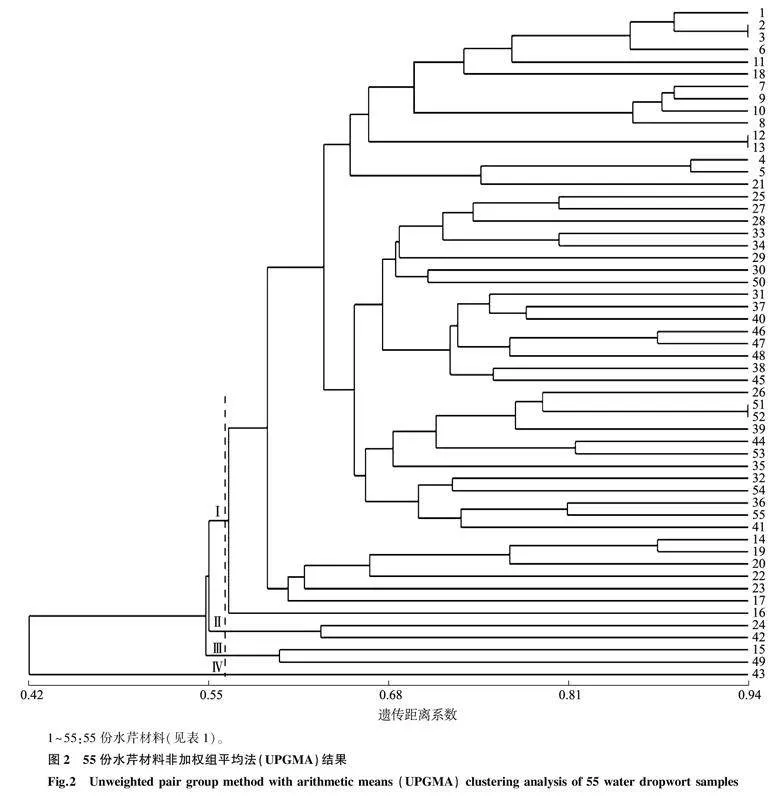
根据33对引物的遗传信息数据,用软件NTSYS-PC计算遗传距离系数,构建55份水芹材料的UPMGA聚类图。结果(图2)表明,55份水芹材料的遗传距离系数为0.42~0.95,当遗传距离系数为0.56时,55份水芹材料可聚为4组。第Ⅰ组包括编号为1、18、21、40、48等50份材料;第Ⅱ组包括编号为24、42的2份材料,其中编号为24的材料来源于安徽省六安市,编号为42的材料来自安徽省合肥市;第Ⅲ组包括编号为15、49的2份材料,其中编号为15的材料来自安徽舒城县,编号为49的材料来自安徽省池州市;第Ⅳ组中仅聚类了1份材料,该材料来自安徽省安庆市,与其他水芹材料相比,该水芹与其他水芹间的亲缘关系较远(图2)。当遗传距离系数为0.63时,第Ⅰ组中的50份材料被划分为6个亚群,编号为1、2、3、6、11、18、7、9、10、8、12、13、4、5、21的材料属于第Ⅰ亚类,除了编号为18、21的材料外,其余材料均来自江苏省水生作物资源圃;编号为25、27、28、33、34、29、30、50等材料属于第Ⅱ亚类,其中多数材料的来源地均为安徽省合肥市的不同区域;编号为14、19、20、22的材料属于第Ⅲ亚类,其中编号为19、20的材料的来源地为安徽省舒城县农业科学研究所;编号为23、17、16的材料分别属于第Ⅳ、Ⅴ、Ⅵ亚类。综上所述,用33对引物可以将取自不同地区的水芹材料完全区分开。通过UPMGA聚类图可以明确不同地区的水芹材料与已知水芹材料间的亲缘关系,此外还可以发现,来自相同区域的多数水芹材料被聚类在一起,表明水芹群体中遗传差异与地理来源间的关系较为密切。
2.6DNA指纹图谱构建
用33对多态性引物得到扩增结果后,从上往下读取条带,有条带的记为1,无条带的记为0,缺失条带的记为9,准确读出条带数据。通过在线工具(http://cloud.genepioneer.com:9929)计算最小标记组合。结果表明,最少可用4对引物(Oj-084、Oj-110、Oj-112、Oj-156)将55份水芹材料完全区分开,其中引物Oj-112的多态性位点数达12个。根据上述4对引物的条带数据,以十进制数字构建55份水芹材料的DNA指纹图谱(表6)。
3讨论与结论
近年来,随着分子标记技术的发展,DNA指纹技术在农作物品种鉴定领域的优势与潜力越发明显[29-31],并且弥补了形态学鉴定的不足而成为品种鉴定的重要方法。SSR分子标记被认为是研究植物遗传多样性较有效的标记[32],在水稻[33]、小麦[34]、玉米[35]及伞形科植物如芹菜[36]、胡萝卜[37]等作物上均有应用。中国水芹种质资源丰富,分布较广,为了充分利用水芹种质资源,就需要对水芹种质资源的遗传多样性进行全面分析。本研究首次基于溧阳白芹基因组数据挖掘SSR位点,随机抽取并合成160对引物进行筛选,利用筛选到的33对SSR引物对55份水芹材料进行遗传多样性分析,为水芹种质资源遗传鉴定奠定了基础。
基于溧阳白芹基因组数据,本研究共得到1 112种类型的SSR,其中二核苷酸重复单元占比最高,达到54.62%。Feng等[38]构建了水芹长/短读转录组,从57 743个非冗余高质量转录本中鉴定出28 514个SSR,且单核苷酸重复序列是最丰富的SSR。本研究结果则显示,二核苷酸重复序列是最丰富的类型。在重复单元类型中,(AT/AT)n重复基序类型最丰富,约占总SSR位点数的35.70%;其次是A/T重复基序,约占总SSR位点数的29.98%,说明溧阳白芹基因组中富含A、T碱基,这与对苦荞[24]、芹菜[39]等植物中SSR基序的研究结果一致。
目前,SSR分子标记被广泛应用于种质资源亲缘关系区分、品种鉴定及遗传多样性分析[32],本研究开发的33对多态性SSR引物(PIC>0.250 0)可用于55份水芹材料的遗传多样性分析,且本研究共检测出164个等位基因,遗传距离系数为0.42~0.95,平均遗传距离系数为0.68。由UPGMA聚类分析结果可知,当遗传距离系数为0.56时,55份水芹材料可聚为Ⅳ组,其中Ⅰ组有50份材料,且6份属于已知水芹材料,说明第Ⅰ组50份水芹材料间的亲缘关系较近;位于第Ⅱ组的24号(舒城县张母桥镇)和42号(合肥市庐阳区淝河西)以及第Ⅲ组的15号(舒城县农业科学研究所)和49号(池州市牌楼镇)水芹材料之间的亲缘关系较近;遗传差异最大的是位于第Ⅳ组来自安庆市的水芹材料。对聚类结果进一步分析可知,本研究所用水芹材料的遗传背景较为单一,多数来源于相同区域的材料被聚集在一起,可能由于地区之间引种频繁,基因交流密切,导致水芹的遗传多样性降低。因此,为了改善水芹遗传背景的狭隘性,应该开发更多分子标记,对水芹种质资源进行鉴定与保护,并加大种质创新、品种改良的力度。
中国水芹资源分布较广,品种差异较大。水芹主要是按地域命名,由于各地间相互引种,导致水芹同种异名和同名异种的现象普遍存在。目前,有关水芹种质资源的研究相对较少,赵书花[19]利用RAPD标记对20份水芹材料进行了聚类分析,认为地理因素对水芹品种的影响很大,但是也有来自不同地区水芹材料间的遗传距离相近,这与本研究UPGMA聚类分析结果一致。本研究以最少的4对引物(Oj-084、Oj-110、Oj-112、Oj-156)将55份水芹材料完全区分开,并根据这4对引物的条带数据,用十进制数字构建了55份水芹材料的DNA指纹图谱。
综上所述,本研究利用水芹全基因组开发了33对高多态性SSR分子标记,并用这些标记成功鉴定6份已知水芹材料和49份来自不同地区的自然水芹材料,并对55份水芹材料进行遗传多样性分析和DNA指纹图谱构建。但是,水芹种质资源丰富,品种间的形态差异较大,加上各地的相互引种,使得水芹品种的命名比较混乱,还需要进一步对其遗传多样性进行分析,相关工作对于水芹种质资源的鉴定保护、利用和创新具有十分重要的意义,也可为水芹的分子育种提供重要理论参考。
参考文献:
[1]赵有为. 中国水生蔬菜[M]. 北京:中国农业出版社,1999.
TRIY9I8i1CYrpxEhTo2nN101aA5Cl/O00Kxqbrjx+gs=[2]AI G, HUANG Z M, LIU Q C, et al. The protective effect of total phenolics from Oenanthe javanica on acute liver failure induced by D-galactosamine[J]. Journal of Ethnopharmacology,2016,100(186):53-60.
[3]CHAN E W C, WONG S K, CHAN H T. Ulam herbs of Oenanthe javanica and Cosmos caudatus:an overview on their medicinal properties[J]. Journal of Natural Remedies,2017,16(4):137.
[4]WANG W N,YANG X B,LIU H Z,et al. Effect of Oenanthe javanica flavone on human and duck hepatitis B virus infection[J]. Acta Pharmacologica Sinica,2005,26(5):587-592.
[5]李瑞,王燕,李良俊. 水芹品质研究现状[J]. 长江蔬菜,2017(22):27-31.
[6]WEI R R, SANG Z P, MA Q G. A new geranylated lignan from Oenanthe javanica and anti-inflammatory activity[J]. Chemistry of Natural Compounds,2022,58(5):808-811.
[7]JO B R, KIM H S, AHN J W, et al. A novel antiviral protein derived from Oenanthe javanica:type I interferon-dependent antiviral signaling and its pharmacological potential[J]. Biomolecules,2022,12(6):835.
[8]尹渝来,孙芳芳,鲍忠洲,等. 不同的水芹栽培方法介绍[J]. 长江蔬菜,2017(18):123-125.
[9]朱顺华,罗庆,李梦瑶,等. 水芹雄性不育材料的鉴定及营养品质分析[J]. 植物科学学报,2023,41(3):343-348.
[10]LU C L,LI X F. A review of Oenanthe javanica (blume) DC. as traditional medicinal plant and its therapeutic potential[J]. Evidence-Based Complementary and Alternative Medicine,2019:6495819. DOI:10.1155/2019/6495819.
[11]吕艳. 湿栽水芹遮光软化栽培关键技术研究[D]. 扬州:扬州大学,2022.
[12]YAO D R, CHANG Y J, WANG W, et al. The safety of consuming water dropwort used to purify livestock wastewater considering accumulated antibiotics and antibiotic resistance genes[J]. Antibiotics,2022,11(4):428.
[13]GAO J Q, LI Q, ZHANG J S, et al. Purification of micro-polluted lake water by biofortification of vertical subsurface flow constructed wetlands in low-temperature season[J]. Water,2022,14(6):896.
[14]欧开翔,谷荣辉. 水芹的化学成分、药理活性及其功能性食品研究进展[J]. 食品工业科技,2022,43(1):435-444.
[15]程雷,崔明晓,刘可玉,等. 水芹多糖的提取及其对巨噬细胞RAW264.7免疫活性的初步研究[J]. 食品与发酵工业,2023,49(6):79-85.
[16]袁丽,陈欣,周龙甫,等. 水芹提取物降低高尿酸血症大鼠血尿酸水平及机制研究[J]. 中国新药杂志,2020,29(22):2597-2604.
[17]ZHANG Z, DONG H Z, YUAN M, et al. The complete chloroplast genome of Oenanthe javanica[J]. Mitochondrial DNA Part B-Resources,2020,5(3):3151-3153.
[18]LIU J X, JIANG Q, TAO J P, et al. Integrative genome,transcriptome,microRNA,and degradome analysis of water dropwort (Oenanthe javanica) in response to water stress[J]. Horticulture Research,2021,8(1):262.
[19]赵书花. 水芹种质资源亲缘关系分析[D]. 扬州:扬州大学,2010.
[20]傅劭. 水芹种质资源的系统学及繁殖生态学研究[D]. 武汉:武汉大学,2015.
[21]王月,刘佳,陈闽,等. 基于AOX1和MCM5基因水芹地方品种的遗传关系分析及‘玉祁红芹’ISSR-SCAR标记建立[J]. 植物资源与环境学报,2021,30(4):50-59.
[22]马名川,刘龙龙,刘璋,等. 苦荞全基因组SSR位点特征分析与分子标记开发[J]. 作物杂志,2021,37(1):38-46.
[23]杜伟,王东航,侯思宇,等. 基于苦荞全长转录组测序开发SSR标记及遗传多样性分析[J]. 植物生理学报,2020,56(7):1432-1444.
[24]蔡齐宗,王佳蕊,陈庆富,等. 苦荞全基因组SSR位点鉴定及分子标记开发[J]. 河南农业大学学报,2022,56(3):392-400.
[25]杨梦婷,黄洲,干建平,等. SSR分子标记的研究进展[J]. 杭州师范大学学报(自然科学版),2019,18(4):429-436.
[26]FANG X M, HUANG K H, NIE J, et al. Genome-wide mining,characterization,and development of microsatellite markers in Tartary buckwheat (Fagopyrum tataricum Garetn.)[J]. Euphytica,2019,215(11):183.
[27]李金璐,王硕,于婧,等. 一种改良的植物DNA提取方法[J]. 植物学报,2013,48(1):72-78.
[28]CHEN C J, CHEN H, ZHANG Y, et al. TBtools:an integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[29]仇律雯,杨扬,范亚明,等. 国家东南区鲜食糯玉米品质及农艺性状与SSR标记遗传多样性分析[J]. 江苏农业科学,2022,50(18):130-135.
[30]周彩霞,罗培四,孔方南,等. 木奶果种质资源的遗传多样性分析及DNA指纹图谱构建[J]. 南方农业学报,2022,53(5):1207-1215.
[31]陈翠萍,刘洋. 基于SSR标记的藜麦种质资源遗传多样性分析与指纹图谱构建[J]. 江苏农业科学,2022,50(13):26-31.
[32]王凤格,田红丽,易红梅,等. 植物品种DNA指纹鉴定原理及其鉴定方案[J]. 分子植物育种,2018,16(14):4756-4766.
[33]CHAKRAVARTHI B K, NARAVANENI R. SSR marker based DNA fingerprinting and diversity study in rice (Oryza sativa. L)[J]. African Journal of Biotechnology,2006,5(9):684-688.
[34]SALEHI M, ARZANI A, TALEBI M, et al. Genetic diversity of wheat wild relatives using SSR markers[J]. ABI Genetika,2018,50(1):131-141.
[35]王凤格,杨扬,易红梅,等. 中国玉米审定品种标准SSR指纹库的构建[J]. 中国农业科学,2017,50(1):1-14.
[36]陈昌龙,董岩,田宇,等. 芹菜转录组数据SSR标记的开发及其遗传多样性分析[J]. 农业生物技术学报,2020,28(4):616-628.
[37]马振国,欧承刚,刘莉洁,等. 胡萝卜品种资源遗传多样性及亲缘关系研究[J]. 中国蔬菜,2015(11):28-34.
[38]FENG K, KAN X Y, LI R, et al. Integrative analysis of long- and short-read transcriptomes identify the regulation of terpenoids biosynthesis under shading cultivation in Oenanthe javanica[J]. Frontiers in Genetics,2022,13:813216.
[39]FU N, WANG P Y, LIU X D, et al. Use of EST-SSR markers for evaluating genetic diversity and fingerprinting celery (Apium graveolens L.) cultivars[J]. Molecules,2014,19(2):1939-1955.
(责任编辑:徐艳)

