小菜蛾杀虫抗体的对靶设计及验证







摘要:本研究拟通过模拟Cry毒素创制新型杀虫蛋白质用于小菜蛾防治,主要利用三维结构模拟及分子对接技术,以前期获得的抗Cry1Ab抗体为模板设计2个基因工程抗体(GEAb)。其中,具有杀虫活性的GEAb-GGCC与小菜蛾中肠刷状边缘膜囊泡(BBMV)具有较高结合活性,并与Cry1A和Cry1B具有重叠的BBMV结合位点。BBMV免疫沉淀分析鉴定结果显示,与GEAb-GGCC结合的中肠蛋白质包括氨肽酶N(APN)、V-ATP酶B亚基和polycalin。由于GEAb-GGCC缺乏Cry1A类蛋白质中负责成孔的α-螺旋结构,推测GEAb-GGCC或通过结合小菜蛾中肠受体激活下游信号通路,引起中肠损伤,导致虫体死亡。
关键词:对靶设计;杀虫基因工程抗体;分子对接;小菜蛾;Cry毒素
中图分类号:Q816文献标识码:A文章编号:1000-4440(2024)07-1212-08Target design and verification of insecticidal antibody against Plutella xylostellaXIE Yajing YANG Liying HU Xiaodan XU Chongxin ZHANG Xiao GAO Meijing LU Lina ZHONG Jianfeng ZHU Qing LIU Yuan LIU Xianjin
(1.School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China;2.Key Laboratory of Food Quality and Safety of Jiangsu Province-State Key Laboratory Breeding Base of Ministry of Science and Technology/Key Laboratory of Control Technology and Standard for Agro-product Safety and Quality, Ministry of Agriculture and Rural Affairs/Key Laboratory for Agro-product Safety Risk Evaluation (Nanjing), Ministry of Agriculture and Rural Affairs/Institute of Food Safety and Nutrition, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;3.Jiangsu Vocational College of Agriculture and Forestry, Zhenjiang 212400, China)
Abstract:To generate new insecticidal proteins against Plutella xylostella by mimicking Cry toxins, two genetically engineered antibodies (GEAb) were designed by using previously obtained anti-Cry1Ab idiotypic-antibody as template, mainly by three-dimensional structure modeling and molecular docking technology. The insecticidal GEAb-GGCC of GEAb was found to show high affinity to P. xylostella brush border membrane vesicles (BBMV), and had superposed BBMV binding sites with Cry1A and Cry1B. Identification results of BBMV immunoprecipitation analysis showed that the midgut proteins bonded with GEAb-GGCC included aminopeptidases N (APN), B subunit of V-ATPase and polycalin. Because the GEAb-GGCC is lack of α-helix structure which is responsible for pore forming in Cry1A proteins, it is speculated that GEAb-GGCC may activate the downstream signal pathway by binding with the midgut receptors to cause midgut injury, which leads to the death of P. xylostella larva.
Key words:target design;insecticidal genetically engineered antibody;molecular docking;Plutella xylostella;Cry toxin
苏云金芽孢杆菌(Bacillus thruingiensis, Bt)是目前应用最广泛的微生物杀虫剂[1]。随着转Bt基因作物在全球的大量种植,Bt抗性风险也引起人们的广泛关注[2]。传统的蛋白质工程手段主要通过构建随机突变体库筛选改良的突变体[3],还可以通过定向进化等手段来提高酶(蛋白质)的生物活性和特异性等[4-5],如哈佛大学[6]以类钙黏蛋白作为靶标,对Bt蛋白Cry1Ac进行多轮定向进化,获得对抗性粉纹夜蛾具有高毒力的突变体。随着计算机技术的应用,人们借助计算机模拟对蛋白质结合关键位点进行理性分析,从而对蛋白质进行计算机设计、分子改造,以改善其生物活性[7-8]。Tinberg等[8]使用计算机对接技术分析洋地黄毒苷与靶标结合界面的关键位点,通过突变极大地提高了靶标与配体的亲和力。
小菜蛾(Plutella xylostella)属于鳞翅目害虫,主要对十字花科蔬菜产生较重危害[9-10]。随着长期种植转Bt基因作物和施用Bt农药(以Cry1Ac为主),导致小菜蛾产生广泛抗性,目前小菜蛾已成为世界上抗药性最强的农业害虫之一[11]。据报道,小菜蛾对Cry1Ac的抗性主要与其受体ATP结合盒亚家族C成员2(ABCC2)和碱性磷酸酶(ALP)的表达减少有关[12]。
本团队在前期基于噬菌体库筛选获得2个模拟Bt蛋白Cry1Ab对稻纵卷叶螟具有杀虫活性的抗独特型抗体(B12和G1),本研究主要针对B12和G1抗独特型抗体进行同源建模并对靶小菜蛾(碱性磷酸酶, ALP)进行分子对接分析,根据对接预测结果进行对靶设计及改造获得基因工程抗体(GEAb)-GGCC和GEAb-CCGG,并通过筛选获得对小菜蛾中肠刷状边缘膜囊泡(BBMV)具有高结合活性的新型杀虫基因工程抗体GEAb-GGCC。
1材料与方法
1.1三维建模
利用B12、G1、GEAb-GGCC、GEAb-CCGG、Cry1Ab和小菜蛾ALP的蛋白质氨基酸序列在swissmodel网站(https://swissmodel.expasy.org/)分别进行同源建模。B12、G1、GEAb-GGCC、GEAb-CCGG的模板分别为1f3r、6g8r、4q9r和6g8r,Cry1Ab和ALP的模板分别为1ciy和1zef。选取最优结构用于下一步分子对接。
1.2与小菜蛾ALP分子对接分析
用ZDOCK软件(https://zdock.umassmed.edu/)对配体(Cry1Ab、B12、G1、GEAb-GGCC和GEAb-CCGG)和受体(ALP)进行分子对接预测,选取最优对接复合物,利用蛋白质结合热点预测软件KFC2(https://mitchell-web.ornl.gov/KFC_Server)[13]进行配体/受体的结合热点区域预测分析。
1.3GEAb的表达及纯化
人工合成GEAb-GGCC和GEAb-CCGG的核酸序列,利用Nco I和Not I酶切位点将人工合成的核酸序列连接至pET-26b载体中,在大肠杆菌BL21(DE3)中表达。表达蛋白质经组氨酸(His)标签纯化及脱盐,利用Easy Protein Quantitative Kit进行蛋白质浓度测定,并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。
1.4Cry蛋白的准备
Cry1Ac、Cry1Ab和Cry1Ba蛋白用碳酸钠缓冲液(0.05 mol/L NaHCO3, pH 9.6)溶解后分装,-80 ℃保存。
1.5小菜蛾BBMV的制备
选取四龄小菜蛾的中肠,用匀浆缓冲液[7 mmol/L 三羟甲基氨基甲烷盐酸盐(Tris-HCl),5 mmol/L 乙二醇二乙醚二胺四乙酸(EGTA),300 mmol/L 甘露醇,1 mmol/L 苯甲基磺酰氟(PMSF),pH 7.5]洗涤后,置于匀浆缓冲液中匀浆2~3次;加入MgCl2溶液,4 ℃、6 000 g离心10 min;取上清液至超速离心管中,4 ℃、24 000 g离心30 min;BBMV用4-羟乙基哌嗪乙磺酸(HEPES)缓冲液溶解,分装后于-80 ℃保存。BBMV浓度用BCA蛋白浓度测定试剂盒进行测定。
1.6Cry毒素和GEAb与BBMV的结合酶联免疫吸附测定(ELISA)试验在96孔板中加入100 μL小菜蛾BBMV(50 μg/mL),37 ℃孵育2 h(包被),封闭。加入100 μL(4 μmol/L)抗体(B12、G1、GEAb-GGCC和GEAb-CCGG)或Cry毒素(Cry1Ab和Cry1B)孵育。GEAb等抗体组加入100 μL抗组氨酸(HIS)二抗37 ℃孵育;Cry蛋白组加入100 μL抗Cry1A或Cry1B的兔抗血清孵育,再加入100 μL羊抗兔二抗孵育。用四甲基联苯胺(TMB)显色,测定450 nm波长的吸光度(OD450)值。每组3个重复,重复3次。
1.7Cry毒素和GEAb与BBMV的结合生物膜干涉技术(BLI)试验氨基丙基硅烷(APS)传感器平衡后,在小菜蛾BBMV(20 μg/mL)溶液中进行5 min(包被)固化,在封闭液中封闭1 min,分别在不同稀释浓度(0.5~4.0 μmol/L)的Cry1B、GEAb-GGCC和Cry1Ab溶液中进行10 min结合,在封闭液中解离10 min。
1.8GEAb对小菜蛾的生物活性测定
用磷酸盐溶液(PBS)分别对纯化的B12、G1、GEAb-GGCC、GEAb-CCGG和Cry1Ab溶液进行2倍梯度稀释。每个皿中加入1 mL上述稀释的蛋白质溶液,晾干后,挑入30只小菜蛾2龄幼虫。在饲喂3 d、5 d后,进行观察并记录试虫死亡数。每组3个重复,重复3次。死亡率=死亡数/小菜蛾总数×100%。
1.9Cry1类毒素与GEAb-GGCC的BBMV竞争ELISA试验对Cry1类毒素(Cry1Ab、Cry1B和Cry1Ac)(500 mg/mL)进行2倍梯度稀释后,与等体积的GEAb-GGCC(终浓度2 μmol/L)混匀,37 ℃孵育2 h。在96孔板上用100 μL小菜蛾BBMV包被,封闭过夜。分别加入100 μL上述Cry1类毒素与GEAb-GGCC的混合物孵育2 h;加入100 μL抗His二抗孵育2 h;用四甲基联苯胺显色,测定OD450。每组3个重复,重复3次。
1.10GEAb-GGCC的小菜蛾BBMV结合蛋白质的鉴定BBMV免疫沉淀:将GEAb-GGCC与小菜蛾BBMV在冰上孵育12 h;将混合物于4 ℃、16 000 g 离心1 h,沉淀用1 mL溶解缓冲液[50 mmol/L PBS, pH 7.4;1 mmol/L 乙二胺四乙酸(EDTA), pH 7.4;1 mmol/L MgSO4;10%甘油;2% 3-(3-(胆酰胺丙基)二甲基氨基丙基)-1-丙磺酸内盐(CHAPS);1 mmol/L PMSF]重悬后,冰上孵育1 h。4 ℃、16 000 g 离心1 h,取上清液,加入DynabeadsHis-Tag 磁珠,冰上孵育过夜。混匀后,将装有磁珠的离心管置于磁力架上,吸去上清液。用Binding/Wash buffer (50 mmol/L PBS, 150 mmol/L NaCl, pH 7.4)重悬后,清洗4次。将磁珠重悬于50 μL电泳加样缓冲液中,煮沸后用于SDS-PAGE。
肽指纹质谱(PMF)分析:将相应条带切胶后用胰酶消化,用超高效液相色谱法/串联质谱分析,使用Mascot v2.3搜索引擎在美国国家生物技术信息中心(NCBI)小菜蛾数据库(plutella_db.fa)中进行搜索及注释。
2结果与分析
2.1GEAb的设计以及与ALP的分子对接分析
在BLAST网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上将母本B12和G1分别与Cry1类毒素(Cry1Ab、Cry1Aa和Cry1Ac)进行序列比对,发现B12的重链CDR 1区与Cry1类毒素的保守结构域Endotoxin N结构域的序列相似,B12的轻链CDR 1和轻链CDR 2区与保守结构域Endotoxin C结构域的序列相似; G1的轻链CDR 1’区与保守结构域Endotoxin C结构域的序列相似(表1)。基于上述结果,我们设计了2个GEAb (图1A),并进行了蛋白质序列同源BLAST分析(表1)。
Cry1Ac的受体蛋白小菜蛾ALP,与ABCC2相比,具有较小的相对分子量以及较为可信的结构模型,被选为GEAb分子对接的靶标,用于分子对接(图1B)。经分子对接预测,Cry1Ab和GEAb分别与小菜蛾ALP上的2个结合区结合,分别为ALP受体结合区Ⅰ(W53)和ALP受体结合区Ⅱ(A409、Y411、Y433)(图2)。经预测,GEAb-GGCC与ALP受体结合的热点部位较母体(B12、G1)有所增加,包括重链CDR 1、重链CDR 2、重链CDR 3和轻链CDR 2(图2),推测GEAb-GGCC与ALP的结合活性更高。
2.2GEAb对小菜蛾的BBMV结合活性验证
GEAb-GGCC和GEAb-CCGG与小菜蛾BBMV的结合力利用ELISA筛选,结果表明,GEAb-GGCC具有较高的BBMV结合活性(图3B)。用小菜蛾BBMV结合BLI的试验对GEAb-GGCC进行亲和力测定,确定GEAb-GGCC对BBMV具有较高亲和力[亲和力常数(KD)=12.8 nmol/L],且与Cry1Ab (KD=127.10 nmol/L)相比,GEAb-GGCC对BBMV的亲和力高(图3C、图3D)。GEAb对小菜蛾的生物活性测定结果显示,3 d时GEAb-GGCC对小菜蛾的致死率较母本B12、G1高,5 d时GEAb-GGCC的致死率可达95%(图4)。
2.3GEAb-GGCC与Cry1类蛋白质有重叠的BBMV结合位点采用间接竞争ELISA验证GEAb-GGCC是否与Cry1类蛋白质有重叠的BBMV结合位点。随着Cry1类蛋白质(Cry1Ab、Cry1Ac和Cry1Ba)的添加浓度的增高,小菜蛾BBMV与GEAb-GGCC的结合被逐步抑制(图5),即GEAb-GGCC与Cry1类蛋白质有重叠的BBMV结合位点,初步确定GEAb-GGCC通过模拟Cry1Ba、Cry1Ab和Cry1Ac毒素与BBMV结合。在添加Cry1Ac和Cry1Ba至高浓度(125 μg/mL)时,对GEAb-GGCC与BBMV结合的抑制率分别可达69.8%和73.6%;在使用Cry1Ab作为竞争对象时,有着相似的抑制率,但需要大约2倍的蛋白质浓度。Cry1Ab、Cry1Ba与Cry1Ac对GEAb-GGCC的半抑制浓度(IC50)分别为89.6 g/mL、37.99 g/mL和49.18 g/mL。
2.4与GEAb-GGCC结合的小菜蛾BBMV蛋白
利用BBMV-pulldown和PMF分析鉴定出18个GEAb-GGCC的BBMV结合蛋白(图6、表2),其中包括常见的Cry1Ac受体氨肽酶N(APN)和Cry1Ac结合蛋白V-ATP酶B亚基、polycalin,未鉴定到Cry1Ac的常见受体如钙黏蛋白(CAD)或ABCC2。通过比对,发现与我们前期筛选获得的GEAb-dVL存在相同的BBMV结合蛋白,如polycalin、肌球蛋白、肌动蛋白和ATP合酶亚基。分析后发现多个线粒体中的蛋白质也与GEAb-GGCC结合,这与前期获得的关于GEAb-dVL[14]的研究结果类似,即多个线粒体中的蛋白质与GEAb-dVL结合。
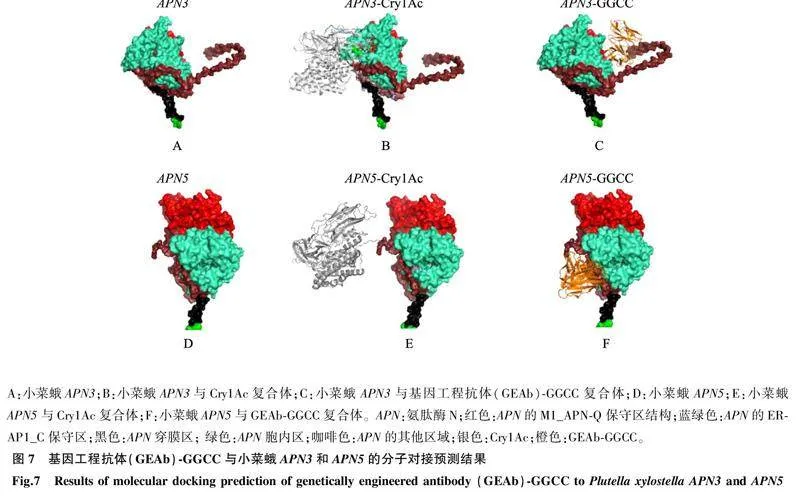
2.5GEAb-GGCC与小菜蛾APN3和APN5的分子对接预测分析小菜蛾APN3经验证为Cry1Ac的中肠功能受体,且与Cry1Ac抗性相关[12]。在Cry1Ac抗性小菜蛾品系(如DBM1Ac-R、NIL-R、SZ-R和SH-R等品系)中,APN3等Bt受体的相对表达量下调,但与此同时上调了APN5等同源非Bt受体基因的相对表达量。分子对接预测结果显示,GEAb-GGCC分别可与小菜蛾APN3和APN5结合,但GEAb-GGCC与小菜蛾APN3的结合区与Cry1Ac不同,Cry1Ac仅与APN3结合(图7)。
3讨论
我们对小菜蛾ALP进行杀虫蛋白的对靶设计,并筛选获得了1个新型的杀虫基因工程抗体GEAb-GGCC,主要由母本(抗Cry1Ab的抗独特型抗体)G1和B12的重链、轻链重组而成。对GEAb-GGCC、Cry1Ac与小菜蛾ALP进行分子对接比对,预测结果表明GEAb-GGCC与Cry1Ac具有相似的受体结合区,GEAb-GGCC或可与小菜蛾BBMV结合。与预测结果相似,GEAb-GGCC可以识别小菜蛾中肠BBMV中Cry1A/Cry1B的结合位点,并通过与BBMV结合导致虫体的死亡。
在Cry1A类蛋白质的结构中,结构域Ⅰ的α-螺旋结构对杀虫毒性至关重要 [15-16]。因此,结构域Ⅰ中部分氨基酸的替换可导致Cry蛋白毒性丧失,并且去除结构域Ⅰ的Cry1Ab也丧失了对小菜蛾幼虫的毒性。由于GEAb-GGCC缺乏α-螺旋的穿孔结构,以及GEAb-GGCC与BBMV受体的结合区和Cry1Ab蛋白与BBMV受体的结合区的结构相似性,我们推测GEAb-GGCC与BBMV结合蛋白质的作用,和Cry1Ab与钙黏蛋白受体的结合类似,通过与受体结合时激活细胞死亡途径来发挥其杀虫活性。
GEAb-GGCC可与Cry1类蛋白质竞争,印证了其能够识别小菜蛾BBMV中Cry1A和Cry1B的结合位点。GEAb-GGCC不能完全竞争Cry1Ac或Cry1Ab的结果,说明在这个Cry1Ab/Cry1Ac结合位点群中存在多个结合位点,并且只有其中一部分被GEAb-GGCC识别。
GEAb-GGCC在小菜蛾中肠中的候选受体包含氨肽酶APN2、APN3、APN4a和APN5,以及其他已报道的具有Cry1A结合位点的BBMV蛋白,如V-ATP酶B亚基、polycalin和热激蛋白60。分子对接预测结果显示,GEAb-GGCC可与小菜蛾APN3、APN5结合。这与前期获得的杀虫蛋白GEAb-dVL的结果类似,经预测GEAb-dVL也可与小菜蛾APN3和APN5结合,且GEAb-dVL对表达APN5的sf9昆虫细胞具有细胞毒性(数据未发表),提示GEAb-GGCC或与GEAb-dVL类似,通过与多个中肠受体(如APN)结合,诱导中肠损伤、虫体死亡。
参考文献:
[1]FIUZA L, POLANCZYK R, CRICKMORE N. Bacillus thuringiensis and Lysinibacillus sphaericus[M]. Switerland:Springer, Cham,2017.
[2]TABASHNIK B E, CARRIèRE Y. Surge in insect resistance to transgenic crops and prospects for sustainability[J]. Nature Biotechnology, 2017,35(10):926-935.
[3]GUPTA R D, GOLDSMITH M, ASHANI Y, et al. Directed evolution of hydrolases for prevention of G-type nerve agent intoxication[J]. Nature Chemical Biology,2011,7(2):120-125.
[4]WILLIAMS G J, ZHANG C, THORSON J S. Expanding the promiscuity of a natural product glycolsyl-transferase by directed evolution[J]. Nature Chemical Biology,2007,3(10):657-662.
[5]BADRAN A H, GUZOV V M, HUAI Q, et al. Continuous evolution of Bacillus thuringiensis toxins overcomes insect resistance[J]. Nature,2016,533:58-63.
[6]LEE C C, PERCHIACCA J M, TESSIER P M. Toward aggregation-resistant antibodies by design[J]. Trends in Biotechnology,2013,31(11):612-620.
[7]吴梧桐. 蛋白质工程技术与新型生物催化剂设计[J]. 药物生物技术,2004,11(1):1-6.
[8]TINBERG C E, KHARE S D, DOU J, et al. Computational design of ligand-binding proteins with high affinity and selectivity[J]. Nature,2013,501(7466): 212-216.
[9]LI Z, ZALUCKI M P, YONOW T, et al. Population dynamics and management of diamondback moth(Plutella xylostella) in China: the relative contributions of climate, natural enemies and cropping patterns [J]. Bulletin of Entomological Research,2016,106(2):197-214.
[10]FURLONG M J, WRIGHT D J, DOSDALL L M. Diamondback moth ecology and management: pro-blems, progress, and prospects [J]. Annual Review of Entomology,2013,58:517-541.
[11]JURAT-FUENTES L, HECKEL F. Mechanisms of resistance to insecticidal proteins from Bacillus thuringiensis[J]. Annual Review of Entomology,2021,66:121-140.
[12]GUO Z, KANG S, SUN D, et al. MAPK-dependent hormonal signaling plasticity contributes to overcoming Bacillus thuringiensis toxin action in an insect host[J]. Nature Communication,2020,11:3003.
[13]ZHU X, MITCHELL J C. KFC2:a knowledge-based hot spot prediction method based on interface solvation, atomic density and plasticity features[J]. Proteins,2011,79:2671-2683.
[14]XIE Y J, XU C X, GAO M J, et al. Docking-based generation of antibodies mimicking Cry1A/1B protein binding sites as potential insecticidal agents against diamondback moth(Plutella xylostella) [J]. Pest Management Science,2021,77(10):4593-4606.
[15]CHEN X J, CURTISS A, ALCANTARA E, et al. Mutations in domain I of Bacillus thuringiensis d-endotoxin CryIAb reduce the irreversible binding of toxin to Manduca sexta brush border membrane vesicles[J]. Journal of Biological Chemistry,1995,270:6412-6419.
[16]WU D, ARONSON A I. Localized mutagenesis defines regions of the Bacillus thuringiensis delta-endotoxin involved in toxicity and specificity[J]. Journal of Biological Chemistry,1992,267:2311-2317.
(责任编辑:陈海霞)

