配合物或配离子中心原子化合价的判断




配合物是高中化学新教材中重要的概念和知识点,配合物中心原子化合价的判断已经成为近年来高考试题中的新热点.本文通过回顾教材,重构认知模型,并对高考真题进行剖析,总结出确定配合物或配离子中心原子化合价的判断方法.
1 例题感悟
例1 (2021 年湖南卷)铁的配合物离子(用[L—Fe—H]+ 表示)催化某反应的一种反应机理和相对能量的变化情况如图1所示.下列各项说法错误的是( ).
A.该过程的总反应为HCOOH =催化剂=CO2↑+H2↑
B.H+ 浓度过大或者过小,均导致反应速率降低
C.该催化循环中Fe元素的化合价发生了变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
分析 该题的解题关键在于判断配合物离子或配合物各元素的化合价,选项C是学生的困难所在.
[L—Fe—H]+ 中配位原子H 有单电子,先从外界获得1个电子,形成孤电子对,之后再与中心离子形成σ配位键,配体为离子,整体记作-1价.若将配位原子L视为-1价,则中心原子Fe为+3价.同理可判断Ⅱ中,H(-1价)、O(-1价)、L(-1价),则中心原子Fe为+3价.Ⅲ 中H(-1价)、L(-1价)、Fe(+3价),Ⅳ中H2(0价)、H(-1价)、L(-1价),配离子整体化合价为+1,可知Fe的化合价为+3.将L视为分子,则中心原子Fe的化合价均为+2.选项C说法正确.本题答案为D.
由此可见,正确判断配合物中元素的化合价是学习配合物的难点.
2 模型建构
2.1 配合物或配离子的配体和中心原子
由中心原子或离子与某些分子或离子以配位键结合形成的化合物叫作配位化合物,简称配合物.在配位化合物中,接受配体孤电子对的原子或离子统称为中心原子,作为中心原子的离子或原子,必须具有可以接受配体给予的孤电子对的空轨道.给予电子对的分子或离子称为配位体,简称配体,配体必须具有至少1个孤电子对,在配体中提供孤对电子,直接与中心原子连接的原子称为配位原子.
常见的配体有:NO- 2 、NO- 3 、Cl- 、F- 、CN- 、C5H5-、CH3COO-、CO、NH3、H2O、NO、CH3CN、H2NCH2CH2NH2 等.
2.2 配合物或配离子的符号表征
配合物化学式中方括号表示在括号内的组分是由配位键结合而成的,为一个稳定的整体.在写配合物的化学式时必须用方括号标明这一由配位键结合而成整体的部分.这个整体可以是中性分子,也可以是正离子或者负离子.
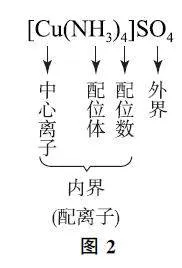
配位化合物包括配位中性分子和含有配位正离配位化合物包括配位中性分子和含有配位正离统称为配离子.配合物在方括号之内的组分为内界组分,在方括号之外的组分为外界组分(如图2).在溶液中,配合物内界部分不解离或难解离,外界部分容易解离.
高中化学教材中配合物的符号表征有多种(如图3).
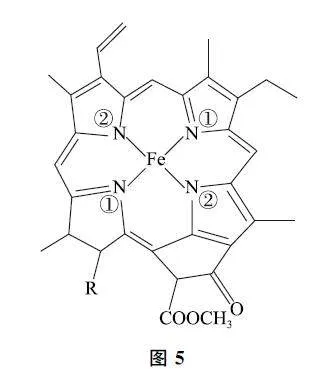
将人教版(2020年版)选择性必修2第98页中叶绿素结构示意图(如图4)中的中心原子Mg换为Fe,可得如图5所示的结构.
配位原子是N,提供孤电子对,4个氮原子中,左下和右上的2个氮原子(记作①),与左上和右下的2个氮原子(记作②)不一样.
①直接提供孤电子对,化合价记作0;②有一个单电子,先获得一个电子,才能形成电子对,与Mg形成σ配键,化合价记作-1.于是4个氮原子化合价代数和为-2.故Mg的化合价为+2.若结构为图5时,可快速判断铁元素的化合价为+2.
此处,基于以下认知重新建构了确定配合物中心原子化合价的方法.
1)中心原子仅提供空轨道,不提供电子.
2)配位原子提供孤电子对:若孤电子对完全由配位原子提供,则配体为分子,化合价记作0价.若配位原子有单电子,假设先从外界获得一个电子,形成孤电子对,之后再与中心离子形成σ配键,配体为离子,整体记作-1价.
由配体的化合价以及配离子的电荷数,结合整体电荷数可确定中心原子的化合价.这样的认知模型,能有效帮助学生判断陌生情境下配合物中的配体及配合物或配离子中心原子的化合价.
3 模型应用
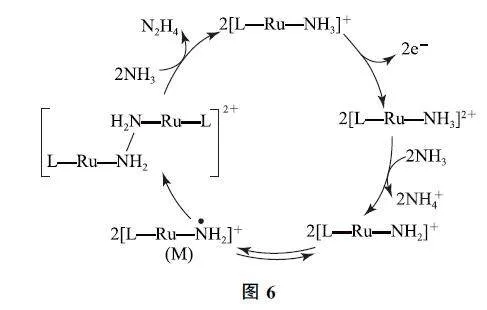
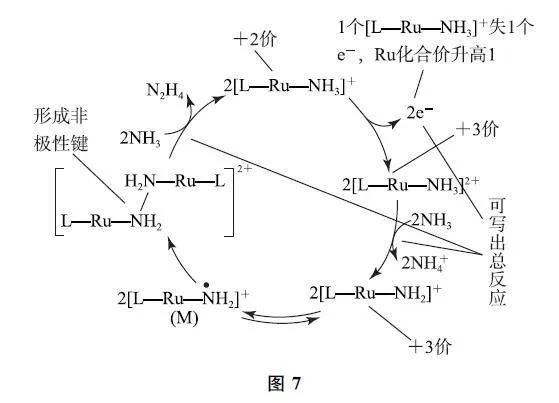
例2 (2023年湖南卷)N2H4 是一种强还原性的高能物质,在航天、能源等领域有广泛应用.我国科学家合成的某Ru(Ⅱ)催化剂(用[L—Ru—NH3]+ 表示)能高效电催化氧化NH3 合成N2H4,其反应机理如图6所示.
下列说法错误的是( ).
A.Ru(Ⅱ)被氧化至Ru(Ⅲ)后,配体NH3 失去质子能力增强
B.M 中Ru的化合价为+3
C.该过程中有非极性键形成
D.该过程的总反应式:4NH3-2e-=N2H4+2NH4+
分析 由题干文字表述“某Ru(Ⅱ)催化剂(用[L—Ru—NH3]+ 表示)”可知,中心原子Ru 为+2价,配体NH3 整体为0价,根据化合价代数和为+1,可知L为-1价,即配体分别为NH3 和L.具体分析如图7所示.
结合图示分析可知,[L—Ru—NH3 ]2+ →[L—Ru—NH2]+ 失去1个质子,所带电荷数减1,则Ru化合价不变,与[L—Ru—NH2]+ 相比,M 中N 原子的孤电子对变为单电子,说明N 原子孤电子对中的1个电子转移给了Ru,所以M 中Ru的化合价变为+2,选项B说法错误.答案为B.
例3 (2023 年全国甲卷第35 题,节选)将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂.
酞菁和钴酞菁的分子结构如图8所示.
钴酞菁分子中,钴离子的化合价为____,氮原子提供孤对电子与钴离子形成键____.
分析 标号为③的N 原子有单原子,须先从外界获取一个电子后,再提供孤电子对与中心原子钴离子配对,化合价记为-1价,标号为②的N 原子没有单电子,可直接提供孤电子对,化合价可记为0价.根据钴酞菁分子化合价代数和等于0,即可判断出中心原子Co的化合价为+2价.
此题也可以通过分析酞菁和钴酞菁分子结构的差异进行分析,在钴酞菁分子中失去了2个H 的酞菁离子(+2价)再与钴离子通过配位键结合成分子,因此,钴离子的化合价为+2,氮原子提供孤对电子与钴离子形成配位键.
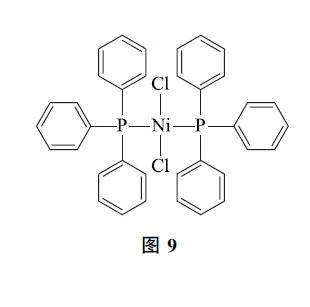
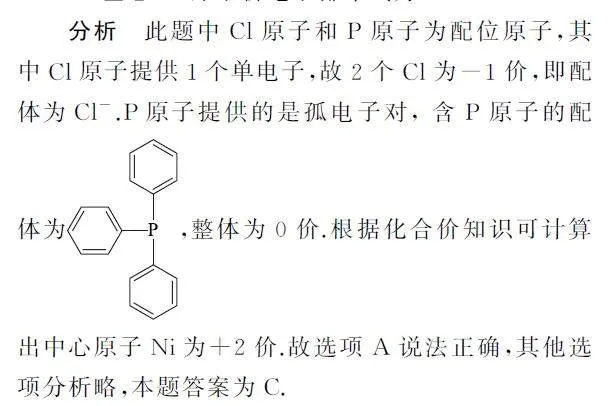
例4 (2024年安徽卷)某催化剂结构简式如图9所示,下列说法错误的是( ).
A.该物质中Ni为+2价
B.基态原子的第一电离能:Cl>P
C.该物质中C和P均采取sp2 杂化
D.基态Ni原子价电子排布式为3d84s2
4 深挖教材,原创试题
在命制试题时,不必舍近求远,教材是命题的首要素材.例如人教版(2019年版)选择性必修3介绍的维生素B12 便是极好的考查配合物化合价的命题素材.
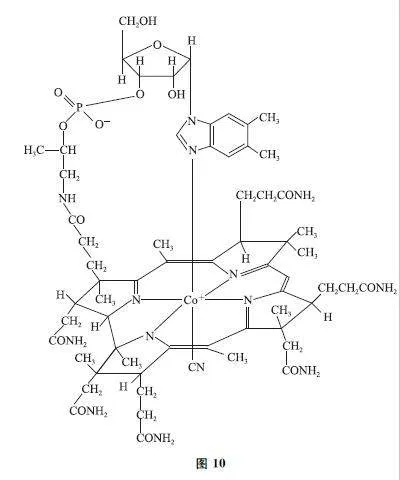
原创试题 “有机合成之父”伍德沃德合成了维生素B12,其结构如图10所示.设阿伏加德罗常数的值为N A,下列有关说法错误的是( ).
A.Co的化合价为+2
B.1mol维生素B12含手性碳的数值为13N A
C.酸性、加热条件下,可引入7个羧基
D.N原子参与形成的σ键与π键数目之比为12∶1
分析 本题以维生素B12为素材考查化合价的判断、阿伏加德罗常数的相关计算.与钴元素配位的5个氮原子中,有1个氮原子共形成3个共价键,说明N贡献-1,另一个配体为CN- ,贡献-1,结构中还含有O 带1个负电荷,且Co自身带1个正电荷,说明Co为+2 价,选项A 说法正确.结构中含有6 个—CONH2,酸性水解产生6个—COOH,而—CN 在酸性条件下也能水解产生—COOH,选项C 说法正确.结构中有12个N 形成3个σ键,有1个N 形成1个σ键,共37个σ键,很明显N 参与形成的π键有3个,故σ键与π键数目之比为37∶3,选项D说法错误.答案为D.
5 启示与结语
教师要注重概念的建构,在日常教学中引导学生把化学基础知识与不同信息整合起来,逐渐帮助学生搭建概念认知模型,改善思维品质,帮助学生形成“证据推理与模型认知”的关键能力,跳出题海战术的魔咒,使复习备考更有针对性.
本文系湖南省教育信息技术研究“十四五”规划2024年度立项课题“基础教育精品课制作与应用策略研究” (课题立项编号:HNETR24005)、湖南省教育科学“十三五”规划2018年度立项课题“基于微信公众平台的高中化学微课程设计与应用”(课题立项编号:XJK18QJC007)的阶段性研究成果.

