例谈2024年高考中的键角大小判断与模型建构

键角是共价键的参数之一,是描述分子立体构型的重要因素.分子中键角的大小比较及原因解释是考试中常见的一类问题.下面结合2024年高考命题题型和键角判断的规律和答题模板予以阐释.
1 近两年高考键角考查频次和呈现形式
1.1 融合杂化方式和孤对电子考查键角大小
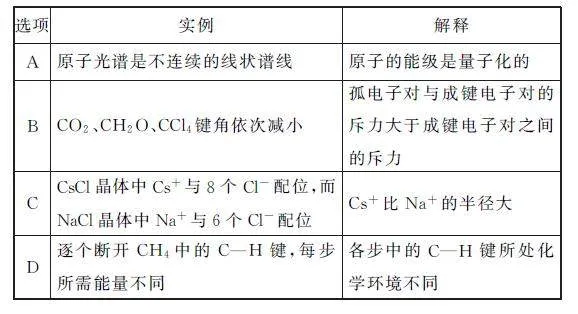
例1 (2024年河北卷)从微观视角探析物质结构及性质是学习化学的有效方法.下列实例与解释不符的是( ).
解析 原子光谱是不连续的线状谱线,说明原子的能级是不连续的,即原子能级是量子化的,选项A 不符合题意.CO2中心C原子为sp杂化,键角为180°,CH2O 中心C 原子为sp2 杂化,键角大约为120°,CH4中心C 原子为sp3 杂化,键角为109°28′,3种物质中心C原子都没有孤电子对,三者键角大小与孤电子对无关,选项B符合题意.离子晶体的配位数取决于阴、阳离子半径的相对大小,离子半径比越大,配位数越大,Cs+ 周围最多能排布8个Cl- ,Na+周围最多能排布6个Cl- ,说明Cs+ 比Na+ 半径大,选项C不符合题意.断开第一个键时,碳原子周围的共用电子对多,原子核对共用电子对的吸引力较弱,需要能量较小,断开C—H 键越多,碳原子周围共用电子对越少,原子核对共用电子对的吸引力越大,需要的能量变大,所以各步中的C—H 键所处化学环境不同,每步所需能量不同,选项D 不符合题意.答案为B.
1.2 融合元素化合物转化和具体物质考查键角大小
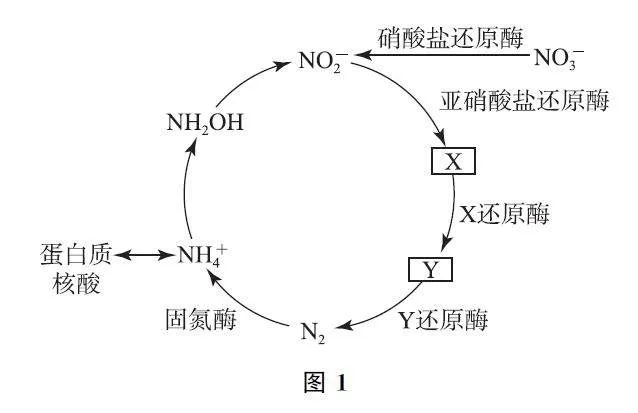
例2 (2024年安徽卷)地球上的生物氮循环涉及多种含氮物质,转化关系之一如图1所示(X、Y 均为氮氧化物),羟胺(NH2OH)以中间产物的形式参与循环.常温常压下,羟胺易潮解,水溶液呈碱性,与盐酸反应的产物盐酸羟胺([NH3OH]Cl)广泛用于药品、香料等的合成.
已知25℃时,
Ka(HNO2)=7.2×10-4,
Kb(NH3·H2O)=1.8×10-5,
Kb(NH2OH)=8.7×10-9.
下列有关物质结构或性质的比较中,正确的是( ).
A.键角:NH3>NO- 3
B.熔点:NH2OH>[NH3OH]Cl
C.25℃同浓度水溶液的pH:[NH3OH]Cl>NH4Cl
D.羟胺分子间氢键的强弱:O—H…O>N—HN
解析 NH3中N 原子的价层电子对数=3+1/2(5-3×1)=4,为sp3 杂化,键角为107°,NO- 3 中N 原子的价层电子对数=3+1/2(5+1-3×2)=3,为sp2 杂化,键角为120°,故键角:NH3<NO- 3 ,选项A 错误.NH2OH 为分子晶体,[NH3OH]Cl为离子晶体,故熔点:NH2OH<[NH3OH]Cl,选项B错误.由题目信息可知,25 ℃下,Kb(NH3H2O)>Kb(NH2OH),故NH2OH 的碱性比NH3H2O 弱,即同浓度的水溶液中,[NH3OH]+ 的水解程度大于 NH4+ 的水解程度,则同浓度水溶液的pH:[NH3OH]Cl<NH4Cl,选项C错误.O 的电负性大于N,O—H 键的极性大于N—H键,故羟胺分子间氢键的强弱为O—H…O>N—H…N,选项D正确.答案为D.
1.3 融合“位、构、性”推断考查键角大小
例3 (2024年6月浙江卷)X、Y、Z、M4种主族元素,原子序数依次增大,分别位于3个不同短周期,Y与M 同主族,Y 与Z核电荷数相差2,Z原子的最外层电子数是内层电子数的3倍.下列说法不正确的是( ).
A.键角:YX3+>YX3-
B.分子的极性:Y2X2>X2Z2
C.共价晶体熔点:Y>M
D.热稳定性:YX4>MX4
解析 由题给信息分析可知,Z为O 元素,Y 为C元素,X 为 H 元素,M 为 Si元素.YX3+ 为CH3+,其中C原子的杂化类型为sp2,CH3+ 的空间构型为平面正三角形,键角为120°;YX3-为CH3-,其中C原子的杂化类型为sp3,CH3- 的空间构型为三角锥形,由于C 原子还有1 个孤电子对,故键角小于109°28′,因此,键角的大小关系为 YX3+>YX3-,选项A 说法正确.Y2X2为C2H2,为直线形分子,分子结构对称,分子中正负电荷的重心是重合的,故为非极性分子;H2O2分子结构不对称,分子中正负电荷的重心是不重合的,故为极性分子,因此,两者极性的大小关系为Y2X2<X2Z2,选项B说法不正确.金刚石和晶体硅均为共价晶体,但是由于C的原子半径小于Si,因此,C—C键的键能大于Si—Si键的,故共价晶体熔点较高的是金刚石,选项C 说法正确.元素的非金属性越强,其气态氢化物的热稳定性越强;C 的非金属性强于Si,因此,甲烷的热稳定性较高,选项D 说法正确.答案为B.
2 解题思维建模
比较键角大小的思维模型如下.
1)判断杂化类型
2)确定孤电子对数
当中心原子的杂化类型相同时,中心原子上的孤电子对数越多,键角越小,如H2O、NH3、CH4 分子的中心原子均采用sp3 杂化,其孤电子对数分别是2、1、0,则键角∠H—O—H(105°)<∠H—N—H(107°)<∠H—C—H(109°28′).
3)看电负性
当中心原子的杂化类型和孤电子对数都相同时,可根据中心原子和配位原子电负性大小判断,其中,中心原子电负性越大,键角越大;配位原子电负性越大,键角越小.例如,NH3 和PH3 的杂化类型、孤电子对数均相同,但电负性N>P,因此,键角∠H—N—H(107°)>∠H—P—H(935°).再如,NF3 和NCl3 的杂化类型、孤电子对数均相同,但电负性F>Cl,因此,键角∠Cl—N—Cl>∠F—N—F.
4)看化学键类型
双键间的斥力>双键与单键间的斥力>单键间的斥力,如HCHO 中∠O—C—H(大于120°)大于∠H—C—H(小于120°).
特别强调:配体体积对键角的影响规律如下:
配体体积越大,电子云占据空间越大,对成键电子对的斥力越强,导致键角减小.例如,NH3 >NH2OH>NH2CH3.
3 迁移整合运用
练习1 (2024年江西卷)科学家发现宇宙中存在100多种星际分子.下列关于星际分子说法正确的是( ).
A.分子的极性:SiH4>NH3
B.键的极性:H—Cl>H—H
C.键角:H2O>CH4
D.分子中三键的键长:HC≡N>HC≡CH
答案 B.
练习2 (2023 年天津卷)常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被世界卫生组织(WHO)列为A1级高效安全消毒剂.已知,工业上制备二氧化氯的方法之一是用甲醇在酸性条件下与氯酸钠反应,其反应的化学方程式为CH3OH+6NaClO3+3H2SO4=CO2↑+6ClO2↑+3Na2SO4+5H2O.下列说法正确的是( ).
A.CO2 是非极性分子
B.键角:ClO- 3 <ClO- 2
C.NaClO3 在反应中作还原剂
D.ClO2 分子空间构型为直线形
答案 A.
练习3 (2023年福建卷)某含锰着色剂的化学式为XY4MnZ2Q7,Y、X、Q、Z为原子序数依次增大的短周期元素,其中 XY4+ 具有正四面体空间结构,Z2Q47- 结构如图2所示.下列说法正确的是( ).
A.键角:XY3>XY4+
B.简单氢化物沸点:X>Q>Z
C.第一电离能:X>Q>Mn
D.最高价氧化物对应的水化物酸性:Z>X
答案 C.
练习4 (2024年1月浙江卷,节选)H2N—NH2+H+→H2N—NH3+,其中—NH2 的 N 原子杂化方式为____;比较键角∠HNH:H2N—NH2 中的—NH2____H2N—NH3+ 中 的—NH3+ (填 “>”“<”或“=”),请说明理由: ____.
答案sp3;<;—NH2 中的N 原子含有孤电子对,孤电子对对成键电子排斥力大,键角小.
(完)

