“物质结构与性质”易错点专题




“物质结构与性质”是高中化学中的重点,也是高考中的高频考点,内容比较抽象,知识点比较零散,容易出错.分析近几年高考试题可以发现,考查题型变化并不大,所考知识点具有一定的系统性与关联性.因此,在复习时,要注意对其中易错知识点的梳理及归纳,以提高复习的质量.
1 元素周期律与元素周期表
1.1 原子序数与元素位置的“序数差值”规律
1)同周期相邻主族元素的“序数差值”规律.
第ⅡA 族和第ⅢA 族中的元素,其原子序数差存在以下关系:第二、第三周期相差为1;第四、第五周期相差为11;第六、第七周期相差为25;其余同周期相邻元素之间,相差为1.
2)同族相邻元素的“序数差值”规律.
第二、第三周期,差值为8;第三、第四周期,存在两种情况:第ⅠA、第ⅡA 族相差为8,其他族相差为18;第四、第五周期,相差为18;第五、第六周期,若在镧系之前,相差为18,之后则相差为32;第六、第七周期,相差为32.
1.2 运用“三看”法判断粒子的半径大小
1)看电子层数:电子层数越多,粒子半径越大.
2)看核电荷数:在电子层数相同的情况下,核电荷数越多,其半径越小.当粒子具有相同的电子层结构时,其半径满足“序大径小”.
3)看核外电子数:同种元素的各种微粒,核外电子数越多,则半径也就越大.
例1 化合物A 是一种常用的表面活性剂,具有起泡性能好、去污能力强等特点,其结构如图1所示.已知X、Y、Z、W、M 均为短周期常见元素,W 是形成物质种类最多的元素,X、Y 为同族元素,Z、M 为同族元素,基态Z原子的核外电子有6种空间运动状态.下列说法错误的是( ).
A.原子半径:Z>Y>X>M
B.电负性:X>Y>W>M>Z
C.X、Y、Z、W 的简单氢化物中稳定性最强、熔沸点最高的为X的氢化物
D.均由X、Y、Z、M4种元素组成的两种盐可以发生反应
解析
W 是形成物质种类最多的元素,故W 为C元素;由图可知,Z可形成+1价阳离子,且基态Z原子的核外电子有6种空间运动状态,所以Z为Na元素;Z、M 为同族元素,M 可形成1个共价键,故M 为H 元素;X、Y 为同族元素,X 可形成1个双键,Y可形成2个单键和2个双键,则X为O 元素,Y为S元素.同周期主族元素,从左到右原子半径依次减小.同主族元素,从上到下原子半径依次增大,选项A说法正确.
通常情况下,在同一周期的主族元素中,从左到右,电负性增大.同主族元素从上到下电负性减小,故电负性:O>S>C>H>Na,选项B说法正确.
X、Y、Z、W 的简单氢化物分别为H2O、H2S、NaH、CH4,NaH 为离子化合物,熔沸点最高,选项C说法错误.
NaHSO3 和NaHSO4 可以发生反应:NaHSO3+NaHSO4=Na2SO4+H2O+SO2↑,选项D说法正确.答案为C.
2 化学键、分子间作用力
1)σ键与π键的判断方法如表1所示.
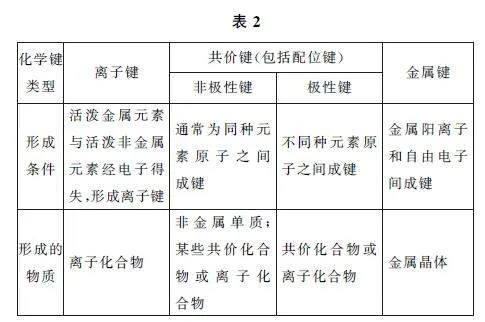
2)离子键、共价键及金属键的比较如表2所示.
例2 «淮南万毕术»中记载“曾青得铁则化为铜”,这是古代湿法炼铜的方法,胆矾可作为湿法炼铜的原料.胆矾(CuSO45H2O)的可能结构如图2所示,N A 为阿伏加德罗常数的值,对于该结构,下列说法错误的是( ).
A.胆矾中既有配位键,又有氢键
B.加热时胆矾中的结晶水会同时失去
C.1mol胆矾所含σ键的数目为18N A
D.粒子内部的键角SO24->H2O
解析 由胆矾的结构可知其中含有配位键和氢键,选项A 说法正确.胆矾中有1个水分子和其他微粒通过氢键结合,有4个水分子和Cu2+ 通过配位键结合,作用力不同,加热时分步失去结晶水,选项B说法错误.1mol胆矾所含σ键的数目为18N A(注意:氢键不是σ键),选项C说法正确.SO24- 空间结构为正四面体形,键角约为109°28′,H2O 的空间结构为V形,中心 O原子上孤电子对数为2,键角小于SO24-的,选项D说法正确.答案为B.
3 分子结构与性质
中心原子杂化轨道数的判断方法:杂化轨道数=σ键电子对数+孤电子对数=价层电子对数.
1)看中心原子是否形成双键及三键.如果能够形成1个三键,则存在2个π键,占用了2个p轨道,碳原子为sp杂化;如果能够形成1个双键,则存在1个π键,碳原子为sp2 杂化;如果其中全部是单键,则碳原子为sp3 杂化.
2)结合价层电子对的互斥模型看分子的空间结构.通常情况下,没有填充电子的空轨道,一般不参与杂化;若存在1个孤电子对,则占据1个杂化轨道.
例3 下列实验事实对应的理论解释不正确的是( ).
解析 Fe2+ 和Fe3+ 的价电子排布式分别为3d6、3d5,故Fe3+ 比Fe2+ 的化学性质稳定,选项A不符合题意.丙酸分子中,只有羧基形成分子间氢键,而氨基乙酸分子中,羧基和氨基均能形成分子间氢键,氢键越多,沸点越高,选项B 不符合题意.[PtCl4(NH3)2]中N 原子形成3个N—H 和1个N→Pt配位键,N→Pt配位键相比于孤电子对,对其他成键电子对的排斥作用减小,选项C 不符合题意.在环状S8 分子结构中,每个S原子与相邻2个S原子形成2个σ键,其原子上还含2个孤电子对,故S原子杂化类型为sp3 杂化,选项D符合题意.答案为D.
“物质结构与性质”这部分内容比较复杂,知识点零碎.建议在复习时,教师要引导学生建构知识网络与体系,同时注意对易错知识的梳理与总结,提高做题的质量与效率.
(完)

