不同猪源受体菌表达猪流行性腹泻病毒保护性抗原S1诱导免疫应答的比较研究


摘 要:
旨在比较猪源副干酪乳酪杆菌(Lacticaseibacillus paracasei)、罗伊氏黏液乳杆菌(Limosilactobacillus reuteri)、约氏乳杆菌(Lactobacillus johnsonii)作为口服疫苗载体,表达外源蛋白刺激仔猪产生免疫能力的强弱,以期选取合适乳酸菌作为受体菌载体。
本研究首先体外鉴定表达PEDV S1蛋白的重组猪源副干酪乳酪杆菌(pPG-T7g10-S1/L. paracasei 27-2)、猪源罗伊氏黏液乳杆菌(pPG-T7g10-S1/L. reuteri J31)、猪源约氏乳酸杆菌(pPG-T7g10-S1/L. johnsonii 6332)的耐酸耐胆盐能力,考察3株重组菌的抗逆性。结果表明,3株重组菌均能够耐受酸和胆盐环境,且与其野生型菌株没有显著差异。接下来为比较3株重组菌的免疫效果,口服免疫初生仔猪后,利用间接ELISA和中和试验检测仔猪产生的特异性抗体水平及其中和活性;并测定免疫后仔猪血清和肠黏膜中各细胞因子水平。结果显示,口服免疫后,与对照组相比,3株免疫组仔猪血清IgG抗体和鼻拭子、肛拭子、肠黏液中SIgA抗体水平均显著升高,且可持续至第28天左右,其中pPG-T7g10-S1/L. paracasei 27-2组诱导产生的抗体水平显著高于其他两组免疫组(P<0.05);仔猪产生特异性的IgG和 SIgA对 PEDV均具有中和活性。仔猪血清中细胞因子IFN-γ、IL-2、IL-4、IL-10水平和对照组相比显著升高(P<0.05),但3株重组菌组间细胞因子水平未见明显差异;仔猪空肠黏膜中细胞因子IFN-γ、IL-2、IL-4、IL-5、IL-6、IL-17、IL-21、TGF-β、APRIL和BALL水平与对照组相比有所升高,且pPG-T7g10-S1/L. paracasei 27-2 组IL-4、IL-5、IL-6、TGF-β、IL-17、IL-21和BALL相比其他组显著升高(P<0.05)。综上所述,本研究分别将质粒组成型表达PEDV主要保护性抗原S1的重组猪源副干酪乳酪杆菌、猪源罗伊氏黏液乳杆菌和猪源约氏乳酸杆菌口服免疫仔猪,结果显示能够刺激机体产生针对PEDV的黏膜免疫、体液免疫和细胞免疫,且相较于其他2株重组菌,重组猪源副干酪乳酪杆菌pPG-T7g10-S1/L. paracasei 27-2的口服免疫效果最好。该试验结果为构建更为有效的乳酸菌口服疫苗提供了科学数据。
关键词: 猪流行性腹泻;S1 蛋白;副干酪乳酪杆菌;罗伊氏黏液乳杆菌;约氏乳杆菌;口服疫苗;免疫分析
中图分类号:S852.659.6
文献标志码:A""" 文章编号:0366-6964(2024)05-2090-10
收稿日期:2023-07-18
基金项目:“十四五”国家重点研发项目(2022YFD1800800);国家自然科学基金青年项目(32102707);黑龙江省自然科学基金联合引导项目(LH2021C043)
作者简介:马茹梦 (1997-),女,河南三门峡人,硕士生,主要从事动物微生物学与免疫学研究,E-mail: mrm0134@163.com
*通信作者:王晓娜,主要从事兽医微生物与免疫学的教学与研究,E-mail:xiaonawang0319@163.com;李一经,主要从事兽医微生物与免疫学的教学与研究,E- mail:yijingli@163.com
Comparative Study on the Immune Response Induced by the Different Porcine
Receptor Bacteria with Expressing the Protective Antigen S1 of Porcine Epidemic Diarrhea Virus
MA" Rumeng1, ZHAO" Yuliang1, MA" Mingshuang1, GUO Guihai1, LIU" Xinzi1, LI" Jiaxuan1,2, CUI" Wen1,2, JIANG" Yanping1,2, SHAN" Zhifu1,2, ZHOU" Han1,2, WANG" Li1,2, QIAO" Xinyuan1,2, TANG" Lijie1,2, WANG" Xiaona1,2*, LI" Yijing1,2*
(1.College of Veterinary Medicines, Northeast Agricultural University, Harbin 150030," China;
2.Provincial Key Laboratory of Animal Disease Prevention and Control Technology and Preparation Development, Harbin 150030," China)
Abstract:
The aim was to compare the strength of Lacticaseibacillus paracasei of porcine origin, Limosilactobacillus reuteri of porcine origin, and Lactobacillus johnsonii of porcine origin as oral vaccine vectors to express exogenous proteins to stimulate immunity production in piglets with a view to selecting suitable lactic acid bacteria as receptor vectors.
In this study, the acid and bile salt tolerance of recombinant porcine Lacticaseibacillus paracasei (pPG-T7g10-S1/L. paracasei 27-2), Limosilactobacillus reuteri (pPG-T7g10-S1/L. reuteri J31) and Lactobacillus johnsonii (pPG-T7g10-S1/L. johnsonii 6332) were measured in vitro to investigate the resistance of the three strains expressing PEDV S1 protein.
The results showed that all the three recombinant strains could tolerate acid and bile salt environment, and there was no significant difference with their wild type strains. Then to compare the immune effects, the newborn piglets were orally immunized with the three recombinant strains, separately. Indirect ELISA and neutralization test were used to detect the specific antibodies and neutralizing activity of the piglets, and the levels of each cytokine in serum and intestinal mucosa of the immunized piglets were measured. The results showed that after oral immunization, compared with the control group, the levels of serum IgG antibody and SIgA antibody in nasal swabs, anal swabs and intestinal mucus of piglets in the three recombinant strains groups were significantly increased, lasted to the 28th day. The antibody level induced by pPG-T7g10-S1/L. paracasei 27-2 group was significantly higher than that of the other two groups (Plt;0.05). Pigley-produced specific IgG and SIgA both showed neutralizing activity against PEDV. The levels of IFN-γ, IL-2, IL-4 and IL-10 in the serum of piglets were significantly higher than those in the control group (Plt;0.05), but there was no significant difference in the levels of cytokines among the three recombinant strains. The levels of cytokines IFN-γ, IL-2, IL-4, IL-5, IL-6, IL-17, IL-21, TGF-β, APRIL and BALL in the jejunal mucosa of piglets were higher than those in the control group. The levels of IL-4, IL-5, IL-6, TGF-β, IL-17, IL-21 and BALL in pPG-T7g10-S1/L. paracasei 27-2 group were significantly higher than those in other groups (Plt;0.05). In conclusion, in this study, oral immunization of piglets with recombinant L. paracasei, L. reuteri and L. johnsonii, constitutively expressing the major protective antigen S1 of PEDV, showed that they could stimulate mucosal immunity, humoral immunity and cellular immunity against PEDV. Compared with the other two recombinant strains, the recombinant porcine pPG-T7g10-S1/L. paracasei 27-2 had the best oral immunization effect. The results of this experiment provide scientific data for the construction of a more effective oral vaccine for lactic acid bacteria.
Key words: porcine epidemic diarrhea; S1 protein; Lacticaseibacillus paracasei; Limosilactobacillus reuteri; Lactobacillus johnsonii; oral vaccines; immune analysis
*Corresponding authors:" WANG Xiaona,E-mail:xiaonawang0319@163.com;LI Yijing,E- mail:yijingli@163.com
猪流行性腹泻(porcine epidemic diarrhea,PED)是由冠状病毒科冠状病毒属的猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的各日龄猪呕吐、水样腹泻、脱水及仔猪高致死率为特征的急性肠道传染病[1]。流行病学资料表明,哺乳期仔猪感染PEDV后死亡率可达50%以上,其中7日龄内仔猪死亡率可达100%[2]。疫苗免疫接种是预防该病的主要措施,但传统强毒灭活苗和弱毒活疫苗对PEDV感染的控制并不理想。PEDV的S1蛋白在病毒与宿主细胞受体结合、病毒的膜融合与进入、激活宿主免疫系统与产生中和抗体等方面起重要作用[3-4]。因此,S1蛋白成为PEDV 诊断和基因工程疫苗研究的靶点。
PEDV呈典型的黏膜感染,提高机体黏膜免疫屏障防控PED是十分有效的[5-6]。肠道黏膜作为机体免疫的第一道屏障,在PEDV的免疫保护中发挥重要作用,肠道黏膜表面特异性SIgA水平直接决定疾病的发生和疾病临床表现的严重程度。因此,针对PEDV黏膜感染与黏膜免疫的特点,研制能有效刺激黏膜免疫系统产生免疫应答的疫苗对PED的防治具有重要的科学意义。
口服疫苗因具有操作简单、风险性低、可同时诱导局部黏膜免疫和全身免疫等优势而受到关注[7]。基于乳酸菌而研发的口服疫苗已有众多报道[8-10]。乳酸菌活载体口服疫苗具有常规灭活疫苗的安全性,又具有弱毒疫苗的持久性,同时还能够增强机体非特异性免疫和非特异性抗菌抗腹泻能力。但当前所用乳酸菌部分来源于体外环境,由于菌株生存的环境条件发生变化,环境之间的差异导致其应用效果不佳,无法充分发挥其益生作用。有学者认为,理想的动物用乳酸菌最好从同源动物自身消化道中分离筛选[11]。因此本源乳酸菌成为诱导黏膜免疫的理想抗原传递载体。本研究体外验证质粒成功表达PEDV保护性抗原S1的重组猪源副干酪乳酪杆菌、猪源罗伊氏黏液乳杆菌与猪源约氏乳杆菌,并对其抗逆性进行了检测,将重组菌口服免疫新生仔猪并比较分析其诱导的免疫应答水平,筛选候选猪源乳酸杆菌活载体,为新型口服疫苗的研发与临床应用奠定一定的理论和实践基础。
1 材料与方法
1.1 材料
1.1.1 细菌、病毒
猪源副干酪乳酪杆菌27-2株(Lacticaseibacillus paracasei 27-2)[12]、猪源罗伊氏黏液乳杆菌J31株(Limosilactobacillus reuteri J31, GenBank登录号:MK921700)和猪源约氏乳杆菌6332株(Lactobacillus johnsonii 6332, GenBank登录号:MH492312)由本实验室分离并保存。
表达PEDV S1蛋白的重组猪源副干酪乳酪杆菌pPG-T7g10-S1/L.paracasei 27-2、重组猪源罗伊氏黏液乳杆菌pPG-T7g10-S1/L.reuteri J31、重组猪源约氏乳杆菌pPG-T7g10-S1/L. johnsonii 6332和对照菌株重组猪源副干酪乳酪杆菌pPG-T7g10-PPT/L. paracasei 27-2、重组猪源罗伊氏黏液乳酪杆菌pPG-T7g10-PPT/L. reuteri J31、重组猪源约氏乳杆菌pPG-T7g10-PPT/L. johnsonii 6332由本实验室构建并保存。PEDV流行毒株(CH/HLJ/2019)毒株由本实验室于2019 年分离鉴定并保存,S1基因以PEDV(CH/HLJ/2019)毒株为模板扩增获得[13]。
1.1.2 抗体
HRP标记山羊抗猪IgG和SIgA抗体购自艾博抗(上海)贸易有限公司。HRP标记山羊抗鼠IgG和FITC标记的山羊抗鼠IgG抗体均购自北京中杉金桥生物技术有限公司。
1.1.3 动物
28头抗体血清阴性、健康的杜长大新生仔猪,购自东北农业大学阿城实验实习基地(哈尔滨)。
1.2 方法
1.2.1 耐酸性和胆盐耐受性测定
野生型乳酸杆菌L. paracasei 27-2、L. reuteri J31、L. johnsonii 6332和重组乳酸杆菌pPG-T7g10-S1/L. paracasei 27-2、pPG-T7g10-S1/L.reuteri J31和pPG-T7g10-S1/L. johnsonii 6332分别接种于pH=2、pH=3、pH=4和pH=5.85和胆盐浓度为0.1%和0.5%的MRS液体培养基中,37 ℃静置培养6 h后,采用10倍比稀释的方法在平板上进行活菌计数,利用如下公式计算菌株的耐酸性和耐胆盐情况。菌株的耐酸性(胆盐耐受性)=对应pH(胆盐浓度下)的活菌数/正常MRS培养下的活菌数×100%,每个试验设3个重复。
1.2.2 实验动物分组及免疫接种
将28头新生仔猪,随机分成7(1~7组)组,每组4头。1~3组:分别口服2 mL 1×1011CFU·mL-1 的pPG-T7g10-S1/L.paracasei 27-2、pPG-T7g10-S1/L. reuteri J31和pPG-T7g10-S1/L. johnsonii 6332。4~6组:分别口服2 mL 1×1011CFU·mL-1 的pPG-T7g10-PPT/L.paracasei 27-2、pPG-T7g10-PPT/L. reuteri J31和pPG-T7g10-PPT/L. johnsonii 6332。7组作为空白对照组,口服2 mL PBS。
1.2.3 样品采集与体液免疫、黏膜免疫与细胞免疫指标检测
免疫后第0、3、7、10、14、17、21、24、28、35和42天采集仔猪血液,收取上层血清,并同时采集仔猪鼻拭子、肛拭子样本,-80℃冰箱保存;免疫后第7、14、21天刮取仔猪空肠黏液,-80℃冰箱保存。采用ELISA方法检测仔猪空肠黏液,鼻拭子和肛拭子中SIgA,血清中IgG和细胞因子IL-2、IL-4、IL-10与IFN-γ含量;采用荧光定量PCR方法检测空肠细胞因子IFN-γ、IL-2、IL-4、IL-5、IL-6、IL-17、IL-21、TGF-β、APRIL和BAFF转录水平。
1.2.4 抗体中和活性测定
采集免疫后第7天仔猪的血清和空肠黏液,检测血清和肠黏膜中抗体中和PEDV病毒的活性。血清样本和肠黏液上清过滤除菌并热灭活,于96孔细胞培养板中进行2倍比稀释至1∶256,每孔100 μL;每孔加入100 μL含100 TCID50的PEDV病毒液,同时设阳性血清对照、阴性血清对照、病毒对照与空白对照,37℃条件下静置1 h;将混合物与长满单层Vero细胞作用2 h,弃上清后补加细胞培养液;于37℃含5% CO2温箱中培养,待阳性对照病变后,记录并计算中和效价。
1.2.5 统计分析
使用GraphPad Prism(8.4.3版)统计软件对实验数据进行统计分析。数据以“平均值±标准差(x-±s)”表示,并使用SPSS进行双向方差分析和多重比较(LSD)检验。不同字母表示在同一时间点存在显著差异(Plt;0.05)
2 结 果
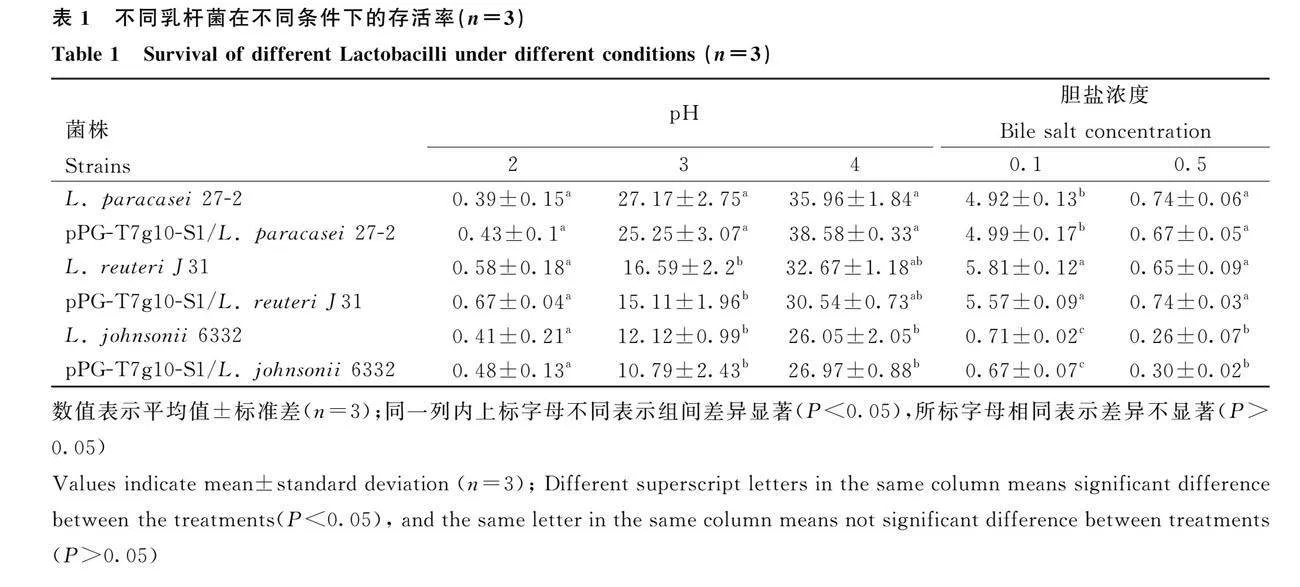
2.1 耐酸和耐胆盐性能分析
3株重组乳酸杆菌及野生型乳酸杆菌耐酸和耐胆盐性能结果如表1所示,6株乳杆菌都具有一定的耐酸和耐胆盐能力,重组乳杆菌和野生型乳杆菌的耐酸和耐胆盐性能没有显著差异;在pH为4.0条件下,pPG-T7g10-S1/L. paracasei 27-2的存活率显著高于pPG-T7g10-S1/L. johnsonii 6332(Plt;0.05)。在pH为3.0条件下,pPG-T7g10-S1/L. paracasei 27-2的存活率显著高于其他2组(Plt;0.05)。在0.1%胆盐条件下,pPG-T7g10-S1/L.paracasei 27-2与pPG-T7g10-S1/L. reuteri J31的存活率显著高于pPG-T7g10-S1/L. johnsonii 6332组(Plt;0.05)。
上述结果表明,3株重组菌间的耐酸性和胆盐耐受性存在差异,pPG-T7g10-S1/L. paracasei 27-2对酸耐受性显著高于其他组,pPG-T7g10-S1/L. paracasei 27-2与pPG-T7g10-S1/L. reuteri J31对胆盐的耐受性显著高于其他组。
2.2 重组乳杆菌免疫新生仔猪的免疫应答评价
口服免疫3株重组乳酸杆菌后的血清及黏液抗体水平结果如图1所示,口服pPG-T7g10-S1/L. paracasei 27-2、pPG-T7g10-S1/L. reuteri J31和pPG-T7g10-S1/L. johnsonii 6332组血清特异性IgG水平、黏膜特异性SIgA抗体水平均在第7天达到峰值且可持续至第21天 左右,其中pPG-T7g10-S1/L. paracasei 27-2组的特异性SIgA显著高于其他组(Plt;0.05)。以上结果表明3株重组菌均可有效诱导仔猪的体液和黏膜免疫且pPG-T7g10-S1/L. paracasei 27-2组可诱导产生更强的肠道黏膜免疫。
2.3 抗体中和活性测定
血清和肠黏液抗体中和活性结果如表2所示,口服重组菌pPG-T7g10-S1/L. paracasei 27-2、pPG-T7g10-S1/L. reuteri J31和pPG-T7g10-S1/L. johnsonii 6332仔猪血清中IgG抗PEDV中和抗体效价分别为1∶44.67、1∶44.67和1∶41.69,仔猪肠黏液中SIgA抗PEDV中和抗体效价分别为1∶18.84、1∶18.20和1∶17.78,均显著性高于PBS组(P<0.05),但3株重组菌间无显著差异。以上结果表明,3株重组菌诱导仔猪产生的血清IgG抗体和肠黏液SIgA抗体均具有中和PEDV的活性,具有预防PEDV感染的作用。
2.4 血清和肠道细胞因子检测
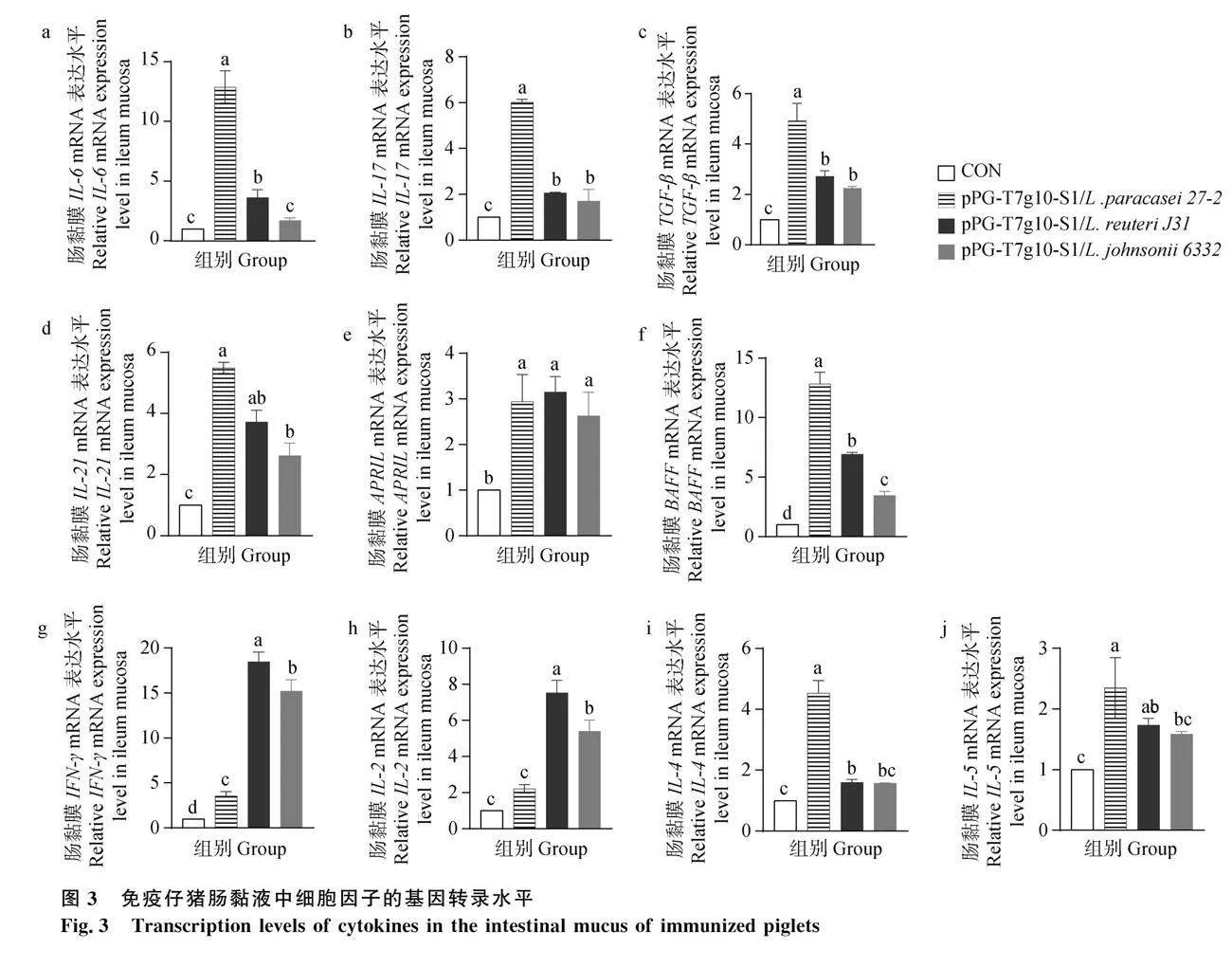
血清细胞因子表达水平结果如图2所示,重组菌pPG-T7g10-S1/L. paracasei 27-2、pPG-T7g10-S1/L. reuteri J31和pPG-T7g10-S1/L. johnsonii 6332 诱导血清中细胞因子 IFN-γ、IL-2、IL-4、IL-10的水平均显著高于对照组(P<0.05),但3株重组菌组间细胞因子水平未见明显差异,表明3株重菌口服免疫仔猪后均可诱导产生了Th1和Th2型细胞免疫反应。
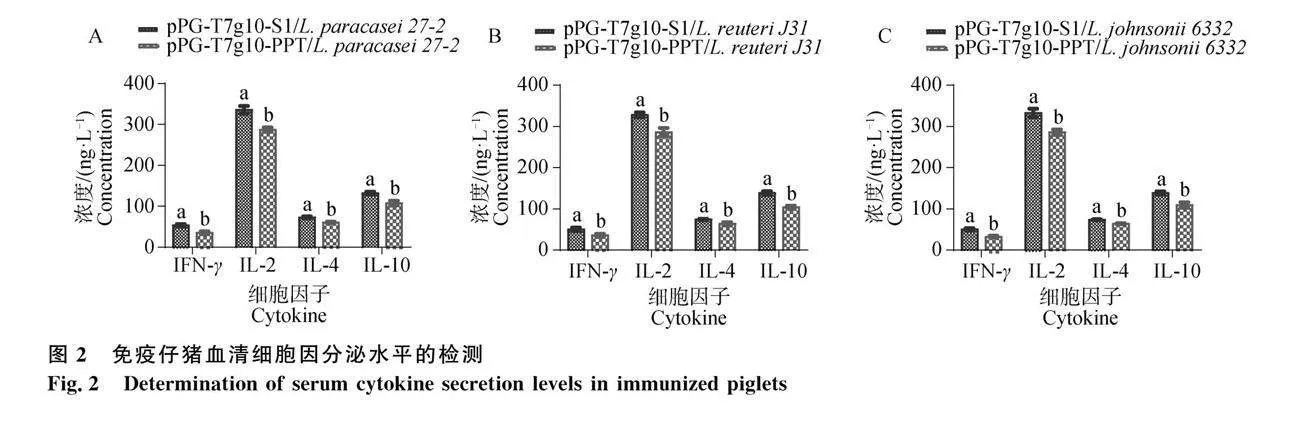
肠黏膜细胞因子转录水平结果如图3所示,3株重组菌诱导的IFN-γ、IL-2、IL-4、IL-5、IL-6、IL-17、IL-21、TGF-β、BAFF和APRIL细胞因子水平均高于对照组;重组菌pPG-T7g10-S1/L. paracasei 27-2的TNF-β、IL-17和APRIL细胞因子水平显著高于重组菌pPG-T7g10-S1/L. reuteri J31和pPG-T7g10-S1/L. johnsonii 6332,IL-4、IL-6和IL-21细胞因子水平显著高于其他3株重组菌(P<0.05)。
3 讨 论
近年来,乳酸菌被广泛应用在口服活菌疫苗载体的研制上,对疫苗的发展产生了重要的促进作用[14]。它具有维持肠道菌群平衡、增强机体免疫力、免疫调节与促进肠道内营养物质的消化吸收等广泛的益生作用;此外,乳酸菌还能通过细胞壁相关分子与宿主细胞发生作用,激活免疫相关的细胞信号转导通路,调控细胞因子以及抗体的分泌水平,从而增强免疫功能[15-16]。此外,有研究证实,在动物肠道细菌在与特定宿主物种的长期进化过程中,同一菌种的不同亚种已经产生了不同的特性,以更好地适应宿主[11]。因此,利用本源动物乳酸菌作为活载体表达异源抗原,制备口服疫苗,对科学防控黏膜感染性疾病,特别是肠道疾病具有重要意义。
PED是由PEDV感染引起的各日龄猪呕吐、水样腹泻、脱水及仔猪高致死率为特征的急性肠道传染病[1]。给养猪业造成了巨大的经济损失。因此,研制针对PEDV的有效疫苗至关重要。目前已经在PEDV S蛋白中鉴定出了多个中和表位区域,其中S1亚基含有包括COE区在内的大量中和表位,能够广泛、有效地诱导机体产生中和抗体[17]。已有许多研究利用S1基因作为候选抗原研制疫苗[3,13,18-19]。基于以上研究结果,本研究选用PEDV流行毒株S1基因作为靶标基因,构建质粒表达PEDV S1蛋白的不同猪源乳杆菌活菌载体系统,利用猪源乳杆菌肠道黏膜良好的定植作用,能够较为持久地刺激猪肠道免疫系统,诱导 PEDV 黏膜抗体的产生。
口服疫苗诱导的肠道黏膜免疫对黏膜感染性疾病的免疫预防具有独特的免疫接种优势和潜在的应用价值,但口服疫苗免疫动物普遍存在着免疫应答水平低,免疫保护效果差的瓶颈问题,因此,提高口服疫苗免疫效力是亟待探索的科学问题。口服疫苗要达到良好的免疫效果需面临诸多挑战。其中之一是口服疫苗必须克服胃液、肠液、胆汁酸盐对抗原物质的破坏作用,使抗原物质完整无损地被肠道免疫细胞所识别,才能启动免疫应答。乳杆菌能够抵抗胃肠道的强酸和肠道高胆盐胁迫而在肠道中存活下来,在体内发挥其益生作用[20-21]。乳酸菌的这种抗逆性能也是制备乳酸菌活菌载体口服疫苗的优势所在。哺乳仔猪胃液中胃酸的主要成分为盐酸,其pH通常在4左右[22],猪肠道内胆盐含量一般在0.03%~0.50%波动[23]。本研究耐酸性与胆盐耐受性结果表明,3株重组菌均具有一定的耐酸性和胆盐耐受性,能够直达靶标部位,在一定程度上增强了免疫效果。但在耐酸与耐胆盐能力中有所不同,其中猪源副干酪乳酪杆菌对酸耐受性相对较好,猪源罗伊氏黏液乳杆菌与猪源副干酪乳酪杆菌对胆盐的耐受性相对较好,这些结果为选择抗逆性强的乳酸菌制备口服疫苗提供了科学依据。因此,本研究中具有耐酸性、胆盐耐受性的副干酪乳酪杆菌是诱导黏膜免疫应答的优势候选菌株。
在免疫原性研究中,首先研究比较了两种口服疫苗方案诱导的免疫反应的差异,结果表明,免疫程序出生立即口服免疫一次相比于出生后连续免疫3 d,每天1次能更好地诱导全身和黏膜免疫应答(结果未显示)。选择相对最佳的疫苗接种程序用于分析比较重组菌pPG-T7g10-S1/L. paracasei 27-2、pPG-T7g10-S1/L. reuteri J31和pPG-T7g10-S1/L. johnsonii 6332诱导的免疫应答效果。对于肠道黏膜感染的病原,黏膜表面SIgA抗体水平是评价疫苗免疫效力和个体或畜群对肠道传染病感染的免疫状态。PEDV黏膜SIgA抗体检测广泛用于评估感染和疫苗对PEDV的免疫效果[24]。结果表明,3株重组菌均可显著诱导仔猪产生针对PEDV的特异性SIgA抗体,与其他2株重组菌相比,重组菌pPG-T7g10-S1/L. paracasei 27-2口服免疫仔猪后能诱导更高、更持续的黏膜SIgA抗体水平。
有研究表明,IgA+B细胞的分化及IgA的分泌与多种细胞因子相关[25]。其中IL-5能够刺激B细胞的增殖与分化,促进活化的B细胞分化成IgA+B细胞。IL-4能够促进特异的重链稳定区(CH)Ig类型的转换,增加SIgA的细胞数量增加。IL-6主要诱导活化后期的B细胞大量合成分泌性Ig的mRNA,从而增加Ig(IgM、IgG和IgA)的分泌。在肠道黏膜免疫中,IL-6 也可以协同IL-4、IL-5诱导SIgA+B细胞分化成为是SIgA+浆细胞,使其最终分化为SIgA[26]。TGF-β可介导初始 B 细胞分化发育成IgA+B细胞,并产生抗原特异性的高亲和力IgA。IL-21能够通过促进B细胞的增殖、浆细胞分化和IgA类别转换,最终提高IgA的分泌[27]。检测肠道细胞因子水平转录水平,结果显示,3株重组菌诱导的IFN-γ、IL-2、IL-4、IL-5、IL-6、IL-17、IL-21和TGF-β细胞因子水平均高于对照组;重组菌pPG-T7g10-S1/L. paracasei 27-2组IL-4、IL-6、IL-21、TNF-β、IL-17和APRIL显著高于其他组(P<0.05)。研究发现,抗原刺激机体时,B 细胞活化因子(BAFF)和增殖诱导配体(APRIL)的表达增加,可促进B细胞增殖,延长B细胞存活时间;同时,二者可诱导B细胞免疫球蛋白类别转换重组(CSR),使幼稚B细胞转化为IgA或IgG分泌的浆细胞,同时促进B细胞产生IgA[27-28]。本研究发现,3株重组菌均可显著促进肠道中APRIL和BAFF的表达,且pPG-T7g10-S1/L. paracasei 27-2组BAFF的表达显著高于其他组,可有效地促进B细胞的成熟和活化。IL-17是由Th17细胞合成并分泌的一种细胞因子,具有促炎和抗感染的作用[28-29]。在肠道炎症性疾病过程中可缓解肠道炎症的发病症状。有研究表明重组乳杆菌诱导的IL-17在全身和黏膜免疫应答中的表达,以防止TGEV感染[30]。同样,在本项研究中,本研究发现3株重组乳杆菌可以显著诱导仔猪肠黏膜中IL-17的表达,其中pPG-T7g10-S1/L. paracasei 27-2组更显著。推测这可能由于猪源副干酪乳酪杆菌具有较强的耐酸性及胆盐耐受性,其可能更多地存活并定植于仔猪肠道而更强地刺激仔猪肠道B细胞的增殖,并延长B细胞的存活时间,促进活化的B细胞分化成IgA+B细胞和IgA+浆细胞,提高仔猪肠道SIgA的分泌。
综上所述,本研究对表达PEDV S1蛋白的不同乳酸菌载体系统进行了与免疫相关的体外试验和猪体内免疫效力测定,综合比较发现,pPG-T7g10-S1/L. paracasei 27-2具有较强的抗酸、耐胆汁酸盐作用,口服免疫动物,能够更好地诱导机体的局部黏膜免疫、系统体液免疫和细胞免疫应答,该菌是作为口服疫苗载体良好的候选菌株。作为疫苗免疫效力的全面评价,应该进行动物的攻毒保护试验,这也是本项研究后续开展的重要工作。
4 结 论
本研究成功构建表达PEDV保护性抗原S1蛋白的3株猪源重组乳酸菌pPG-T7g10-S1/L. paracasei 27-2、pPG-T7g10-S1/L. reuteri J31和pPG-T7g10-S1/L. johnsonii 6332,经口服途径免疫仔猪后结果表明,3株重组菌均能够诱导仔猪产生特异性的黏膜免疫、体液免疫和细胞免疫应答,且重组猪源副干酪乳酪杆菌pPG-T7g10-S1/L. paracasei 27-2的效果更为显著,为口服疫苗候选菌株的选取奠定基础。
参考文献(References):
[1] JUNG K, SAIF L J, WANG Q H. Porcine epidemic diarrhea virus (PEDV):an update on etiology, transmission, pathogenesis, and prevention and control[J]. Virus Res, 2020, 286:198045.
[2] 万 进, 李 智, 陈学友, 等. 浅谈重要疫病对生猪产业的经济影响[J]. 中国动物检疫, 2023, 40(1):55-60.
WAN J, LI Z, CHEN X Y, et al. Discussion on the economic impact of major diseases on pig industry[J]. China Animal Health Inspection, 2023, 40(1):55-60. (in Chinese)
[3] 武旺盛. 两种猪流行性腹泻病毒S1亚单位疫苗的免疫原性[D]. 长春:吉林农业大学, 2020.
WU W S. Immunogenicity of two porcine epidemic diarrhea virus S1 subunit vaccines[D]. Changchun:Jilin Agricultural University, 2020. (in Chinese)
[4] LIN H X, ZHOU H, GAO L, et al. Development and application of an indirect ELISA for the detection of antibodies to porcine epidemic diarrhea virus based on a recombinant spike protein[J]. BMC Vet Res, 2018, 14(1):243.
[5] SUNGSUWAN S, JONGKAEWWATTANA A, JARU-AMPORNPAN P. Nucleocapsid proteins from other swine enteric coronaviruses differentially modulate PEDV replication[J]. Virology, 2020, 540:45-56.
[6] LI Y C, WU Q X, HUANG L L, et al. An alternative pathway of enteric PEDV dissemination from nasal cavity to intestinal mucosa in swine[J]. Nat Commun, 2018, 9(1):3811.
[7] ALOTAIBI B S, BUABEID M, IBRAHIM N A, et al. Recent strategies driving oral biologic administration[J]. Expert Rev Vaccines, 2021, 20(12):1587-1601.
[8] 王书博, 徐义刚, 陈秋艳, 等. 表达猪圆环病毒2型cap蛋白的重组罗伊氏乳酸杆菌在小鼠诱导的免疫应答分析[J]. 畜牧兽医学报, 2020, 51(9):2238-2249.
WANG S B, XU Y G, CHEN Q Y, et al. Analysis of immune response induced by recombinant Lactobacillus reuteri expressing cap protein of porcine circovirus type 2 in mice[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(9):2238-2249. (in Chinese)
[9] XIAO Y, WANG X N, LI Y, et al. Evaluation of the immunogenicity in mice orally immunized with recombinant Lactobacillus casei expressing porcine epidemic diarrhea virus S1 protein[J]. Viruses, 2022, 14(5):890.
[10] ZHAO Z L, WANG H, ZHANG D X, et al. Oral vaccination with recombinant Lactobacillus casei expressing Aeromonas hydrophila Aha1 against A. hydrophila infections in common carps[J]. Virulence, 2022, 13(1):794-807.
[11] MORAN N A, MCCUTCHEON J P, NAKABACHI A. Genomics and evolution of heritable bacterial symbionts[J]. Annu Rev Genet, 2008, 42:165-190.
[12] 李封赛. 表达猪轮状病毒VP4营养缺陷型乳杆菌的构建及其诱导免疫应答的研究[D]. 哈尔滨:东北农业大学, 2022.
LI F S. Construction and analysis of induced immune response of expressing VP4 of porcine rotavirus with the auxotrophic Lactobacillu[D]. Harbin: Northeast Agricultural University, 2022. (in Chinese)
[13] 肖 雅. 组成型表达猪流行性腹泻病毒保护性抗原S1重组乳酸菌的构建及其免疫原性分析[D]. 哈尔滨:东北农业大学, 2022.
XIAO Y. Construction and immunogenicity analysis of recombinant lactic acid bacteria constitutively expressing porcine epidemic diarrhea virus protective antigen S1[D]. Harbin: Northeast Agricultural University, 2022. (in Chinese)
[14] 陈妍卉, 刘军亭, 于 潜, 等. 重组细菌活载体疫苗研究进展[J]. 中国预防兽医学报, 2022, 44(2):219-224, 231.
CHEN Y H, LIU J T, YU Q, et al. Advances of recombinant live bacterial vector vaccine[J]. Chinese Journal of Preventive Veterinary Medicine, 2022, 44(2):219-224, 231. (in Chinese)
[15] TAKAHASHI T. Stimulation of the immune system by lactic acid bacteria[J]. Biosci Microflora, 2001, 20(1):1-8.
[16] ROCHA-RAMREZ L M, HERNNDEZ-CHIAS U, MORENO-GUERRERO S S, et al. Probiotic properties and immunomodulatory activity of Lactobacillus strains isolated from dairy products[J]. Microorganisms, 2021, 9(4):825.
[17] WANG X N, WANG L, HUANG X W, et al. Oral delivery of probiotics expressing dendritic cell-targeting peptide fused with porcine epidemic diarrhea virus COE antigen:a promising vaccine strategy against PEDV[J]. Viruses, 2017, 9(11):312.
[18] 聂民财, 岳健国, 邓益超, 等. 表达猪流行性腹泻病毒S1基因植物乳酸杆菌工程菌的免疫原性分析[J]. 生物工程学报, 2021, 37(8):2779-2785.
NIE M C, YUE J G, DENG Y C, et al. Immunogenicity of engineered Lactobacillus plantarum expressing porcine epidemic diarrhea virus S1 gene[J]. Chinese Journal of Biotechnology, 2021, 37(8):2779-2785. (in Chinese)
[19] EGELKROUT E, HAYDEN C, FAKE G, et al. Oral delivery of maize-produced porcine epidemic diarrhea virus spike protein elicits neutralizing antibodies in pigs[J]. Plant Cell Tissue Organ Cult, 2020, 142(1):79-86.
[20] 张 桢. 猪源乳酸杆菌安全性和抗逆性研究及其合生元制剂对小鼠溃疡性结肠炎的影响[D]. 南京:南京农业大学, 2020.
ZHANG Z. Thes safety and stress resistance of lactobacilli isolated from swine and the effect of its combination with prebiotics on ulcerative colitis in mice[D]. Nanjing: Nanjing Agricultural University, 2020. (in Chinese)
[21] 赵东方. 罗伊氏乳酸杆菌的分离鉴定及其抵抗仔猪感染F4+ETEC效果的分析[D]. 哈尔滨:东北农业大学, 2019.
ZHAO D F. Isolation and identification of Lactobacillus reuteri and its effection on F4+ETEC infection piglets[D]. Harbin:Northeast Agricultural University, 2019. (in Chinese)
[22] 李梦娇, 夏 东, 字正浩, 等. 二甲酸钾对仔猪直肠内乳酸杆菌和肠杆菌的影响[J]. 畜牧与兽医, 2015, 47(6):31-35.
LI M J, XIA D, ZI Z H, et al. Effect of dietary potassium diformate on population of Enterobacteria and Lactobacilli in rectum chyme of weaning piglets[J]. Animal Husbandry amp; Veterinary Medicine, 2015, 47(6):31-35. (in Chinese)
[23] 李金龙, 邓 欢, 刘金艳, 等. 益生菌大肠杆菌Nissle 1917抗逆性能、猪肠上皮细胞黏附率及抑菌效果研究[J]. 动物营养学报, 2017, 29(4):1241-1247.
LI J L, DENG H, LIU J Y, et al. Probiotics Escherichia coli Nissle 1917:stress resistance, swine intestinal epithelial cells adhesion rate and antimicrobial effects[J]. Chinese Journal of Animal Nutrition, 2017, 29(4):1241-1247. (in Chinese)
[24] 吕秀莉, 岳莹雪, 平丽筠, 等. 益生菌黏附机制及其拮抗肠道致病菌研究进展[J]. 食品科学, 2023, 44(9):313-320.
L X L, YUE Y X, PING L Y, et al. Research progress on the adhesion mechanism and antagonistic effects against intestinal pathogens of probiotics[J]. Food Science, 2023, 44(9):313-320. (in Chinese)
[25] 宫德正, 邹 原, 梅懋华. 肠粘膜免疫系统与细胞因子[J]. 大连医科大学学报, 2002, 24(1):56-60.
GONG D Z, ZOU Y, MEI M H. Intestinal mucosal immune system and cytokines[J]. Journal of Dalian Medical University, 2002, 24(1):56-60. (in Chinese)
[26] 曹晋宜, 韩军丽, 王友湘, 等. 瑞士乳杆菌对小鼠肠道黏膜和肠组织中细胞因子影响的研究[J]. 食品科学, 2009, 30(21):338-342.
CAO J Y, HAN J L, WANG Y X, et al. Effect of lactobacillus helveticus on cytokines in intestinal mucosa and tissue of mice[J]. Food Science, 2009, 30(21):338-342. (in Chinese)
[27] 刘 果. 猪流行性腹泻病毒诱导派伊尔结内T细胞依赖性IgA+B细胞分化的机制研究[D]. 兰州:中国农业科学院, 2020.
LIU G. Study on the differentiation mechanisms of T cell-dependent IgA+ B cell in Peyer’s patches induced by porcine epidemic diarrhea virus[D]. Lanzhou: Chinese Academy of Agricultural Sciences, 2020. (in Chinese)
[28] FAGARASAN S, KAWAMOTO S, KANAGAWA O, et al. Adaptive immune regulation in the gut:T cell-dependent and T cell-independent IgA synthesis[J]. Annu Rev Immunol, 2010, 28:243-273.
[29] HOU X Y, JIANG X P, JIANG Y P, et al. Oral immunization against PEDV with recombinant Lactobacillus casei expressing dendritic cell-targeting peptide fusing COE protein of PEDV in piglets[J]. Viruses, 2018, 10(3):106.
[30] JIANG X P, YU M L, QIAO X Y, et al. Up-regulation of MDP and tuftsin gene expression in Th1 and Th17 cells as an adjuvant for an oral Lactobacillus casei vaccine against anti-transmissible gastroenteritis virus[J]. Appl Microbiol Biotechnol, 2014, 98(19):8301-8312.
(编辑 孟 培)

