自然低温下23个青钱柳家系耐寒性评价



摘要:【目的】评价青钱柳(Cyclocarya paliurus)不同家系受自然低温胁迫后的耐寒性,筛选出耐寒能力强的家系,为青钱柳的引种、选育和栽培提供参考。【方法】以青钱柳23个家系的1年生枝条为研究材料,在自然低温胁迫后测定其相对电导率(REC),丙二醛(MDA)、可溶性糖(SS)、可溶性蛋白(SP)、淀粉(ST)和游离脯氨酸(Pro)含量,以及过氧化物酶(POD)、超氧化物歧化酶(SOD)活性等指标,并结合主成分分析、聚类分析等方法对不同家系青钱柳的耐寒性进行初步评价。【结果】自然低温胁迫后,23个家系的1年生枝条中相对电导率、过氧化物酶和超氧化物歧化酶活性,以及丙二醛、可溶性糖、可溶性蛋白、淀粉和游离脯氨酸含量等指标存在显著差异。主成分分析发现,4个主成分能够代表各项生理指标72.4%的信息。将各家系的主成分综合得分进行聚类分析,23个家系的耐寒性可分为3大类:第1类综合得分为1.208~1.284,耐寒性较强,仅包含2个家系(SCMC31和ZJTTS2);第2类综合得分为-0.343~0.631,耐寒性一般,包含GZSQ12、GXBS12、ZJFYS6、AHQLF8、HBWF10等17个家系;第3类综合得分为-1.259~-0.745,耐寒性较差,包含GZSQ9、ZJTTS3、SCMC22、SCMC30等4个家系。【结论】自然低温胁迫后,不同家系青钱柳1年生枝条的相关耐寒性生理指标差异显著,综合主成分分析和聚类分析结果,23个青钱柳家系在耐寒性上可以分为3大类。研究结果可为深入研究青钱柳耐寒机理及耐寒青钱柳家系(品种)的筛选提供参考。
关键词:青钱柳;家系;低温胁迫;主成分分析;生理指标;综合评价
中图分类号:S725;S718"""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)04-0085-08
An" evaluation" on the" cold tolerance of twenty-three" Cyclocarya paliurus families under natural low temperatures
ZHANG Zanpei1, GU Yueying1, SHANG Xulan1,2," WANG Ji1, 3, FANG Shengzuo1,2
(1. College of Forestry and Grassland, Nanjing Forestry University, Nanjing 210037, China; 2. Co-Innovation Center for"" Sustaniable Forestry in Southern China," Nanjing Forestry University, Nanjing 210037, China; 3. Nanjing Xiaozhuang University, Nanjing 210037, China)
Abstract: 【Objective】 To provide a theoretical basis for the introduction, selective breeding, and cultivation of Cyclocarya paliurus, the cold resistance of different families of C. paliurus under natural low temperature stress was evaluated. 【Method】 Using the current branches of C. paliurus from 23 families as materials, the" relative electric conductivity (REC), malondialdehyde (MDA) content, peroxidase (POD) activity, superoxide dismutase (SOD) activity, soluble sugar (SS), soluble protein (SP), starch (ST)" and free proline (Pro) content were determined after natural low temperature stress. A preliminary evaluation of the cold resistance of C. paliurus families was conducted through a principal component analysis (PCA) and cluster analysis. 【Result】 After natural low temperature stress, there were significant differences in the REC, MDA, POD and" SOD activity, SS, SP, ST" and Pro" content among the current branches of the 23 families. The PCA found that the four principal components represented 72.4% of the information regarding the various physiological indicators. A cluster analysis showed that the cold resistance of 23 families could be divided into three categories based on the comprehensive score of the PCA for each family. The first category" included only"" two families (SCMC31 and ZJTTS2) with the good cold resistance, and the compositive score ranging from 1.208 to 1.284. The second category indude 17 families (including GZSQ12, GXBS12, ZJFYS6, AHQLF8" and HBWF10) that exhibited moderate" cold resistance, with composite scores ranging from"" -0.343" to" 0.631. The third category included four families (GZSQ9, ZJTTS3, SCMC22, and SCMC30) with" poor" cold tolerance, with composite scores ranging from -1.259 to -0.745. 【Conclusion】 After natural low temperature stress, significant differences" in the measured physiological indices were observed between the" current branches of C. paliurus from different families (P lt; 0.05). Based on the PCA and cluster analysis results, there were"" different" cold resistances among the 23 Cyclocarya paliurus families, which could be divided into three categories. The results" not only" provide a basis for an in-depth study of the cold tolerate" mechanism of C. paliurus, but also for future" screening of" the" cold tolerate" genotypes of C. paliurus.
Keywords:Cyclocarya paliurus; family; low temperature stress; principal component analysis(PCA); physiological indicators; overall evaluation
青钱柳(Cyclocarya paliurus)是胡桃科青钱柳属乔木,为第四纪冰川期幸存树种,其天然林多零星分布于浙江、江西、江苏、安徽南部、湖北、湖南、四川、贵州、广西等地[1]。青钱柳树形高大,姿态优美,翅果似铜钱,具有良好的观赏价值[2]。据《中国中药志要》记载,其叶片有清热、解毒等止痛功能,民间常用其叶片做茶。不少学者先后从青钱柳叶中分离得到甜茶树苷A、青钱柳苷Ⅰ、青钱柳酸A和青钱柳酸B等生物活性成分[3-4]。已有研究结果表明,青钱柳多糖在甲状腺癌细胞的凋亡中可能发挥重要作用[5],青钱柳中类黄酮化合物能够作为抗菌剂和抗氧化剂用于医药、功能食品和天然化妆品中[6-7]。现有研究主要从分离技术、提纯方法、合成路径和药性药理等方面对青钱柳叶中生物活性成分进行了深入研究,而关于青钱柳耐寒性的研究鲜见报道。但近年来随着全球气候变化异常,极端天气日益频发,在实践中已经观察到南京种植的青钱柳出现冷害现象;另一方面,青钱柳天然林目前主要分布在亚热带地区,温带地区分布较少,南京地区现有青钱柳为人工栽培,是否能露地越冬是青钱柳引种成功的重要影响因素。因此,研究青钱柳的耐寒性很有必要。低温胁迫是限制植物生长主要非生物胁迫因素之一,低温胁迫发生时会导致细胞膜系统受到损伤,从而导致植物体内的渗透性物质以及酶活性发生变化[8]。在低温胁迫发生初期,植物通过增加脯氨酸、可溶性糖和可溶性蛋白等渗透性物质的含量,维持细胞内外渗透压平衡,起到保护细胞膜的作用,从而减缓低温对植物的伤害[9]。超氧化物歧化酶和过氧化物酶作为植物体内重要的保护性酶,当细胞膜受到伤害时,为了更快地清除植物体内的活性氧,维持细胞的正常形态,保护性酶活性会显著提高[10]。已有研究结果表明,桃(Prunus persica)[9]、月季(Rosa chinensis)[11]、葡萄(Vitis vinifera)[12-13]等的抗寒性与相对电导率、丙二醛及渗透性物质含量、保护性酶活性等生理指标关系密切。
为了解不同家系青钱柳的耐寒性,在推广中做到适地适家系,从现有的种质资源库中根据其生长状态和成活率选取23个家系作为研究材料,通过自然低温胁迫,测定其1年生枝条的相对电导率、过氧化物酶和超氧化物歧化酶活性,丙二醛、可溶性糖、可溶性蛋白、淀粉、游离脯氨酸含量等指标,比较各家系间生理指标的差异,同时结合主成分分析和聚类分析,对不同家系青钱柳的耐寒性进行初步评价,旨在为青钱柳耐寒家系的选育提供参考。
1 材料与方法
1.1 试验材料
23个青钱柳家系材料来自15个不同地点(103° 46′ 48″ ~ 121° 46′ 48″E,24° 27′36″~30°24′35″N),海拔为275~1 708 m。2014年10月从不同种源中选取优势木或亚优势木按单株采集种子(半同胞家系),经净种去翅、层积催芽、芽苗移栽和壮苗炼苗等过程,于2017年4月将各家系定植于江苏省青钱柳种质资源库(119°09′E,31°35′N)。经初步筛选后,每个家系定植株数为5~30株,定植株行距为2 m×3 m,定植后管理措施一致。用于研究的23个家系分别为安徽旌德1号(AHJD1)、安徽清凉峰3号(AHQLF3)、安徽清凉峰8号(AHQLF8)、安徽清凉峰16号(AHQLF16)、广西百色12号(GXBS12)、广西金钟山1号(GXJZS1)、贵州剑河15号(GZJH15)、贵州黎平4号(GZLP4)、贵州石阡9号(GZSQ9)、贵州石阡12号(GZSQ12)、湖北五峰10号(HBWF10)、湖北五峰15号(HBWF15)、四川沐川22号(SCMC22)、四川沐川30号(SCMC30)、四川沐川31号(SCMC31)、浙江凤阳山2号(ZJFYS2)、浙江凤阳山6号(ZJFYS6)、浙江龙王山3号(ZJLWS3)、浙江梅坞岭4号(ZJMWL4)、浙江商量岗9号(ZJSLG9)、浙江天童山2号(ZJTTS2)、浙江天童山3号(ZJTTS3)、浙江文成1号(ZJWC1)。
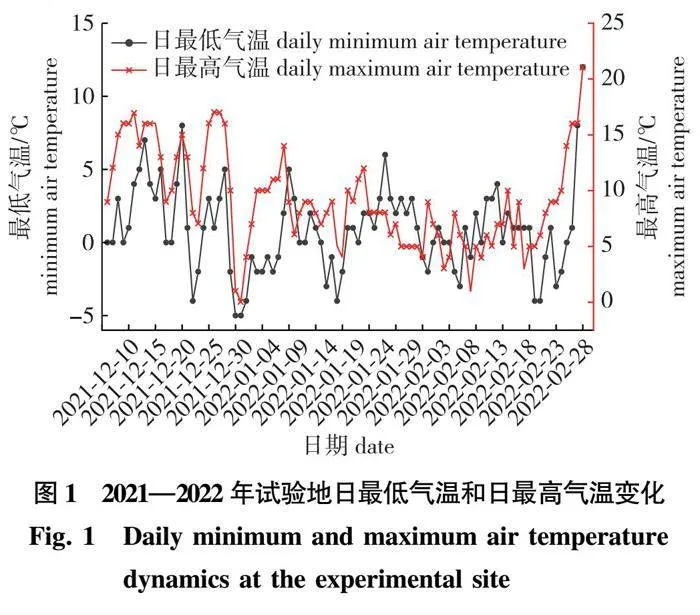
江苏省青钱柳种质资源库位于南京林业大学白马教学科研基地(119° 09′E,31°35′N),属亚热带季风气候,雨量充沛,四季分明,土壤为黄棕壤。2021年12月1日至2022年2月28日试验地日最低气温和日最高气温变化情况见图1(数据来源于http://lishi.tianqi.com/lishui2/index.html)。
1.2 研究方法
1.2.1 取样时间及方法
于2022年2月21日,在植株经历年度周期的自然低温胁迫后,从23个青钱柳家系中每个家系选取3~8株, 采集1年生枝条[枝条直径为(0.6 ± 0.1) cm,长度为10 ~ 15 cm],混合后放入自封袋带回实验室,置于4" ℃冰箱短暂贮藏备用。
1.2.2 指标测定
1)相对电导率测定。将枝条清洗干净后,除去表面水分,切成2 mm的薄片,称取0.5 g放入具塞试管中,并加入20 mL去离子水,抽取真空15 min后室温下测定浸出液电导率(R1),测试材料进行3组重复,R1测定结束后,将试管加上玻璃塞放入沸水浴中20 min,充分冷却后室温下测定浸出液电导率(R2)[14]。根据下列公式计算得到相对电导率(R)。
R= R1R2×100%。
2)丙二醛含量测定。丙二醛含量的测定使用新鲜样品,采用硫代巴比妥酸(TBA)显色法测定[15]。
3)酶活性测定。酶活性的测定采用新鲜样品,超氧化物歧化酶(SOD)活性测定使用氯化硝基四氮唑蓝(NBT)光化还原法,过氧化物酶(POD)活性测定使用愈创木酚法[16]。
4)渗透性物质含量测定。将样品充分烘干后进行渗透性物质含量的测定,可溶性糖含量和淀粉含量的测定采用蒽酮比色法[17],可溶性蛋白含量测定采用考马斯亮蓝G-250染色法[18],游离脯氨酸含量测定采用茚三酮比色法[19]。
1.2.3 耐寒能力综合性评价
采用主成分分析法综合各项指标进行抗寒性评价,各个家系综合得分(Y)的计算公式如下:
W= ∑ni=1Wi;(1)
Y=∑ni=1Wi×YiW。(2)
式中:Wi为第i个主成分的贡献率,W为主成分的总贡献率,Yi为第i个主成分的得分。
1.3 数据处理
使用IBM SPSS" 26.0对数据进行单因素方差分析,通过Duncan检验进行差异显著性分析。使用Excel 2010进行数据的整理。采用Origin 2019进行图表绘制。
2 结果与分析
2.1 不同青钱柳家系相对电导率和丙二醛含量的差异
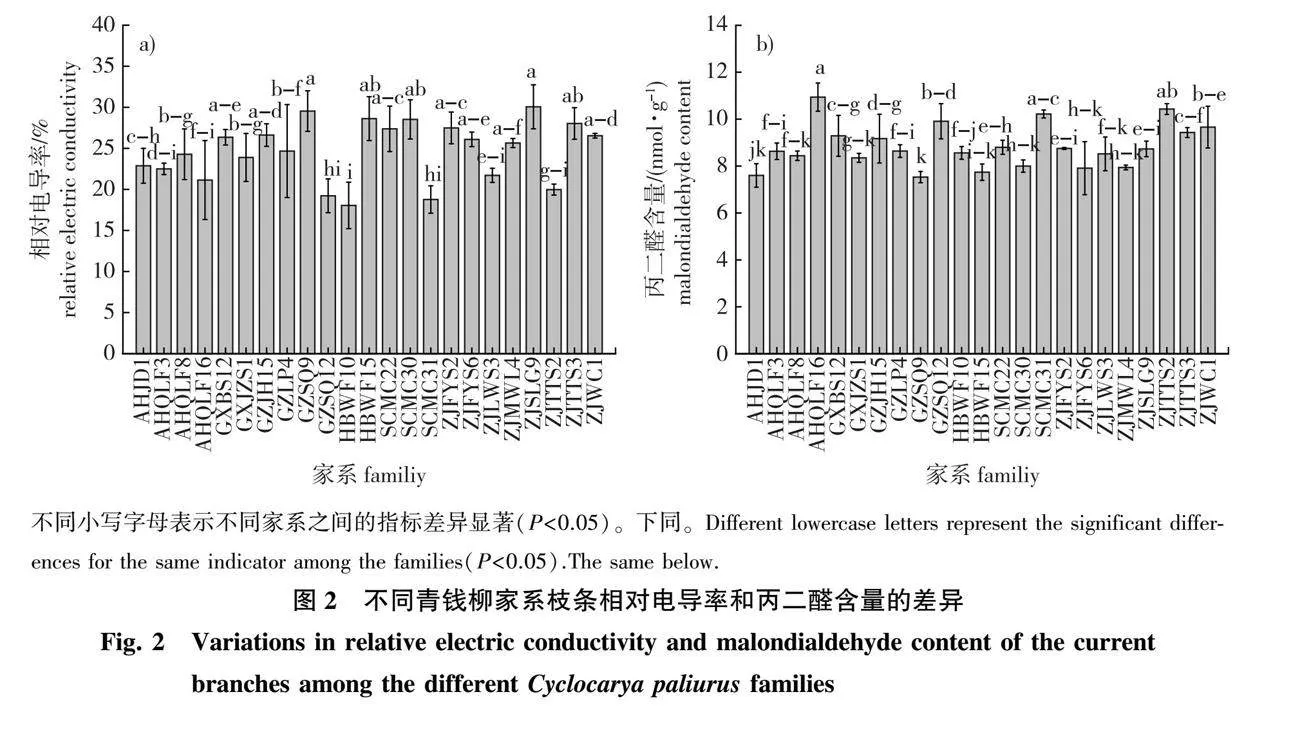
来自不同家系的青钱柳1年生枝条的相对电导率存在显著差异(P<0.05,图2a)。相对电导率分布在18.05%~30.06%,23个家系的相对电导率平均值为24.70%,HBWF10、SCMC31和GZSQ12等11个家系的相对电导率均低于平均值,表明其耐寒性可能强于GXBS12、ZJFYS6和ZJMWL4等12个家系。11个耐寒性较强的家系中有10个家系来源地的纬度高于27° 00′ 00″N,仅有GXJZS1的纬度低于25° 00′ 00″N,但其来源地海拔却高达1 700 m,表明青钱柳的耐寒性可能不仅与来源地纬度有关,还可能与其海拔有关。
膜脂过氧化的产物丙二醛是判断植物受损伤程度的重要指标之一,不同家系青钱柳枝条的丙二醛含量存在显著差异(P<0.05,图2b)。家系AHQLF16的丙二醛含量最高(10.22 nmol/g),GZSQ9的醛含量最低(7.53 nmol/g)。这表明自然低温胁迫后,AHQLF16膜脂过氧化程度高,细胞膜受到的伤害大于GZSQ9。根据膜脂过氧化程度判断,GZSQ9的耐寒性可能强于AHQLF16。
2.2 不同青钱柳家系保护酶活性的差异
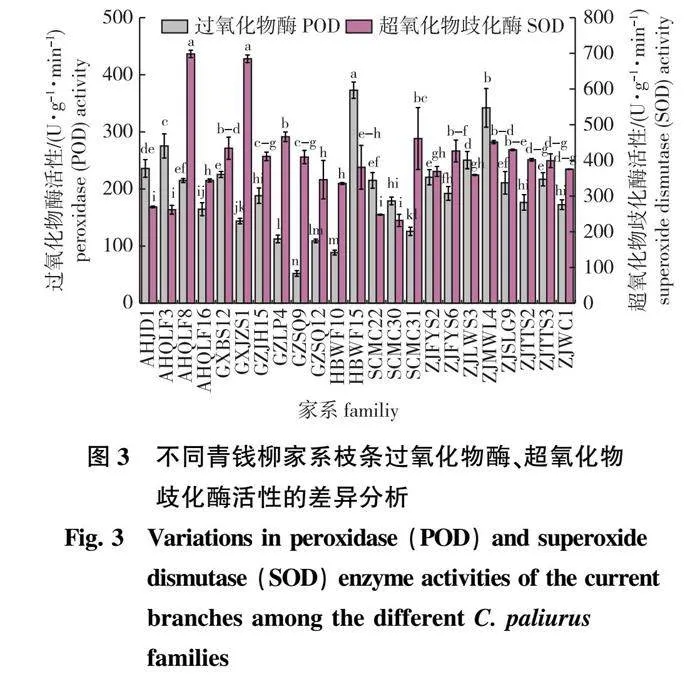
23个家系的POD酶活性结果如图3所示,含量最高的家系为HBWF15,是含量最低家系GZSQ9的7.17倍,表明HBWF15的耐寒性可能最强,GZSQ9的耐寒性可能最低。Duncan检验表明,除ZJTTS3、ZJFYS2和GXBS12之间,ZJSLG9、AHQLF8和SCMC22之间,ZJWC1、ZJTTS2、SCMC30和GZJH15之间差异不显著外,其他家系之间POD酶活性均有显著差异。
不同青钱柳家系的1年生枝条SOD酶活性有显著性差异(P<0.05,图3)。酶活性在231.79~698.34 U/(g·min)变化,其中AHQLF8的SOD酶活性最高,GXJZS1次之,SCMC30酶活性最低。说明在相同温度条件下AHQLF8清除能力强于SCMC30,家系AHQLF8的耐寒性可能强于SCMC30。
2.3 不同青钱柳家系渗透性物质含量的差异
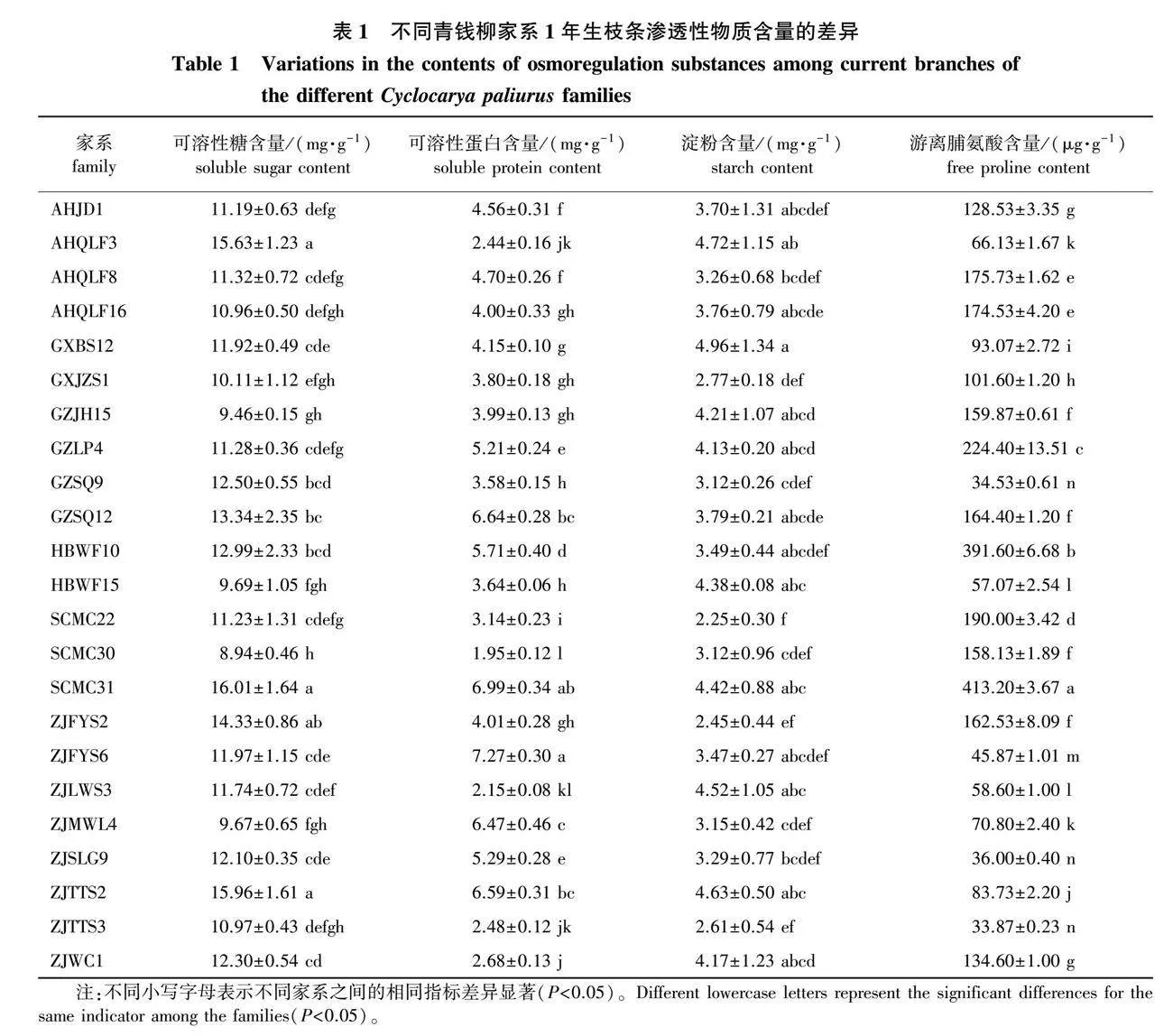
对23个不同家系的可溶性蛋白、可溶性糖、淀粉以及游离脯氨酸含量进行测定分析,对不同家系的相同指标进行单因素方差分析。结果(表1)表明,不同家系的可溶性蛋白、可溶性糖、淀粉和游离脯氨酸含量差异均达到显著水平(P<0.05)。
可溶性蛋白含量为1.95~7.27 mg/g,平均值为4.41 mg/g,其中10个家系可溶性蛋白含量高于平均值,按照可溶性蛋白含量从大到小排序为ZJFYS6gt; SCMC31gt; GZSQ12gt; ZJTTS2gt; ZJMWL4gt; HBWF10gt; ZJSLG9gt; GZLP4gt;AHQLF8gt;AHJD1,ZJFYS6的耐寒性可能最优。
23个家系可溶性糖含量的平均值为11.98 mg/g,其中SCMC31、AHQLF3和ZJTTS2等9个家系的可溶糖含量高于平均值,SCMC30、GZJH15和ZJMWL4等14个家系的含量低于平均值,表明SCMC31、AHQLF3和ZJTTS2等9个家系的耐寒性可能较强,其来源地纬度均大于27° 00′ 00″N,耐寒性可能是SCMC31gt;ZJTTS2gt;AHQLF3gt;ZJFYS2gt;GZSQ12gt;HBWF10gt;GZSQ9gt;ZJWC1gt;ZJSLG9。Duncan检验结果显示,SCMC31、AHQLF3和ZJTTS2之间可溶性糖含量无显著差异,但与其他20个家系差异显著。
23个家系的淀粉含量为2.25~4.96 mg/g,其中GXBS12的含量最高,是含量最低家系SCMC22的2.20倍,说明23个家系中GXBS12的耐寒性可能最强。Duncan检验结果显示,GXBS12和SCMC22淀粉含量与其他家系之间差异显著。
不同家系的游离脯氨酸含量分布为33.87~413.20 μg/g,23个家系中 SCMC31游离脯氨酸含量最高,是游离脯氨酸含量最低家系ZJTTS3的12倍,这表明同等条件下SCMC31受到的伤害大于ZJTTS3,23个家系中耐寒性相对最强的家系是ZJTTS3。
2.4 青钱柳家系抗寒性的综合评价
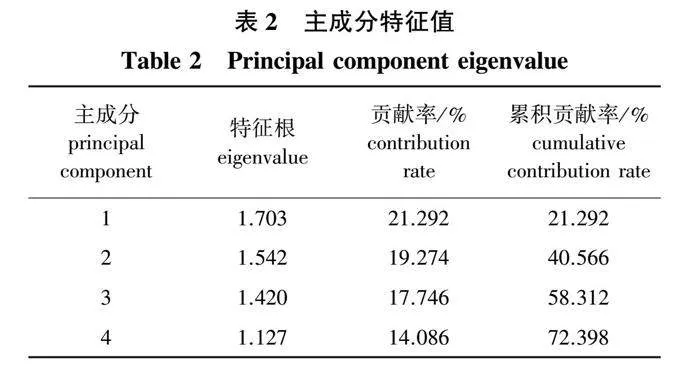
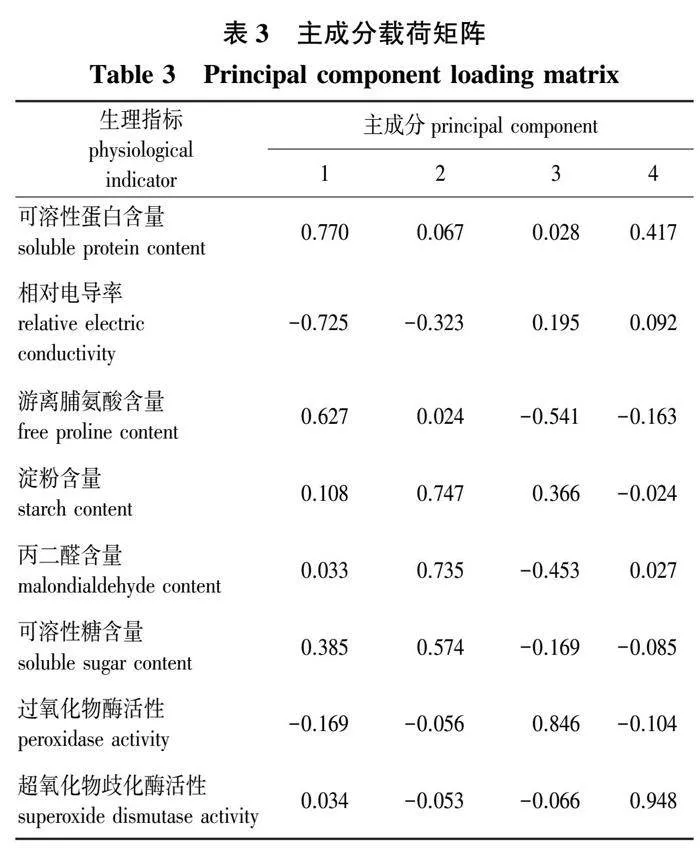
选取可溶性蛋白含量(X1)、相对电导率(X2)、游离脯氨酸含量(X3)、淀粉含量(X4)、丙二醛含量(X5)、可溶性糖含量(X6)、过氧化物酶含量(X7)和超氧化物歧化酶活性(X8)等8个能够反映青钱柳抗寒性的生理指标,经数据标准化后进行主成分分析,得到主成分特征值(表2)和主成分载荷矩阵(表3)。从表2、表3中可以看出,4个主成分能够代表各项生理指标72.398%的信息。主成分1的贡献率为21.292%,主要反映了可溶性蛋白、相对电导率、游离脯氨酸的贡献;主成分2的贡献率为19.274%,主要反映了淀粉、丙二醛、可溶性糖的贡献;主成分3主要反映过氧化物酶的贡献,贡献率为17.746%;主成分4贡献率为14.086%,主要反映了超氧化物歧化酶的贡献。
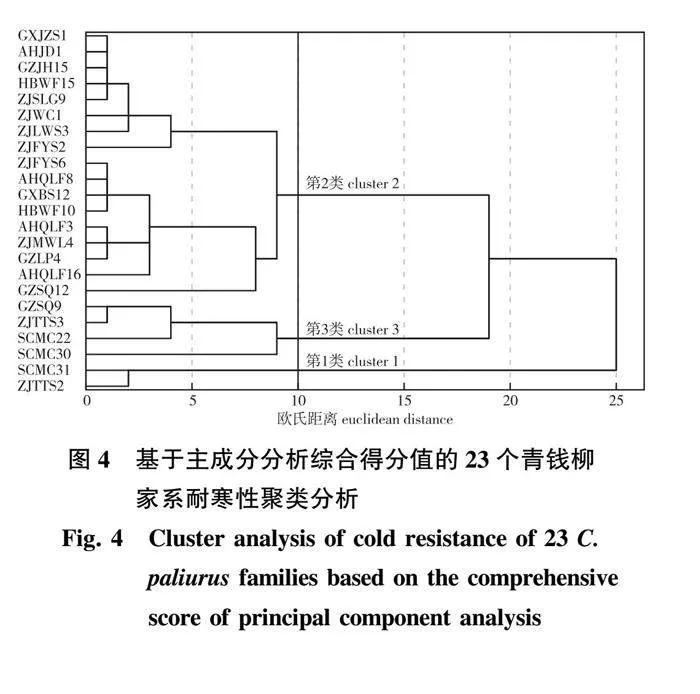
将公式(3)—(6)代入公式(2)中,可得到各个家系的综合得分。采用系统聚类法,将23个家系耐寒能力的综合得分进行聚类分析,得到聚类谱系图(图4),当欧氏距离为10时,按照耐寒性不同可初步划分为3类:
第1类,耐寒性较强,仅有2个家系(SCMC31和ZJTTS2),综合得分为1.208~1.284。
第2类,耐寒性一般,包括GZSQ12、GXBS12、ZJFYS6、AHQLF8、HBWF10、AHQLF3、ZJMWL4、GZLP4、AHQLF16、ZJLWS3、ZJSLG9、HBWF15、GXJZS1、AHJD1、GZJH15、ZJWC1、ZJFYS2等17个家系,综合得分为-0.343~0.631;第3类,耐寒性较差,包括GZSQ9、ZJTTS3、SCMC22、SCMC30等4个家系,综合得分为-1.259~-0.745。
3 讨 论
细胞膜是抵御温度胁迫的第一道防线,冷应激和热应激都能够改变细胞膜的流动性[20]。正常情况下,细胞膜具有一定的选择透过性,但当植株受到低温胁迫时,细胞膜的结构发生变化,细胞膜透性增大,导致组织浸泡液的电导率发生变化。丙二醛含量是判断逆境对细胞膜伤害度的重要指标[21],研究表明,在低温、干旱、盐渍、重金属等的胁迫下细胞的活性氧平衡被破坏,发生膜脂过氧化作用,导致丙二醛含量不断产生并积累,使膜系统受到损害[22-23]。因此,相对电导率和丙二醛含量均可用来表示植物的受伤害程度,且其受损害程度均与两者的含量成正比。低温不仅影响细胞膜结构,还能够改变细胞膜组分[24-25]。过氧化物酶和超氧化物歧化酶是植物体内重要的保护酶,当植物受到非生物胁迫时,其酶活性增强以提高清除自由基的能力。本研究结果表明,通过单一的相对电导率和单一的丙二醛含量对23个家系做出的耐寒性分析结果两者并不一致,而同一家系的过氧化物酶活性和超氧化物歧化酶的活性也不一致。可能是由于23个家系的来源地不尽相同,各家系母株生长的环境因子(如降雨量、空气湿度、海拔、光照强度等)对其遗传因子产生影响,使各家系的遗传性状有所差异,从而导致不同家系下的相同生理指标有显著性差异。
渗透调节物质一般包括环境中的无机离子(K+、Cl-、Na+等)和植物体内自身合成的无机物(可溶性糖、可溶性蛋白、脯氨酸等[26])。当低温来临时,植物体内淀粉等大分子物质会分解成可溶性糖,同时光合产物形成时直接转向低分子的可溶性糖[27-28]。在一定低温范围内,青钱柳1年生枝条中贮藏的淀粉等大分子营养物质可能会分解转化为葡萄糖、蔗糖等可溶性糖,从而提高自身耐寒性。在逆境条件下,游离脯氨酸一方面作为渗透物质能够保持渗透平衡且不会引起酶失活,另一方面能够增强蛋白质的水合作用[29]。但是可溶性糖含量最高的家系为SCMC31,可溶性蛋白含量最高的家系为ZJFYS6,淀粉含量最高的家系为GXBS12,游离脯氨酸含量最高的家系是SCMC31,这说明各种渗透性物质在抵御低温过程中,可能并不是简单地起到协同作用,因此不能单一采用某一种渗透性物质对耐寒性做出评价,与桃种质资源耐寒性评价[9]和月季耐寒性评价[12]等的研究相符。
目前,将半致死低温、主成分分析、聚类分析、隶属函数等方法进行结合能够对植物的耐寒性做出较为客观的评价,且在桃[9]、葡萄[13]、苹果(Malus domestica)[30-31]、核桃(Juglans regia)[32-34]等的应用中较为普遍。隶属函数需要明确了解青钱柳1年生枝条各生理指标与耐寒性之间的关系,由于本研究完全在自然条件下进行,因此选择将主成分分析和聚类分析结合的方法对其耐寒性进行综合评价。但是,逆境下植物的变化是多种多样的,不仅可以通过生理变化抵御不良生长环境,也可以通过调节生长发育,如萌发时间、生长速度、结实率,甚至衰老时间等增强抗性[35]。生长指标能够更直观地反映不同家系青钱柳抗寒能力的强弱,后续可以在整个年周期内对低温后不同家系青钱柳的生长情况进行观察与记录,将生理指标和生长指标结合,以便更好地应用于生产实践。
青钱柳抗寒性受到多种生理指标的共同作用,将主成分分析和聚类分析结合能够更好地解释其耐寒能力的强弱。通过对青钱柳种质资源库中23个家系耐寒性进行比较和综合评价,将其耐寒性分成3类,SCMC31、ZJTTS2耐寒性相对较强,这2个家系可在暖温带南部地区及高海拔(1 000 m以上)地区试种栽培;GZSQ12、GXBS12、ZJFYS6、AHQLF8、HBWF10、AHQLF3、ZJMWL4、GZLP4、AHQLF16、ZJLWS3、ZJSLG9、HBWF15、GXJZS1、AHJD1、GZJH15、ZJWC1、ZJFYS2等17个青钱柳家系耐寒性一般,适宜在亚热带及海拔1 000 m左右地区栽培,在暖温带南部种植越冬时需要采取一定的防寒措施;GZSQ9、ZJTTS3、SCMC22、SCMC30耐寒性相对较弱,适宜在与其自然分布相似的地区栽培,不宜引种推广到暖温带南部及高海拔地区。
参考文献(reference):
[1]谢明勇,谢建华.青钱柳研究进展[J].食品与生物技术学报,2008,27(1):113-121.XIE M Y,XIE J H.Review about the research on Cyclocarya paliurus (Batal.) Iljinskaja[J].J Food Sci Biotechnol,2008,27(1):113-121.DOI: 10.3321/j.issn:1673-1689.2008.01.021.
[2]方升佐,洑香香.青钱柳资源培育与开发利用的研究进展[J].南京林业大学学报(自然科学版),2007,31(1):95-100.FANG S Z,FU X X.Progress and prospects on silviculture and utilization of Cyclocarya paliurus resources[J].J Nanjing For Univ (Nat Sci Ed),2007,31(1):95-100.DOI: 10.3969/j.issn.1000-2006.2007.01.023.
[3]舒任庚,徐昌瑞,黎莲娘.青钱柳甜味成分的研究[J].药学学报,1995,30(10):757-761. SHU R G, XU C R, LI L N. Studies on the sweet principles from the leaves of Cyclocarya paliurus(Batal.)Iljinsk[J].Acta Pharm Sin,1995,30(10):757-761. DOI: 10.16438/j.0513-4870.1995.10.008.
[4]钟瑞建,高幼衡,徐昌瑞,等.青钱柳中五环三萜成分的研究[J].中草药,1996,27(7):387-388. ZHONG R J,GAO Y H, XU C R, et al.Pentacyclic triterpenoids from rounduing fruit Cyclocarya(Cycocarya paliurus)[J].Chin Tradit Herb Drugs,1996,27(7):387-388.
[5]HE Z W,LV F F,GAN Y L,et al.Anticancer effects of Cyclocarya paliurus polysaccharide (CPP) on thyroid carcinoma in vitro and in vivo[J].Int J Polym Sci,2018,2018:2768120.DOI: 10.1155/2018/2768120.
[6]HU W B,YANG Z W,WANG W J.Enzymolysis-ultrasonic assisted extraction of flavanoid from Cyclocarya paliurus (Batal.) Iljinskaja:HPLC profile,antimicrobial and antioxidant activity[J].Ind Crops Prod,2019,130:615-626.DOI: 10.1016/j.indcrop.2019.01.027.
[7]ZHANG L,ZHANG Z J,FANG S Z,et al.Integrative analysis of metabolome and transcriptome reveals molecular regulatory mechanism of flavonoid biosynthesis in Cyclocarya paliurus under salt stress[J].Ind Crops Prod,2021,170:113823.DOI: 10.1016/j.indcrop.2021.113823.
[8]DING Y, SHI Y, YANG S. Advances and challenges in uncovering cold tolerance regulatory mechanisms in plants[J]. New Phytol, 2019, 222(4): 1690-1704. DOI: 10.1111/nph.15696.
[9]权威, 薛文通, 赵天瑶, 等. 植物对低温胁迫的响应机制研究进展[J].中国农业大学学报, 2023, 28(2): 14-22. QUAN W, XUE W T, ZHAO T Y, et al. A review on the response mechanism of plant to low temperature stress[J]. J China Agric Univ, 2023, 28(2): 14-22. DOI: 10.11841/j.issn.1007-4333.2023.02.02.
[10]刘紫烟, 刘佳乐, 朱圆圆, 等. 木本植物低温应答机制研究进展[J].西北林学院学报, 2022, 37(2): 157-163. LIU Z Y, LIU J L, ZHU Y Y, et al. Research process on the the response mechanism of woody plants to low temperature[J]. J Northwest For Univ, 2022, 37(2): 157-163. DOI: 10.3969/j.issn.1001-7461.2022.02.21.
[11]牟开萍,李维芳,杨文新,等.20个月季品种的抗寒性综合评价[J].草原与草坪,2021,41(6):58-66.MOU K P,LI W F,YANG W X,et al.Comprehensive evaluation on the cold resistance of 20 Rosa chinensis cultivars[J].Grassland Turf,2021,41(6):58-66.DOI: 10.13817/j.cnki.cyycp.2021.06.009.
[12]刘钰玺,陈佰鸿,马宗桓,等.河西走廊酿酒葡萄砧木抗寒性综合评价[J].甘肃农业大学学报,2020,55(6):86-96.LIU Y X,CHEN B H,MA Z H,et al.Comprehensive evaluation of cold resistance of grape rootstock in Hexi Corridor[J].J Gansu Agric Univ,2020,55(6):86-96.DOI: 10.13432/j.cnki.jgsau.2020.06.011.
[13]何伟,艾军,范书田,等.葡萄品种及砧木抗寒性评价方法研究[J].果树学报,2015,32(6):1135-1142.HE W,AI J,FAN S T,et al.Study on evaluation method for cold resistance of grape cultivars and rootstock[J].J Fruit Sci,2015,32(6):1135-1142.DOI: 10.13925/j.cnki.gsxb.20150150.
[14]ZHOU W J,LEU L M.Uniconazole-induced alleviation of freezing injury in relation to changes in hormonal balance,enzyme activities and lipid peroxidation in winter rape[J].Plant Growth Regul,1998,26(1):41-47.DOI: 10.1023/A:1006004921265.
[15]赵世杰,许长成,邹琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.ZHAO S J,XU C C,ZOU Q,et al.Improvement of determination method of malondialdehyde in plant tissues[J].Plant Physiol Commun,1994,30(3):207-210.DOI: 10.13592/j.cnki.ppj.1994.03.016.
[16]AMAKO K,CHEN G X,ASADA K.Separate assays specific for ascorbate peroxidase and guaiacol peroxidase and for the chloroplastic and cytosolic isozymes of ascorbate peroxidase in plants[J].Plant Cell Physiol,1994,35(3):497-504.DOI: 10.1093/oxfordjournals.pcp.a078621.
[17]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:196-197.LI H S.Principles and techniques of plant physiological biochemical experiment[M].Beijing:Higher Education Press,2000:196-197.
[18]GIANNOPOLITIS C N,RIES S K.Superoxide dismutases:I.Occurrence in higher plants[J].Plant Physiol,1977,59(2):309-314.DOI: 10.1104/pp.59.2.309.
[19]ABRAHM E,HOURTON-CABASSA C,ERDEI L,et al.Methods for determination of proline in plants[J].Methods Mol Biol,2010,639:317-331.DOI: 10.1007/978-1-60761-702-0_20.
[20]DING Y L,YANG S H.Surviving and thriving:how plants perceive and respond to temperature stress[J].Dev Cell,2022,57(8):947-958.DOI: 10.1016/j.devcel.2022.03.010.
[21]SUZUKI N,KOUSSEVITZKY S,MITTLER R,et al.ROS and redox signalling in the response of plants to abiotic stress[J].Plant Cell Environ,2012,35(2):259-270.DOI: 10.1111/j.1365-3040.2011.02336.x.
[22]NADARAJAH K K.ROS homeostasis in abiotic stress tolerance in plants[J].Int J Mol Sci,2020,21(15):5208.DOI: 10.3390/ijms21155208.
[23]DRAPER H H,HADLEY M.Malondialdehyde determination as index of lipid Peroxidation[M]//Oxygen Radicals in Biological Systems Part B:Oxygen Radicals and Antioxidants.Amsterdam:Elsevier,1990:421-431.DOI: 10.1016/0076-6879(90)86135-i.
[24]徐亚军,赵龙飞,邢鸿福,等.内生细菌对盐胁迫下小麦幼苗脯氨酸和丙二醛的影响[J].生态学报,2020,40(11):3726-3737.XU Y J,ZHAO L F,XING H F,et al.Effects of endophytic bacteria on proline and malondialdehyde of wheat seedlings under salt stress[J].Acta Ecol Sin,2020,40(11):3726-3737.DOI: 10.5846/stxb201802060309.
[25]GONG Z Z,XIONG L M,SHI H Z,et al.Plant abiotic stress response and nutrient use efficiency[J].Sci China Life Sci,2020,63(5):635-674.DOI: 10.1007/s11427-020-1683-x.
[26]HUANG Z,ZHAO N,QIN M F,et al.Mapping of quantitative trait loci related to cold resistance in Brassica napus L[J].J Plant Physiol,2018,231:147-154.DOI: 10.1016/j.jplph.2018.09.012.
[27]PONTIS H G.Fructans and cold stress[J].J Plant Physiol,1989,134(2):148-150.DOI: 10.1016/s0176-1617(89)80047-1.
[28]GUY C L,HUBER J L,HUBER S C.Sucrose phosphate synthase and sucrose accumulation at low temperature[J].Plant Physiol,1992,100(1):502-508.DOI: 10.1104/pp.100.1.502.
[29]YAMADA M,MORISHITA H,URANO K,et al.Effects of free proline accumulation in petunias under drought stress[J].J Exp Bot,2005,56(417):1975-1981.DOI: 10.1093/jxb/eri195.
[30]李晓龙,褚燕南,张磊,等.苹果花期抗寒能力判定指标解析[J].果树学报,2022,39(10):1935-1944.LI X L,CHU Y N,ZHANG L,et al.Analysis of evaluation indexes of cold resistance of apple trees at flowering stage[J].J Fruit Sci,2022,39(10):1935-1944.DOI: 10.13925/j.cnki.gsxb.20210704.
[31]张博,刘立强,秦伟,等.新疆野苹果抗寒生理生化机制研究[J].经济林研究,2021,39(4):60-68.ZHANG B,LIU L Q,QIN W,et al.Study on physiological and biochemical mechanism of cold resistance of Malus sieversii[J].Non Wood For Res,2021,39(4):60-68.DOI: 10.14067/j.cnki.1003-8981.2021.04.008.
[32]韩立群,马凯,丁军伟,等.低温处理下新疆野生核桃的生理响应及抗寒性评价[J].西北林学院学报,2019,34(5):98-101,126.HAN L Q,MA K,DING J W,et al.Physiological response and evaluation of cold resistance of Xinjiang wild walnut under low temperature stress[J].J Northwest For Univ,2019,34(5):98-101,126.DOI: 10.3969/j.issn.1001-7461.2019.05.15.
[33]吴硕,贾彦丽,智福军.低温胁迫下核桃枝条抗寒性综合评价[J].林业与生态科学,2020,35(3):314-319.WU S,JIA Y L,ZHI F J.Comprehensive evaluation of cold resistance of walnut branches under low temperature stress[J].For Ecol Sci,2020,35(3):314-319.DOI: 10.13320/j.cnki.hjfor.2020.0042.
[34]王一峰,赵淑玲,王瀚,等.不同核桃种质展叶期抗寒性的综合评价[J].经济林研究,2019,37(1):50-60.WANG Y F,ZHAO S L,WANG H,et al.Comprehensive evaluation on cold resistance of different walnut germplasms at leaf-expansion period[J].Non Wood For Res,2019,37(1):50-60.DOI: 10.14067/j.cnki.1003-8981.2019.01.008.
[35]WISNIEWSKI M,NASSUTH A,TEULIRES C,et al.Genomics of cold hardiness in woody plants[J].Crit Rev Plant Sci,2014,33(2/3):92-124.DOI: 10.1080/07352689.2014.870408.
(责任编辑 吴祝华)
收稿日期Received:2022-08-12""" 修回日期Accepted:2023-02-02
基金项目:江苏省重点研发计划(现代农业)重点项目(BE2019388);江苏省研究生科研与实践创新计划项目(KYCX23_1215)。
第一作者:张赞培(zhangzanpei@njfu.edu.cn),博士生。
*通信作者:方升佐(fangsz@njfu.edu.cn),教授。
引文格式:张赞培,谷月营,尚旭岚,等. 自然低温下23个青钱柳家系耐寒性评价[J]. 南京林业大学学报(自然科学版),2024,48(4):85-92.
ZHANG Z P, GU Y Y, SHANG X L, et al. An" evaluation" on the" cold tolerance of twenty-three" Cyclocarya paliurus families under natural low temperatures[J]. Journal of Nanjing Forestry University (Natural Sciences Edition),2024,48(4):85-92.
DOI:10.12302/j.issn.1000-2006.202208024.

