模拟氮沉降对杨树人工林土壤跳虫群落的影响


摘要:【目的】土壤跳虫(弹尾纲物种)在调节土壤生态系统功能方面发挥着重要作用。本研究旨在了解添加氮对杨树人工林土壤跳虫群落结构的影响,为进一步明晰人工林生态系统土壤动物群落对未来大气氮沉降的响应与适应机制提供理论参考。【方法】在江苏省东台林场的杨树人工林中建立样地,通过人工林施氮肥的方式模拟大气氮沉降,设置N0(对照,不施氮肥)和3个模拟氮沉降处理,施氮水平分别为N5[5 g/(m2·a)]、N15[15 g/(m2·a)]、N30[30 g/(m2·a)],每个施氮水平设置4个重复,共16块样地。于2021—2022年的春季(4月)、夏季(7月)、秋季(10月)和冬季(1月),用取样框采集凋落物层土壤跳虫,后采用不同直径的土钻分3层,即采集[0,10)、[10,25)、[25,40) cm土壤层跳虫和土壤样品。样品带回实验室后用干漏斗法(Tullgren法)收集跳虫并分析土壤理化性质,最后用SPSS 26和Canoco 5.0进行统计分析。【结果】研究共捕获跳虫1 446只,隶属于4目7科18属,优势种群分属等节跳属(Isotoma)、鳞跳属(Toocerus)、长跳属(Entomobrya)和小等跳属(Isotomiella),4属共占总个体数的66.87%。土壤跳虫的个体数在N15处理时显著增加,N30处理时则减少;不同层次中,凋落物层的跳虫个体数显著高于土壤层;在不同季节,跳虫的个体数总体从大到小呈现为秋>夏>春>冬。土壤跳虫Shannon-Wiener多样性指数在N15处理最高,Pielou均匀度指数基本在N30处理最高。RDA分析表明,土壤pH、硝态氮含量和碳氮比是影响土壤跳虫分布的主要环境因子。【结论】氮沉降会显著影响土壤跳虫的群落组成结构,并表现出一定的季节差异;适度的氮添加能增加跳虫的个体数和多样性,而过量的氮添加则导致跳虫个体数减少。
关键词:杨树;人工林;氮添加;土壤动物;弹尾纲;群落结构;群落多样性
中图分类号:S718.5"""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)04-0243-11
Effects of nitrogen addition on soil springtail(Collembolan) community in a poplar plantation
WANG Zimeng1, RUAN Honghua1*, WU Xiaoqiao2, YANG Yan2, XIE Youchao2, SHEN Caiqin3, DING Xuenong3, CAO Guohua3
(1.Co-Innovation Center for Sustainable Forestry in Southern China, College of Ecology and Environment, Nanjing Forestry University, Nanjing 210037, China; 2. Forestry Bureau of Jiangsu Province, Nanjing 210036, China; 3.Dongtai State Forest Farm of Jiangsu Province, Dongtai 224200, China)
Abstract: 【Objective】 Springtail(Collembolan species), as a kind of microarthropods widely distributed in soils, plays an important role in regulating the functions of soil ecosystems. However, the effects of nitrogen deposition on springtail communities in soils are poorly understood. This study aimed to elucidate the effects of nitrogen addition on springtail communities in soils by simulating nitrogen deposition for 10 years in a poplar plantation in Dongtai Forest Farm, Jiangsu Province. 【Method】 Four experimental treatments with different concentrations of nitrogen addition, i.e., the control (N0,No nitrogen addition), N5[5 g/(m2·a)], N15[15 g/(m2·a)], and N30[30 g/(m2·a)], were established in May 2012, respectively. A total of four replicate plots were prepared for each treatment, thus accounting for a total of 16 sample plots. The springtail communities in the litter and soil layers were analyzed in July 2021, October 2021, January 2022, and April 2022. The springtails in the litter layer were collected using a collection frame. Springtail samples were collected using soil drills with different diameters from the three soil layer at depths of 0 (floormas), 10 and 25 cm, respectively. Following transportation to the laboratory, the springtails were collected according to the Tullgren method, and the physical and chemical properties of the soil were analyzed. Statistical analysis was performed using SPSS 26 and Canoco 5.0. 【Result】 A total of 1 446 springtails, belonging to 4 Orders, 7 Families, and 18 Genera, were collected in this study. Of these, the Isoma, Toocerus, Entomobrya and Folsomia genera were the most abundant and accounted for 66.87% of the total number of individuals. The number of springtails in the soil increased significantly at a nitrogen concentration of 15 g/(m2·a), but decreased at a concentration of 30 g/(m2·a). The number of springtails in litter layer was significantly higher than that in the soil layer. The number of individuals varied across the seasons, in the following order: October (autumn) gt; July (summer) gt; April (spring) gt; January (winter). The Shannon-Wiener diversity index and Simpson dominance index were highest in the 15 g/(m2·a) treatment group, whereas the Pielou evenness index was highest for the 30 g/(m2·a) treatment group. The results of RDA analysis demonstrated that the pH, nitrate nitrogen content, and the C/N were the primary environmental factors that affected the distribution of springtails in the soil, and that different springtail populations responded differently to the environmental factors. 【Conclusion】The results demonstrated that nitrogen deposition affected the composition of the springtail community in the soil. The findings further revealed that the application of nitrogen within a moderate concentration might increase the number and diversity of springtails; however, the excessive addition of nitrogen may reduce the number of springtails, thus indicating a threshold effect.
Keywords:poplar; plantation; nitrogen addition; soil fauna; Collembola; community structure; community diversity
日益增加的大气氮(N)沉降已对全球生物多样性和生态系统功能构成严重威胁[1]。研究表明,全球人类活动产生的活性氮,在2005年已增加到187 Tg[2]。氮沉降可能在未来几十年进一步增加,在全球造成日益严重的生态问题[3]。过多的大气氮沉降对森林生态系统结构和功能产生显著影响[4],对我国不同的森林生态系统均造成了重大影响[5]。绝大部分沉降氮最终会进入土壤生态系统之中[6],而土壤动物多样性是生态系统生物多样性的重要组成部分,氮沉降也会对土壤动物产生影响。由于土壤动物物种丰富,体型微小,研究难度大,通常少受关注[7]。弹尾纲(Collembola)物种(即跳虫)是一种土栖微型节肢动物[8],对环境变化非常敏感,已被作为环境变化的重要指标[9]。例如,跳虫被证明是高寒草地生态系统酸化和山地森林空气污染物影响的生物指标[10],通常被认为遵循r策略并快速响应环境变化[11]。此外,跳虫被证明对有机质分解过程有显著影响,不仅直接取食有机物,而且还通过改变微生物活动和运输细菌或真菌繁殖体间接影响分解过程[7]。
目前,有关氮沉降对生态系统跳虫群落特征的影响研究中,Yang等[12]发现在氮添加下亚热带湿地森林跳虫数量显著增加;Mcglynn等[13]发现在氮添加下的热带雨林森林中,跳虫数量无显著变化;而Kelly等[14]发现在氮添加下亚热带常绿阔叶林中,跳虫因食物资源质量变差而数量减少。因此,不同森林生态系统土壤环境复杂多样,氮添加对土壤跳虫的影响也有所差异。
第九次全国森林资源清查结果显示,我国人工林面积7 954.28万hm2,居世界首位[15],其中杨树人工林面积超过850万hm2 [16]。杨树是世界中纬度地区广泛栽培的工业用材树种和行道树,具有生长快、成材早、产量高和易于更新等特点,且大多数能够进行无性繁殖,发展杨树产业是解决中国木材短缺的有效途径。目前,关于跳虫群落对大气氮沉降的响应的研究还很有限,对人工林生态系统的研究更是鲜见报道。本研究探讨在人工模拟氮沉降条件下杨树人工林土壤跳虫群落组成的动态变化,为进一步研究土壤动物群落对未来大气氮沉降的响应与适应机制提供理论参考。
1 材料与方法
1.1 研究区概况及样地设置
试验地位于江苏省盐城市东台市国有林场(120°07′E,32°33′N),地处暖温带向北亚热带的过渡地带,为海洋性季风气候。年平均气温达14.6" ℃,年平均相对湿度88.3%,无霜期约225 d,年均降水量约1 050 mm,年平均日照约2 200 h,10" ℃以上年积温4 565" ℃。土壤类型为脱盐草甸土,质地为砂质壤土。林场土地面积2 800 hm2,其中有林地面积2 186 hm2,活立木蓄积量14.8万 m3,森林覆盖率85%,乔木林主要是杨树(Populus sp.)、水杉(Metasequoia glyptostroboides)、银杏(Ginkgo biloba)等人工林。林下灌木主要为构树(Broussonetia papyrifera)和桑树(Morus alba)等。林下草本植物主要有矮小沿阶草(Ophiopogon bodinieri)、一年蓬(Erigeron annuus)、阿拉伯婆婆纳(Veronica persica)、葎草(Humulus scandens)、加拿大一枝黄花(Solidago canadensis)、乌蔹莓(Causonis japonica)等。
1.2 样地设置及土壤样品采集
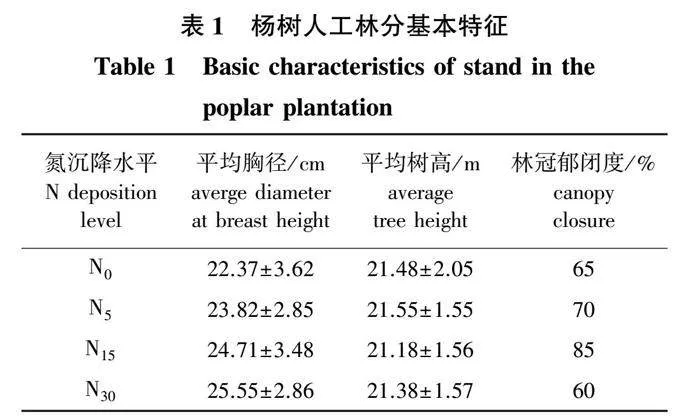
选取立地条件和经营管理措施基本一致的杨树人工林作为试验地(林分年龄为8 a),采用随机区组设计,设置4个重复固定样区(区组),样区大小为30 m×190 m。每个样区随机设置4种施氮沉降处理样地(面积为25 m×30 m),共计16块样地。样地之间保留10 m宽的缓冲带。参考同类研究和大气氮沉降的相关研究[17-19],采用人工施氮肥的方式模拟大气氮沉降。于2012年始生长季(5—10月)的每个月进行不同水平的施氮肥(有效成分NH4NO3)处理,4个施氮处理水平分别为:对照(N0,不施氮)、低氮[N5,5 g/(m2·a)]、高氮[N15,15 g/(m2·a)]和超高氮[N30,30 g/(m2·a)]。将年施氮量均匀分成6等份,在生长季每月中旬,将各水平处理所需NH4NO3溶解在20 L水中,均匀喷施入样地,对照样地喷洒等量水,各处理林分的基本特征见表1。
于2021年7月(夏)、10月(秋),2022年1月(冬)、4月(春)进行采样,在每一个样地内按照“S”形取样法选取4个采样点(4个样点的样品混合形成1个样地的样品),分别采集用于调查凋落物跳虫、土壤跳虫以及测定土壤理化性质的样品:
1)凋落物层土壤跳虫样品采集。将1个30 cm×30 cm的取样框(上面覆盖孔径为0.425 mm的筛网防止跳虫逃逸)扣于地表,迅速将取样框内地表凋落物装入自封袋封存。共计采集64个样品:4(样地)×4(季节)×4(重复),用于调查凋落物层的土壤跳虫。
2)土壤层土壤跳虫样品采集。用直径50 mm的土钻分3层取样,深度分别为[0,10)、[10,25)、[25,40) cm。共计采集192个土壤样品:4(样地)×4(季节)×3(土层)×4(重复),用于调查不同土壤层次的土壤跳虫。
3)土壤理化分析样品采集。用直径38 mm的土钻取样。共计采集192个土壤样品:4(样地)×4(季节)×3(土层)×4(重复),用于测定土壤理化性质。
所有样品装入PE自封袋、并编号,收集好后带回实验室用于后续测定分析。
1.3 跳虫分离与鉴定
土壤跳虫样品用改良的干漏斗装置(Tullgren Funnel Unit,BURKARD,UK)进行分离,在15 W的白炽灯下放置48 h,用75%(体积分数)酒精收集保存跳虫样本。用显微镜(LEICA M205A,Germany)进行镜检,将跳虫分类到科,再鉴定到属。鉴定主要参考《中国土壤动物检索图鉴》[20]和世界跳虫名录网站(https://www.Collembolan.org/)等。
1.4 土壤理化性质分析
将采集的土壤样品带回实验室,手动挑拣去除样品中的植物根系和石块等杂物,将风干的土壤样品后自然风干,分别过孔径为0.85 mm和0.15 mm的筛网,编号并用PE自封袋装好保存。
采用试验用水为超纯水并去除CO2,以V(水)∶m(土)=2.5∶1.0,运用酸度计(PHS-2F,上海雷磁)进行pH测定,每个土样做3次重复,求平均值;土壤含水率(WC)采用鲜土烘干法测定[21];土壤硝态氮(NO-3-N)和铵态氮(NH+4-N)的含量测定采用紫外分光光度法[22]测定;可溶性有机碳(DOC)含量的测定采用TOC分析仪(TOC-L,日本岛津);碳氮比(C/N)、有机碳(SOC)、全氮(TN)含量采用元素分析仪(Elementar Vario Macro Cube,德国)测定,在测定SOC前,先用0.1 mol/L的盐酸对土壤样品进行酸处理以去除其中的无机碳。
1.5 数据分析
土壤跳虫种群数量等级划分:个体数量占总捕获数量≥10%时为优势种群;占(1%,10%)时为常见种群;占(0,1%]时为稀有种群[23]。
跳虫群落多样性特征主要采用Shannon-Wiener多样性指数(H′)、Simpson优势度指数(D)和Pielou均匀度指数(J)来计算。计算公式如下:
H′=-∑Si=1PilnPi,(1)
D=1-∑Si=1P2i,(2)
J=H′/lnS。(3)
式中:S为单元样方中的所有属数;Pi为第i属的个体数占样方中总个体数的比率。
使用重复测量方差分析(Repeated ANOVA)对氮沉降和土壤层次、季节间的差异进行检验。使用单因素方差分析(One-way ANOVA)对跳虫的数量特征和种群特征的指数进行统计分析,采用LSD法进行多重比较。对于不服从正态分布的数据,进行log(x+1)对数转换。统计分析使用SPSS" 26软件,显著性水平为α= 0.05,最后在Origin 2019b软件中绘制图表。使用Canoco 5.0软件进行RDA冗余分析。
2 结果与分析
2.1 添加氮对土壤跳虫种群总体数量与组成的影响
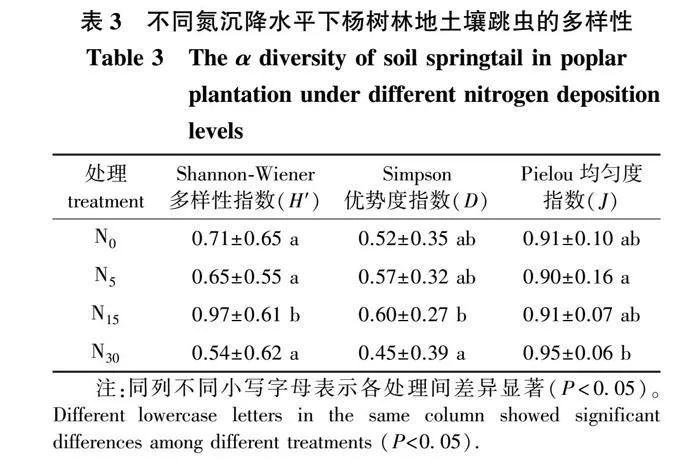
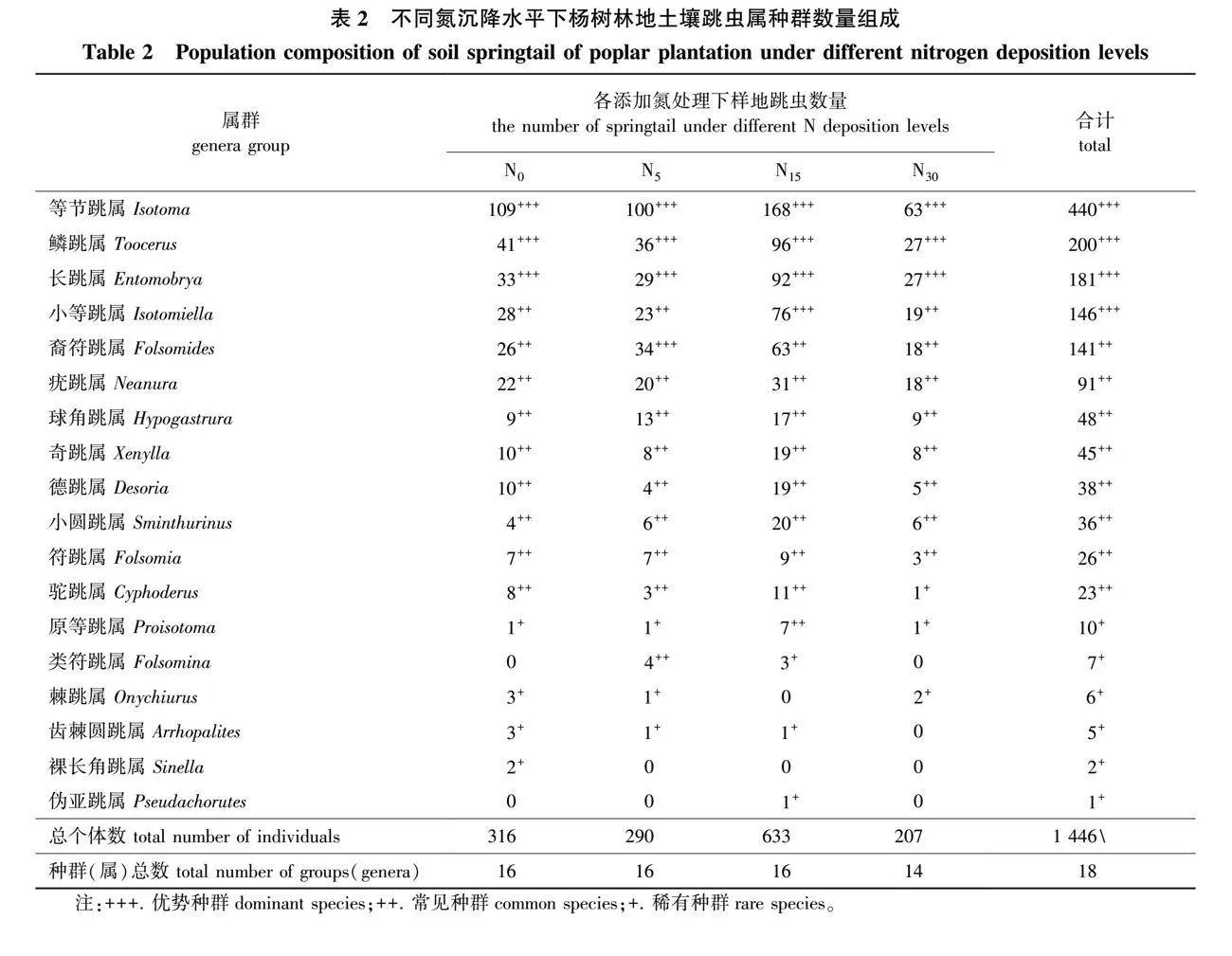
本次研究共分离出土壤跳虫1 446只,隶属于4目7科18属。不同氮沉降水平下的样地跳虫种群及数量组成见表2,其中优势种群共4属,分别为等节跳属(Isotoma)、鳞跳属(Toocerus)、长跳属(Entomobrya)和小等跳属(Isotomiella),共占总个体数的66.87%。稀有种群共6属,为原等跳属(Proisotoma)、类符跳属(Folsomina)、棘跳属(Onychiurus)等。其余8个种群,如:裔符跳属(Folsomides)、疣跳属(Neanura)等均为常见种群。不同氮沉降水平样地的跳虫个体数占比分布从大到小为:N15(43.78%)> N0(21.85%)> N5(20.06%)> N30(14.32%)。从属分类等级来看,等节跳属、鳞跳属和长跳属在4个氮沉降水平样地均为优势种群。
N15处理样地跳虫Shannon-Wiener多样性指数(H′)最高(表3),与其他处理存在显著差异(Plt;0.05);N15与N30处理跳虫Simpson优势度指数(D)差异显著;但多重比较结果显示,N15的优势度指数显著高于N30。添加氮处理对跳虫Pielou均匀度指数(J)也不显著(N5与N30除外)。但多重比较结果表明,N30的均匀度指数显著高于N5N5处理跳虫Pielou均匀度指数(J)显著高于N30处理(表3)。
2.2 添加氮对土壤跳虫种群个体数的影响
2.2.1 土壤跳虫个体数随土层的变化
在凋落物层,共分离土壤跳虫13个属,占总个体数的63.69%。优势种群为等节跳属、鳞跳属和长跳属,所占比例分别达到33.44%、15.31%和14.44%。
在[0,10) cm土层共分离土壤跳虫17个属299只,占总个体数的20.68%。优势种群为等节跳属、鳞跳属和小等跳属,所占比例分别达到28.43%、14.72%和10.03%。在[10,25) cm土层共分离土壤跳虫219只,共15个属,占总个体数的15.11%。优势种群为等节跳属、裔符跳属、鳞跳属和小等跳属,所占比例分别达到28.43%、13.70%、12.79%和10.96%。在[25,40) cm土层共分离土壤跳虫166只,共17个属,占总个体数的11.48%。优势种群为等节跳属、小等跳属、裔符跳属和长跳属,所占比例分别达到25.90%、13.86%、13.86%和11.45%。此外,棘跳属、齿棘圆跳属、伪亚跳属、类符跳属和裸长角跳属都只在土壤层分布。
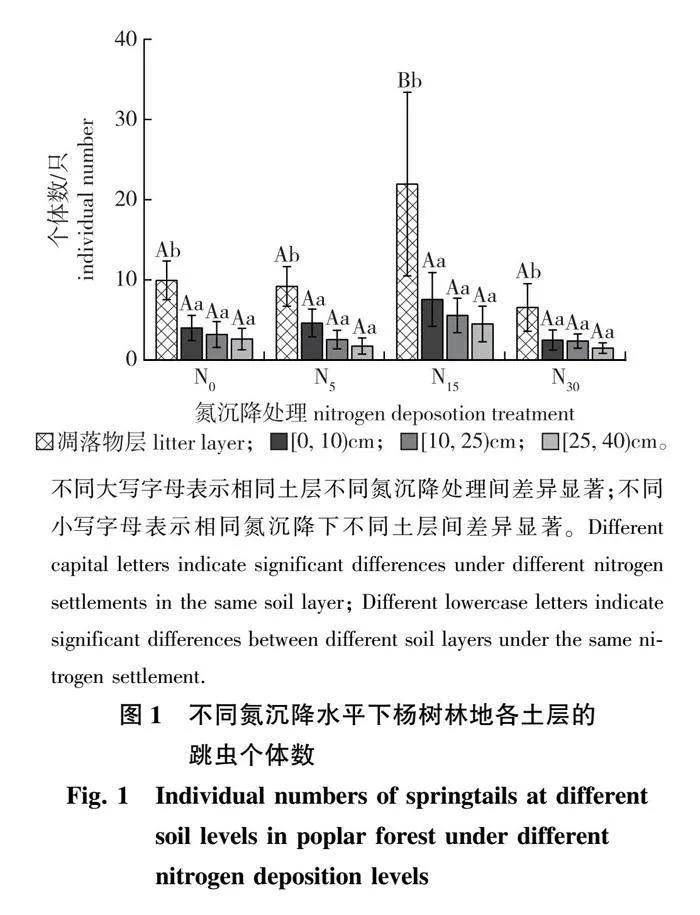
凋落物层土壤跳虫个体数均显著高于土壤层(Plt;0.05)。在凋落物层,随着氮沉降的上升,N5处理水平与N0相比,跳虫个体数量略有减少,而N15处理水平的跳虫个体数则显著高于N0,至N30处理时又下降。在土壤层,随着土壤深度的增加,不同氮沉降下的土壤跳虫个体数均呈现下降趋势,但这种下降趋势并不显著(图1)。以季节作为重复,对跳虫的个体数分别做重复测量方差分析显示,跳虫的个体数在凋落物层和土壤层间均有显著差异(Plt;0.05)。
2.2.2 土壤跳虫个体数的季节变化
在夏季共分离土壤跳虫359只,共13个属,占总个体数的24.83%。优势种群为等节跳属、鳞跳属、长跳属、小等跳属和裔符跳属,所占比例分别达到36.21%、16.43%、15.04%、11.98%和10.31%。在秋季共分离土壤跳虫488只,共15个属,占总个体数的33.75%。优势种群为等节跳属、长跳属和小等跳属,所占比例分别达到39.96%、14.55%和10.45%。在冬季共分离土壤跳虫299只,共14个属,占总个体数的20.06%。优势种群为等节跳属、小等跳属、疣跳属和裔符跳属,所占比例分别达到22.76%、13.79%、12.07%和10.69%。在春季共分离土壤跳虫309只,共16个属,占总个体数的21.37%。优势种群为鳞跳属、等节跳属和长跳属,所占比例分别达到27.51%、15.86%和10.68%。
总体来看,随着氮处理水平的上升,N15时跳虫个体数量增多,至N30时又下降,说明跳虫对N15水平敏感度较大(图2)。发现不同氮沉降下的跳虫数量变化的季节动态为:从春季到冬季总体呈现先下降后上升的趋势。同一季节不同添加氮沉降下的跳虫数量变化的趋势为:随着氮沉降的提高,跳虫数量总体呈现上升趋势,直到N30水平梯度时下降到比N0的数量还少。这表明适量的添加氮会使跳虫数目增多,过量的添加氮会导致跳虫数目减少。
在不同季节背景下跳虫的总个体数以10月(秋)>7月(夏)>4月(春)>1月(冬)。在春季、夏季和冬季,个体数总体表现以N15水平最多,N30水平最少。秋季采样中,N5水平个体数最少,N15水平最多。以土壤层次作为重复,对跳虫的个体数分别做重复测量方差分析,结果显示,跳虫的个体数在秋季和冬季之间均有显著差异(Plt;0.01)。
2.3 添加氮对土壤跳虫种群多样性的影响
2.3.1 不同土层的土壤跳虫多样性特征
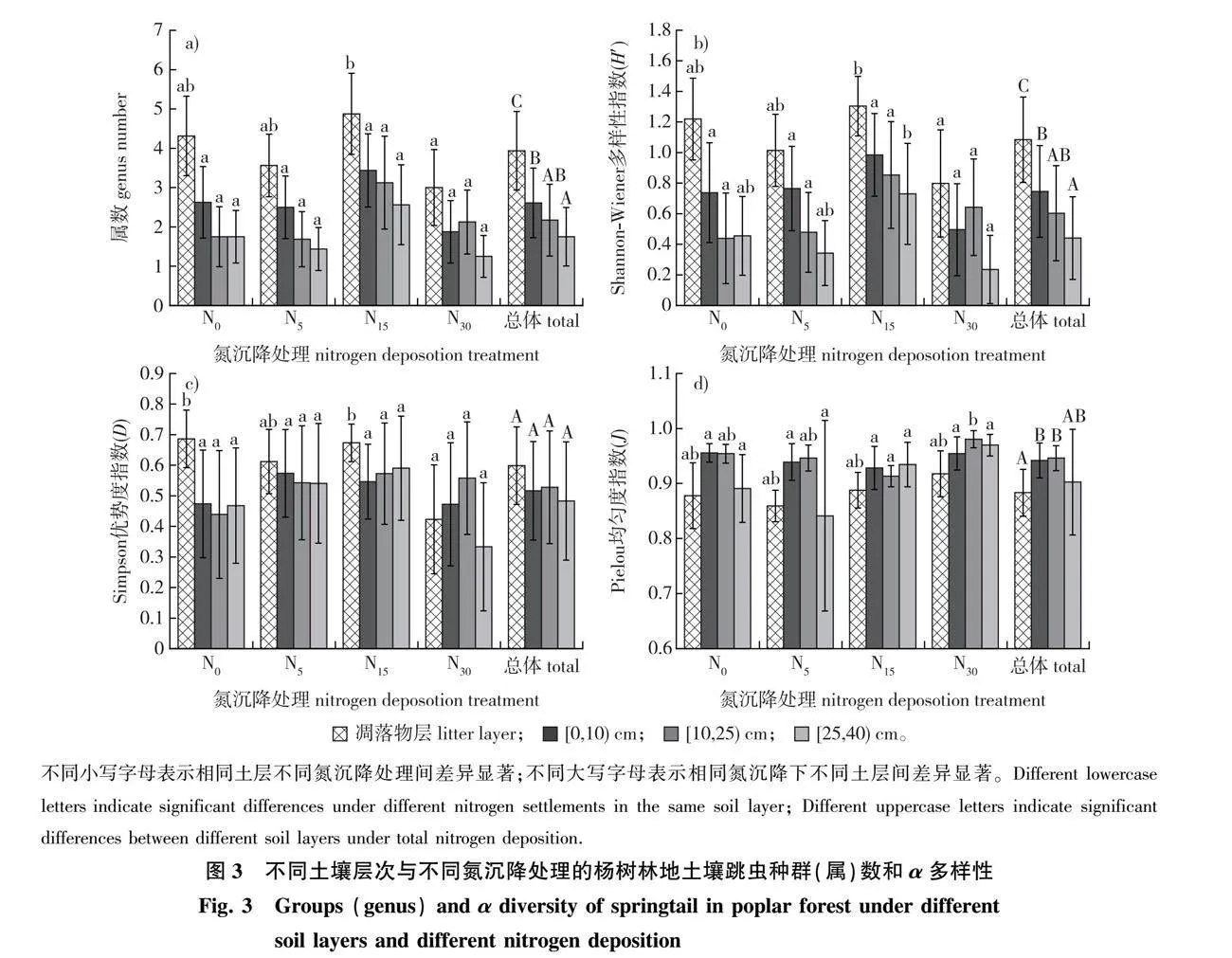
经分析,凋落物层的跳虫种群(属)数显著多于土壤层(Plt;0.05)。凋落物层中跳虫种群(属)数在N15水平最多,N15和N30之间有显著差异(Plt;0.05)。总体上,在各土壤层,跳虫种群数在[0,10) cm土壤层最多,[0,10) cm与[25,40) cm土壤层之间有显著差异(Plt;0.05)。不同的土壤层次,跳虫种群数均在N15水平最多,不同氮沉降之间没有显著差异(图3a)。
凋落物层的跳虫Shannon-Wiener多样性指数显著高于土壤层(Plt;0.05)(图3b)。在凋落物层,N15水平的跳虫Shannon-Wiener多样性指数最高,N15和N30水平间存在显著差异(Plt;0.05);跳虫Simpson优势度指数在N0和N30水平间存在显著差异(Plt;0.05);跳虫Pielou均匀度指数在不同氮沉降水平之间也无显著差异(图3d)。总体上,[0,10) cm土层的跳虫Shannon-Wiener多样性指数最高,且显著高于[25,40) cm土层(Plt;0.05),[0,10) cm土壤层和[10,25) cm土壤层在不同氮沉降处理下的跳虫Shannon-Wiener多样性指数均无显著差异,在[25,40) cm土层中,N15 水平处理显著高于N30(Plt;0.05)。跳虫Simpson优势度指数在各土层之间无显著差异,在相同土层不同氮沉降之间也无显著差异。跳虫Pielou均匀度指数在各土壤层之间无差异显著,[0,10)和[25,40) cm土层在不同氮沉降处理下均无显著差异,仅在[10,25) cm土层中,N15和N30水平间存在显著差异(图3c)。
2.3.2 不同季节的土壤跳虫多样性特征
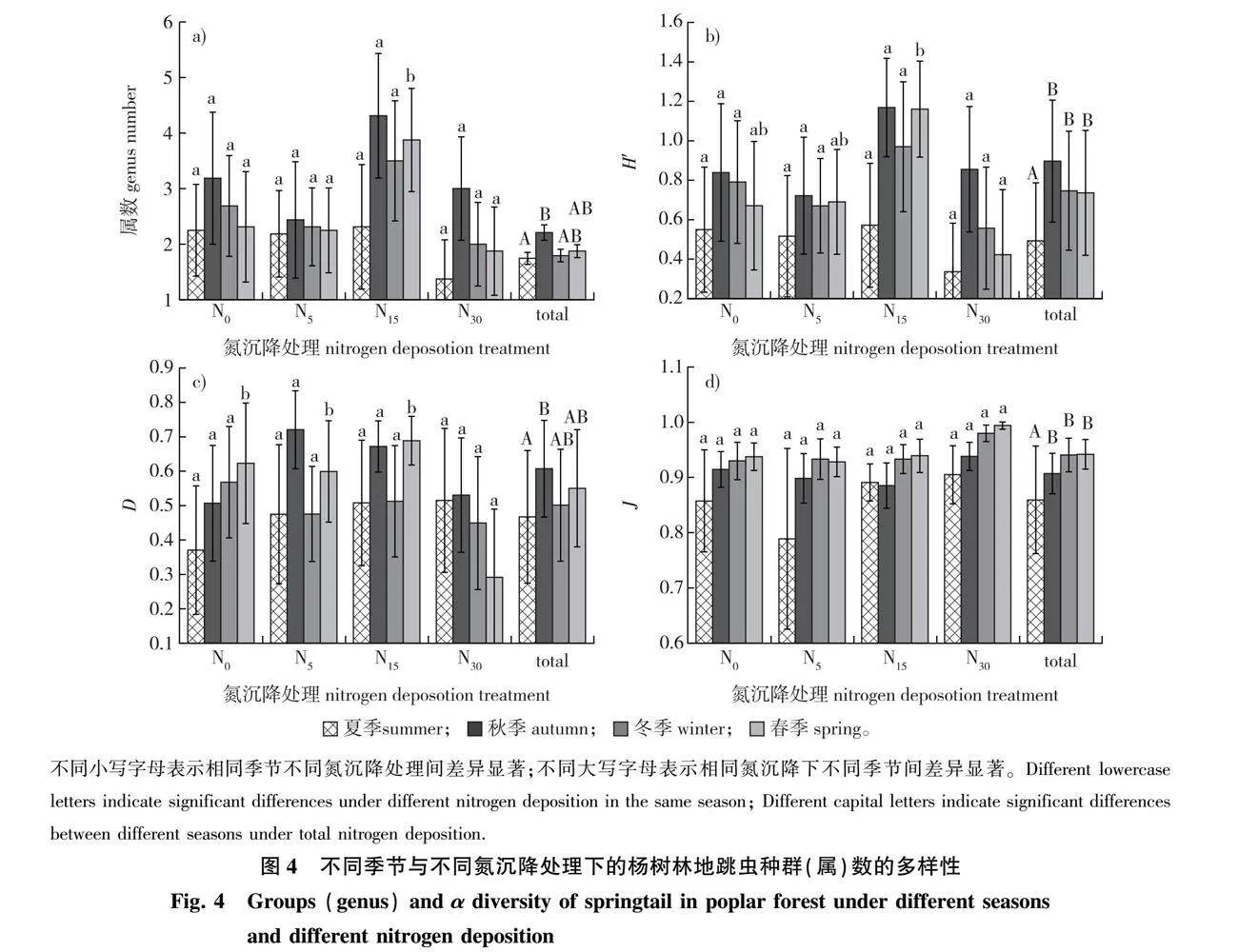
秋季跳虫种群(属)数显著多于夏季(Plt;0.05)。夏、秋和冬季的跳虫种群数在不同氮沉降之间没有显著差异,春季的跳虫种群数在N15水平下显著高于其他水平(Plt;0.05)(图4a)。
夏季土壤跳虫Shannon-Wiener多样性指数显著低于其他季节(Plt;0.05),秋、冬和春季之间无显著差异(图4b)。夏、秋和冬季的跳虫Shannon-Wiener多样性指数在不同氮沉降之间没有显著差异,但在春季,N15水平最高,显著高于N30水平(Plt;0.05)。跳虫Simpson优势度指数在夏季和秋季之间差异显著(Plt;0.05),秋、冬和春季之间无显著差异(图4c)。夏、秋和冬季的跳虫Simpson优势度指数在不同氮沉降之间没有显著差异,但在春季,N30水平显著低于其他水平(Plt;0.05)。夏季跳虫Pielou均匀度指数显著低于其他季节(Plt;0.05),秋、冬和春季之间无显著差异(图4d)。不同季节跳虫的Pielou均匀度指数在不同氮沉降之间均没有显著差异(图4)。
2.4 影响土壤跳虫种群的因子分析
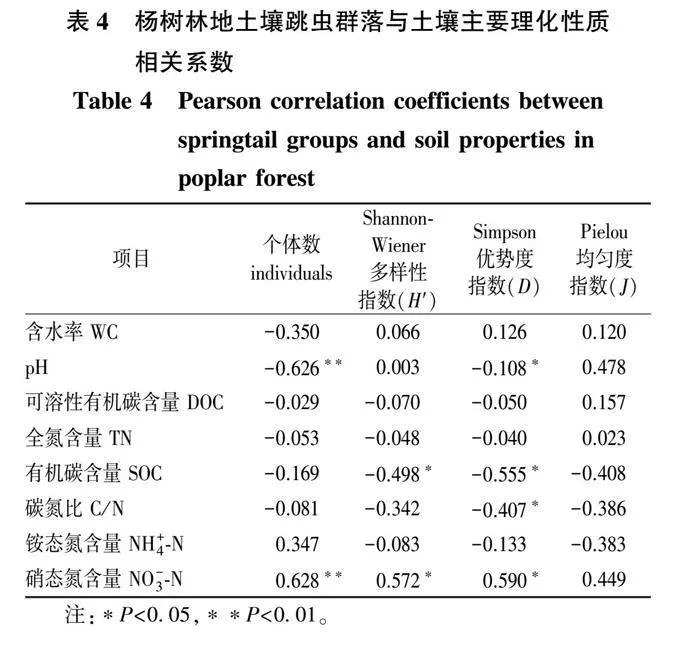
对土壤跳虫群落与土壤主要理化性质进行Pearson相关系数分析,结果(表4)可知,跳虫个体数与土壤 pH存在极显著负相关(Plt;0.01,与土壤硝态氮含量极显著正相关);跳虫Shannon-Wiener多样性指数(H′)与土壤有机碳含量存在显著负相关(Plt;0.05),与硝态氮含量显著正相关(Plt;0.05)与土壤硝态氮含量显著正相关;跳虫Simpson优势度指数(D)与土壤 pH和碳氮比,以及有机碳含量呈显著负相关(Plt;0.05),这与土壤占有态氮含量显著正相关(Plt;0.05);而跳虫Pielou均匀度指数与各土壤理化性质相关性均不显著(Pgt;0.05)。
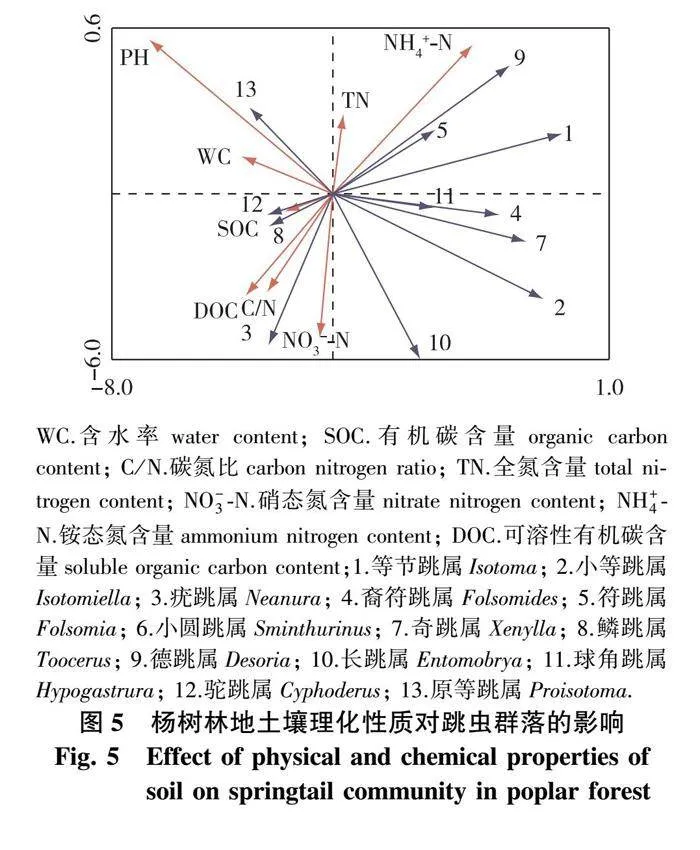
对土壤跳虫群落进行消除趋势对应分析(DCA),结果显示排序轴梯度长度(LGA)小于3,适用于线性模型(即RDA分析),共筛选出8个环境因子包括土壤含水率、有机碳含量、碳氮比、全氮含量、硝态氮含量、铵态氮含量、可溶性有机碳含量和pH。由图5可知,pH、硝态氮含量和碳氮比对土壤跳虫群落的解释率共达到54.2%,且均达到显著水平(Plt;0.05),可以认为是影响土壤跳虫数目的主要环境因子。pH与大部分土壤跳虫的个体数呈显著负相关,例如优势种群等节跳属和长跳属等。而优势种群鳞跳属和常见种群驼跳属、原等跳属的个体数随pH的下降而下降,呈显著正相关关系;跳虫优势种群鳞跳属和长跳属与土壤硝态氮含量和碳氮比呈现显著正相关,而跳虫优势种群等节跳属与土壤硝态氮含量和碳氮比呈现显著负相关。
3 讨 论
本研究表明适量水平的氮添加会使跳虫数目增多,而过量的氮添加会导致跳虫数目减少。这一结果与Xu等[24]在欧洲森林生态系统的研究结论基本一致;但宋敏[25]在草地生态系统的研究显示,添加氮对土壤跳虫的数量没有显著影响,这显示不同生态系统添加氮对跳虫的影响不一致。
1)研究发现,N15处理下对跳虫的个体数和多样性指数均高于其他处理。N15处理下的土壤有机碳和全氮含量均为最低,pH和C/N相对较低,且硝态氮含量显著高于N0和N5处理,所以本样地的添加氮达到15 g/(m2·a)时,跳虫Shannon-Wiener多样性指数和Simpson优势度最高。适度添加氮整体上有利于土壤跳虫的生长。李曾燕等[26]发现,土壤动物数量的变化主要取决于其中优势种群的消长。本实验中,随着添加氮处理水平的上升,pH随之下降,跳虫的优势种群等节跳属、长跳属和小等跳属的个体数显著增多,从而整体上增加了土壤跳虫的数目。土壤pH下降会导致土壤中硝化细菌的活性升高[27],矿化速率降低[28],利于微生物发展和有机质分解。添加氮处理的土壤硝态氮含量显著高于对照样地,这有利于微生物的生长[29],促进有机物分解。土壤C/N是土壤质量的敏感指标,通常被看作是土壤氮素矿化的标志,本研究中添加氮处理降低了土壤C/N,利于提升凋落物质量水平[30],加快土壤有机质的分解速度[31],促进有机物质的积累,从而为跳虫提供了一定食物资源,进而使跳虫的数量上升。随着添加氮处理水平的上升,土壤有机碳和全氮的含量也随之增加。林英华等[32]在农田生态系统进行长期定位施肥的研究中发现,土壤有机碳和全氮含量对跳虫个数影响较大,具有正向作用。
2)当添加氮达到30 g/(m2·a)时,跳虫的数量低于对照,产生了消极影响,说明氮添加量存在阈值效应[33]。影响跳虫个体数的因素有正效应因素,例如可利用氮增加、微生物生物量碳增加导致凋落物质量提高等,以及负效应因素,例如pH的降低、N/P 提高导致凋落物质量变差等[34]。本试验中,添加氮可能是通过影响土壤理化性质从而影响土壤跳虫群落。虽然添加氮对土壤跳虫整体上表现为积极作用,但过量的添加氮,尤其是长期超高氮处理势必会对其产生一定的负面效应。长期高水平氮添加会导致土壤pH过度下降[35]。土壤pH会影响跳虫的繁殖力和寿命,土壤酸化会跳虫群落结构发生严重变化[36],自由酸性水可以被跳虫直接吸收,但只适应特定的pH环境[37]。
添加氮会影响土壤pH,但对跳虫群落的影响不是仅通过pH来解释,土壤微生物和土壤真菌也会间接地影响跳虫群落。薛璟花等[38]研究发现过量的添加氮会使得土壤微生物的量减少、微生物群落结构发生改变,甚至改变一些微生物的生态功能,如土壤呼吸率变低、土壤酶活性下降等。郭超等[39]的研究也发现施氮进入后期,微生物活性下降,会抑制土壤微生物呼吸,土壤微生物的取食活动和代谢过程受到影响,从而影响了跳虫的食源,导致土壤跳虫多样性减少。跳虫取食范围很广,但主要以真菌的菌丝和孢子为食[36,40],许多研究发现,氮添加会影响土壤真菌[41]。过量的添加氮会使土壤真菌的生物量减少[38],长期氮输入会导致外生菌根多样性降低、丰富度下降并且影响群落组成[42-43]。高氮处理下,土壤C/N显著低于对照,导致嗜酸性细菌生长迅速,抑制其他细菌的生长,土壤微生物的繁殖受到限制,不利于凋落物的分解[32]。由于食物资源减少,跳虫[40,44]会出现负面反应。过量地添加氮则会引起土壤硝态氮含量过剩[44],引起土壤酸化[45]。土壤中过量硝态氮的淋失通常被视为森林中氮饱和的主要症状[46],所以本样地的添加氮达到30 g/(m2·a)时,可能造成氮饱和,从而对跳虫产生了负面影响[47]。
3)土壤跳虫表现出一定的土层分布差异和季节动态变化。本研究中,土壤跳虫在不同土壤层次中的垂直分布表现出表聚性,凋落物层的跳虫数量显著高于土壤层,这与谢致敬等[48]的研究结果相符。这是由于跳虫本身特性,与土壤孔隙大小分布、相对湿度和营养丰富程度相关[38]。土壤跳虫表现出一定的季节差异性。造成此现象的原因应该与温度和土壤含水量有关[49]。土壤温度在近地层的整体变化趋势与气温一致,只是变化幅度相对缓慢,季节性温度变化对跳虫的影响依旧是明显的。1月处于冬季,跳虫的生长繁殖处于低谷期;4月进入春季,跳虫数量较1月相比呈现上升趋势;7月温度升高,跳虫的数量也在逐步上涨;10月的秋季落叶,使土壤养分丰富,此时的跳虫处于生长繁殖的高峰期。
总之,该研究区域杨树人工林土壤跳虫的优势种群为等节跳属、鳞跳属、长跳属和小等跳属,跳虫个体数在凋落物层显著高于土壤层。添加氮会显著影响土壤跳虫的群落组成结构,适度的添加氮则会增加土壤跳虫的个体数目和多样性,而过量的添加氮则会导致跳虫数目减少,存在阈值效应;影响土壤跳虫分布的主要环境因子是pH、硝态氮含量和碳氮比。
参考文献(reference):
[1]STEVENS C J.How long do ecosystems take to recover from atmospheric nitrogen deposition?[J].Biol Conserv,2016,200:160-167.DOI:10.1016/j.biocon.2016.06.005.
[2]GALLOWAY J N.The global nitrogen cycle:past,present and future[J].Sci China Ser C-Life Sci,2005,48(2):669-678.DOI:10.1007/BF03187108.
[3]GALLOWAY J N,COWLING E B.Reactive nitrogen and the world:200 years of change[J].Ambio,2002,31(2):64-71.DOI:10.1579/0044-7447-31.2.64.
[4]于美佳,叶彦辉,韩艳英,等.添加氮对森林生态系统影响的研究进展[J].安徽农业科学,2021,49(3):19-24,27.YU M J,YE Y H,HAN Y Y,et al.Research progress on the effects of nitrogen deposition on forest ecosystem[J].J Anhui Agric Sci,2021,49(3):19-24,27.DOI:10.3969/j.issn.0517-6611.2021.03.005.
[5]LIU X J,SONG L,HE C N,et al.Nitrogen deposition as an important nutrient from the environment and its impact on ecosystems in China[J].Null,2010,2(2):137-143.DOI:10.3724/sp.j.1227.2010.00137.
[6]徐国良,莫江明,周国逸.模拟添加氮增加对南亚热带主要森林土壤动物的早期影响[J].应用生态学报,2005,16(7):1235-1240.XU G L,MO J M,ZHOU G Y.Early responses of soil fauna in three typical forests of south subtropical China to simulated N deposition addition[J].Chin J Appl Ecol,2005,16(7):1235-1240.
[7]GEISSEN V,KAMPICHLER C.Limits to the bioindication potential of Collembola in environmental impact analysis:a case study of forest soil-Liming and fertilization[J].Biol Fertil Soils,2004,39(6):383-390.DOI:10.1007/s00374-003-0714-2.
[8]孙元,兰晓萍,邵红涛.土栖弹尾虫环境指示作用研究进展[J].中国农学通报,2014,30(13):6-9.SUN Y,LAN X P,SHAO H T.Advances of researches on soil-dwelling springtails as bioindicators[J].Chin Agric Sci Bull,2014,30(13):6-9.
[9]FENN M E,BARON J S,ALLEN E B,et al.Ecological effects of nitrogen deposition in the western United States[J].BioScience,2003,53(4):404.DOI:10.1641/0006-3568(2003)053[0404:eeondi]2.0.co;2.
[10]RUSEK J.Air-pollution-mediated changes in alpine ecosystems and ecotones[J].Ecol Appl,1993,3(3):409-416.DOI:10.2307/1941910.
[11]CHAUVAT M,ZAITSEV A S,WOLTERS V.Successional changes of Collembola and soil microbiota during forest rotation[J].Oecologia,2003,137(2):269-276.DOI:10.1007/s00442-003-1310-8.
[12]YANG X D,WARREN M,ZOU X M.Fertilization responses of soil litter fauna and litter quantity,quality,and turnover in low and high elevation forests of Puerto Rico[J].Appl Soil Ecol,2007,37(1/2):63-71.DOI:10.1016/j.apsoil.2007.03.012.
[13]MCGLYNN T P,SALINAS D J,DUNN R R,et al.Phosphorus limits tropical rain forest litter fauna[J].Biotropica,2007,39(1):50-53.DOI:10.1111/j.1744-7429.2006.00241.x.
[14]KELLY J M,HENDERSON G S.Effects of nitrogen and phosphorus additions on deciduous litter decomposition[J].Soil Sci Soc Am J,1978,42(6):972-976.DOI:10.2136/sssaj1978.03615995004200060030x.030x.
[15]崔海鸥,刘珉.我国第九次森林资源清查中的资源动态研究[J].西部林业科学,2020,49(5):90-95.CUI H O,LIU M.Analysis on the results of the 9th national forest inventory[J].J West China For Sci,2020,49(5):90-95.DOI:10.16473/j.cnki.xblykx1972.2020.05.014.
[16]赵文芹,席本野,刘金强,等.不同灌溉条件下杨树人工林蒸腾过程及环境响应[J].植物生态学报,2021,45(4):370-382.ZHAO W Q,XI B Y,LIU J Q,et al.Transpiration process and environmental response of poplar plantation under different irrigation conditions[J].Chin J Plant Ecol,2021,45(4):370-382.DOI:10.17521/cjpe.2020.0343.
[17]彭赛,张雅坤,葛之葳,等.添加氮对微生物分解森林地上凋落物过程的影响[J].南京林业大学学报(自然科学版),2016,40(1):1-7.PENG S,ZHANG Y K,GE Z W,et al.Effects of nitrogen deposition on litter decomposition by microorganisms in forests[J].J Nanjing For Univ (Nat Sci Ed),2016,40(1):1-7.DOI:10.3969/j.issn.1000-2006.2016.01.001.
[18]段娜,李清河,多普增,等.植物响应大气添加氮研究进展[J].世界林业研究,2019,32(4):6-11.DUAN N,LI Q H,DUO P Z,et al.Plant response to atmospheric nitrogen deposition:a research review[J].World For Res,2019,32(4):6-11.DOI:10.13348/j.cnki.sjlyyj.2019.0029.y.
[19]李德军,莫江明,方运霆,等.添加氮对森林植物的影响[J].生态学报,2003,23(9):1891-1900.LI D J,MO J M,FANG Y T,et al.Impact of nitrogen deposition on forest plants[J].Acta Ecol Sin,2003,23(9):1891-1900.DOI:10.3321/j.issn:1000-0933.2003.09.022.
[20]尹文英.中国土壤动物检索图鉴[M].北京:科学出版社,1998.YIN W Y.Pictorical keys to soil animals of China[M].Beijing:Science Press,1998.
[21]DROLC A , VRTOVEK J .Nitrate and nitrite nitrogen determination in waste water using on-line UV spectrometric method[J].Bioresour Technol, 2010, 101(11):4228-4233.DOI:10.1016/j.biortech.2010.01.015.
[22]HALL A .Application of the indophenol blue method to the determination of ammonium in silicate rocks and minerals[J]. Applied Geochemistry, 1993, 8(1):101–105. DOI:10.1016/0883-2927(93)90059-P.
[23]张珂,左鑫钰,胡娅丽,等.塞罕坝不同植被类型地表土壤动物群落特征[J].林业与生态科学,2022,37(3):223-237.ZHANG K,ZUO X Y,HU Y L,et al.Community structure of soil fauna of different vegetation types in Saihanba[J].For Ecol Sci,2022,37(3):223-237.DOI:10.13320/j.cnki.hjfor.2022.0033.
[24]XU G L,SCHLEPPI P,LI M H,et al.Negative responses of Collembola in a forest soil (Alptal,Switzerland) under experimentally increased N deposition[J].Environ Pollut,2009,157(7):2030-2036.DOI:10.1016/j.envpol.2009.02.026.
[25]宋敏.增加降水及施氮对弃耕草地土壤线虫和小型节肢动物的影响[J].生态学杂志,2017,36(3):631-639.SONG M.Effects of water and nitrogen addition on soil nematodes and small arthropods in an oldfield grassland of north China[J].Chin J Ecol,2017,36(3):631-639.DOI:10.13292/j.1000-4890.201703.001.
[26]李曾燕,邱细容,陈冠陶,等.多年模拟添加氮对华西雨屏区苦竹人工林土壤节肢动物的影响[J].生态学杂志,2019,38(5):1419-1425.LI Z Y,QIU X R,CHEN G T,et al.Effects of long-term simulated nitrogen deposition on soil arthropods in a Pleioblastus amarus plantation in rainy area of western China[J].Chin J Ecol,2019,38(5):1419-1425.DOI:10.13292/j.1000-4890.201905.037.
[27]焦亚青.土壤无机氮(铵态氮、硝态氮)时空变化研究现状[J].现代盐化工,2022,49(1):20-22.JIAO Y Q.Research status of spatial and temporal changes of soil inorganic nitrogen (ammonium nitrogen,nitrate nitrogen)[J].Mod Salt Chem Ind,2022,49(1):20-22.DOI:10.19465/j.cnki.2095-9710.2022.01.055.2.01.055.
[28]CURTIN D,CAMPBELL C A,JALIL A.Effects of acidity on mineralization:pH-dependence of organic matter mineralization in weakly acidic soils[J].Soil Biol Biochem,1998,30(1):57-64.DOI:10.1016/S0038-0717(97)00094-1.
[29]薛璟花,莫江明,李炯,等.土壤微生物数量对模拟添加氮增加的早期响应[J].广西植物,2007,27(2):174-179,202.XUE J H,MO J M,LI J,et al.The short-term response of soil microorganism number to simulated nitrogen deposition[J].Guihaia,2007,27(2):174-179,202.DOI:10.3969/j.issn.1000-3142.2007.02.008.
[30]费裕翀,叶义全,郑宏,等.外源氮素调控C/N比对杉木林凋落叶细菌群落结构的影响[J].生态学报,2021,41(5):2011-2023.FEI Y C,YE Y Q,ZHENG H,et al.Effects of C/N ratio under the control of exogenous nitrogen on the bacterial community structure in litters of Cunninghamia lanceolata plantation under different undergrowth vegetation management measures[J].Acta Ecol Sin,2021,41(5):2011-2023.DOI:10.5846/stxb202005081149.
[31]张春华,王宗明,居为民,等.松嫩平原玉米带土壤碳氮比的时空变异特征[J].环境科学,2011,32(5):1407-1414.ZHANG C H,WANG Z M,JU W M,et al.Spatial and temporal variability of soil C/N ratio in Songnen plain maize belt[J].Environ Sci,2011,32(5):1407-1414.DOI:10.13227/j.hjkx.2011.05.014.014.
[32]林英华,黄庆海,刘骅,等.长期耕作与长期定位施肥对农田土壤动物群落多样性的影响[J].中国农业科学,2010,43(11):2261-2269.LIN Y H,HUANG Q H,LIU H,et al.Effect of long-term cultivation and fertilization on community diversity of cropland soil animals[J].Sci Agric Sin,2010,43(11):2261-2269.DOI:10.3864/j.issn.0578-1752.2010.11.009.
[33]孙元,邵红涛,薛春梅,等.添加氮对我国森林生态系统生物多样性的影响研究进展[J].黑龙江大学工程学报,2013,4(2):33-37.SUN Y,SHAO H T,XUE C M,et al.Advance of nitrogen deposition on biodiversity in forest ecosystem in China[J].J Eng Heilongjiang Univ,2013,4(2):33-37.DOI:10.13524/j.2095-008x.2013.02.003.
[34]张燕,张阿娟,罗如熠,等.土壤跳虫对氮磷养分响应的研究进展[J].应用生态学报,2022,33(9):2585-2592.ZHANG Y,ZHANG A J,LUO R Y,et al.Response of soil Collembola to nitrogen and phosphorus deposition:a review[J].Chin J Appl Ecol,2022,33(9):2585-2592.DOI:10.13287/j.1001-9332.202209.034.
[35]肖辉林.大气添加氮对森林土壤酸化的影响[J].林业科学,2001,37(4):111-116.XIAO H L.Effects of atmospheric nitrogen deposition on forest soil acidification[J].Sci Silvae Sin,2001,37(4):111-116.DOI:10.3321/j.issn:1001-7488.2001.04.018.
[36]RUSEK J.Biodiversity of Collembola and their functional role in the ecosystem[J].Biodiversity and Conservation,1998,7(9):1207-1219.DOI:10.1023/A:1008887817883.
[37]JAEGER G,EISENBEIS G.pH-dependent absorption of solutions by the ventral tube of Tomocerus flavescens (Tullberg,1871) (Insecta,Collembola)[J]. Rev" Ecol" Biol,1984(21):519-531.
[38]薛璟花,莫江明,李炯,等.添加氮增加对土壤微生物的影响[J].生态环境,2005,14(5):777-782.XUE J H,MO J M,LI J,et al.Effects of nitrogen deposition on soil microorganism[J].Ecol Environ Sci,2005,14(5):777-782.DOI:10.16258/j.cnki.1674-5906.2005.05.032.
[39]郭超,王霖娇.添加氮对森林生态系统土壤微生物、酶活性以及细根生产与周转的影响研究进展[J].生态学杂志,2021,40(11):3730-3741.GUO C,WANG L J.Effects of nitrogen deposition on soil microbes,enzyme activities,fine root production and turnover in forest ecosystems:a review[J].Chin J Ecol,2021,40(11):3730-3741.DOI:10.13292/j.1000-4890.202111.010.
[40]MEBES K H,FILSER J.Does the species composition of Collembola affect nitrogen turnover?[J].Appl Soil Ecol,1998,9(1/2/3):241-247.DOI:10.1016/s0929-1393(97)00051-6.
[41]BERG M P,VERHOEF H A.Ecological characteristics of a nitrogen-saturated coniferous forest in The Netherlands[J].Biol Fertil Soils,1998,26(4):258-267.DOI:10.1007/s003740050377.
[42]WALLENDA T,KOTTKE I.Nitrogen deposition and ectomycorrhizas[J].New Phytol,1998,139(1):169-187.DOI:10.1046/j.1469-8137.1998.00176.x.
[43]LILLESKOV E A,FAHEY T J,LOVETT G M.Ectomycorrhizal fungal aboveground community change over an atmospheric nitrogen deposition gradient[J].Ecol Appl,2001,11(2):397-410.DOI:10.1890/1051-0761(2001)011[0397:efacco]2.0.co;2.
[44]李鹏,李玉浸,杨殿林,等.不同施氮处理对菠菜土壤硝态氮累积的影响[C]//第十届中国科协年会论文集(二).郑州,2008:1181-1186.
[45]鲁显楷,莫江明,张炜,等.模拟大气添加氮对中国森林生态系统影响的研究进展[J].热带亚热带植物学报,2019,27(5):500-522.LU X K,MO J M,ZHANG W,et al.Effects of simulated atmospheric nitrogen deposition on forest ecosystems in China:an overview[J].J Trop Subtrop Bot,2019,27(5):500-522.DOI:10.11926/jtsb.4113.
[46]GUNDERSEN P,EMMETT B A,KJNAAS O J,et al.Impact of nitrogen deposition on nitrogen cycling in forests:a synthesis of NITREX data[J].For Ecol Manag,1998,101(1/2/3):37-55.DOI:10.1016/S0378-1127(97)00124-2.
[47]徐国良,莫江明,周国逸.N沉降下土壤动物群落的响应:1年研究结果总述[J].北京林业大学学报,2006,28(3):1-7.XU G L,MO J M,ZHOU G Y.Effects of N deposition on soil fauna:a summary for one year[J].J Beijing For Univ,2006,28(3):1-7.DOI:10.3321/j.issn:1000-1522.2006.03.001.
[48]谢致敬,常亮,STEFAN S,等.长白山森林生态系统凋落物层和土壤层跳虫物种多样性和功能多样性对海拔梯度的响应[J].生态学报,2022,42(9):3471-3481.XIE Z J,CHANG L,STEFAN S,et al.Taxonomic and functional diversity of Collembola in litter and soil along an altitudinal gradient at Changbai Mountain,China[J].Acta Ecol Sin,2022,42(9):3471-3481.DOI:10.5846/stxb202104221060.
[49]林青战.牡丹区土壤动物多样性研究及弹尾目等节跳科昆虫系统分类[D].哈尔滨:东北农业大学,2016.LIN Q Z.Diversity research of soil animals and the systematics of Collembola:isotomadea in Mudan district[D].Harbin:Northeast Agricultural University,2016.
(责任编辑 王国栋)
收稿日期Received:2022-09-29""" 修回日期Accepted:2023-04-15
基金项目:国家自然科学基金项目(32071594);国家重点研发计划(2021YFD2200403);江苏省林业局揭榜挂帅项目(LYKJ【2022】01);江苏省林业局造林专项项目(【2021-2022】)。
第一作者:王梓萌(799733209@qq.com)。
*通信作者:阮宏华(hhruan@njfu.edu.cn),教授。
引文格式:王梓萌, 阮宏华,吴小巧,等. 模拟氮沉降对杨树人工林土壤跳虫群落的影响[J]. 南京林业大学学报(自然科学版),2024,48(4):243-253.
WANG Z M, RUAN H H, WU X Q, et al. Effects of nitrogen addition on soil springtail(Collembolan) community in a poplar plantation[J]. Journal of Nanjing Forestry University (Natural Sciences Edition),2024,48(4):243-253.
DOI:10.12302/j.issn.1000-2006.202209066.

