磁性微球在循环肿瘤细胞和病毒以及核酸分离富集和检测分析中的应用进展
摘要 磁性微球是一种多用途复合材料,通常以纤维素、壳聚糖、二氧化硅以及聚苯乙烯等生物兼容性好的材料为包覆载体,通过表面的活性基团(—OH、—COOH、—NH2 和—SH 等)负载荧光分子、抗体和核酸等,可以特异性识别癌细胞、病毒和遗传物质。借助其自身优异的磁响应特性,磁性微球可实现快速分离和富集,在免疫分析、细胞分离以及环境检测等领域具有广阔的应用前景;磁性微球还可与微流控芯片等结合,构建高通量检测平台。本文介绍了近5 年来磁性微球在循环肿瘤细胞检测、病毒抗原抗体和核酸检测等前沿分析领域中的应用进展,并讨论了以磁性微球以及以其为载体开发的检测分析试剂盒的商业化前景。
关键词 磁性微球;循环肿瘤细胞;病毒抗原;核酸检测;评述
磁性微球也称磁珠(Magnetic beads, MB),是一种由纤维素、壳聚糖、聚苯乙烯或二氧化硅等材料包覆磁性纳米颗粒(NPs)制备而成的复合材料。由于包覆的纳米颗粒一般小于20 nm, 磁性微球具有超顺磁性,磁响应强且只在外界磁场下表现出磁性,避免了铁磁性微球的不可逆聚集。磁性微球的商品化程度很高,较成功的案例是挪威Ugelstad 教授于1987 年开发的Dynal™系列[1-2]。该磁性微球制备涉及多步溶胀,通过添加制孔剂,制得单分散的多孔聚合物微球。然后,通过聚合物官能团(如环氧乙烷等)修饰,吸附Fe2+和Fe3+,最终实现Fe3O4 纳米粒子(~8 nm)在聚合物微球孔中的原位沉降。通过该方法可制备含铁量高达25%的单分散的磁珠[3]。然而,该方法步骤复杂,目前市面上尚无成功复现的产品。也可采用多层夹心结构的Magnefy™制备磁珠,实现很高的磁负载量,但是微球尺寸偏差较大。
磁珠具有高比表面积,不仅可通过共聚、表面改性等方式引入多种活性基团(如—OH、—COOH、—NH2 和—SH 等),也可通过共价键结合大量荧光探针、生物抗体和适配体等方式,构建生物分析载体,进而可以利用磁珠优异的磁响应特性,实现分离和富集,在细胞分离和标记、蛋白质和核酸分离提纯以及免疫分析等生物医学领域具有广阔的应用用景。此外,磁珠还可与微流控芯片等装置结合,进一步提高检测的通量。因此,磁珠在循环肿瘤细胞(CTCs)、抗体抗原、核酸检测以及分离和提纯等领域具有广阔的应用前景。本文主要总结了近5 年来磁珠在CTCs、病毒抗原抗体和核酸检测方面的最新研究进展,并对其未来的发展前景进行了展望。
1 磁微球用于CTCs 检测
CTCs 是从肿瘤边缘脱落,进入外周血的各种肿瘤细胞的统称。由于CTCs 可出现在癌症早期,甚至早于实体瘤,可作为早期肿瘤转移的标志物[4-6],因此, CTCs 计数和检测对于评估肿瘤进展、预后以及个体化治疗方案的制定和实施至关重要。CTCs 数量极少,在50 亿个红细胞和1000 万个白细胞中只有几个CTCs[7-8],因此,需要利用其与正常细胞之间的物理特征、形态学(如大小、密度、变形性和电荷)或特定生物学特性(如肿瘤细胞表面标志物表达)差异进行分离和富集。常见的分离和富集方法包括免疫捕获法、生物物理特性富集法以及二次分离法等[9]。其中,生物物理特性富集法的富集效率较低,并且容易堵塞过滤装置;二次分离方法的操作比较复杂,需要手动操作显微镜寻找染色的CTCs。其它方法,如微流控法,其优点在于通量大,但存在层流, CTCs 与通道表面抗体的接触不充分,捕获效率低,因此需要采用更有效的通道设计方案;静脉留置针采样法是将留置针在血管中留置一段时间,弥补了传统抽取外周血捕获CTCs 时血液样品量不足的缺点,而且原位采集能保证CTCs 维持原始特性,避免多次洗涤带来的细胞活性损失,假阳率显著降低,但是该方法操作复杂且检测成本高。与上述方法相比,基于磁性颗粒的磁分离免疫捕获法具有操作简单、可与其它技术和鉴定方法耦合等优点。
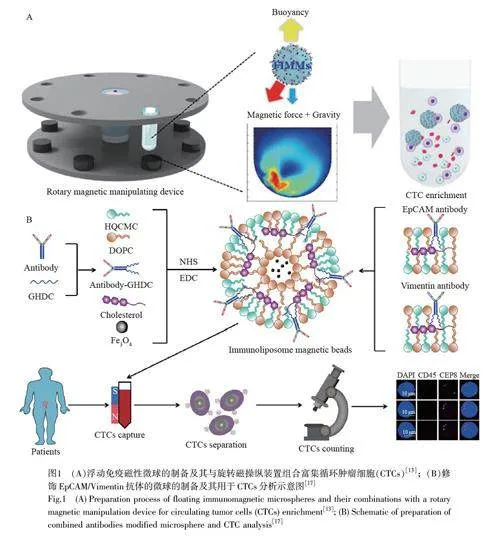
基于磁性颗粒的磁分离方法的主要机理是:磁性颗粒表面修饰的特异性识别分子与CTCs 结合后,在外部磁场的作用下可定向移动;去除磁场后,捕获的CTCs 被释放出来。磁分离技术易与其它技术联用,如结合微流控器件的磁分离技术兼具微芯片和磁选的优点,可高效捕获CTCs;同时,利用外部磁场进行磁珠回收,成本大幅降低。不同形状的磁性颗粒对细胞内化和肿瘤积累的效果不同[ 10- 11]。Chang 等[12]设计了球状和棒状的磁性荧光微粒,并在表面修饰上皮细胞黏附分子(EpCAM)抗体,用于临床血液样本中CTCs 的分离和检测。结果表明,棒状颗粒比球状颗粒具有更快的分离速度和更好的性能。传统方法常采用免疫磁珠分离CTCs,需要机械搅拌混合磁珠和试样,会导致细胞损伤。Yu 等[13]开发了一种免疫浮动微球(FIMMs)及其配套的操纵装置(图1A)用于CTCs 捕获。该微球的密度较低,在常规样品中可以悬浮,通过调控磁力实现其在血液样本中的移动。在微球表面修饰特异性抗体能够选择性捕获CTCs,借助旋转磁力操纵装置可以更有效地引导和操纵微球,提高捕获效率。该设备捕获CTCs 的效率最高可达到93%,检出限低至5 cell/mL。
CTCs 通常可表达多种生物标志物,因此,基于两种或两种以上抗体或靶向探针的多重识别方式可弥补单个抗体识别的不足,有效地增强其对罕见CTCs 的捕获,如低EpCAM 表达的肿瘤细胞[14-15]。当EpCAM 的表达在上皮-间充质转化过程中丢失或者下调时,可能会显著降低CTCs 的检测灵敏度。基于EpCAM 的CELL Search 平台仅能在1/3 的Ⅳ期非小细胞肺癌患者中检测到CTCs。基于此, Gao 等[16]开发了一种基于EpCAM、Ⅰ型跨膜糖蛋白(MUC1)和表皮生长因子受体(EGFR)3 种识别分子组合的免疫磁珠,用于回收来自血液样品中93.35%的H446 细胞,并且在近90%的肺癌患者中检测到CTCs。Chen 等[17]在Fe3O4 微球表面修饰EpCAM 和波形蛋白(Vimentin)的识别分子(图1B),用于捕获CTCs,在模拟血液环境中的捕获效率高达90.85%,在肺癌患者中检测到的平均CTCs 数量为12.47/7.5 mL, 明显高于传统的基于EpCAM 的CTCs 检测值[18]。
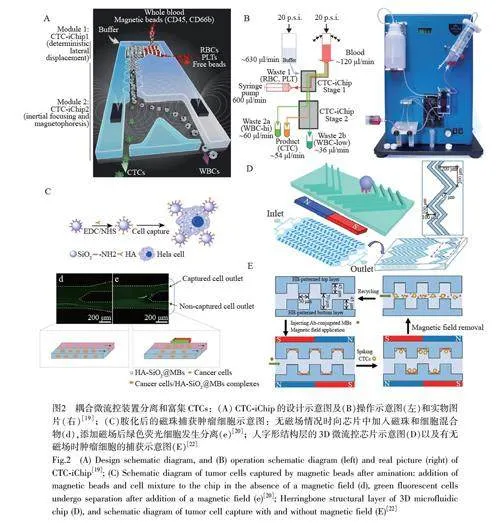
阳性富集策略捕获CTCs 时会被白细胞严重污染,采用洗涤步骤虽然可以减少污染,但是会导致CTCs 丢失或牺牲细胞活性,而CTCs 的阴性富集策略可以实现白细胞与CTCs 的有效分离。磁选方法结合微流控装置可实现CTCs 更高通量的分离与富集。Karabacak 等[19]利用阴性富集策略设计了用于捕获CTCs 的多级微流控装置(CTC-iChip)(图2A 和2B),包括:(1)专门设计的柱阵列,将血小板、红细胞以及多余的磁珠分离出来;(2)蛇形通道,先利用惯性聚焦将细胞排成一排,随后在偏转区利用磁泳将CTCs 和白细胞分离,分别收集。实验结果表明,该装置每小时可以处理8 mL 全血,实现了97.0%±2.7%的CTCs 的收集效率。有研究者进一步改进了微流控芯片中的磁珠,提高了CTCs 的捕获效率和捕获速度。Yin 等[20]开发了一种新的快速捕获CTCs 的方法,在微流控芯片中使用透明质酸(HA)修饰的SiO2 磁珠(HA-SiO2@MBs),可以特异性结合过度表达CD44 受体的HeLa 细胞,并在外部磁场下分离。该微流控芯片对CTCs 的捕获效率达到92%(图2C),与其它微流控芯片相比,该芯片制备简单且较容易实现,可快速、高效地分离CTCs,在癌症诊断方面具有广阔的应用前景。
由于微通道中存在层流,微流控芯片微通道中的CTCs 通常遵循直线流线,大大降低了与捕获配体涂层表面的相互作用,不利于有效捕获CTCs。近年来,研究人员为了解决这些问题,开发了一系列新结构的芯片(如3D 纳米结构[21])提高CTCs 的捕获效率。Zhang 等[22]开发了一种具有双层人字槽的微流控芯片(图2D 和2E)用于CTCs 捕获。将修饰有CTCs 靶向抗体的磁珠固定在槽口通道的内壁,样品中的CTCs 在被动涡旋的作用下偏离到人字槽中,进而被磁珠捕获。在常规病理细胞浓度(100 和50 cell/mL)下,肿瘤细胞捕获效率分别为92.5%±2.7%和90.5%±5.0%;移去磁场后,超过90%捕获的CTC 可以从芯片中释放出来。
2 磁性微球在病毒抗原抗体检测中的应用
病毒等病原体检测一般分为核酸检测、抗原检测和特异性抗体检测。新型冠状病毒感染的肺炎疫情期间,基于抗原检测的快速诊断检测试剂盒(RDT)已被广泛用于居家即时检测。然而,基于传统胶体金和免疫荧光法的RDTs 经常出现假阴性结果;磁性颗粒由于具有独特的物理化学特性,已成为提高检测灵敏度以及缩短传统抗原检测时间的理想介质。
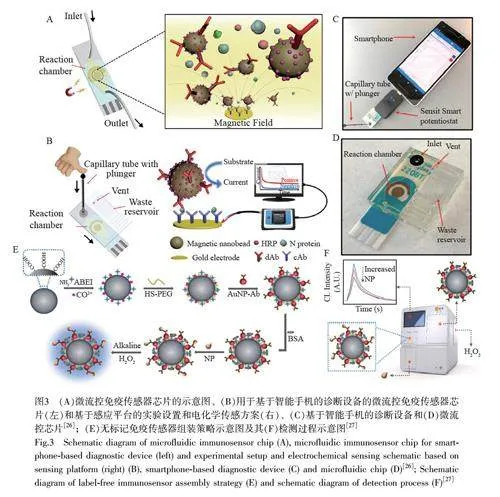
SARS-CoV-2 的结构蛋白(如刺突蛋白(SP)和核衣壳蛋白(NP)等)可用于诊断COVID-19[23]。NP 和SP 具有高抗原性,但N 基因比S 基因更保守和稳定,突变更少[24-25],因此, NP 是SARS-CoV-2 抗原检测中更稳定有效的靶标。Li 等[26]开发了一种磁性免疫传感器(图3A 和3B),用于快速、高灵敏地检测血清中的NP。该传感器利用双标记的磁性纳米珠进行免疫磁富集和信号放大,可在几分钟内完成检测,检出限低至230 pg/mL。其中,阴性人群和阳性患者的电信号差异明显,阳性患者临床血清标本的NP 浓度及S/B 比值均明显高于阴性人群。此外,可将该传感器与智能手机的传感设备连接,实现用户友好的即时定量检测(图3C 和3D)。
荧光标记的磁性微球也可快速识别病毒[27-28]。Lyu 等[27]报道了一种自动无标记化学发光免疫测定方法(图3E)用于NP 检测。采用商业化的磁珠,通过静电作用将N-(4-氨丁基)-N-乙基异鲁米诺和Co2+接枝到羧基功能化的磁珠表面,制备出一种双功能化学发光磁珠dfCL-MB;将巯基聚乙二醇包覆在dfCL-MB 表面,通过Au—S 键组装dfCL-MB 和抗体偶联的金纳米颗粒;采用全自动化学发光分析仪进行化学发光强度检测(图3F),并根据化学发光强度和NP 蛋白的线性关系测定病毒含量。该方法的检出限为21 fg/mL,利用其测定健康人血清和COVID-19 患者临床血清中的NP 蛋白,回收率大于91%。
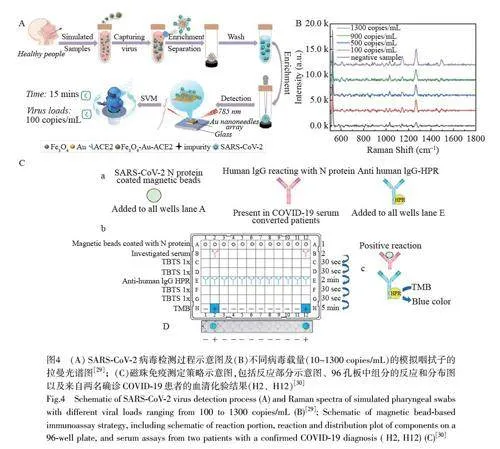
Li 等[ 29]开发了一种由Fe3O4-Au 纳米复合材料和Au 纳米针阵列组成的磁性SERS 生物传感器(图4A)。该传感器采用磁性Fe3O4-Au 纳米复合材料来捕获和分离鼻腔和喉咙拭子中的病毒,增强了SARS-CoV-2 的拉曼信号,可在15 min 内完成检测,检出限为100 copies/mL(图4B)。Huergo 等[30]将SARS-CoV-2 核衣壳蛋白修饰在MagneHis Ni 磁珠表面,开发了一种简单的基于显色磁珠的免疫测定方法(图4C)。将微球与血清混合,磁珠表面的SARS-CoV-2 核衣壳蛋白与血清中的抗体形成复合物,通过操控磁场可迅速分离微球,同时通过测量荧光信号强度或化学发光强度间接测定血清样本中的病毒含量。
除检测SARS-CoV-2 病毒外,还可以将磁性微球与金纳米颗粒结合检测丙型肝炎(HCV)病毒[31],以及将磁性微球和SERS 技术结合用于同时检测多种病毒抗原[32]。此外,磁珠也被广泛应用于微生物抗原检测。Wu 等[33]将磁性微球和侧流免疫分析技术相结合开发了一系列细菌检测策略, Shang 等[34]将磁性微球与微流控技术相结合开发了一系列检测细菌的新技术。
3 磁性微球在核酸提纯和检测方面的应用
核酸是最基本的生命物质之一,具有极其重要的生物学功能,主要存储和传输遗传信息,核酸检测有助于监测与某些健康状况相关的遗传变化[35-36]。与抗原检测方法相比,核酸检测多为直接方法,灵敏度更高,核酸检测试剂盒的制备耗时也更短[37]。其中,聚合酶链式反应(PCR)是核酸检测的金标准,然而PCR 检测设备昂贵,需要专业人员操作。传统的核酸提取和分离耗时长,需要经过多个离心步骤,导致产量和纯度较低[38]。因此,开发低成本的核酸检测试剂盒以满足居家检测的需要,是解决传染病大流行期间核酸检测需求激增问题的有效方法。磁性颗粒是核酸纯化的良好工具,与其它化学方法相比,磁性颗粒辅助核酸检测方法是一种相对安全环保的方法[39]。研究人员可以根据样品选择不同类型和大小的磁性颗粒,有利于提高提取效率,降低成本[40]。此外,在磁场驱动下,磁性颗粒可不受液体体积的限制,有利于集成、便携和快速的核酸检测[41],有望实现核酸纯化、扩增和检测一体化[42]。目前,已开发出多种磁珠提取试剂盒,并已实现商品化[43]。
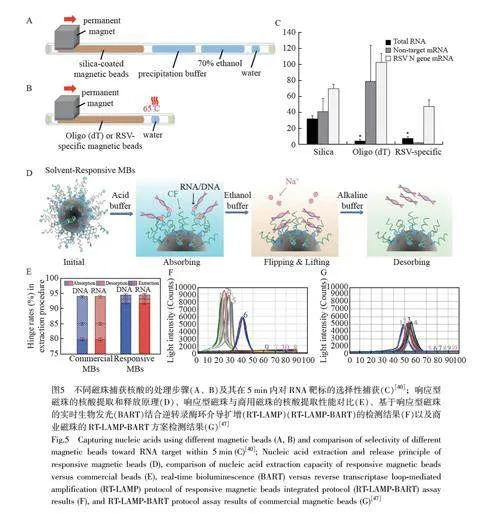
Boom 等[44-45]利用SiO2 颗粒回收高浓度异硫氰酸胍(GTC)中的核酸,用于提取血清中乙型肝炎病毒(HBV)的DNA。基于此, Sun 等[46]制备了一种SiO2 包被的Fe3O4 磁珠,当硫氰酸胍存在时,采用鲑精DNA 和大肠杆菌JM109 菌株的RNA 评估其吸附能力,结果表明,在pH=5.5 的条件下, SiO2 包覆的磁性颗粒对DNA 和RNA 的最大吸附量分别高达10.6 和7.7 mg/g。与商业化试剂盒对比, SiO2 包被的磁性颗粒可在30 min 内快速、简便地从血清中分离出病毒核酸,具有大规模商用的前景。Adams 等[40]采用不同磁珠选择性地提取核酸(图5A 和5B),评估了SiO2 包被、寡核苷酸包被和特异性寡核苷酸序列包被的磁性颗粒的分析性能,用于实际样品检测,回收率分别为75%、71%和7%(图5C);当孵育时间延长至180 min 时,特异性寡核苷酸序列包被磁性颗粒对靶标的回收率达到77%。
传统磁珠具有可逆吸附性,其核酸脱附效率欠佳。Fei 等[47]开发了一种响应型Fe3O4 磁珠(图5D),其表面涂有一层碳氟化合物表面活性剂,这使得羧基基团在磁珠表面具有反转属性,降低了核酸的可逆吸附性。该磁珠对RNA 和DNA 的解吸率分别达到94.0%和93.5%,高于商业磁珠约10%(图5E)。将响应型磁珠的实时生物发光(BART)与逆转录酶环介导扩增(RT-LAMP)相结合,其检测结果优于商业磁珠(图5F 和5G),对SARS-CoV-2 病毒的检出限低至5 copies/mL。
磁性微球可用于高效纯化核酸。Huang 等[48]制备了一种表面电性可调的氨基化Fe3O4@SiO2 微球,通过静电吸附作用实现了基因组DNA 的选择性捕获,将之用于人体血液中基因组DNA 的提取,提取率高达70%。Cui 等[49]提出了一种基于顺磁磁珠和油水界面的平台,用于快速提取临床样本中的核酸。此平台利用顺磁磁珠、油水界面、小型永久磁铁和微流控通道分离和纯化裂解液中的核酸,省略了多个洗涤步骤,简化了纯化流程,缩短了纯化时间。结果表明,此装置不仅能够能从临床鼻咽拭子样本中高效分离流感病毒RNA,并能保持病毒基因组的高度完整性。与Ambion MagMAX 试剂盒相比,此平台提取RNA 的时间显著减少,仅为原时间的1/3,但检测效果几乎相同,在临床和高通量检测方面具有很大的应用潜力。
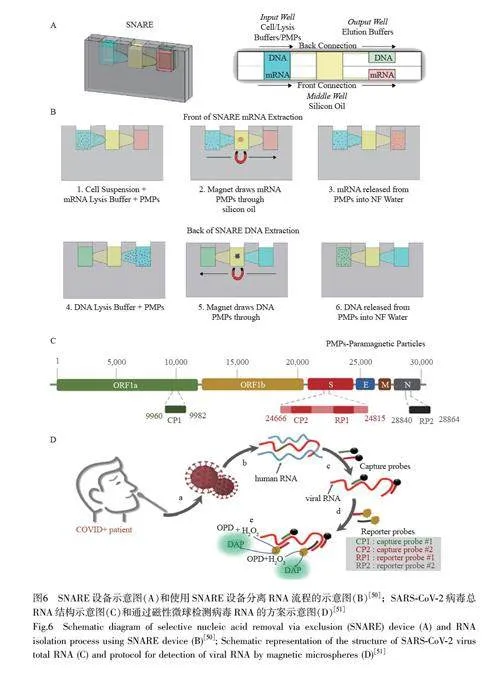
以上方案是基于核酸的化学性质提取总核酸,为了更好地分离、提纯和检测核酸,有时需要同时纯化RNA 和DNA。传统的核酸提取技术操作复杂,并需要使用有毒化学试剂。为解决此问题, Strotman 等[50]开发了一种SNARE(Selective nucleic acid removal via exclusion)核酸提取技术(图6A 和6B)。SNARE 无需稀释性洗涤和离心过程,可重复使用,可从极少的样本中分离纯化mRNA 和DNA,用于下游分析。与商业化磁珠Qiagen 试剂盒相比, SNARE 提取DNA 效果更好,提取RNA 效果相近。SNARE 装置具有灵敏度高、检测成本低以及可用于快速检测等优势,与其它微流控设备结合,在疾病早期检测、监测治疗反应和靶向治疗等领域拥有巨大的应用潜力。
通过靶向指定的基因位点可分离特定核酸,但是基于PCR的检测平台成本高且操作复杂。Zayani等[51]基于磁性微球技术,结合核酸杂交和荧光检测原理,设计了多重荧光生物平台(图6C 和6D),用于无核酸扩增情况下SARS-CoV-2 病毒RNA 检测。该方法通过特异性的DNA 探针分子与目标SARS-CoV-2 病毒RNA 的互补序列杂交,形成DNA-RNA 复合物,固定在磁性微球表面。随后将病毒RNA 与辣根过氧化物酶(HRP)标记的探针分子杂交,加入H2O2 和邻苯二胺溶液产生荧光信号,通过分析荧光信号实现对SARS-CoV-2 病毒RNA 的定量检测。BEAMing 技术是一种磁珠和PCR 流式技术相结合的数字PCR 流式技术,该技术先将修饰有链霉亲和素的磁珠和生物素标记的寡核苷酸结合,然后利用PCR 技术将单个靶标DNA 在单个磁珠上扩增,最后通过统计磁珠的数量实现DNA 的测定[52-53]。Cabezas-Camarero[54]等首次将BEAMing 技术用于胶质瘤患者血浆中循环肿瘤DNA 的检测。Garrido 等[55]在临床研究中使用高灵敏的BEAMing 方法检测和定量分析循环肿瘤DNA 中的表皮生长因子受体突变,在优化晚期非小细胞肺癌患者的治疗方案中具有应用潜力。
4 结论与展望
磁性微球具有良好的磁性和生物相容性,可用于CTCs 的检测,通过与肿瘤细胞的某些分子标记物结合,实现对血液中CTCs 的高效捕获和分离,在肿瘤的早期诊断、治疗和监测等领域极具应用潜力。磁性微球在抗病毒检测方面也具有重要的应用价值。通过在微球表面修饰具有高特异性病毒抗体,实现对SARS-CoV-2 捕获,而微球的磁性使检测过程中的分离和洗涤过程更加高效。同时,磁性微球可用于核酸提纯和检测,主要通过在磁性表面修饰具有高特异性的核酸探针捕获目标核酸。此外,磁性微球具有较大的表面积和较高的结合容量,可以提供更多的结合位点,提高检测灵敏度,并可利用外部磁场提高检测效率。目前,磁性微球已经商业化,在抗体抗原检测、核酸检测和纯化以及CTCs 富集检测等领域已实现临床应用,并已研发出基于磁性微球的商业化检测工具。未来,磁性微球与人工智能技术、纳米技术和微流控技术等新兴技术相结合,可为疾病的诊断和治疗带来全新的解决方案。
References
[1] UGELSTAD J, ELLINGSEN T, BERGE A, BERTIL H. US Patent. 4654267. 1987.
[2] UGELSTAD J, BERGE A, ELLINGSEN T, SCHMID R, NILSEN T N, MORK P C, STENSTAD P, HORNES E, OLSVIK O.Prog. Polym. Sci. , 1992, 17(1): 87-161.
[3] FONNUM G, JOHANSSON C, MOLTEBERG A, MØRUP S, AKSNES E. J. Magn. Magn. Mater. , 2005, 293(1): 41-47.
[4] MICALIZZI D S, MAHESWARAN S, HABER D A. Genes Dev. , 2017, 31(18): 1827-1840.
[5] HÜSEMANN Y, GEIGL J B, SCHUBERT F, MUSIANI P, MEYER M, BURGHART E, FORNI G, EILS R, FEHM T,RIETHMÜLLER G, KLEIN C A. Cancer Cell, 2008, 13(1): 58-68.
[6] RING A, NGUYEN-STRÄULI B D, WICKI A, ACETO N. Nat. Rev. Cancer, 2023, 23(2): 95-111.
[7] BACCELLI I, SCHNEEWEISS A, RIETHDORF S, STENZINGER A, SCHILLERT A, VOGEL V, KLEIN C, SAINI M,BÄUERLE T, WALLWIENER M, HOLLAND-LETZ T, HÖFNER T, SPRICK M, SCHARPFF M, MARMÉ F, SINN H P,PANTEL K, WEICHERT W, TRUMPP A. Nat. Biotechnol. , 2013, 31(6): 539-544.
[8] NELLORE B P V, KANCHANAPALLY R, PRAMANIK A, SINHA S S, CHAVVA S R, HAMME II A, RAY P C.Bioconjugate Chem. , 2015, 26(2): 235-242.
[9] FERREIRA M M, RAMANI V C, JEFFREY S S. Mol. Oncol. , 2016, 10(3): 374-394.
[10] SHAO D, LU M M, ZHAO Y W, ZHANG F, TAN Y F, ZHENG X, PAN Y, XIAO X A, WANG Z, DONG W F, LI J, CHENL. Acta Biomater. , 2017, 49: 531-540.
[11] WANG Z, CHANG Z, LU M, SHAO D, YUE J, YANG D, ZHENG X, LI M, HE K, ZHANG M, CHEN L, DONG W F.Biomaterials, 2018, 154: 147-157.
[12] CHANG Z M, WANG Z, SHAO D, YUE J, XING H, LI L, GE M, LI M, YAN H, HU H, XU Q, DONG W F. ACS Appl.Mater. Interfaces, 2018, 10(13): 10656-10663.
[13] YU Y, ZHANG Y, CHEN Y, WANG X, KANG K, ZHU N, WU Y, YI Q. ACS Sens. , 2023, 8(4): 1858-1866.
[14] WANG Z, SUN N, LIU H, CHEN C, DING P, YUE X, ZOU H, XING C, PEI R. ACS Appl. Mater. Interfaces, 2019, 11(43):39586-39593.
[15] WANG G, BENASUTTI H, JONES J F, SHI G, BENCHIMOL M, PINGLE S, KESARI S, YEH Y, HSIEH L E, LIU Y T,ELIAS A, SIMBERG D. Colloids Surf. , B, 2018, 161: 200-209.
[16] GAO W, HUANG T, YUAN H, YANG J, JIN Q, JIA C, MAO G, ZHAO J. Talanta, 2018, 185: 229-236.
[17] CHEN J, XIE T, YANG J, LIN X, HUANG L, SU S, DENG J. J. Cancer Res. Clin. Oncol. , 2023, 149(11): 8699-8709.
[18] LIU C, CHEN H, SUN T, WANG H, CHEN B, WANG X. Transl. Oncol. , 2021, 14(5): 101052.
[19] KARABACAK N M, SPUHLER P S, FACHIN F, LIM E J, PAI V, OZKUMUR E, MARTEL J M, KOJIC N, SMITH K,CHEN P I, YANG J, HWANG H, MORGAN B, TRAUTWEIN J, BARBER T A, STOTT S L, MAHESWARAN S, KAPURR, HABER D A, TONER M. Nat. Protoc. , 2014, 9(3): 694-710.
[20] YIN D, SHI A, ZHOU B, WANG M, XU G, SHEN M, ZHU X, SHI X. Langmuir, 2022, 38(36): 11080-11086.
[21] CHENG S B, XIE M, CHEN Y, XIONG J, LIU Y, CHEN Z, GUO S, SHU Y, WANG M, YUAN B F, DONG W G, HUANGW H. Anal. Chem. , 2017, 89(15): 7924-7932.
[22] ZHANG L, XU Z, KANG Y, XUE P. Electrophoresis, 2018, 39(12): 1452-1459.
[23] KANG S, YANG M, HE S, WANG Y, CHEN X, CHEN Y Q, HONG Z, LIU J, JIANG G, CHEN Q, ZHOU Z, ZHOU Z,HUANG Z, HUANG X, HE H, ZHENG W, LIAO H X, XIAO F, SHAN H, CHEN S. Nat. Commun. , 2021, 12(1): 2697.
[24] LI Q, WU J, NIE J, ZHANG L, HAO H, LIU S, ZHAO C, ZHANG Q, LIU H, NIE L, QIN H, WANG M, LU Q, LI X, SUNQ, LIU J, ZHANG L, LI X, HUANG W, WANG Y. Cell, 2020, 182(5): 1284-1294.e9.
[25] LU R, ZHAO X, LI J, NIU P, YANG B, WU H, WANG W, SONG H, HUANG B, ZHU N, BI Y, MA X, ZHAN F, WANG L,HU T, ZHOU H, HU Z, ZHOU W, ZHAO L, CHEN J, MENG Y, WANG J, LIN Y, YUAN J, XIE Z, MA J, LIU W J, WANGD, XU W, HOLMES E C, GAO G F, WU G, CHEN W, SHI W, TAN W. Lancet, 2020, 395(10224): 565-574.
[26] LI J, LILLEHOJ P B. ACS Sens. , 2021, 6(3): 1270-1278.
[27] LYU A, JIN T, WANG S, HUANG X, ZENG W, YANG R, CUI H. Sens. Actuators, B, 2021, 349: 130739.
[28] KONG W, ZHAO X, ZHU Q, GAO L, CUI H. Anal. Chem. , 2017, 89(13): 7145-7151.
[29] LI Y, LIN C, PENG Y, HE J, YANG Y. Sens. Actuators, B, 2022, 365: 131974.
[30] HUERGO L F, SELIM K A, CONZENTINO M S, GERHARDT E C M, SANTOS A R S, WAGNER B, ALFORD J T,DEOBALD N, PEDROSA F O, DE SOUZA E M, NOGUEIRA M B, RABONI S M, SOUTO D, REGO F G M, ZANETTE DL, AOKI M N, NARDIN J M, FORNAZARI B, MORALES H M P, BORGES V A, NELDE A, WALZ J S, BECKER M,SCHNEIDERHAN-MARRA N, ROTHBAUER U, REIS R A, FORCHHAMMER K. ACS Sens. , 2021, 6(3): 703-708.
[31] NEVES W L L, MARIUBA L A M, ALVES K C S, COELHO K F, TARRAGÔ A M, COSTA A G, CHAVES Y O,VICTORIA F D, VICTORIA M B, MALHEIRO A. Biotechnol. Biotechnol. Equip. , 2021, 35(1): 103-110.
[32] SEBBA D, LASTOVICH A G, KURODA M, FALLOWS E, JOHNSON J, AHOUIDI A, HONKO A N, FU H, NIELSON R,CARRUTHERS E, DIÉDHIOU C, AHMADOU D, SOROPOGUI B, RUEDAS J, PETERS K, BARTKOWIAK M,MAGASSOUBA N, MBOUP S, BEN AMOR Y, CONNOR J H, WEIDEMAIER K. Sci. Transl. Med. , 2018, 10(471):eaat0944.
[33] WU P, SONG J, SUN C, ZUO W, DAI J, JU Y. TrAC, Trends Anal. Chem. , 2023, 166: 117203.
[34] SHANG Y, XIANG X, YE Q, WU Q, ZHANG J, LIN J. TrAC, Trends Anal. Chem. , 2022, 147: 116509.
[35] LEE D, GORKIN D U, BAKER M, STROBER B J, ASONI A L, MCCALLION A S, BEER M A. Nat. Genet. , 2015, 47(8):955-961.
[36] LEK M, KARCZEWSKI K J, MINIKEL E V, SAMOCHA K E, BANKS E, FENNELL T, O’DONNELL-LURIA A H,WARE J S, HILL A J, CUMMINGS B B, TUKIAINEN T, BIRNBAUM D P, KOSMICKI J A, DUNCAN L E, ESTRADA K,ZHAO F, ZOU J, PIERCE-HOFFMAN E, BERGHOUT J, COOPER D N, DEFLAUX N, DEPRISTO M, DO R,FLANNICK J, FROMER M, GAUTHIER L, GOLDSTEIN J, GUPTA N, HOWRIGAN D, KIEZUN A, KURKI M I,MOONSHINE A L, NATARAJAN P, OROZCO L, PELOSO G M, POPLIN R, RIVAS M A, RUANO-RUBIO V, ROSE S A,RUDERFER D M, SHAKIR K, STENSON P D, STEVENS C, THOMAS B P, TIAO G, TUSIE-LUNA M T, WEISBURD B,WON H H, YU D, ALTSHULER D M, ARDISSINO D, BOEHNKE M, DANESH J, DONNELLY S, ELOSUA R, FLOREZJ C, GABRIEL S B, GETZ G, GLATT S J, HULTMAN C M, KATHIRESAN S, LAAKSO M, MCCARROLL S,MCCARTHY M I, MCGOVERN D, MCPHERSON R, NEALE B M, PALOTIE A, PURCELL S M, SALEHEEN D,SCHARF J M, SKLAR P, SULLIVAN P F, TUOMILEHTO J, TSUANG M T, WATKINS H C, WILSON J G, DALY M J,MACARTHUR D G. Nature, 2016, 536(7616): 285-291.
[37] BURROWS J, NITSCHE A, BAYLY B, WALKER E, HIGGINS G, KOK T. BMC Microbiol. , 2002, 2(1): 12.
[38] WU K, SAHA R, SU D, KRISHNA V D, LIU J, CHEERAN M C J, WANG J P. ACS Appl. Nano Mater. , 2020, 3(10):9560-9580.
[39] ADAMS C F, RAI A, SNEDDON G, YIU H H P, POLYAK B, CHARI D M. Nanomedicine, 2015, 11(1): 19-29.
[40] ADAMS N M, BORDELON H, WANG K K A, ALBERT L E, WRIGHT D W, HASELTON F R. ACS Appl. Mater.Interfaces, 2015, 7(11): 6062-6069.
[41] SUN N, DENG C, GE G, XIA Q. Biotechnol. Lett. , 2015, 37(1): 211-218.
[42] MOERLAND C P, VAN IJZENDOORN L J, PRINS M W J. Lab Chip, 2019, 19(6): 919-933.
[43] CAO Q, HAN X, LI L. Lab Chip, 2014, 14(15): 2762-2777.
[44] BOOM R, SOL C J, SALIMANS M M, JANSEN C L, WERTHEIM-VAN DILLEN P M, VAN DER NOORDAA J. J. Clin.Microbiol. , 1990, 28(3): 495-503.
[45] BOOM R, SOL C J A, HEIJTINK R, WERTHEIM-VAN DILLEN P M, VAN DER NOORDAA J. J. Clin. Microbiol. , 1991,29(9): 1804-1811.
[46] SUN N, DENG C L, LIU Y, ZHAO X L, TANG Y, LIU R X, XIA Q, YAN W L, GE G L. J. Chromatogr. A, 2014, 1325: 31-39.
[47] FEI Z, LIU P, CHENG C, WEI R, XIAO P, ZHANG Y. ACS Appl. Mater. Interfaces, 2023, 15(4): 4924-4934.
[48] HUANG Hua-Bin, ZHUANG Zhi-Xia, YANG Chao-Yong, WANG Xiao-Ru. Chin. J. Anal. Chem. , 2014, 42(11): 1598-1603.
黄华斌, 庄峙厦, 杨朝勇, 王小如. 分析化学, 2014, 42(11): 1598-1603.
[49] CUI F R, WANG J, OPAL S M, TRIPATHI A. PloS One, 2016, 11(2): e0149522.
[50] STROTMAN L, O′CONNELL R, CASAVANT B P, BERRY S M, SPERGER J M, LANG J M, BEEBE D J. Anal. Chem. ,2013, 85(20): 9764-9770.
[51] ZAYANI R, REZIG D, FARES W, MARRAKCHI M, ESSAFI M, RAOUAFI N. Anal. Chem. , 2021, 93(32): 11225-11232.
[52] LI M, DIEHL F, DRESSMAN D, VOGELSTEIN B, KINZLER K W. Nat. Methods, 2006, 3(2): 95-97.
[53] DIEHL F, LI M, HE Y, KINZLER K W, VOGELSTEIN B, DRESSMAN D. Nat. Methods, 2006, 3(7): 551-559.
[54] CABEZAS-CAMARERO S, GARCÍA-BARBERÁN V, PÉREZ-ALFAYATE R, CASADO-FARIÑAS I, SLOANE H,JONES F S, PÉREZ-SEGURA P. Cancers, 2022, 14(12): 2891.
[55] GARRIDO P, PAZ-ARES L, MAJEM M, MORÁN T, TRIGO J M, BOSCH-BARRERA J, GARCΊA-CAMPELO R,GONZÁLEZ-LARRIBA J L, SÁNCHEZ-TORRES J M, ISLA D, VIÑOLAS N, CAMPS C, INSA A, JUAN Ó, MASSUTI B,PAREDES A, ARTAL Á, LÓPEZ-BREA M, PALACIOS J, FELIP E. Cancer Med. , 2021, 10(17): 5878-5888.

