脂滴荧光探针的研究进展


摘要 脂滴(LDs)是真核细胞中一类重要的细胞器,在脂质代谢等生命活动中发挥了重要作用。脂滴的检测不仅有助于理解脂滴参与生命活动的作用机制,而且对相关疾病的诊断和治疗具有重要的指导意义。脂滴荧光探针可分为两类:一类是单功能脂滴定位探针,仅对细胞中的脂滴进行特异性标记和荧光成像;另一类是多功能脂滴荧光探针,具有定位脂滴、监测细胞微环境、同时成像双细胞器、检测脂滴中活性物种和诊疗一体化等多重功能。本文对近年来报道的脂滴荧光探针进行了总结与评述,探讨了脂滴荧光探针应用于探究重要细胞生理过程、脂滴与其它细胞器(如内质网、线粒体、溶酶体和细胞核等)的动态相互作用以及在相关疾病诊断方面的发展趋势。
关键词 脂滴;荧光探针;生物成像;细胞器靶向;评述
脂滴(Lipid droplets, LDs)是一种普遍存在于大多数细胞和生物体中的高度动态的球形细胞器[1]。脂滴的结构与传统的膜结构细胞器不同,其疏水的中性脂质核心被单层磷脂膜和一组具有不同功能的表面蛋白覆盖[2]。脂滴是一种多功能细胞器,不仅用于细胞内脂质储存,还参与调节多种代谢过程[3],如脂质代谢、膜合成和转移、信号转导和蛋白质降解等[4]。脂滴的相关性质与细胞的生理状态密切相关,细胞内稳态破坏或微环境突变使得细胞器出现异常,从而导致紊乱,甚至发生肥胖、糖尿病、神经退行性疾病、炎症性疾病和癌症等疾病[ 5-8] ,因此,异常积累的脂滴已成为多种脂质失衡有关疾病的标志物[9-10]。脂滴与许多细胞器存在相互作用,包括线粒体、过氧化物酶体、溶酶体、内质网和细胞核等[11]。实时监测脂滴动态变化及脂滴与其它细胞器的相互作用,对深入了解细胞的生理状态以及对相关疾病的早期诊断具有重要意义。
传统的透射电镜和拉曼显微镜方法由于操作过程复杂,不适合实时跟踪活细胞内脂滴的分解、融合以及运动等行为[12]。荧光成像技术因具有高灵敏度、高选择性、无创、可实时成像、样品制备方便以及具有高时空分辨率等优点[13-14],已成为活细胞内脂滴精确定位的有力工具。荧光成像技术的核心为荧光探针分子,虽然尼罗红(NileRed)和BODIPY 493/503 等商业染料已广泛用于标记脂滴[15],但是仍有很多局限之处,如尼罗红会同时染色细胞中的其它疏水结构,导致对脂滴的选择性较低;BODIPY 493/503对脂滴虽然表现出较高的选择性,但染色耗时长,斯托克斯位移小,可能会导致激发光谱和发射光谱之间的严重串扰[16]。因此,开发性能优良的脂滴靶向荧光探针对相关疾病的诊断至关重要。
近年来,一系列具有较高选择性、良好光学性质以及低细胞毒性的脂滴靶向性荧光探针陆续被报道[17-18]。脂滴荧光探针设计的关键点之一是调节探针的疏水性,探针的亲脂基团与脂滴内脂质结合,使其优先聚集于脂滴疏水内核,从而实现脂滴的特异性识别。研究者常利用长烷基链、三苯胺和苝等取代基团,提高探针的脂滴靶向能力[19-20]。探针设计的另一个关键点在于提高其在脂滴中的荧光量子产率[21]。依据脂滴极性、粘度以及含水量等微环境,研究者常基于分子内电荷转移(Intramolecular charge"transfer, ICT)、聚集诱导发光(Aggregation-induced emission, AIE)、扭曲分子内电荷转移(Twisted intramolecularcharge transfer, TICT)和激发态分子内质子转移(Excited state intramolecular proton transfer,ESIPT)等荧光响应机理合理设计脂滴荧光探针的结构[22-25]。此外,基于碳点和量子点的荧光纳米探针也被应用于脂滴成像。本文从荧光探针的设计、结构和功能等方面对近年来开发的脂滴荧光探针及其生物学应用进行了总结和评述。
1 单功能脂滴特异性荧光探针
1.1 有机小分子脂滴荧光探针
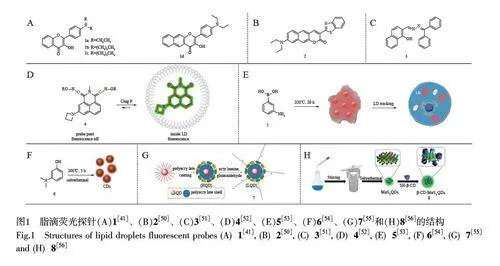
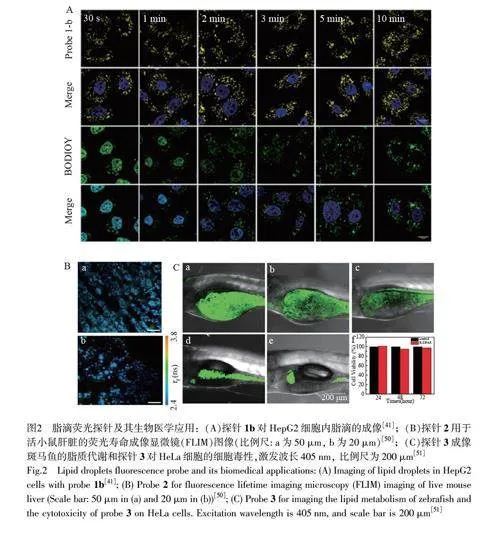
近年来,有机小分子荧光探针在生物分析领域备受关注。基于BODIPY[26-30]、苯并噻唑[31-36]、萘酰亚胺[37-39]、3-羟基黄酮衍生物[40-41]、香豆素[42-44]、单苯环[45]和多环芳烃[46-49]等结构的荧光团被广泛应用于脂滴荧光探针的设计。Jiang 等[41]报道了一系列基于3-羟基黄酮的荧光探针(图1A, 1a~1d),用于监测细胞和组织中脂滴的动态变化。该系列探针的亲脂性可通过二烷基氨基的链长调节,不同链长的探针(1a~1c)均有良好的膜通透性和两亲性,并能特异性染色脂滴。同时,通过调节3-羟基黄酮单元的共轭结构,该研究组还开发了另外一种不同发射波长的脂滴探针1d。该系列探针在水溶液中发射较弱荧光,在有机溶剂中则显示较强的荧光和较大的Stokes 位移(gt;150 nm), 并表现出良好的亲脂性。HepG2 细胞成像实验表明,该系列探针可用于有效观测脂滴的动态变化(图2A)[41]。
Yoshihara等[50]构建了一种脂滴靶向的香豆素类荧光探针2(图1B)。光谱实验结果表明,探针从正己烷(λex=498 nm)到乙腈(λex=625 nm)有较大红移,表现出明显的溶剂变色效应。同时,探针2 在正己烷和乙腈中均表现出较高的荧光量子产率(Φgt;0.8)。此外,利用荧光寿命成像显微镜对活体小鼠肝细胞中的脂滴进行成像,可以明显区分脂滴探针的荧光信号与细胞/组织的自发荧光(图2B)[50],并可用于监测和跟踪培养细胞、特定组织和器官中脂滴的形成。Zhou 等[51]结合ESIPT 机制开发了一种AIE 荧光探针3(图1C)用于细胞内脂滴成像,具有高选择性、良好的光稳定性、大的斯托克斯位移、良好的生物相容性以及免洗成像等优点。生物实验结果表明,探针3 可用于监测斑马鱼中脂滴的形成及变化发展过程(图2C)[51]。
Chen 等[52]设计合成了基于萘酰亚胺荧光团的探针4(图1D)。探针4 的荧光开-关由氢键可逆控制,根据脂滴内/外的质子和非质子环境对脂滴进行荧光染色。萘酰亚胺核心的两个羰基可作为质子接受位点,这些位点在脂滴外的质子环境中形成氢键,从而使探针处于荧光淬灭状态,而探针4 在脂滴内的弱极性、非质子性环境中荧光开启。与传统高亲脂性脂滴探针不同,该探针不完全进入到脂滴内,而是在脂滴外形成一个缓冲池。进入到脂滴的探针分子开启荧光成像脂滴。探针分子在脂滴内的部分被氧化,发生光漂白,又使得亲水性增加,光漂白的荧光团会从脂滴中释放出来,并与缓冲池中未被氧化的探针进行动态交换,从而实现长期稳定地动态监测脂滴。
1.2 基于碳点/量子点的脂滴荧光纳米探针
碳点(CDs)具有优异的光学性能,如高量子产率、可调谐的发射波长和良好的生物相容性等优点。She 等[53]合成了一种基于硼和氮共掺杂碳点的脂滴纳米荧光探针5(图1E)。该探针以3-氨基苯硼酸为原料,通过热干法制备而成,平均尺寸约为6.9 nm。探针5 可在不引入脂滴靶向配体的情况下实现脂滴免洗成像,并可动态监测活细胞中的脂滴。Jing 等[54]以3-(二甲胺基)苯酚为原料,采用溶剂热合成法合成了一种基于碳点的脂滴荧光探针6(图1F),由于该探针具有低光毒性和良好的光稳定性,不仅能追踪活细胞中脂滴的动态,并可在不同细胞系和富脂组织中成像脂滴以及区分癌细胞与正常细胞,对深入了解脂滴相关疾病具有重要价值。
Mandal 等[55]设计了一种基于量子点的脂滴荧光纳米探针7(图1G)。该探针具有一个量子点核心和一个具有两性离子表面电荷的聚合物外壳。该纳米探针具有30~40 nm 的水动力尺寸,在生理pH 条件下表面电荷接近于零,通过脂筏内吞作用进入细胞并标记脂滴。Liang 等[56]开发了一种环糊精修饰表面的基于二硫化钼量子点的荧光探针8(图1H)。二硫化钼量子点具有良好的荧光特性、优异的生物相容性和良好的稳定性。细胞成像实验显示,这些量子点通过多种内化途径进入活细胞的脂滴内,有望成为一种有效的细胞脂质代谢监测工具。
基于碳点和量子点的脂滴荧光探针制备工艺简单,可通过控制纳米粒子的大小调谐荧光发射性能,并且无需脂滴靶向基团的修饰,一般通过细胞的内吞作用最终靶向脂滴。有些结构复杂的有机小分子脂滴荧光探针的合成步骤繁琐,成本相对较高,但可通过对荧光团的修饰进行一定预期的功能化,可进一步设计成为多功能脂滴荧光探针,应用范围更广。
2 多功能脂滴特异性荧光探针
2.1 脂滴微环境检测荧光探针
脂滴内微环境因素主要包括极性、粘度和pH 值等,与细胞代谢和生理过程密切相关,其非正常水平变化可在一定程度上反映细胞功能的异常[57-58]。
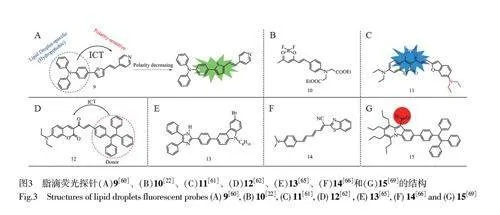
脂滴的极性反映了脂滴的状态和功能,在调节生物过程中发挥了关键作用[59]。Fan 等[60]报道了一种可视化炎症模型和临床癌症患者样本中脂滴极性的荧光探针9(图3A)。该探针具有典型的D-π-A结构,脂滴靶向基团三苯胺作为电子供体,吡啶作为电子受体。由于ICT 效应,在低极性条件下,探针由于电荷分离较少,与溶剂的相互作用较弱,因而发出强而较短的荧光。在高极性介质中,由于探针与溶剂之间的偶极-偶极相互作用,使其发生大的电荷分离和激发态能量耗散,导致激发能非辐射弛豫,使得荧光猝灭。探针在Δf=0.258~0.312 的线性范围内对极性变化表现出较高的灵敏度,荧光增强超过278 倍。使用该探针首次通过共聚焦激光扫描成像脂肪肝组织、炎症活小鼠和癌症患者手术样本中脂滴的极性,在癌症的临床诊断中拥有巨大的应用潜力。近年报道了许多基于ICT 机制的极性敏感的脂滴探针如探针10~12(图3B~3D)[22,61-62],为深入研究脂滴极性提供了更多工具。
细胞粘度在与扩散控制相关的生理过程中起着关键作用。粘度异常可直接反映身体功能异常,异常的粘度会破坏机体中不同细胞器与细胞代谢的相互作用,甚至引起潜在的脂质毒性,导致阿尔茨海默病、高血压、动脉粥样硬化和高脂血症等疾病[63-65]。Chen 等[65]合成了一种对粘度敏感的脂滴荧光探针13(图3E)。在低粘度下,苯环与咔唑之间的单键可自由旋转,整个探针不共平面,探针不发射荧光;在较高粘度下,由于单键旋转受到限制,荧光强度明显增加。此外,修饰咔唑的己基可增加探针的脂质相容性,能准确地靶向活细胞中的脂滴并检测其粘度。利用单键旋转受限, Dong 等[66]设计并合成了一种粘度敏感的近红外荧光探针14(图3F)用于对细胞铁死亡过程中脂滴粘度的实时和原位成像。随着粘度增加,探针中3 个单键的自由旋转被限制,导致723 nm 处的荧光显著增强。生物成像实验表明,细胞发生铁死亡过程并导致脂滴粘度增加。
细胞内/外多种生理和病理过程导致的pH 值变化,可以反映一些相关的炎症和疾病[67-68]。Sk 等[69]开发了一种基于烷基取代吡啶醇和四苯乙烯的pH 敏感型脂滴荧光探针15(图3G)。该探针在酸性条件下发生质子化,进而影响探针的光物理性质。质子化过程改变探针平面结构,削弱共轭,导致荧光发射减弱甚至完全猝灭。随着pH 值增大,探针在碱性环境下发生去质子化,分子平面结构恢复,荧光强度增强。此外,该探针对高/低等真核生物中的脂滴均具有靶向能力。
2.2 双细胞器靶向脂滴荧光探针
细胞中的生命活动通常与多个细胞器相关,可同时定位多个细胞器的单一荧光探针近年受到广泛关注[70]。具有特定功能的细胞器之间密切接触并相互协作,形成细胞器互作网络,实现快速的信息交流和物质交换,高效有序地进行不同细胞生命条件下的多种生物学过程。对不同细胞器的同时成像对于阐明它们的分布和相互作用非常有价值[71,73]。因此,开发可同时靶向脂滴和其它细胞器的有机小分子荧光探针,对研究细胞器间相互作用、分子调节机制乃至在细胞、组织、个体水平的生理功能研究中均具有重要意义。
内质网主要由不饱和磷脂组成的脂质双分子层包围,包括一定数量的水,并显示出比脂滴更高的极性[74-75]。Guo 等[23]利用脂滴与内质网含水量的差异,以经典的ESIPT 骨架3-羟基黄酮为基础,通过引入不同侧取代基设计并合成了两种荧光探针(图4A, 16a 和16b),用于对脂滴和内质网的双色成像。一方面,不同侧取代基可以通过调整探针的亲脂性提高对脂滴和内质网的靶向能力;另一方面,侧取代基的供电子能力又会影响探针对不同含水环境的荧光响应敏感性。原位和实时荧光成像实验结果表明,探针16a/16b 可通过不同荧光颜色区分脂滴和内质网,脂滴和内质网分别显示橙色和绿色荧光,进一步揭示了脂滴和内质网之间的相互作用,有助于深入了解与其相关的生理过程。
线粒体作为细胞内的能量工厂,能够为发生在细胞质膜上的多种生命活动,如细胞的分裂、增殖等生理活动提供主要能量。单层质膜结构的脂滴与线粒体存在密切的联系[76-77]。靶向线粒体和脂滴的荧光探针应分别具有阳离子结构和中性亲脂性结构,为了能够同时兼具这两种结构特性,并克服在成像应用上的局限性, Zhang 等[24]设计了一种AIE 单分子双靶标探针17(图4B),实现了脂滴和线粒体双色成像。基于这种兼具亲脂性和阳离子结构的设计,该探针能够穿过磷脂双分子层生物膜结构,并于较大膜电位驱动下在线粒体内积累。探针17 通过酯酶介导的水解调节探针的双色发射。探针17 的阳离子部分通过静电作用靶向线粒体,并在650 nm 处发射红色荧光;经酯酶水解后,亲脂性片段在脂滴内富集,并同时在480 nm 处发出蓝色荧光。该探针为酯酶活性检测和细胞活力评估提供了强有力的工具。这种同时靶向线粒体和脂滴的单分子荧光探针受到了广泛研究,探针18 和19(图4C 和4D)[78-79]基于分子螺旋环化的策略,利用线粒体和脂滴之间的电荷差异,分别以阳离子开环和中性闭环形式靶向线粒体和脂滴,实现线粒体和脂滴的双色成像。
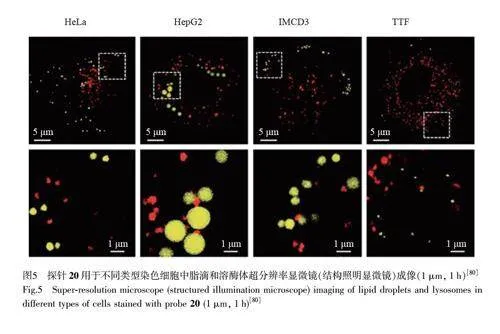
溶酶体是典型的酸性细胞器(pH 4.5~5.0),在内吞和内源性胞内物质的消化和清除过程中起着关键作用。脂滴和溶酶体在某些生物过程中也会相互作用[80-82]。Zheng 等[80]报道了一种基于萘酰亚胺的荧光探针20(图4E),用于同时双色成像脂滴和溶酶体。探针在中性脂滴内发出黄色荧光,而萘酰亚胺相连的二甲氨基又会在酸性微环境的溶酶体中发生质子化,从而靶向溶酶体发出红色荧光。探针20 通过对脂滴和溶酶体的超分辨率成像,可以定量检测这两种细胞器的数量和直径,并能够实时跟踪脂滴和溶酶体的运动行为(图5)[80]。此外,该探针还可用于不同细胞系和斑马鱼胚胎的成像,为脂滴和溶酶体之间的相互作用提供了证据。类似地,探针21~23(图4F~4H)[83-85]也被应用于脂滴和溶酶体的同时成像,并具有较好的光稳定性和较低的细胞毒性,为深入研究二者的相互作用提供了更多方法。
细胞核是存在于真核细胞中的封闭式膜状细胞器,储存了真核细胞的遗传物质,在调节细胞分化和行为方面具有重要作用[86]。原位检测脂滴和细胞核,对于深入探索亚细胞器的相互作用具有重要意义。Wang 等[87]利用香豆素和阳离子喹啉单元开发了一种用于同时靶向脂滴和细胞核的荧光探针24(图4I)。探针24 可以通过产生比率荧光发射和荧光寿命信号对细胞微环境极性的变化进行监测。荧光成像实验表明,利用探针24 可观察到在铁死亡过程中脂滴极性明显增加,并且脂滴与细胞质之间的极性均质化。探针24 还具有良好的核酸结合能力,可用于区分铁死亡和细胞凋亡。
2.3 生物活性物种检测荧光探针
活性氧(ROS)、活性氮(RNS)和活性硫(RSS)是多种类型细胞中产生的活性小分子,在调节许多生理过程中发挥了重要作用,监测其变化有助于研究氧化应激导致的疾病的发病机制和进展,并促进早期诊断和药物开发。近年来,研究者开发了许多用于监测ROS、RNS 和RSS 水平的荧光探针[88-90]。
Li 等[91]以三苯胺为骨架,通过在三苯胺上连接富电子硫醚基团和强吸电子–CN 基团构建D-π-A 分子结构,开发了一种可检测ROS 的新型脂滴荧光探针25(图6A)。探针25 具有较好的细胞穿透性,可特异性定位于脂滴并发出橙色荧光。探针25 不仅表现出典型的AIE 特性,还具有较大的Stokes 位移,避免了与细胞自身荧光重叠。另外,探针25 的硫醚和乙烯基两个位点对ClO–具有良好的灵敏度和选择性,可特异性检测活细胞中的ClO–(图7A)[91]。这种具有高亮度、低细胞毒性的多功能脂滴荧光探针被应用于斑马鱼体成像以及实时监测HeLa 细胞中ClO–波动。Shi 等[92]报道了一种AIE 近红外荧光探针26(图6B),不仅可通过比率成像细胞的内/外源性ClO–,还可特异性靶向脂滴。当探针26 与ClO–反应时,ICT 过程中断,荧光增强,并由红色变为蓝色。此外,通过将探针26 负载到蛋白上还可有效提高其对ClO–的响应速度。
本研究组[93]开发了一种脂滴靶向和生物硫醇敏感的荧光探针27(图6C)。该探针以苯并噻唑衍生物为荧光团、2, 4-二硝基苯磺酰(DNBS)为生物硫醇响应位点,对生物硫醇具有高选择性,并显示出明显且快速的荧光开启反应,这是由于强亲核取代生物硫醇和硫化钠促进DNBS 裂解,然后快速环化释放荧光苯并噻唑基伊豆素BTDA。此外,探针27 还具有优异的脂滴靶向能力(图7B)[93],不仅可用于活细胞中脂滴内生物硫醇的选择性成像,还可用于区分癌细胞/组织和正常细胞/组织以及癌症患者手术标本的诊断。
Pan 等[94]报道了一种基于BODIPY 的脂滴荧光探针28(图6D),探针通过β-D-半乳糖部分与肝癌细胞表面高水平的唾液糖蛋白受体(ASGPr)结合,并在ASGPr 介导下通过内吞作用靶向肝癌细胞,进入到肝癌细胞后的探针分子富集在低极性的脂滴内。探针28 具有高选择性和高灵敏度,在肝细胞中实现了对脂滴和NO 的双重靶向识别。通过探针28 可实时观察NO 对HIF-1 活性的影响,为深入理解HIF-1 的上调途径提供了可能。
2.4 诊疗一体化脂滴荧光探针
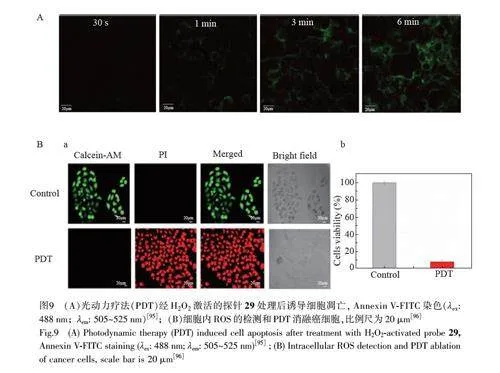
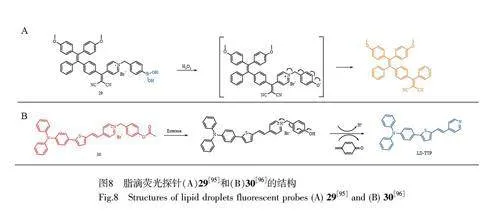
光动力治疗(PDT)作为一种无创癌症治疗方式,主要利用光敏剂在细胞内产生细胞毒性的ROS 引导癌症治疗[95]。Jiang 等[95]制备了一种H2O2 激活的脂滴靶向荧光探针29(图8A),用于荧光引导癌细胞光动力治疗。硼酸酯作为H2O2 反应位点,在缺氧的癌细胞中与高水平的H2O2 反应,探针释放出的疏水部分积聚在脂滴内,并发出红色荧光。此外,在光照射下,探针29 激活H2O2 产生单线态氧,触发癌细胞凋亡,从而达到治疗的目的。经探针29 处理后由H2O2 激活诱导的细胞凋亡实验中,随时间延长,探针的荧光信号增强,在6 min 时大部分细胞发生凋亡,显示出较高的PDT 效率(图9A)[95]。
本研究组[96]开发了一种多功能AIE 脂滴荧光探针30(图8B),用于癌症的诊断和治疗。酯酶介导的水解过程不仅能反映酯酶活力水平,还可利用发射波长的变化区分活细胞、凋亡细胞和死细胞。脂滴荧光探针30 在白光照射下也表现出显著的ROS 生成能力,被成功用于癌细胞的高效PDT(图9B)[96]。因此,探针30 在实时监测细胞凋亡和光动力消融癌细胞方面均具有巨大的应用潜力,可望作为癌细胞诊疗一体化的分子工具。
3 总结与展望
本文总结了近年来脂滴荧光探针的研究进展,并分别介绍了这些荧光探针在生物成像中的应用及其响应机理。此类荧光探针大多具有某种识别基团或结合位点,基于同一个功能化的分子,以不同的相互作用或不同的响应机理与受体结合,从而产生明显的光谱变化,达到特异性识别的目的。这些荧光探针或能用于脂滴成像、监测脂滴微环境或同时靶向其它细胞器,以及监测多种活性物质和诊疗疾病等。深入研究脂滴探针将有助于研究者进一步理解亚细胞水平上生理活动的分子机制和探究脂滴相关疾病的影响因素,以及利用脂滴探针进行疾病的早期诊断及后期治疗。作为一种重要的成像工具,脂滴荧光探针在生理学、医学等领域具有越来越广阔的应用前景。但是,近红外脂滴探针尤其是近红外二区探针的数量目前仍较为有限,组织穿透深度等问题依然未得到有效解决。因此,结合不同的响应机制并引入共轭度更高的基团,将发射波长扩展至近红外区,将是该类荧光探针的重要研究方向之一。开发同时靶向多种细胞器并可与多种活性物质或离子发生灵敏响应的脂滴探针也是未来该领域需关注的方向。此外,结合脂滴探针的成像优势及光疗特征,同时在探针平台中负载药物活性分子,在脂质异常类疾病的诊疗一体化方面具有广阔的应用前景。因此需要研究者对探针分子结构进行更合理的设计,探索更多反应机制,满足更多场景的实际应用需求。但是,目前的工作主要集中在基础研究方面,在临床上尚未广泛应用。总之,脂滴荧光探针的开发设计应考虑以下方面:(1)潜在的生物毒性可能会对人体生理功能产生不利影响;(2)荧光寿命短、响应时间长、灵敏度不高、化学合成过程繁琐耗时等缺点会阻碍脂滴荧光探针的产业化发展;(3)除通过合理的策略消除上述不利因素外,脂滴在活体动物模型中的活性、毒理学和药代动力学评价测试,对于脂滴荧光探针的更广泛应用至关重要。
References
[1] NIU G, ZHANG R, KWONG J P C, LAM J W Y, CHEN C, WANG J, CHEN Y, FENG X, KWOK R T K, SUNG H H Y,WILLIAMS I D, ELSEGOOD M R J, QU J, MA C, WONG K S, YU X, TANG B Z. Chem. Mater. , 2018, 30(14): 4778-4787.
[2] GELTINGER F, SCHARTEL L, WIEDERSTEIN M, TEVINI J, AIGNER E, FELDER T K, RINNERTHALER M.Molecules, 2020, 25(21): 5053.
[3] DEJGAARD S Y, PRESLEY J F. Int. J. Mol. Sci. , 2021, 22(5): 2776.
[4] SAYED S M, LI X-F, JIA H R, DURRANI S, WU F G, LU X. Sens. Actuators, B, 2021, 343: 130128.
[5] APPELQVIST H, STRANIUS K, BÖRJESSON K, NILSSON K P R, DYRAGER C. Bioconjugate Chem. , 2017, 28(5):1363-1370.
[6] GOLDBERG I J, REUE K, ABUMRAD N A, BICKEL P E, COHEN S, FISHER E A, GALIS Z S, GRANNEMAN J G,LEWANDOWSKI E D, MURPHY R, OLIVE M, SCHAFFER J E, SCHWARTZ-LONGACRE L, SHULMAN G I,WALTHER T C, CHEN J. Circulation, 2018, 138(3): 305-315.
[7] MAAN M, PETERS J M, DUTTA M, PATTERSON A D. Biochem. Biophys. Res. Commun. , 2018, 504(3): 582-589.
[8] TEIXEIRA V, MACIEL P, COSTA V. Biochim. Biophys. Acta, Mol. Cell Biol. Lipids, 2021, 1866(1): 158820.
[9] PETAN T. Rev. Physiol. Biochem. Pharmacol. , 2020, 185: 53-86.
[10] ZADOORIAN A, DU X, YANG H. Nat. Rev. Endocrinol. , 2023, 19(8): 443-459.
[11] ZHOU R, WANG C, LIANG X, LIU F, YAN X, LIU X, SUN P, ZHANG H, WANG Y, LU G. ACS Mater. Lett. , 2021, 3(5):516-524.
[12] DAI Y, ZHANG P, ZHAO X, ZHANG D, XUE K, MISAL S, ZHU H, QI Z. Dyes Pigm. , 2021, 188: 109167.
[13] ZHU L, HUANG L, SU W, LIANG X, LIN W. Chem. Asian J. , 2022, 17(5): e202101304.
[14] ZHAO N, LI Y, YIN W, ZHUANG J, JIA Q, WANG Z, LI N. ACS Appl. Mater. Interfaces, 2020, 12(2): 2076-2086.
[15] MOTA A A R, CORREA J R, DE ANDRADE L P, ASSUMPÇÃO J A F, DE SOUZA CINTRA G A, FREITAS-JUNIOR L H, DA SILVA W A, DE OLIVEIRA H C B, NETO B A D. ACS Omega, 2018, 3(4): 3874-3881.
[16] FAM T, KLYMCHENKO A, COLLOT M. Materials, 2018, 11(9): 1768.
[17] MURALE D P, HAQUE M M, HONG K T, LEE J S. Bull. Korean Chem. Soc. , 2021, 42(1): 111-114.
[18] SUN Z, LIU Y, GUAN P, YANG B, LIU B. Dyes Pigm. , 2021, 185: 108884.
[19] ZHANG S, YANG Z, LI M, ZHANG Q, TIAN X, LI D, LI S, WU J, TIAN Y. Analyst, 2020, 145(24): 7941-7945.
[20] O′ CONNOR D, BYRNE A, BERSELLI G B, LONG C, KEYES T E. Analyst, 2019, 144(5): 1608-1621.
[21] ZHAO Y, SHI W, LI X, MA H. Chem. Commun. , 2022, 58(10): 1495-1509.
[22] WANG H, HU L, SHEN S, YU K, WANG Y. New J. Chem. , 2021, 45(46): 21553-21556.
[23] GUO L, TIAN M, ZHANG Z, LU Q, LIU Z, NIU G, YU X. J. Am. Chem. Soc. , 2021, 143(8): 3169-3179.
[24] ZHANG R, NIU G, LIU Z, CHAU J H C, SU H, LEE M M S, GU Y, KWOK R T K, LAM J W Y, TANG B Z. Biomaterials,2020, 242: 119924.
[25] TIAN H, SEDGWICK A C, HAN H H, SEN S, CHEN G R, ZANG Y, SESSLER J L, JAMES T D, LI J, HE X P. Coord.Chem. Rev. , 2021, 427: 213577.
[26] GUPTA I, KESAVAN P E. Front. Chem. , 2019, 7: 841.
[27] GUPTA G, SUN Y, DAS A, STANG P J, YEON LEE C. Coord. Chem. Rev. , 2022, 452: 214308.
[28] CHENG H B, CAO X, ZHANG S, ZHANG K, CHENG Y, WANG J, ZHAO J, ZHOU L, LIANG X J, YOON J. Adv. Mater. ,2023, 35(18): 2207546.
[29] CHEN J, LIU W, FANG X, QIAO Q, XU Z. Chin. Chem. Lett. , 2022, 33(12): 5042-5046.
[30] LI G, LI J, OTSUKA Y, ZHANG S, TAKAHASHI M, YAMADA K. Materials, 2020, 13(3): 677.
[31] DAS S, INDURTHI H K, ASATI P, SAHA P, SHARMA D K. Dyes Pigm, 2022, 199: 110074.
[32] TANG C, WANG X, JIN Y, WANG F. Biochim. Biophys. Acta, Rev. Cancer, 2022, 1877(5): 188788.
[33] LIU Y, YU Y, ZHAO Q, TANG C, ZHANG H, QIN Y, FENG X, ZHANG J. Coord. Chem. Rev. , 2021, 427: 213601.
[34] CHO M K, SEO M J, JUVEKAR V, JO J H, KIM W, CHOI K S, KIM H M. Anal. Chem. , 2020, 92(16): 11223-11231.
[35] LI S, ZHUANG W, CHEN J, LI G, LI C, CHEN L, LIAO Y, CHEN M, WANG Y. J. Mater. Chem. B, 2021, 9(19): 4050-4055.
[36] MA H, HU D, ZHAO J, TIAN M, YUAN J, WEI Y. CCS Chem. , 2021, 3(6): 1569-1606.
[37] GERAGHTY C, WYNNE C, ELMES R B P. Coord. Chem. Rev. , 2021, 437: 213713.
[38] YE P, ZHANG H, QU J, WANG J Y, ZHU X, SAI F, LV Y, MA S, HU Q. Spectrochim. Acta, Part A, 2022, 281: 121648.
[39] RANJANA M, SUNIL D. Chem.-Biol. Interact. , 2022, 363: 110022.
[40] ZHAO X D, SUN C J, YAO Q Q, LI W B. Chin. Chem. Lett. , 2010, 21(5): 529-532.
[41] JIANG G, JIN Y, LI M, WANG H, XIONG M, ZENG W, YUAN H, LIU C, REN Z, LIU C. Anal. Chem. , 2020, 92(15):10342-10349.
[42] SUN X, LIU T, SUN J, WANG X. RSC Adv. , 2020, 10(18): 10826-10847.
[43] ZHENG Y L, LI X C, TANG W, XIE L, DAI F, ZHOU B. Sens. Actuators, B, 2022, 368: 132169.
[44] SINGH D, TOMAR S, SINGH S, CHAUDHARY G, SINGH A P, GUPTA R. J. Photochem. Photobiol. , A, 2023, 435:114334.
[45] ZHOU R, CUI Y, DAI J, WANG C, LIANG X, YAN X, LIU F, LIU X, SUN P, ZHANG H, WANG Y, LU G. Adv. Opt.Mater. , 2020, 8(13): 1902123.
[46] NIU J, LIU Y, WANG W, LIN W. Spectrochim. Acta, Part A, 2019, 216: 35-44.
[47] YANG L, WANG J, LIU B, HAN G, WANG H, YANG L, ZHAO J, HAN M Y, ZHANG Z. Sens. Actuators, B, 2021, 333:129541.
[48] ZHAN Z, ZHUANG W, LEI Q, LI S, MAO W, CHEN M, LI W. Chem. Commun. , 2022, 58(25): 4020-4023.
[49] TATENAKA Y, KATO H, ISHIYAMA M, SASAMOTO K, SHIGA M, NISHITOH H, UENO Y. Biochemistry, 2019, 58(6):499-503.
[50] YOSHIHARA T, MARUYAMA R, SHIOZAKI S, YAMAMOTO K, KATO S, NAKAMURA Y, TOBITA S. Anal. Chem. ,2020, 92(7): 4996-5003.
[51] ZHOU F, ZHANG K, LI G, GUI C, HU R, LI S, WANG Z, ZHANG Y, TANG B Z. Mater. Chem. Front. , 2020, 4(10): 3094-3102.
[52] CHEN J, WANG C, LIU W, QIAO Q, QI H, ZHOU W, XU N, LI J, PIAO H, TAN D, LIU X, XU Z. Angew. Chem. Int. Ed. ,2021, 60(47): 25104-25113.
[53] SHE C, WANG Z, ZENG J, WU F G. Carbon, 2022, 191: 636-645.
[54] JING Y, LIU G, ZHANG C, YU B, SUN J, LIN D, QU J. ACS Appl. Bio Mater. , 2022, 5(3): 1187-1193.
[55] MANDAL S, JANA N R. J. Phys. Chem. C, 2017, 121(42): 23727-23735.
[56] LIANG K, ZHONG W, WEI M, TAN L L, SHANG L. Anal. Chem. , 2023, 95(20): 8077-8087.
[57] NARDI F, FITCHEV P, BROOKS K M, FRANCO O E, CHENG K, HAYWARD S W, WELTE M A, CRAWFORD S E.Lab. Invest. , 2019, 99(12): 1822-1834.
[58] DUANGKAMOL C, MUANGSOPA P, RATTANOPAS S, WONGSUWAN P, KHROOTKAEW T, CHUEAKWON P,NIAMNONT N, CHANSAENPAK K, KAMKAEW A. Dyes Pigm. , 2023, 216: 111365.
[59] LIU C, YIN J, LU B, LIN W. Sens. Actuators, B, 2021, 346: 130448.
[60] FAN L, WANG X, ZAN Q, FAN L, LI F, YANG Y, ZHANG C, SHUANG S, DONG C. Anal. Chem. , 2021, 93(22): 8019-8026.
[61] ASHOKA A H, ASHOKKUMAR P, KOVTUN Y P, KLYMCHENKO A S. J. Phys. Chem. Lett. , 2019, 10(10): 2414-2421.
[62] LIU C, YIN J, LU B, LIN W. New J. Chem. , 2021, 45(9): 4347-4353.
[63] XU C, LI Y, WU X, LI X, LI L, KONG F, TANG B. Chem. Commun. , 2022, 58(40): 5976-5979.
[64] PAN X, WANG C, ZHAO C, CHENG T, ZHENG A, CAO Y, XU K. Chem. Commun. , 2022, 58(29): 4663-4666.
[65] CHEN H, ZHAO J, LIN J, DONG B, LI H, GENG B, YAN M. RSC Adv. , 2021, 11(14): 8250-8254.
[66] DONG B, SONG W, LU Y, SUN Y, LIN W. ACS Sens. , 2021, 6(1): 22-26.
[67] NA M, HAN Y, CHEN Y, MA S, LIU J, CHEN X. Anal. Chem. , 2021, 93(12): 5185-5193.
[68] YAN L, ZHOU H, WU C, WANG L, YANG W, JIN M, ZHAO Y, XU J. Chem. Res. Chin. Univ. , 2016, 32(6): 877-881.
[69] SK B, THAKRE P K, TOMAR R S, PATRA A. Chem. Asian J. , 2017, 12(18): 2501-2509.
[70] FARÍAS M A, DIETHELM-VARELA B, NAVARRO A J, KALERGIS A M, GONZÁLEZ P A. Cells, 2022, 11(14):2224.
[71] COHEN S. Int. Rev. Cell Mol. Biol. , 2018, 337: 83-110.
[72] CUI L, LIU P. Front. Cell Dev. Biol. , 2020, 8: 618322.
[73] SINGH J, SANGHAVI P, MALLIK R. Front. Cell Dev. Biol. , 2022, 10: 893375.
[74] TIAN M, SUN Y, KONG X, DONG B. Anal. Chem. , 2022, 94(6): 2844-2854.
[75] ZHANG Z, DONG B, TIAN M. Sens. Actuators, B, 2021, 343: 130168.
[76] CARVALHO P H P R, CORREA J R, PAIVA K L R, BARIL M, MACHADO D F S, SCHOLTEN J D, DE SOUZA P E N,VEIGA-SOUZA F H, SPENCER J, NETO B A D. Org. Chem. Front. , 2019, 6(14): 2371-2384.
[77] MA C, XIA F, KELLEY S O. Bioconjugate Chem. , 2020, 31(12): 2650-2667.
[78] LI X, LONG C, CUI Y, TAO F, YU X, LIN W. ACS Sens. , 2021, 6(4): 1595-1603.
[79] BAI Q, YANG C, YANG M, PEI Z, ZHOU X, LIU J, JI H, LI G, WU M, QIN Y, WANG Q, WU L. Anal. Chem. , 2022, 94(6):2901-2911.
[80] ZHENG X, ZHU W, NI F, AI H, GONG S, ZHOU X, SESSLER J L, YANG C. Chem. Sci. , 2019, 10(8): 2342-2348.
[81] GIRALDO A M V, FYRNER T, WENNMALM S, PARIKH A N, ÖLLINGER K, EDERTH T. Langmuir, 2016, 32(50):13566-13575.
[82] RUAN L, BAI J, JI X, ZHAO W, DONG X. Anal. Chim. Acta, 2022, 1205: 339771.
[83] HU R, CHEN B, WANG Z, QIN A, ZHAO Z, LOU X, TANG B Z. Biomaterials, 2019, 203: 43-51.
[84] MENG F, NIU J, ZHANG H, YANG R, LU Q, YU Y, LIU Z, NIU G, YU X. Sens. Actuators, B, 2021, 329: 129148.
[85] MENG F, NIU J, ZHANG H, YANG R, LU Q, NIU G, LIU Z, YU X. Anal. Chem. , 2021, 93(34): 11729-11735.
[86] DAHL K N, RIBEIRO A J S, LAMMERDING J. Circ. Res. , 2008, 102(11): 1307-1318.
[87] WANG K N, LIU L Y, MAO D, XU S, TAN C P, CAO Q, MAO Z N, LIU B. Angew. Chem. Int. Ed. , 2021, 60(27): 15095-15100.
[88] GENG Y, WANG Z, ZHOU J, ZHU M, LIU J, JAMES T D. Chem. Soc. Rev. , 2023, 52(11): 3873-3926.
[89] ROY B, SHIEH M, XU S, NI X, XIAN M. J. Am. Chem. Soc. , 2023, 145(1): 277-287.
[90] WU L, SEDGWICK A C, SUN X, BULL S D, HE X P, JAMES T D. Acc. Chem. Res. , 2019, 52(9): 2582-2597.
[91] LI Z, YANG Y, YIN P, YANG Z, ZHANG B, ZHANG S, HAN B, LV J, DONG F, MA H. ChemistrySelect, 2022, 7(7):e202104525.
[92] SHI S, GUAN P, ZHANG F, CHAI J, YANG B, LIU B. J. Mol. Struc. , 2022, 1267: 133570.
[93] ZHANG Y, ZHANG N, WANG S, ZAN Q, WANG X, YANG Q, YU X, DONG C, FAN L. Analyst, 2022, 147(8): 1695-1701.
[94] PAN Y H, CHEN X X, DONG L, SHAO N, NIU L Y, YANG Q Z. Chin. Chem. Lett. , 2021, 32(12): 3895-3898.
[95] JIANG G, LI C, LIU X, CHEN Q, LI X, GU X, ZHANG P, LAI Q, WANG J. Adv. Opt. Mater. , 2020, 8(20): 2001119.
[96] ZHANG Y, WANG S, ZHANG N, WANG X, ZAN Q, FAN L, YU X, SHUANG S, DONG C. Mater. Chem. Front. , 2022, 6(3):333-340.

