基于非衍生化串联质谱技术分析新生儿滤纸干血片中的乳清酸




摘要 建立了一种基于非衍生化的流动注射串联质谱技术检测新生儿滤纸干血片中乳清酸(ORA)的方法。本方法采用负离子多反应监测模式(MRM)进行检测,通过同位素内标定量,单次仪器分析时间仅需2 min,检测ORA 的线性范围为0.25~40 μmol/L,线性关系良好(R2gt;0.99),检出限(S/N=3)为0.12 μmol/L。混合实验中,混合基质样本与滤纸干血片(DBS)基质样本和溶剂基质样本的均值,差值百分比低于20%,表明本方法的基质效应不影响ORA 的准确定量分析。将本方法用于实际DBS 样本中ORA 的检测,加标回收率为101.4%~122.2%,相对标准偏差(RSD)为0.8%~13.3%,采用高低浓度转换进样实验评估了携带污染效应。采用本方法对900 例正常新生儿DBS 临床实际样本进行了检测,分别以99.00%和1.00%百分位数的浓度值作为参考区间的上限值和下限值,初步获得了基于本实验室新生儿人群DBS 中ORA 浓度的临床诊断参考区间(1.10~1.52 μmol/L),为未来新生儿遗传代谢疾病筛查诊断提供了基础数据。
关键词 非衍生化流动注射串联质谱;乳清酸;滤纸干血片;新生儿;遗传代谢疾病;筛查
遗传代谢疾病(Inherited metabolic diseases, IMD)是指由于基因突变引起酶缺陷、细胞膜功能异常或受体缺陷,从而导致机体生化代谢紊乱,造成中间或旁路代谢产物蓄积或终末代谢产物缺乏而引起一系列临床症状的疾病[1-3]。迄今发现的遗传代谢疾病已经超过1000 种,并且大多数疾病发生在新生儿早期,如果不及早发现并治疗,可对新生儿造成不可逆转的严重损害,如智力低下、终身残疾,甚至死亡。目前,新生儿的遗传代谢疾病筛查已成为全球出生缺陷综合防治中最有效的手段之一[4-6]。
目前,临床上最常用的筛查和诊断新生儿遗传代谢病的方法主要是气相质谱法和串联质谱(Tandemmass spectrometry, MS/MS)法[7-9]。串联质谱法因具有高灵敏性、高特异性及一次进样能同时检测多个分析物等优点,已逐渐成为主流方法[10-11]。滤纸干血片(Dried blood spot, DBS)法早在20 世纪60 年代就已被用于新生儿疾病筛查[12],其原理是将全血滴加在滤纸片上,干燥后得到干血斑,经溶剂萃取后,通过荧光法和串联质谱法等分析干血斑中的待检测组分,反映诊断结果,如代谢产物的含量和酶活性等。该方法主要应用于代谢相关疾病的筛查、药物动力学研究以及新生儿疾病筛查等[13]。相比传统的血样采集方法, DBS 法具有制作简单、所需血量少和保存运输方便等优点。对于遗传代谢性疾病,代谢酶及代谢产物能较稳定地存在于DBS 中,对代谢异常类疾病样本进行筛查分析时, DBS 法能较准确地反映样本中代谢酶或代谢产物的含量[14]。至今,基于串联质谱检测DBS 中氨基酸、游离及酰基肉碱等生物标志物水平的技术,可实现16~46 种遗传代谢疾病的快速筛查与诊断[15-17]。随着串联质谱技术的发展以及对IMD 疾病认识的深入和新生物标志物的扩充,过去较难诊断的疾病的筛查和诊断已取得较大进展[18-21]。典型案例是尿素循环障碍中的氨甲酰磷酸合成酶缺乏症(Carbamoyl phosphate synthetase deficiency, CPSD)和鸟氨酸氨甲酰转移酶缺乏症(Ornithine transcarboxylase deficiency, OTCD)。CPSD 和OTCD 均以瓜氨酸为诊断标志物,检测时均表现为DBS 中瓜氨酸水平降低。对于瓜氨酸水平降低的新生儿,医院检验科或新生儿筛查中心一般都会召回并留取尿液,以尿中乳清酸(Orotic acid, ORA)水平进行鉴别诊断[22-23],ORA 的化学结构如图1 所示。然而,采用气相色谱-质谱检测尿液中ORA,不仅需要增加衍生化步骤,而且还需要萃取、离心和浓缩等前处理步骤,操作复杂。此外,新生儿留尿困难,这也给疾病筛查和诊断带来不便。目前,文献报道的DBS 中ORA 的检测方法均存在样品分析时间长[24-25]、样品前处理操作复杂[26-27]以及检出限高[28-30]等问题;此外,由于国内对DBS 中ORA 的检测方法鲜有研究,因此无法获取并建立相对应的浓度参考区间,导致DBS中ORA 含量无法真正应用于新生儿遗传代谢疾病的临床筛查与诊断。因此,迫切需要建立一种准确、便捷和快速检测DBS 中ORA 的非衍生化检测方法,以建立浓度参考区间,提高对CPSD 和OTCD 的诊断效能,使患者尽早得到治疗,这也符合新生儿疾病筛查的宗旨。
本研究基于非衍生化串联质谱技术,通过加入稳定同位素标记试剂作为内标物,采用同位素内标定量和流动注射进样方式,对新生儿DBS 中的ORA 进行快速定量分析,并以此方法分析了来自本医院的900 例新生儿DBS 样本,初步建立了本实验室新生儿DBS 中ORA 浓度的参考区间,为未来新生儿疾病筛查提供了参考。
1 实验部分
1.1 仪器与试剂
PerkinElemer Qsight 220MD 三重四极杆串联质谱系统(MS/MS,美国珀金埃尔默公司),包括质谱仪、自动进样器、二元液相泵、Simplicity 3Q MD 软件和质谱系统报告软件;Milli-Q plus 超纯水仪(美国密理博公司);微孔板恒温振荡器WZ80-2(美国赛默飞世尔公司);XPE105 微量电子天平(瑞士梅特勒-托利多公司);用于切割直径为3.2 mm 滤纸干血斑的手动打孔器;V 型截底前处理用96 孔板(洁净微孔板,无包被,丹麦NUNC 公司);V 型底检测用96 孔板(耐热微孔板,无包被,丹麦NUNC 公司);粘性微孔板封套及铝箔制微孔板封套(美国珀金埃尔默公司)。
ORA(批号L910S06,含量99%,上海安谱实验科技股份有限公司);乳清酸-15N2(ORA-15N2,批号4-EJB-11-1,化学纯度98%,同位素纯度97%,加拿大TRC 公司);甲醇、甲酸和乙腈(质谱级,上海安谱实验科技股份有限公司)。实验用水为超纯水(18.2 MΩ·cm)。滤纸采用国际通用Samp;S903 标准滤纸(美国沃特曼公司,卡片上印有3~5 个直径10~12 mm 的圆圈,提示采血者滴血位置及采集的血滴应尽量与所标印的圆圈大小接近,保证足够的血量)。全血样本来自于上海市儿童医院临床检验后剩余人源全血样本。分离处理全血样本得到红细胞和血清,红细胞用生理盐水洗3 次,与血清混合调整使红细胞压积为50%~55%,测定此时血液中ORA 浓度作为本底值。
900 个未经选择的正常新生儿DBS 样本来自于上海市儿童医院新生儿筛查中心,其中474 个(52.67%)为男性样品, 426 个(47.33%)为女性样品,平均年龄(天数)为4.62 d。本研究通过了上海市儿童医院伦理审查委员会的批准(批号:2022R112)。
1.2 实验方法
1.2.1 ORA标准品溶液和内标溶液的配制称取ORA 标准品1 mg 和ORA-15N2 1 mg,分别用超纯水溶解并定容至10 mL,得到100 μg/mL 的标准品储备液和内标储备液,于4 ℃保存。使用时,取标准品储备液用超纯水分别稀释成250.0、125.0、62.5、37.5、25.0和12.5 μmol/L的标准品工作液。取内标储备液加萃取液稀释,得到55 μmol/L的ORA-15N2 内标中间液。将萃取液与内标中间液以110∶1(V/V)配制成ORA-15N2 内标工作液(稀释后浓度为0.5 μmol/L)。
1.2.2 ORA标准品滤纸片和ORA标准品DBS、空白DBS的制备
ORA 标准品滤纸片的制备滤纸使用前于65℃烘箱中烘干1.5 h。分别取上述6 种浓度(250.0、125.0、62.5、37.5、25.0、12.5 μmol/L)的标准品工作液20 μL,添加到480 μL 萃取液中,混合均匀后,吸取50 μL 缓慢加到滤纸印圈中,待萃取液初步风干后转移至洁净室,室温干燥6 h,得到含有0.25、0.5、1.0、5.0、10.0、40.0 μmol/L ORA 的标准品滤纸片。晾干后的滤纸片装在洁净防潮袋内,在–20 ℃、相对湿度小于30%的环境中保存。
ORA 标准品DBS 的制备以同样方法,将ORA 标准品工作液分别加入到480 μL 全血中,制备得到添加浓度分别为0.3、1.0 和10.0 μmol/L 的ORA 标准品DBS 样本,用于混合实验、实际样本分析和携带污染实验。
空白DBS 的制备取20 μL 超纯水添加到480 μL 全血中,以同样的方法制备得到空白干血片。
1.2.3 样本前处理
待测样本DBS 用直径3 mm 打孔器取样后,置于96 孔板中进行前处理,每孔加入100 μL ORA 内标工作液,用粘性微孔板封套密封96 孔板,在45 ℃以750 r/min 振荡孵育30 min,吸取80 μL 萃取工作液转移至V 型底检测板内,覆盖铝膜,置于自动进样器上,供质谱分析。
1.2.4 流动相与质谱条件
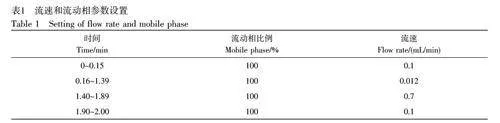
进样方式采用流动注射形式,进样量为10 μL。萃取液为含0.27 g/L 甲酸的甲醇-水(78∶22, V/V)。流动相为含0.1%甲酸的乙腈-水(84∶16, V/V),使用可变流速程序,流速设置见表1。每个样本测定时间为2 min,每针之间用甲醇-水(1∶1, V/V)满针清洗2 次。
质谱条件:负离子模式(ESI–),离子源温度400 ℃,解离温度250 ℃,喷雾电压–3.5 kV,气帘气100 kPa,雾化气250 kPa,干燥气为氮气,碰撞气为氩气(纯度≥99.999%),检测方式为多反应监测(MRM)。
1.2.5 混合实验
在空白DBS 样品经样品前处理后得到的提取液(90 μL)中加入ORA-15N2 内标中间液(10 μL),制成DBS 基质样本。同样地,在90 μL 萃取液中加入10 μL ORA-15N2 内标中间液,制成溶剂基质样本。混合基质样本由DBS 基质样本和溶剂基质样本按照质量比1:1 混合得到。通过上述混合实验得到3 种基质样本,进行检测,计算ORA 与其内标的峰面积比值,用于评估方法的基质效应(ME)。如果1∶1 混合液样本的响应值与生物基质样本和纯溶液样本响应的均值相比,差值低于20%,证明基质效应不影响目标分析物的准确定量分析[31]。
1.2.6 携带污染实验
分别取制作好的加标浓度为低浓度(0.3 μmol/L)和高浓度(10 μmol/L)ORA 的DBS 实际样本,按照1.2.3 节的方法进行样本前处理,得到低浓度和高浓度的萃取液样品。低浓度标本进样10 次,间隔进样高浓度样本,反复循环10 次[31]。
1.2.7 方法学验证及判断标准
采用美国临床和实验室标准协会(Clinical and laboratory standards institute, CLSI)2017 年发布的《Newborn screening by tandem mass spectrometry》[3]、《MS/MS 技术在新生儿氨基酸酸、有机酸及脂肪酸氧化代谢障碍性疾病筛查中的应用共识》[10]和《液相色谱串联质谱临床检测方法的开发与验证》[31]中的方法进行方法学验证和评价。
2 结果与讨论
2.1 质谱仪器参数与流动相、萃取液的优化
为降低基质效应与质谱仪器本身的质量歧视效应,采用同位素内标法进行定量分析。作为新生儿疾病串联质谱筛查的内标,不仅要满足常规内标物的技术要求,也要考虑内标物获得的难易程度、成本等因素。基于上述原则,以稳定同位素15N 标记的ORA-15N2 作为ORA 内标[30]。针对ORA 分子结构的特点,首先通过全扫描模式(Full MS)基本确定其母离子和定量子离子,再采用MRM 模式对入口电压、碰撞室入口电压及碰撞电压进行调整与优化,优化后的参数见表2。
通常采用甲醇或甲醇-水混合溶液从DBS 中萃取氨基酸和酰基肉碱,有时添加少量(≤1%)有机酸(如乙酸或甲酸)促进分析物电离,也可采用乙腈-水混合溶液。萃取液中加入待测分析物的内标,形成萃取工作液。最常用的流动相是乙腈或甲醇与水的混合溶液,通常也添加少量(≤1%)有机酸(如乙酸或甲酸)。综合常见新生儿筛查的萃取液和流动相的研究文献报道[9-11,16-18]以及ORA 在甲醇与乙腈中的溶解度情况,本研究选取添加少量甲酸(0.27 g/L)的甲醇-水(78∶22, V/V)溶液为萃取液,选取含0.1%甲酸的乙腈-水(84∶16, V/V)溶液为流动相。
在上述优化的实验条件下,采用本方法检测ORA 标准品和ORA-15N2 内标,结果如图2 所示, ORA标准品与内标ORA-15N2 在仪器上的信噪比(S/N)gt;5000,表明其具有优异的响应强度。
2.2 标准曲线的建立
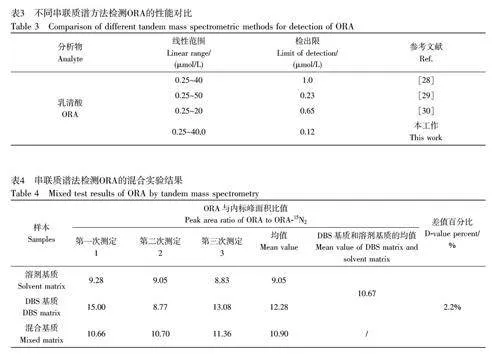
在优化的实验条件下,对不同浓度的ORA 滤纸片进行检测,以质谱对待测目标物的峰面积为响应信号,并以样品峰与内标峰的面积比为纵坐标, ORA 添加浓度为横坐标,二者在0.25~40.0 μmol/L 范围内呈良好的线性关系(图3),线性方程为y=0.051x–0.0073(R2=0.999),检出限(S/N=3)为0.12 μmol/L。与文献报道的串联质谱方法相比,本方法具有相近的线性范围和更低的检出限(表3)。
2.3 基质效应
由于本方法是将DBS 洗脱后,通过流动注射直接注入MS/MS 离子源中,因此可能会将血液或滤纸中的杂质引入到质谱中,导致离子抑制,从而无法准确定量分析。评估基质效应是方法验证的关键部分。本研究采用混合实验评估基质效应[31],结果见表4。计算结果表明,混合基质样本与DBS 基质样本和溶剂基质样本的均值相比,差值百分比为2.2%,显著小于20%,表明本方法的基质效应对准确定量分析ORA 的影响很小。
2.4 DBS样本分析
通过在全血中添加不同浓度水平的ORA,分别制备低浓度(0.3 μmol/L)、中浓度(1.0 μmol/L)和高浓度(10.0 μmol/L)的DBS 样本。样本经前处理后,采用本方法进行检测,低、中、高浓度DBS 的回收率分别为103.3%、122.2%和101.4%, RSD 分别为13.3%、2.3%和0.8%。同时,对本方法的携带污染效应进行了评估,得到高-低浓度转换样本均值与低-低浓度转换样本均值分别为0.33 和0.30 μmol/L,两者的差值(0.03 μmol/L)小于低-低浓度转换样本的3 倍标准偏差(3SD 为0.08 μmol/L)。实验结果表明,本方法的准确度、精密度和携带污染效应均符合要求[3,10,31],可用于实际DBS 中ORA 的分析检测。
2.5 实际样本分析以及参考区间的建立
随机选取了上海市儿童医院新生儿筛查中心900 例正常新生儿的DBS 样本,采用本方法检测其中的ORA 浓度,并对检测结果进行统计分析。ORA 的检出浓度范围为1.02~1.77 μmol/L,平均浓度为(1.24±0.09) μmol/L,依据临床诊断参考区间建立原则[10,32],以99.00%百分位数的浓度值作为参考区间的上限值,使用1.00%百分位数的浓度值作为参考区间的下限值,由此得到DBS 中ORA 的临床诊断参考区间为1.10~1.52 μmol/L。Held 等[30]用FIA-MS/MS 测定了1514 例假定正常新生儿干血片中的ORA 范围为0.59~2.61 μmol/L,均值为(1.2±0.23) μmol/L, 1%~99%浓度的参考区间为0.72~1.84 μmol/L,与本研究结果相近。本研究建立的新生儿ORA 浓度参考区间具有一定的临床应用价值,为将来ORA 列入新生儿筛查项目奠定了初步的临床实验基础。
3 结论
基于非衍生化的串联质谱技术,建立了一种新生儿DBS 中ORA 的检测方法。本方法不仅操作简便,而且检出限低至0.12 μmol/L,灵敏度比文献报道方法提高了至少一倍。在应用于实际DBS 检测时,本方法显示出良好的准确度和精密度,并且携带污染效应小,满足新生儿遗传代谢疾病的筛查要求,并建立了初步的临床诊断参考区间。本研究组未来将开展真实新生儿的临床CPSD 和OTCD 的筛查与诊断,进一步验证本方法对于疾病筛查的特异性与敏感性,以期为患儿提供更精准的诊断与治疗。
References
[1] WILCKEN B, WILEY V. J. Paediatr. Child Health, 2015, 51(1): 103-107.
[2] ADAMS D R, ENG C M. N. Engl. J. Med. , 2018, 379(14): 1353-1362.
[3] Newborn Screening by Tandem Mass Spectrometry, Approved Guiodeline. I/L.A21-A. 2017, Vol.30 No.16.
[4] PEAKE R W, KOZAKEWICH H P. Clin. Chem. , 2017, 63(4): 613-615.
[5] TIAN G L, XU F, JIANG K, WANG Y M, JI W, ZHUANG Y P. Clin. Chim. Acta, 2020, 503: 157-162.
[6] PICKENS C A, ISENBERG S L, CUTHBERT C, PETRITIS K. Clin. Chem. , 2021, 67(12): 1709-1720.
[7] WILCKEN B, WILEY V, HAMMOND J, CARPENTER K. N. Engl. J. Med. , 2003, 348(8): 2304-2312.
[8] HAYNES C A, DEJESUS V R. Clin. Biochem. , 2016, 49(1-2): 161-165.
[9] KIM U J, KANNAN K. Anal. Chem. , 2018, 90(5): 3291-3298.
[10] Clinical Mass Spectrometry Laboratory Medicine Committee. Lab. Med. , 2019, 34(6): 479-485.
中国医师协会检验医师分会临床质谱检验医学专业委员会. 检验医学, 2019, 34(6): 479-485.
[11] SEGER C, SALZMANN L. Clin. Biochem. , 2020, 82: 2-11.
[12] GUTHRIE R, SUSI A. Pediatrics, 1963, 32(3): 338-343.
[13] LI Y, SCOTT C R, CHAMOLES N A, GHAVAMI A, PINTO B M, TURECEK F, GELB M H. Clin. Chem. , 2004, 50(10):1785-1796.
[14] LI W, TSE F L S. Biomed. Chromatogr. , 2010, 24(1): 49-65.
[15] CHACE D H, KALAS T A, NAYLOR E W. Clin. Chem. , 2003, 49(12): 1797-1817.
[16] PICKENS C A, PETRITIS K. Anal. Chim. Acta, 2020, 1120: 85-96.
[17] HONG X Y, SADILEK M, GELB M H. Genet. Med. , 2020, 22(7): 1262-1268.
[18] BERTHIAS F, WANGY L, ALHAJJI E, RIEUL B, MOUSSA F, BENOIST J F, MAÎTRE P. Analyst, 2020, 145(14): 4889-4900.
[19] BIASE I D, YUZYUK T, HERNANDEZ A, BASINGER A. Clin. Chem. , 2021, 67(9): 1290-1292.
[20] DEHORA M R, HEATHER N L, PATEL T, BRESNAHAN L G, WEBSTER D, HOFMAN P L. Clin. Endocrinol. , 2021,94(6): 904-912.
[21] ZOU Lin. Chin. J. Lab. Med. , 2019, 42(12): 1014-1019.
邹琳. 中华检验医学杂志, 2019, 42(12): 1014-1019.
[22] RASHED M S, JACOB M, ALAMOUDI M, RAHBEENI Z, ALSAYED M A, ALAHAIDIB L, SAADALLAH A A A,LEGASPI S. Clin. Chem. , 2003, 49(3): 499-501.
[23] D′APOLITO O, GAROFALO D, LA MARCA G, DELLO RUSSO A, CORSO G. J. Chromatogr. B: Anal. Technol. Biomed.Life Sci. , 2012, 883-884: 155-160.
[24] IAMACA G, CASETTA B, ZAMMARCHI E. Rapid Commun. Mass Spectrom. , 2003, 17(5): 788-793.
[25] GIKA H G, THEODORIDIS G A, VRHOVSEK U, MATTIVI F. J. Chromatogr. A, 2012, 1259(12): 121-127.
[26] HUSKOVA R, BARTAK P, CAP L, FRIEDECKY D, ADAM T. J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. , 2004,799(2): 303-309.
[27] DHILLON K S, BHANDAL A S, AZNAR C P, LOREY F W, NEOGI P. Clin. Chim. Acta, 2011, 412: 873-879.
[28] DAPOLITO O, GAROFALO D, PAGLIA G, ZUPPALDI A, CORSO G. J. Sep. Sci, 2010, 33(7): 966-973.
[29] JANZEN N, TERHARDT M, SANDER S, DEMIRKOL M, GOKCAY G, PETER M, LUCKE T, SANDER J, DAS A M.Clin. Chim. Acta, 2014, 430: 28-32.
[30] HELD P K, HAYNES C A, JESUS V R D, BAKER M W. Clin. Chim. Acta, 2014, 436(25): 149-154.
[31] Clinical Mass Spectrometry Laboratory Medicine Committee. Lab. Med. , 2019, 34(3): 189-196.
中国医师协会检验医师分会临床质谱检验医学专业委员会. Lab. Med. , 2019, 34(3): 189-196.
[32] SASSE E A, DOUMAS B T, MILLER W G, DORAZIO P, ECKFELDT J H, EVANS S A, GRAHAM G A, MYERS G L,PARSONS P J, STANTON N V. How to Define and Determine Reference Intervals in the Clinical Laboratory: Approved Guideline-Second Edition, NCCLS C28-A2 ed. Clinical and Laboratory Standards Institute, Pennsylvania, 2000.

