高温胁迫下外源物质对颖花能量水平的影响及其与水稻耐热性关系分析


摘要:【目的】探究高温胁迫下喷施外源化学物质对水稻颖花能量水平的影响及其与水稻耐热性的关系,以期为水稻的耐热栽培提供理论依据。【方法】以常规籼稻高温耐性品种广陆矮15(GLA15)和高温敏感品种绵恢101(MH101)为试验材料,减数分裂期以叶面喷施清水为对照(CK),设5个外源物质喷施处理:0.15 mmol/L蔗糖(Suc)、25 mmol/L阿卡波糖(Aca)、10 mmol/L水杨酸(SA)、10 mmol/L水杨酸+0.15 mmol/L蔗糖(SA+Suc)、10 mmol/L水杨酸+25 mmol/L阿卡波糖(SA+Aca)。喷施完毕立即利用日光型人工气候室进行高温胁迫(日最高气温/日最低气温为38.0℃/29.0℃)处理,分析高温胁迫下不同外源物质对颖花能量水平、花粉活力、颖花受精率、蔗糖代谢酶活性、抗氧化酶活性、碳水化合物含量、苯丙烷类代谢酶活性和次生代谢物含量的影响。【结果】喷施不同外源物质可构建不同的颖花能量水平,与CK相比,高温胁迫下2个水稻品种的ATP含量和ATPase活性均以SA+Suc处理最高,Aca处理最低,且GLA15颖花的ATP含量和ATPase活性总体高于MH101。高温胁迫下SA+Suc、Suc和SA处理的花粉活力和颖花受精率均较CK提高;Aca处理的花粉活力和颖花受精率则较CK显著降低(Plt;0.05,下同),MH101分别降低10.3%和35.6%,GLA15分别降低2.5%和8.0%,降幅MH101gt;GLA15。与CK相比,高温胁迫下SA、Suc和SA+Suc处理的蔗糖合酶、酸性转化酶、超氧化物歧化酶、过氧化物酶和抗坏血酸过氧化物酶活性增加,Aca处理的上述酶活性均降低;SA、Suc和SA+Suc处理的颖花碳水化合物含量增加,Aca处理的颖花碳水化合物含量降低(MH101的果糖和可溶性糖含量除外),SA可促进颖花的糖代谢水平,进而缓解Aca对可溶性糖、蔗糖和非结构性碳水化合物含量的抑制作用。高温胁迫下2个品种的苯丙氨酸解氨酶、肉桂酸-4-羟化和4-香豆酸辅酶A连接酶活性及木质素含量均以SA+Suc处理较高,总酚和总黄酮含量以Suc处理较高。【结论】外源化学物质主要通过影响碳水化合物含量和蔗糖代谢,调控颖花能量水平,维持较高抗氧化酶活性和次生代谢物水平,增强水稻花器官对高温胁迫的耐性。通过施用外源物质改善颖花能量起始水平可能是有效缓解水稻高温胁迫的一种潜在技术策略。
关键词:水稻;高温胁迫;颖花能量水平;耐热性
中图分类号:S511.21文献标志码:A文章编号:2095-1191(2024)02-0440-11
Effects of exogenous substances on the energy level of spikelets under high temperature stress and its relationship analysis with heat tolerance in rice
CHEN Yu-hang¹,CHEN Hui-li¹,WANG Sheng-yong¹,GAO Zi-hui¹,TIAN Wei¹,TIAN Xiao-hai¹·²,DING Shuang-cheng¹·2*,WANG Hong-wei¹·2*
('Key Laboratory of SustainableCrop Production in the Middle Reaches of theYangtze River,Ministry of Agriculture and Rural Affairs/College ofAgriculture,Yangtze University,Jingzhou,Hubei 434025,China;²Hubei Collaborative Innovation Center for Grain Industry,Jingzhou,Hubei 434025,China)
Abstract:[Objective]The purpose of the study was to investigate the effects of spraying exogenous chemicals on the energy level of rice spikelets under high temperature stress and its relationship with rice high temperature stresstolerance in order to provide atheoretical basis for the cultivation of heat resistant rice.[Method]Common indica rice high tempera- ture tolerant variety GLA15 and high temperature sensitive variety MH101 were used as experimental materials.During meiosis,foliar spraying of clear water was used as acontrol(CK).Five exogenous substance spraying treatments were applied:0.15 mmol/L sucrose(Suc),25 mmol/L acarbose(Aca),10 mmolL salicylic acid(SA),10 mmol/L salicylic acid+0.15 mmol/L sucrose(SA+Suc),and 10 mmol/L salicylic acid+25 mmol/L acarbose(SA+Aca).Immediately after spraying,a sunlight type artificial climate chamber wasused for high temperature stress treatment(daily maximum tem-perature/daily minimum temperature being 38.0℃/29.0℃).The effects of different exogenous substances on the energy level,pollen vitality,spikelet fertilization rate,sucrosemetabolism enzyme activity,antioxidant enzyme activity,carbo-hydrate content,phenylpropanoid metabolism enzyme activity and secondary metabolite content of spikelets under high temperature stress were analyzed.【Result】Spraying different exogenous substances could construct different levels of spikelet energy.Compared with CK,under high temperature stress,the ATP content and ATPase activity of the two rice varieties were the highest in SA+Suc treatment and the lowest in Aca treatment.Moreover,the ATP content and ATPase activity of GLA15 spikelets were generally higher than those of MH101.Under high temperature stress,the pollen via-bility and spikelet fertilization rate ofSA+Suc,Suc and SA treatments were all higherthan those of CK,while the pollen viability and spikelet fertilization rate of Aca treatment were significantly reduced compared to CK(Plt;0.05,the same be- low).The pollen viability and spikelet fertilization rate of MH101 were reduced by 10.3%and 35.6%respectively com-pared to CK,while GLA15 was reduced by 2.5%and 8.0%,with adecrease of MH101gt;GLA15.Compared with CK,under high temperaturestress,the activities of sucrosesynthase,acid invertase,superoxide dismutase,peroxidase,and ascorbic acid peroxidase increased in SA,Suc,and SA+Suc treatments,while the activities of the above enzymes de- creased inAca treatment.The carbohydrate content in the spikelets treated with SA,Suc,and SA+Suc increased,while thecarbohydrate content in thespikelets treated with Aca decreased(except for the fructose content and soluble sugar con- tent of MH101).SA could promote the sugar metabolism level of spikelets,thereby alleviating the inhibitory effect of Aca on soluble sugar,sucrose,and non structural carbohydrate contents.Under high temperature stress,the activities of phenylalanine ammonia lyase,cinnamic acid 4-hydroxylation,4-coumaric acid CoA ligase and lignin content of the two varieties were higher in SA+Suc treatment,while the total phenolic and flavonoid contents were higher in Suc treatment.【Conclusion】Exogenous chemicals mainly affect carbohydrate content and sucrose metabolism,regulate the energy leve of spikelets,maintain high antioxidant enzyme activity and secondary metabolite levels,and enhance the tolerance of rice floral organs to high temperature stress.Improving the initial energy level of spikelets through the application of exo-genous substances maybe apotential technical strategy for effectively alleviating high temperature stress in rice.
Keywords:rice;high temperaturestress;spikelet energy level;heattolerance
Foundation items:Hubei Key Research and Development Plan Project(2020BBB060);Open Fund Project of Hu-bei Collaborative Innovation Center forGrain Industry(KFT202108)
0引言
【研究意义】水稻是我国重要的粮食作物,受稻作种植制度、品种演变和全球气候变暖影响,推广应用的高产品种灌浆结实期普遍较长,导致水稻在孕穗期遭遇高温热害的风险加剧(李勇等,2013;陈阜等,2021;冯向前等,2022)。提高水稻对高温胁迫的耐性是生产上亟待解决的重要问题,除培育优良耐热品种外,利用配套栽培措施缓解高温热害也是一条重要途径,其中外源化学物质在实现水稻抗逆稳产中更能快速发挥作用(田小海等,2009;胡秋倩等,2020)。颖花能量水平对水稻生长发育有重要影响,是提高水稻产量进一步上升的重要因素(盛家艳等,2019)。因此,研究施用外源化学物质对水稻颖花能量水平和水稻耐热性形成的影响,对进一步开展减轻高温胁迫栽培调控措施的研究具有重要意义。【前人研究进展】合理喷施外源化学调控物质可提高水稻的高温耐性(刘奇华等,2016;Tang et al.,2018;杨军等,2019;Karwa et al.,2022)。符冠富等(2015)研究表明,水稻颖花原基分化期喷施水杨酸可改善叶片光合效率,提高抗氧化酶活性及颖花中细胞分裂素和生长素含量,减轻高温对水稻颖花分化的抑制。Feng等(2018)研究表明,花粉母细胞减数分裂期喷施水杨酸可增强水稻颖花中抗氧化酶活性,降低活性氧水平,抑制绒毡层程序性细胞死亡和降解。姜宁等(2020)研究指出,喷施适当浓度蔗糖溶液能缓解水稻灌浆期高温对水稻籽粒充实的伤害。刘晓龙等(2022)研究表明,高温胁迫下孕穗期喷施脱落酸,不仅能激发脱落酸信号通路,还能上调抗氧化防御能力和产量形成基因的表达,进而提高水稻在抽穗开花期的耐热性。徐鹏等(2023)的研究也指出外源海藻糖能较好改善水稻叶片光合生理特性,提高渗透调节能力,增强抗氧化酶系统活性,从而提高水稻耐热性和籽粒产量。以上研究表明,化学调控物质主要通过增加同化物供应,降低生殖器官活性氧水平,减少高温对生殖器官发育的抑制。然而,水稻高温耐性的形成及同化物的转运均为耗能过程,能量代谢与水稻高温耐性密切相关。据报道,耐热性水稻叶片腺苷三磷酸(ATP)含量较高,能量充足能促进抗氧化酶活性增强,从而使水稻在高温胁迫下耐受性较高;提高ATP酶(ATPase)活性能有效改善水稻的能量状态,显著影响水稻耐热及高产和优质性状(Li et al.,2020;Chen et al.,2022)。此外,也有研究表明酸性转化酶促使蔗糖分解代谢,参与维持高温胁迫下的能量稳态,是高温胁迫下评价耐热性的重要指标(Jiang et al.,2020)。【本研究切入点】虽已有研究表明水稻高温耐逆响应与能量稳态密切相关,但具体生理机理制不明晰,外源化学调控物质改善高温耐性是否与能量水平有关尚无研究,能量水平对高温胁迫耐性的影响及其响应机制需深入探讨。【拟解决的关键问题】以本课题组前期筛选的水稻高温典型抗感品种为试验材料,通过喷施不同外源化学调控物质,分析其对水稻颖花能量水平、颖花碳水化合物代谢、抗氧化能力和苯丙烷类代谢等的影响,旨在探究能量水平缓解减数分裂期高温胁迫的生理机制,以期为水稻的耐热栽培提供理论依据。
1材料与方法
1.1试验地点与试验材料
试验于2021—2022年在湖北省荆州市长江大学农学院试验基地进行(30°21'18\"N,112°8'19\"E),当地气候为亚热带季风湿润气候,年日照时数1800~2000 h,年降水量1200~1700mm。供试水稻材料为常规籼稻高温耐性品种广陆矮15(GLA15)和高温敏感品种绵恢101(MH101),均来自本实验室。
供试外源化学物质包括水杨酸(≥99.5%)、阿卡波糖(98%)、蔗糖(≥99.7%)。
1.2试验方法
试验采用盆栽方式进行。盆栽用桶内径30 cm、高40 cm。供试土壤采用稻田表层风干土,每桶17kg土并混合10 g复合肥(N:P₂O₅:K₂O=26:10:15),采用积温法调整播期使水稻品种抽穗开花期一致,播种育秧20 d后选取生长一致的幼苗进行移栽,每桶20株定期剪分蘖,保留主茎,待水稻生长至减数分裂期,依据剥穗观察,判断粒半长时期为花粉母细胞减数分裂期,此时对发育进程基本一致的稻穗挂牌标记,随后进行以下试验操作。
试验设5个外源化学物质喷施处理,以喷施清水为对照(CK),各处理喷施物质及浓度见表1。各外源物质先配制成相应浓度溶液,然后加入1%的Triton X-100以便喷施时试剂能更好附着在叶片表面,喷施状态均以叶片表面形成水滴而不掉落为准。喷施完毕立即进行高温胁迫处理,高温胁迫处理利用日光型人工气候室模拟大田昼夜温度变化,日最高气温/日最低气温为38.0℃/29.0℃,湿度75%(恒湿模式)。处理7 d后,取颖花和剑叶,液氮下研磨至细粉后置于-80℃冰箱冻存。将植株放置在常温下(日最高气温/日最低气温为26.0℃/23.5℃)继续生长至成熟。生长至花期取花药,成熟后测定颖花受精率。
1.3测定项目及方法
1.3.1 ATP含量和ATPase活性测定ATP和ATPase含量选取减数分裂期水稻剑叶进行测定(因采用水稻颖花测定时无结果,故采用同时期取得的水稻剑叶测定)。使用BC0305-ATP含量检测试剂盒(北京索莱宝科技有限公司)测定ATP含量,采用无机磷法测定ATPase活性(徐纪明等,2011)。
1.3.2花粉活力和颖花受精率测定水稻开花期,剥取未开放颖花的花药,进行1%KI/I₂染色,随后于光学显微镜下观察并拍照,统计花粉活力。花粉活力(%)=染色花粉粒数/总花粉粒数×100。水稻成熟期考察颖花受精率,饱满粒和瘪粒均计为受精粒,其余计为非受精粒,颖花受精率(%)=受精粒数/总粒数×100。
1.3.3蔗糖合成酶(SS)、酸性转化酶(INV)及抗氧化酶活性测定称取0.5g冷冻水稻颖花粉末测定相关酶活性。SS活性采用分光光度计法测定(汤章城,1999),INV活性采用磷酸钾法测定(赵智中等,2001);过氧化物酶(POD)活性采用愈创木酚法测定,超氧化物歧化酶(SOD)活性采用氧化还原法测定(王成章等,2007);抗坏血酸过氧化物酶(APX)活性采用紫外分光光度计测定(Mano et.al,2001)。
1.3.4碳水化合物含量测定称取0.5g冷冻水稻颖花粉末进行碳水化合物含量测定。参照李光彦(2021)的方法(略作改动),采用蒽酮法测定可溶性糖、可溶性淀粉和非结构性碳水化合物含量;采用间苯二酚比色法测定蔗糖和果糖含量(韩涛,2014)。
1.3.5苯丙烷类代谢酶活性测定称取0.1 g冷冻水稻颖花粉末样品置于2 mL离心管中,并加入1 mL提取液(5 mmol/L β-巯基乙醇,2%(w/v)聚乙烯吡咯酮(PVP),0.05 mol/L硼酸盐缓冲液,pH 8.8),混匀摇床上萃取离心,收集上清粗酶提取液。苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)和4-香豆酸辅酶A连接酶(4CL)酶活性采用紫外分光光度法测定(汪胜勇等,2023)。
1.3.6次生代谢物含量测定选取0.1 g冷冻水稻颖花粉末测定次生代谢物含量。采用巯基乙酸法测定木质素含量(张水明等,2015);采用亚硝酸钠—硝酸铝一氢氧化钠比色法,以芦丁标准品绘制标准曲线,测定总黄酮含量(黄晓彤等,2022);采用福林酚法,以没食子酸为标准品绘制标准曲线,测定总酚含量(汪胜勇等,2023)。
1.4统计分析
采用Excel 2010对试验数据进行计算和制图,采用SAS 9.2进行方差分析。以Duncan's法检验处理间差异显著性(Plt;0.05)。
2结果与分析
2.1高温胁迫下外源物质对颖花能量代谢物质的影响
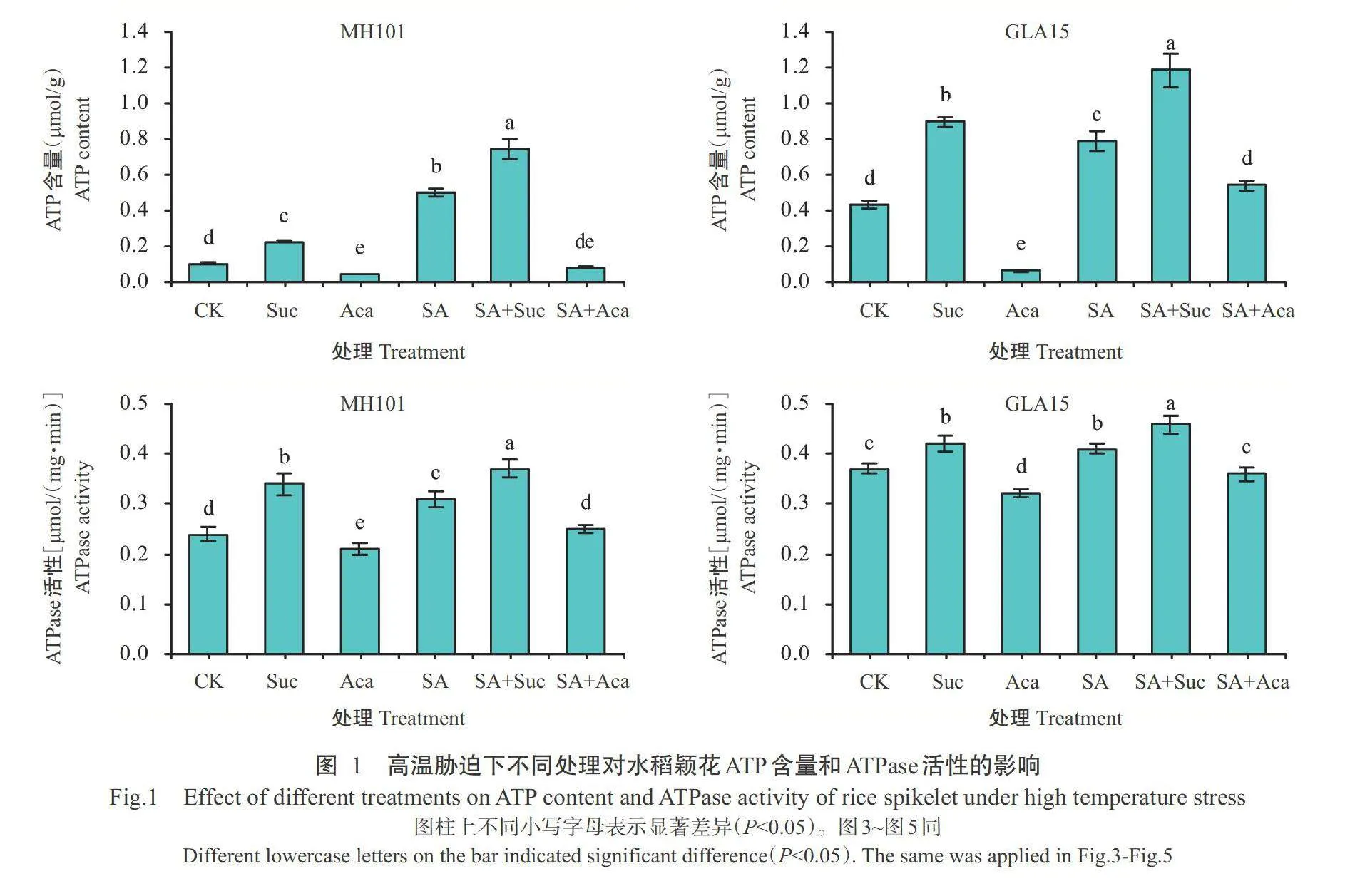
由图1可看出,与CK相比,高温胁迫下2个水稻品种中ATP含量和ATPase活性均以SA+Suc处理最高,Aca处理最低,且GLA15颖花的ATP含量和ATPase活性总体高于MH101。单独喷施SA和Suc,ATP含量和ATPase活性均较CK显著升高(Plt;0.05,下同),而单独喷施Aca则显著降低ATP含量和ATPase活性。SA+Suc处理的ATP含量和ATPase活性较SA处理显著升高,SA+Aca处理较Aca处理显著升高。MH101中,SA和Suc处理间ATP含量和ATPase活性差异显著;GLA15中,SA与Suc处理的ATP含量差异显著,ATPase活性无显著差异(Pgt;0.05,下同)。高温胁迫下,SA+Aca较Aca处理ATP含量和ATPase活性显著升高,表明SA可缓解Aca对颖花能量水平的抑制作用。综上所述,高温胁迫下不同外源化学调控物质可构建不同的颖花能量水平,以SA+Suc处理的颖花能量水平最高,Aca处理则最低。
2.2高温胁迫下外源物质对花粉活力和颖花受精率的影响
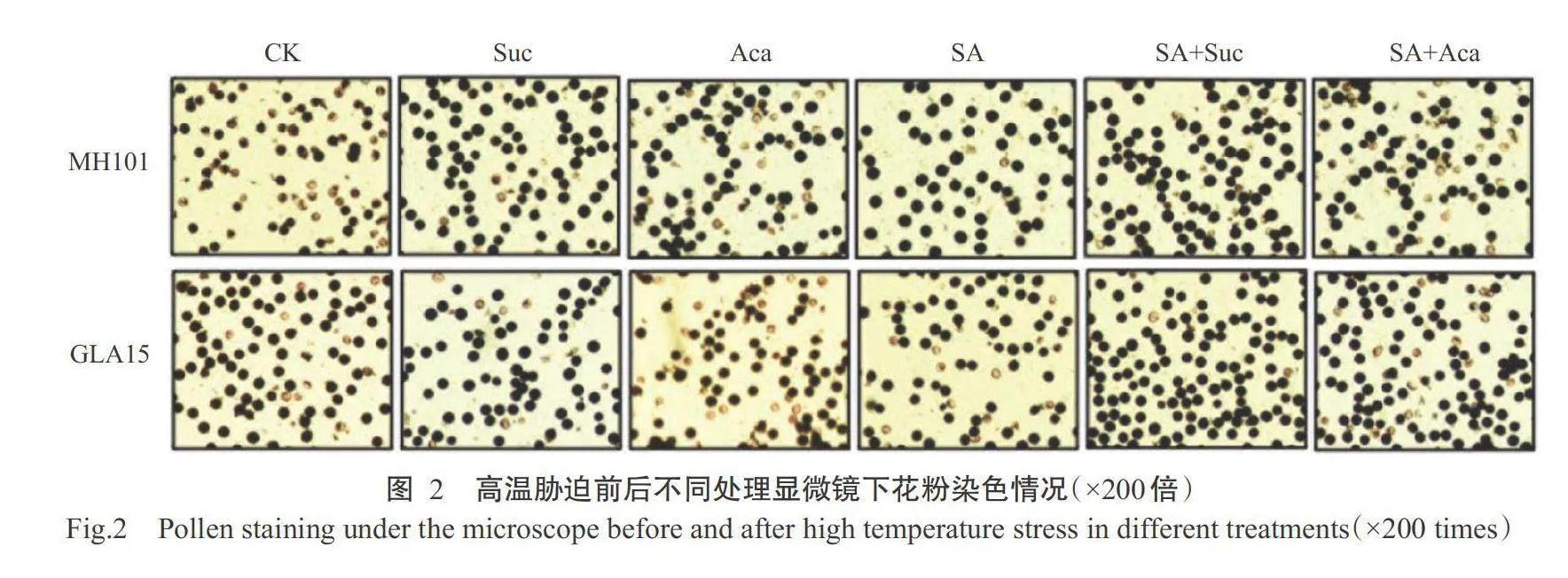
图2为高温胁迫前后各处理显微镜下的花粉染色情况。与CK相比,高温胁迫下2个水稻品种的Aca处理败育花粉较多,而SA+Suc处理败育花粉相对较少,其余处理肉眼观察变化不明显。进一步计算花粉活力,结果(图3)显示,高温胁迫下,花粉活力在MH101中表现为SA+Suc处理最高,Aca处理最低;GLA15中表现为SA处理最高,Aca处理最低,Suc和SA+Suc处理略低于SA处理,三者无显著差异。MH101的颖花受精率表现为SA+Sucgt;Sucgt;SAgt;SA+Acagt;CKgt;Aca,GLA15的颖花受精率表现为SA+Sucgt;Sucgt;SAgt;CKgt;SA+Acagt;Aca,MH101中SA+Suc处理颖花受精率显著高于Suc处理,GLA15中Suc处理与SA+Suc和SA处理的颖花受精率均无显著差异(图3)。与CK相比,高温胁迫下SA+Suc、Suc和SA处理花粉活力和颖花受精率均显著提高;Aca处理花粉活力和颖花受精率显著降低,MH101较CK分别降低10.3%和35.6%,GLA15分别降低2.5%和8.0%,降幅MH101gt;GLA15。综上所述,高温胁迫下花粉活力和颖花受精率在不同喷施处理中受害程度不同,且MH101的受害程度高于GLA15。
2.3高温胁迫下外源物质对颖花SS和INV活性的影响
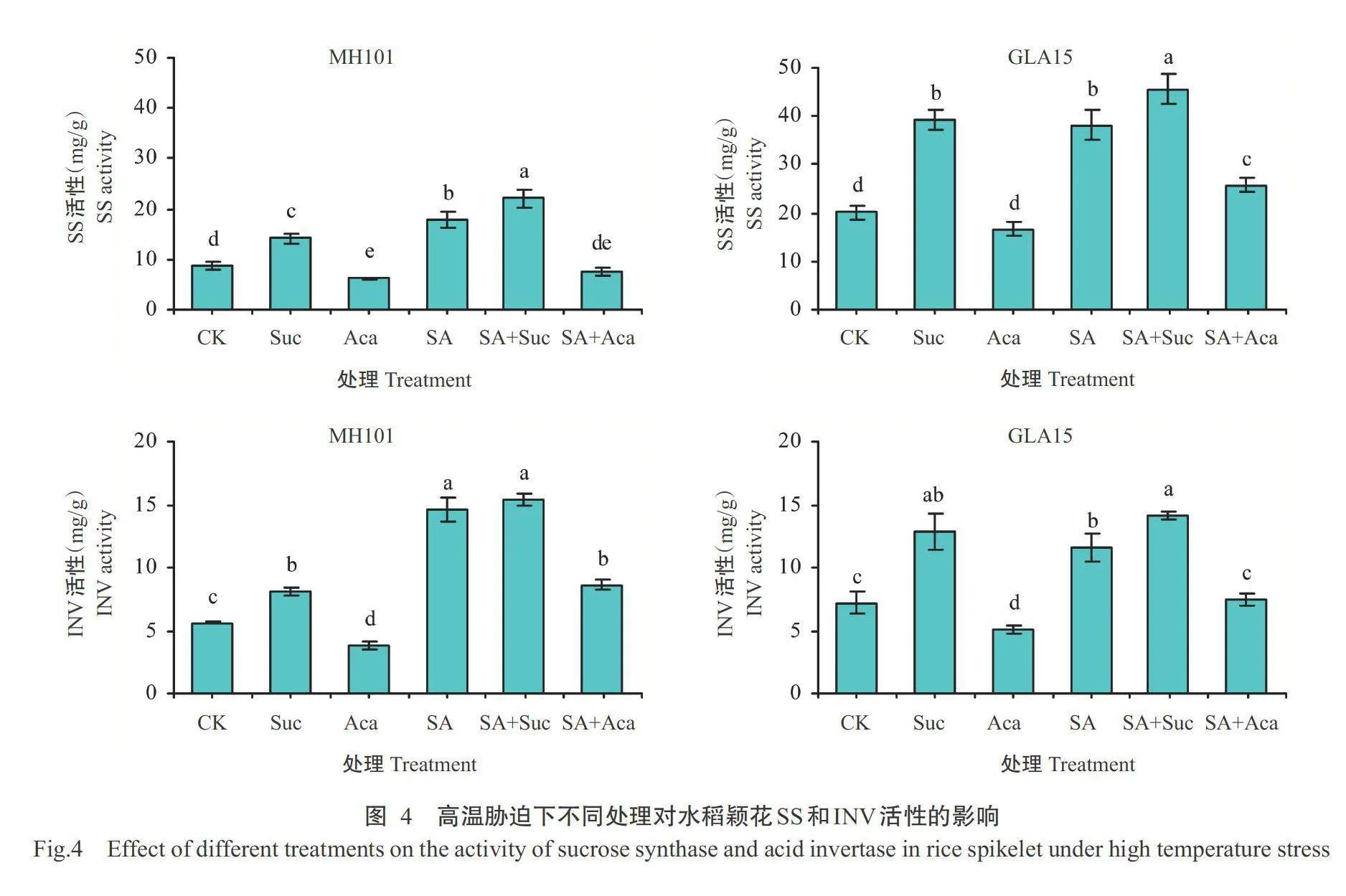
如图4所示,高温胁迫下2个品种的SS和INV活性均表现为SA+Suc处理最高,Aca处理最低。SA和Suc处理在MH101中差异显著,在GLA15中差异不显著。与CK相比,高温胁迫下SA、Suc、SA+Suc处理的SS和INV活性显著增加,Aca处理的INV活性显著降低,SS活性只在MH101中显著降低。此外,高温胁迫下SA+Suc处理的SS活性较SA处理显著增加,SA+Aca处理的SS和INV活性较SA处理均显著降低。由此可见,喷施SA、Suc和SA+Suc可不同程度促进蔗糖代谢,喷施Aca则严重影响蔗糖代谢。
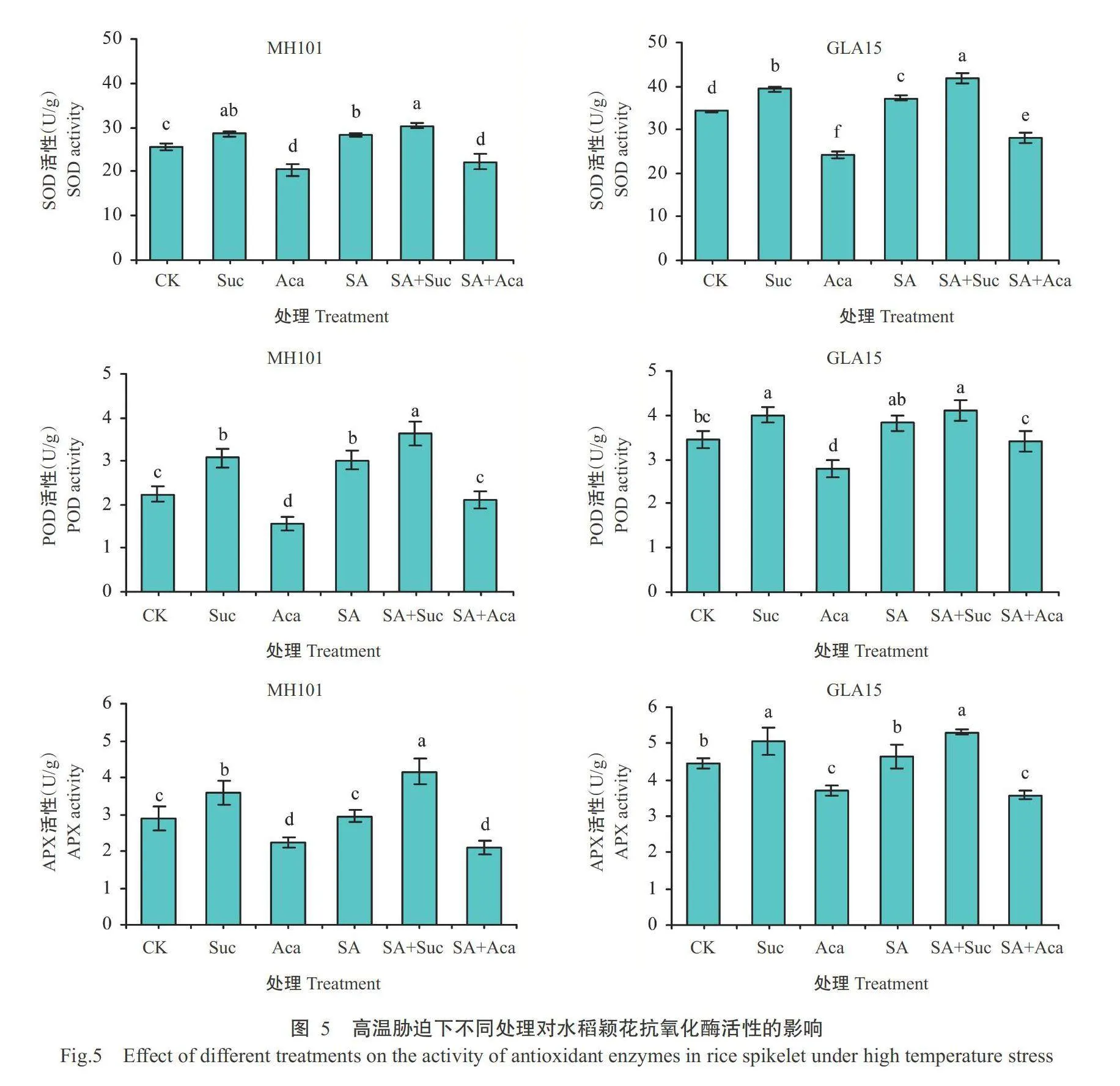
2.4高温胁迫下外源物质对颖花抗氧化酶活性的影响
如图5所示,高温胁迫下各处理的SOD、POD和APX活性均表现为SA+Sucgt;Sucgt;SAgt;CKgt;SA+Acagt;Aca。GLA15中Suc和SA处理的SOD和APX活性差异显著,POD活性差异不显著;MH101中Suc和SA处理的SOD和POD活性差异不显著,APX活性差异显著。与CK相比,高温胁迫下SA、Suc、SA+Suc处理的抗氧化酶活性显著增加(GLA15中SA处理的POD活性除外),Aca处理的抗氧化酶活性则显著降低,增施SA可缓解Aca对抗氧化酶活性的抑制。
2.5高温胁迫下外源物质对颖花碳水化合物含量的影响
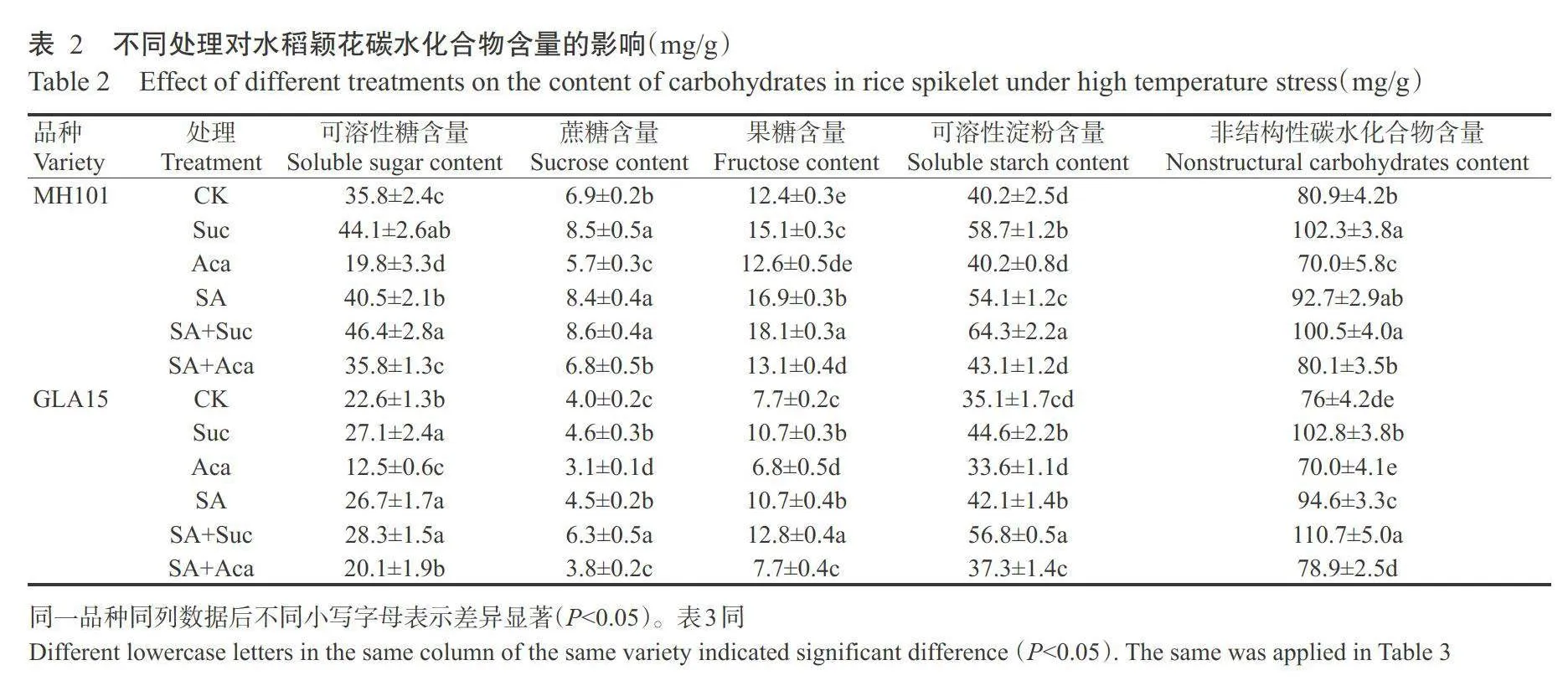
由表2可知,高温胁迫下2个水稻品种的碳水化合物含量表现为SA+Suc处理最高(MH 101的非结构性碳水化合物除外),Aca处理最低。与CK相比,高温胁迫下SA、Suc、SA+Suc处理的颖花碳水化合物含量增加,而Aca处理的颖花碳水化合物含量降低(MH101的果糖和可溶性淀粉含量除外)。高温胁迫下SA+Suc处理的果糖和可溶性淀粉含量较Suc处理显著增加,SA+Aca处理的可溶性糖、蔗糖和非结构性碳水化合物含量较Aca处理显著增加,表明SA可促进颖花的糖代谢水平,进而缓解Aca对可溶性糖、蔗糖和非结构性碳水化合物含量的抑制作用。
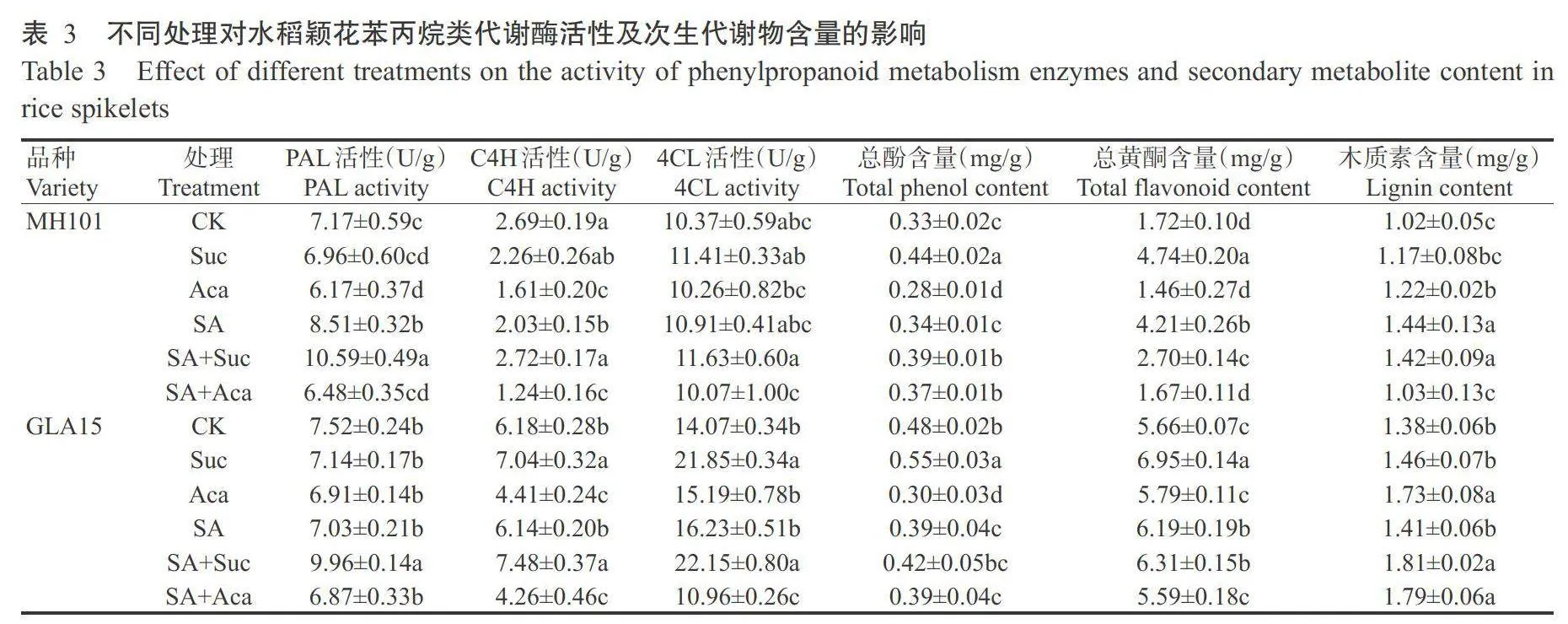
2.6高温胁迫下外源物质对颖花苯丙烷类代谢酶活性及次生代谢物含量的影响
由表3可知,与CK相比,高温胁迫下2个水稻品种的PAL、C4H和4CL活性均以SA+Suc处理较高,Aca和SA+Aca处理较低。与CK相比,高温胁迫下SA+Suc和Suc处理显著增加GLA15中C4H和4CL活性;MH101中SA+Suc和Suc处理的C4H和4CL活性无显著变化,总酚和总黄酮含量显著增加;Aca处理的C4H活性和总酚含量显著降低,木质素含量显著增加。高温胁迫下SA+Suc处理的PAL活性和木质素含量较Suc处理显著增加,总酚和总黄酮含量较Suc处理显著降低;MH101中SA+Aca处理的总酚含量较Aca处理显著增加而木质素含量显著降低,GLA15中SA+Aca处理的4CL活性较Aca处理显著降低而总酚含量显著增加,同时木质素仍能维持较高水平。
3讨论
前人研究发现,喷施外源调控物质是提高水稻颖花育性、缓解高温热害的有效措施之一(刘奇华等,2016;Tang et al.,2018;杨军等,2019;Karwa et al.,2022)。本研究通过喷施不同外源物质,探究颖花能量水平变化与高温胁迫下水稻重要指标的关联,结果发现2个水稻品种颖花的ATP含量和ATPase活性均以SA+Suc处理最高,Aca处理最低,且高温耐性品种GLA15的颖花ATP含量和ATPase活性总体高于高温敏感品种MH101;此外,高温胁迫下Suc、SA和SA+Suc处理的花粉活性和颖花受精率显著升高,而Aca处理花粉活力和颖花受精率显著降低。此结果与前人研究结果一致,即喷施Suc和SA能增强水稻耐热性(Feng et al.,2018),而Aca作为酸性转化酶抑制剂,酸性转化的活性降低可显著影响可育花粉的形成,高温下该酶活性下降是加剧花粉粒败育的主要因素(De Storme and Geelen 2014;Chaturvedi et al.,2021)。本研究中,花粉活力在MH101中表现为SA+Suc处理最高,在GLA15中表现为SA处理最高,2个品种均为Aca处理最低;颖花受精率以SA+Suc、Suc和SA处理相对较高。目前关于Suc、SA和Aca等外源物质如何调控水稻耐热性的机理仍知之甚少,其调控水稻高温耐性是否与能量水平相关也尚不清楚,但高温胁迫下花粉活力和颖花受精率均有不同程度受损,表明颖花能量水平可能是影响水稻耐热性的一个重要因素,而施用合适的外源物质会缓解颖花受到的伤害。
外源生长调节剂能增加同化物供应,降低水稻细胞内活性氧水平,减少高温对生殖器官发育的抑制,从而增强水稻耐热性(Feng et al.,2018)。据报道,水稻生殖阶段对高温胁迫较敏感,其中碳水化合物供应、转化及利用是影响作物非生物胁迫下耐受性的重要因素(Lohani et al.,2020;Chaturvedi et al.,2021;Guan et al.,2023)。高温下碳水化合物代谢受阻,能量缺乏导致花粉粒发育不良、柱头花粉萌发及花粉管伸长受阻,最终导致小穗败育(Jiang et al.,2020;Chen et al.,2022)。在开花时,花粉萌发和花粉管伸长受热应激抑制(Zhang et al.,2016),花粉管伸长到卵巢是一个极其耗能的过程,依赖于质体定位的糖酵解和线粒体定位的呼吸途径(Ge et al.,2019)。此过程中花粉管的呼吸速率急剧增加,尖端的快速增长需对能量生产进行严格的时空调节(Goetz et al.,2017)。但授粉过程中的能量代谢受热应激干扰,导致受精失败(Zhang et al.,2021)。维持能量同质性对所有生物体来说均具有挑战性,植物的能量可用性和胁迫耐受性间密切相关(De Block and Van Lijsebettens,2011;Dröge-Laser et al.,2018)。本研究中,高温胁迫下Suc、SA和SA+Suc处理的SS和INV活性显著增加,转化酶将蔗糖裂解成己糖,己糖酶为细胞提供呼吸燃料以及碳和能量,用于合成不同化合物,而阿卡波糖作为酸性转化酶抑制剂,高温胁迫下2个品种Aca处理的INV活性均降低,高温敏感品种MH101中SS活性也显著降低,表明SA、Suc和SA+Suc处理不同程度促进了蔗糖代谢,而Aca处理则严重影响蔗糖代谢。结合上述ATP含量变化,推断酸性转化酶通过ATP含量来增强植物的耐热性,从而为花序上的花粉萌发和开花热胁迫下雌蕊的花粉管伸长提供能量。此外,高温胁迫下SA、Suc和SA+Suc处理碳水化合物含量均增加,而Aca处理的可溶性糖、蔗糖和非结构性碳水化合物含量降低。说明叶片喷施蔗糖和阿卡波糖可影响蔗糖转运,改变蔗糖代谢,维持碳平衡和能量代谢,影响水稻碳水化合物的积累。因此,推测这可能是导致颖花能量水平和能量生产效率产生差异的重要因素。
高温胁迫通常会引起植物体内活性氧和MDA含量上升,抗氧化防御系统紊乱,活性氧清除能力下降(Wan et al.,2007;Zhao et al.,2018;Xu et al.,2021),而抗氧化能力的增强和热激蛋白的积累等过程均需消耗大量能量,能量不足会抑制生长发育及抗逆性(Yu et al.,2020),因此在水稻生长发育阶段维持其颖花能量稳态对其在非生物逆境下提高抗逆性具有重要意义。Li等(2020)研究表明,耐热性水稻品种的ATP含量高、能量充足,热激蛋白积累和抗氧化酶活性增强,高温下耐性更高。本研究也同样发现,高温胁迫下SA、Suc和SA+Suc处理的抗氧化酶活性增强。此外,本研究中高温耐性品种GLA15的SOD、POD和APX活性总体高于高温敏感品种MH101,且GLA15中ATP含量和ATPase活性也高于MH101,暗示高温耐性品种可能因能量储备充足,可为提高抗氧化能力及热激蛋白积累提供充足能量,具有较强的高温胁迫应答能力,从而在逆境下仍能保持植物系统的高效运行。
苯丙烷途径是植物合成次生代谢物的主要途径之一,其中木质素途径与类黄酮途径是2个重要分支途径,在植物防御反应和逆境胁迫中起重要作用(Dong and Lin,2021)。苯丙烷途径的代谢物可激发体内抗氧化酶活性,清除活性氧自由基,减缓膜质过氧化,其中木质素还参与花药发育和导管水分运输,但目前对其调控植物耐热性却鲜有报道。有研究表明,PAL、C4H和4CL等基因的上调表达能促进木质素、黄酮类及酚类化合物合成,有利于增强水稻对高温胁迫的耐受性(Zhang et al.,2021)。也有研究表明,减数分裂期高温促进颖花中苯丙烷类代谢关键酶活性上升和代谢产物含量增加,耐热品种高温下能积累较多的木质素和类黄酮(汪胜勇等,2023)。
本研究发现,高温胁迫下处理间苯丙烷类代谢酶活性表现为SA+Suc处理较高,Aca和SA+Aca处理较低,与颖花能量水平、蔗糖等碳水化合物含量变化趋势大致相同。一方面说明植物次生代谢与糖代谢密切相关,糖代谢可激活苯丙烷代谢途径;另一方面也表明只有能量充足才能富集更多次生代谢物。水杨酸作为一种内源酚类生长调节剂,激活苯丙烷代谢途径在植物抗病和防御反应中发挥作用。高温胁迫下SA+Suc处理较Suc处理的PAL活性和木质素含量升高,总酚和总黄酮含量降低,而高温敏感品种MH101中SA+Aca处理较Aca处理总酚含量升高、木质素含量降低,高温耐性品种GLA15的总酚和木质素含量也显著增加。以上结果表明,当颖花能量充足时,水杨酸优先诱导高温下木质素富积,以减少花器官中水分散失。当颖花能量不足时,耐性品种通过调控4CL活性,代谢流重新定向,仍能维持较高的木质素水平,增强水稻对高温胁迫的耐受性。
4结论
外源化学物质主要通过影响碳水化合物含量和蔗糖代谢,调控颖花能量水平,维持较高抗氧化酶活性和次生代谢物水平,增强水稻花器官对高温胁迫的耐性。因此,通过施用外源物质改善颖花能量起始水平可能是有效缓解水稻高温胁迫的一种潜在技术策略。
参考文献(References)
陈阜,姜雨林,尹小刚.2021.中国耕作制度发展及区划方案调整[J].中国农业资源与区划,42(3):1-6.[Chen F,Jiang YL,Yin XG.2021.Adjustment of China's farming sys-tem regionalization scheme[J].Chinese Journal of Agricul-tural Resources and Regional Planning,42(3):1-6.]doi:10.7621/cjarrp.1005-9121.20210301.
盛家艳,张伟杨,王志琴,杨建昌.2019.水稻颖花退化机理与调控途径[J].作物杂志,(2):20-27.[Sheng JY,Zhang WY,Wang ZQ,Yang JC.2019.Mechanism andregula-tion in spikelet degeneration of rice[J].Crops,(2):20-27.]doi:10.16035/j.issn.1001-7283.2019.02.004
冯向前,殷敏,王孟佳,马横宇,刘元辉,褚光,徐春梅,章秀福,王丹英,张运波,陈松.2022.播期对长江下游不同类型晚稻品种产量的影响及其与水稻全育期温光资源配置间关系[J].作物学报,48(10):2597-2613.[Feng XQ,Yin M,Wang MJ,Ma HY,Liu YH,Chu G,Xu CM,Zhang XF,WangDY,Zhang YB,Chen S.2022.Effects of sowing date on the yield of different laterice variety types and its relationship with the allocation of tempera-ture and light resourcesduring the whole growthperiod of rice in the lower reaches of the Yangtze River[J].Acta Agronomica Sinica,48(10):2597-2613.]doi:10.3724/SPJ.1006.2022.12072.
符冠富,张彩霞,杨雪芹,杨永杰,陈婷婷,赵霞,符卫蒙,奉保华,章秀福,陶龙兴,金千瑜.2015.水杨酸减轻高温抑制水稻颖花分化的作用机理研究[J].中国水稻科学,29(6):637-647.[Fu GF,Zhang CX,Yang XQ,Yang YJ,Chen TT,Zhao X,FuWM,FengBH,Zhang XF,Tao LX,JinQY.2015.Action mechanism by which SA alleviate high temperature-inducedinhibition to spikelet differentia-tion[J].Chinese Journal of Rice Science,29(6):637-647.]doi:10.3969/j.issn.1001-7216.2015.06.010.
韩涛.2014.孕穗期冷水胁迫对水稻碳水化合物形成积累规律的影响[D].哈尔滨:东北农业大学.[Han T.2014.Bootingstage coldwater stress on rice carbohydrates form accumulation pattern[D].Harbin:Northeast Agricultural University.]doi:10.7666/d.Y2620785.
胡秋倩,闫娜,崔克辉.2020.水稻颖花育性的高温伤害机理及其栽培调控措施[J].植物生理学报,56(6):1177-1190.[Hu QQ,YanN,Cui KH.2020.High temperature injury on spikelet fertility and its regulation in rice[J]Plant Physiology Journal,56(6):1177-1190.]doi:10.13592/j.cnki.ppj.2019.0223.
黄晓彤,史锐,刘苗苗,丛龙娇,刘斯文,王琪瑶.2022.同属不同种桑叶总黄酮的含量测定及分析[J].亚太传统医药,18(8):91-95.[Huang XT,Shi R,Liu MM,Cong LJ,LiuS W,Wang QY.2022.Optimization of extraction pro cess and content determination of total flavonoids from dif-ferent mulberry leaves[J].Asia-Pacific Traditional Medi-cine,18(8):91-95.]doi:10.11954/ytctyy.202208017.
姜宁,符卫蒙,符冠富,陶龙兴.2020.蔗糖减缓水稻灌浆期高温对同化物转运抑制作用的原因分析[J].中国稻米,26(3):13-17.[Jiang N,Fu WM,Fu GF,TaoL X.2020.Sucrose alleviates inhibition on the kernel weight and assimilation distribution caused by heat stress at grain fil-ling stage of rice[J].China Rice,26(3):13-17.]doi:10.3969/j.issn.1006-8082.2020.03.004.
李光彦.2021.能量代谢影响水稻耐热性的作用机理[D].武汉:华中农业大学.[Li GY.2021.The mechanism of energy metabolism mediating rice heat resistance[D].Wu-han:Huazhong Agricultural University.]doi:10.27158/d cnki.ghznu.2021.000074.
李勇,杨晓光,叶清,陈阜.2013.全球气候变暖对中国种植制度可能影响IX.长江中下游地区单双季稻高低温灾害风险及其产量影响[J].中国农业科学,46(19):3997-4006.[LiY,Yang XG,Ye Q,Chen F.2013.The possible effects of global warming on cropping systems in China IX.The risk of high and low temperature disasters for single and double rice and its impacts on rice yield in the middle-lower Yangtze Plain[J].Scientia Agricultura Sinica,46(19):3997-4006.]doi:10.3864/j.issn.0578-1752.2013.19005.
刘奇华,孙召文,信彩云,马加清.2016.孕穗期施硅对高温下扬花灌浆期水稻干物质转运及产量的影响[J].核农学报,30(9):1833-1839.[LiuQH,Sun ZW,XinCY,Ma JQ.2016.Effectsof silicon on dry matter remobilization,distribution and grain yield of rice under high air tempera-ture[J].Journal of Nuclear Agricultural Sciences,30(9):1833-1839.]doi:10.11869/j.issn.100-8551.2016.09.1833.
刘晓龙,季平,杨洪涛,丁永电,付佳玲,梁江霞,余聪聪.2022.脱落酸对水稻抽穗开花期高温胁迫的诱抗效应[J].植物学报,57(5):596-610.[Liu XL,JiP,Yang HT,Ding YD,Fu JL,Liang JX,Yu CC.2022.Priming effect of abscisic acid on high temperature stress during rice heading-flowering stage[J].Chinese Bulletin of Botany,57(5):596-610.]doi:10.11983/CBB22022.
汤章城.1999.现代植物生理学实验指南[M].北京:科学出版社,[Tang ZC.1999.Experimental guide to modern plant physiology[M].Beijing:SciencePress.]
田小海,罗海伟,周恒多,吴晨阳.2009.中国水稻热害研究历史、进展与展望[J].中国农学通报,25(22):166-168.[TianXH,Luo HW,Zhou HD,Wu CY.2009.Research on heat stress of rice in China:Progress and prospect[J]Chinese Agricultural Science Bulletin,25(22):166-168.]
汪胜勇,陈宇航,陈会丽,黄钰杰,张啸天,丁双成,王宏伟.2023.水稻减数分裂期高温对苯丙烷类代谢及下游分支代谢途径的影响[J].中国水稻科学,37(4):368-378.[Wang SY,Chen YH,Chen HL,Huang YJ,ZhangXT,Ding SC,Wang HW.2023.Effects of high temperature"on phenylpropane metabolism and downstream branch metabolic pathways in rice meiosis[J].Chinese Journal of Rice Science,37(4):368-378.]doi:10.16819/j.1001-7216.2023.221112.
王成章,李建华,郭玉霞,方丽云,高永革.2007.光周期对不同秋眠型苜蓿SOD、POD活性的影响[J].草地学报,15(5):407-411.[Wang CZ,LiJH,Guo YX,Fang LY,Gao YG.2007.Effect of photoperiod on SOD and POD activities in alfalfa varieties with different fall dormancy[J].Acta Agrestia Sinica,15(5):407-411.]doi:10.11733/j.issn.1007-0435.2007.05.002.
徐纪明,毛文轩,何秋菊,姜小燕,毛传澡.2011.水稻叶片无机磷测定影响因素探究[J].浙江农业学报,31(11):1790-1795.[Xu JM,Mao WX,HeQJ,Jiang XY,Mao CZ.2011.Analysis of influencing factors for determina-tion of inorganic phosphate concentration in rice leaves[J].Acta Agriculturae Zhejiangensis,31(11):1790-1795.]doi:10.3969/j.issn.1004-1524.2019.11.03.
徐鹏,贺一哲,方双文,朱铁忠,武立权.2023.外源海藻糖对高温胁迫下穗分化期水稻叶片生理特性及产量的影响[J].西北植物学报,43(4):628-637.[Xu P,He YZ,Fang SW,Zhu TZ,Wu LQ.2023.Effects of exogenous treha-loseon leaf physiological characteristics and yield of rice at panicle initiation stage under high temperature stress[J].Acta Botanica Boreali-Occidentalia Sinica,43(4):628-637.]doi:10.7606/j.issn.1000-4025.2023.04.0628.
杨军,蔡哲,刘丹,胡犁月,曲文波.2019.高温下喷施水杨酸和磷酸二氢钾对中稻生理特征和产量的影响[J].应用生态学报,30(12):4202-4210.[Yang J,Cai Z,LiuD,Hu LY,Qu WB.2019.Effects of spraying salicylic acid and potassium dihydrogen phosphate on physiological cha-racteristics and grain yield ofsingle-season rice under high temperature condition[J].Chinese Journalof Applied Eco-logy,30(12):4202-4210.]doi:10.13287/j.1001-9332.201912.029.
张水明,龚凌燕,曹丹琴,张勇娟,杨健.2015.石榴种皮总木质素含量及PgCOMT基因的克隆与表达[J].热带亚热带植物学报,23(1):65-73.[Zhang SM,Gong LY,Cao DQ,Zhang YJ,Yang J.2015.Total lignin content in pomegranate seed coat and coning and expression analy-sis ofPgCOMT gene[J].Journal ofTropical and Subtropi-cal Botany,23(1):65-73.]doi:10.11926/j.issn.1005-33952015.01.010.
赵智中,张上隆,徐昌杰,陈昆松,刘栓桃.2001.蔗糖代谢相关酶在温州蜜柑果实糖积累中的作用[J].园艺学报,28(2):112-118.[Zhao ZZ,Zhang SL,Xu CJ,Chen KS Liu ST.2001.Roles of sucrose-metabolizing enzymes in accumulation of sugars in satsuma mandarin fruit[J].Acta Horticulturae Sinica,28(2):112-118.]doi:10.3321/j.issn:0513-353X.2001.02.004.
Chaturvedi P,Wiese AJ,Ghatak A,Drabková LZ,Weckwerth W,Honys D.2021.Heat stress response mechanisms in pollen development[J].The New Phytologist,231(2):571-585.doi:10.1111/nph.17380.
Chen TT,Ma JY,XuCM,Jiang N,LiG Y,Fu WM,FengB"H,Wang DY,Wu ZH,Tao LX,Fu GF.2022.Increased ATPase activity promotes heat-resistance,high-yield,and high-quality traits in rice by improving energy status[J]Frontiersin Plant Science,13:1035027.doi:10.3389/fpls.2022.1035027.
De Block M,Van Lijsebettens M.2011.Energy efficiency and"energy homeostasis as genetic and epigenetic components of plant performance and crop productivity[J].Current Opinion in Plant Biology,14(3):275-282.doi:10.1016/j.pbi.2011.02.007.
De Storme N,Geelen D.2014.The impact of environmental"stress on male reproductive development in plants:Biologi"cal processes and molecular mechanisms[J].Plant,Cellamp;"Environment,37(1):1-18.doi:10.1111/pce.12142.
Dong NQ,Lin HX.2021.Contribution of phenylpropanoid"metabolism to plant development and plant-environment interactions[J].Journal of Integrative Plant Biology,63(1):180-209.doi:10.1111/jipb.13054.
Droge-Laser W,Weiste C.2018.The C/S₁bZIPnetwork:A regulatory hub orchestrating plant energy homeostasis[J].Trends in Plant Science,23(5):422-433.doi:10.1016/j.tplants.2018.02.003.
FengBH,Zhang CX,Chen TT,Zhang XF,Tao LX,Fu GF.2018.Salicylic acid reverses pollen abortion of rice caused by heat stress[J].BMC Plant Biology,18(1):245.doi:10.1186/s12870-018-1472-5.
GeZ X,Cheung AY,Qu LJ.2019.Pollen tube integrity regu lation in flowering plants:Insights from molecular assem-blies on the pollen tube surface[J].New Phytologist,222(2):687-693.doi:10.1111/nph.15645
Goetz M,Guivarch A,Hirsche J,Bauerfeind MA,González MC,Hyun TK,Eom SH,Chriqui D,Engelke T,GroBkinsky DK,Roitsch T.2017.Metabolic control of tobacco polli-nation bysugars and invertases[J].Plant Physiology,173(2):984-997.doi:10.1104/pp.16.01601.
Guan XY,Zhang Y,Zhou LJ,Asad MAU,Zhao Q,Pan G,Cheng FM.2023.Disruptions of sugar utilizationand car bohydrate meabolism in rice developing anthers aggra vated heat stress-induced pollen abortion[J].Plant Physio-logy and Biochemistry,202:107991.doi:10.1016/j.plaphy.2023.107991.
Jiang N,Yu PH,Fu WM,LiGY,Feng BH,Chen TT,LiH B,Tao LX,Fu GF.2020.Acid invertase confers heat tole-rance in rice plants by maintaining energy homoeostasis of spikelets[J].Plant,Cellamp;Environment,43(5):1273-1287.doi:10.1111/pce.13733.
Karwa S,Taunk J,Maurya S,DasA,Krishna GK,Arya SS,Kumar A,Kumar S,Kumar P,Chinnusamy V,Pal M.2022.Spermidine exogenous application mollifies repro-ductive stage heat stress ramifications in rice[J].Frontiers in Plant Science,13:1027662.doi:10.3389/fpls.2022.1027662.
LiGY,ZhangCX,Zhang GH,Fu WM,Feng BH,Chen TT,PengSB,Tao LX,Fu GF.2020.Abscisic acid negatively
modulates heat tolerance in rolled leaf rice by increasing leaf temperature and regulating energy homeostasis[J].Rice,13(1):18.doi:10.1186/s12284-020-00379-3.
Lohani N,SinghM B,Bhalla PL.2020.High temperature sus-ceptibility of sexual reproduction in crop plants[J].Jour nal of Experimental Botany,71(2):555-568.doi:10.1093/jxb/erz426.
Mano J,Ohno C,Domae Y,Asada K.2001.Chloroplastic ascorbate peroxidase is the primary target of methyl-viologen-induced photooxidative stress in spinach leaves:Its relevance to monodehydroascorbate radical detected with in vivo ESR[J].Biochimica et BiophysicaActa,1504(2-3):275-287.doi:10.1016/s0005-2728(00)00256-5.
Tang S,Zhang HX,Li L,Liu X,Chen L,ChenWZ,Ding YF 2018.Exogenous spermidine enhances the photosynthetic and antioxidant capacity of rice under heat stress during early grain-filling period[J].Functional Plant Biology,45(9):911-921.doi:10.1071/FP¹7149.
Wan CX,LiSQ,WenL,Kong J,Wang K,Zhu YG.2007.Damageof oxidative stress on mitochondriaduring micro-spores development in Honglian CMS line of rice[J].Plant Cell Reports,26(3):373-382.doi:10.1007/s00299-006-0234-2.
Xu YF,Chu CC,Yao SG.2021.The impact of high-temperature stress on rice:Challenges and solutions[J]The Crop Journal,9(5):963-976.doi:10.1016/j.cj.2021.02.011.
Yu PH,Jiang N,Fu WM,Zheng GJ,LiGY,Feng BH,Chen TT,Ma JY,LiHB,Tao LX,Fu GF.2020.ATP hydroly-sis determines cold tolerance by regulating available energy for glutathione synthesis in rice seedling plants[J]Rice,13(1):23.doi:10.1186/s12284-020-00383-7.
Zhang CX,Fu GF,Yang XQ,Yang YJ,Zhao X,ChenTT,ZhangXF,JinQY,Tao LX.2016.Heat stress effects are stronger on spikelets than on flag leaves in rice due to dif-ferences in dissipation capacity[J].Journal of Agronomy and CropScience,202(5):394-408.doi:10.1111jac.12138.
Zhang YM,Yu HX,Ye WW,Shan JX,Dong NQ,Guo T,Kan Y,Xiang YH,Zhang H,Yang YB,LiYC,Zhao HY,LuZQ,Guo SQ,Lei JJ,Liao B,Mu XR,CaoYJ,Yu JJ,Lin HX.2021.A rice QTL GS3.1 regulates grain size through metabolic-flux distribution between flavonoid and lignin metabolons without affecting stress tolerance[J].Communications Biology,4(1):1171.doi:10.1038/s42003-021-02686-x.
Zhao Q,Zhou LJ,Liu JC,DuXX,Asad MAU,Huang FD,Pan G,Cheng FM.2018.Relationship of ROSaccumula-tion and superoxide dismutase isozymes in developing anther with floret fertility of rice under heat[J].Plant Physiology and Biochemistry,122:90-101.doi:10.1016/j.plaphy.2017.11.009.
(责任编辑 王晖)

