长顺绿壳蛋鸡GRIN1 基因 3′ 非翻译区的多态性及其与蛋壳品质的关联性




摘要: 【目的】探索长顺绿壳蛋鸡 GRIN1 基因3′非翻译区(untranslated region,UTR) 多态性对蛋壳品质的影响。【方法】选择185 只健康蛋鸡,测定其第45 周龄产蛋的蛋质量、蛋形指数、蛋壳强度、蛋壳厚度和蛋壳质量5 个指标;使用NCBI 和PrimerPremier 3.0 设计引物,采用正向测序法筛选GRIN1 基因在3′ UTR 区域的SNP 位点。【结果】GRIN1 基因的3′ UTR 检测到4 个SNP 位点:g.30871Cgt;T、g.31017Agt;G、g.31158Agt;C 和g.31166Ggt;C,其中仅g.31158Agt;C 和g.31166Ggt;C 之间存在强连锁不平衡,且g.30871Cgt;T 和g.31017Agt;G 都极显著偏离哈代—温伯格平衡(Plt;0.01)。g.31017Agt;G 与蛋壳品质的关联分析中,GG 基因型的蛋质量显著高于AA 基因型(Plt;0.05)。4 个SNP 位点共产生5 个单倍型(H1、H2、H3、H4、H5) 和8 个双倍型(H1H1、H1H2、H1H3、H2H2、H2H3、H2H4、H3H5、H4H4),双倍型H3H5 的蛋质量显著高于双倍型H2H2 和H2H3 (Plt;0.05),双倍型H3H5 的蛋壳质量显著高于双倍型H2H2 (Plt;0.05),其他双倍型指标间的差异未达到显著水平(Pgt;0.05)。【结论】长顺绿壳蛋鸡GRIN1 基因与蛋壳品质存在显著关联;g.31017Agt;G 对蛋壳品质有显著影响,能够作为改善蛋壳品质的分子标记位点参考。
关键词: 长顺绿壳蛋鸡;GRIN1 基因;3′非翻译区;SNP 位点;蛋壳品质
中图分类号: S831.2 文献标志码: A 文章编号: 1004–390X (2024) 03−0056−08
长顺绿壳蛋鸡是贵州省地方品种,中心产区为黔南布依族苗族自治州长顺县,是该县的地方特产。研究发现:长顺绿壳鸡蛋富含维生素、脑磷脂、卵磷脂、微量元素等营养物质[1-2],其营养价值高于普通地方鸡种所产鸡蛋。MARIE 等[3]研究发现:蛋壳是生物陶瓷性材料,其碳酸钙含量高达95.0%,基质蛋白含量为3.5%。随着当代畜牧业规模化、集约化养殖模式的迅猛发展,提高蛋壳品质对于禽类养殖和蛋类生产具有重要意义。无论是在鸡蛋后期的收集、包装和运输过程中如何提高蛋的商业价值,还是如何降低蛋的损耗率、提高孵化率等,皆对鸡蛋蛋壳品质有着较高的要求[4]。蛋壳品质不仅受疾病、高温、品种、年龄、营养等因素影响[5],家禽机体对钙的吸收利用也会使蛋壳的厚度和强度下降,导致产软壳蛋甚至是无壳蛋[6],在实际生产过程中造成巨大的经济损失。因此,有效提高蛋壳品质、确保蛋类生产的稳定和可持续发展是亟待解决的问题。
谷氨酸离子受体NMDA 型亚单位1 (glutamateionotropic receptor NMDA type subunit 1,GRIN1)基因位于鸡的17 号染色体,含有21 个外显子和20 个内含子。NMDA 受体是谷氨酸离子型受体的主要亚型,包括3 个亚基:NR1、NR2(NR2A-2D) 和NR3 (NR3A 和NR3B)[7],主要在调控学习记忆、兴奋性神经毒性、突触可塑性等生理过程中发挥作用[8]。目前有关GRIN1 基因的研究主要集中于人类疾病,有学者研究发现其表达与精神分裂症相关[9],该基因发生变异可引起癫痫性脑病、语言落后、精神发育迟缓等与大脑相关的疾病[10-12]。5 ′非翻译区(untranslated region,UTR) 和3′ UTR 是GRIN1 基因的重要调控结构域,microRNA (miRNA) 是由21~25 个核苷酸组成的小型非编码RNA,其与3′ UTR 中的序列互补,从而直接影响mRNA 的表达[13]。目前,国内外对于GRIN1 基因与鸡蛋壳品质的研究还比较少。本研究以45 周龄长顺绿壳蛋鸡为研究对象,在GRIN1 基因上寻找SNP 位点,验证GRIN1 基因与长顺绿壳蛋鸡蛋壳品质的关联性,以期为育种工作提供参考。
1 材料与方法
1.1 试验动物
在贵州大学动物科学学院农场选择同批出雏、健康无病的长顺绿壳蛋鸡185 只,在相同饲养条件下饲养45 周;收集其在第45 周龄的产蛋量,共计582 枚,并逐枚标记。
1.2 生产性能指标的测定
根据《家禽生产性能名词术语和度量计算方法》(NY/T 823 —2020)[14], 对蛋质量、蛋形指数、蛋壳强度、蛋壳厚度和蛋壳质量进行测定,并对蛋鸡进行翅静脉采血1.0~1.5 mL,于−20 ℃保存备用。
1.3 DNA 的提取和引物设计
将185 份长顺绿壳蛋鸡血样解冻,按照血样DNA 试剂盒的说明书提取DNA,于−20 ℃ 保存备用。在NCBI 网站(https://www.ncbi.nlm.nih.gov/)查找鸡的GRIN1 全基因序列(NC_052548.1),根据GRIN1 的基因序列设计在g.30448~g.31640区域的1对引物(F:5′-GGGAAAGGACTTGGAAGGCA-3 ′ , R: 5 ′ -CGCCTATGGCTGCTTGAAAC-3′),Tm 值为58 ℃,扩增序列长度为504 bp。
1.4 PCR 扩增
PCR 扩增反应体系为20 μL,包括:RNase-freeH2O 7 μL,2×Taq PCR Master Mix 10 μL,上、下游引物各1 μL,DNA 模板1 μL。反应程序为:94 ℃ 预变性8 min;94 ℃ 变性30 s,62 ℃ 退火30 s,72 ℃ 延伸30 s,共35 个循环;72 ℃ 终延伸5 min;4 ℃ 保存。先用1% 琼脂糖凝胶电泳对PCR 产物进行检测鉴定,再送至生工生物工程(上海) 股份有限公司进行测序,获取目的基因片段。
1.5 数据统计与分析
应用生物信息学分析软件DNAStar V7.1.0 中的EditSeq、MegAlign 程序以及Chromas 软件,结合人工校对法对测序结果进行比对,查找 SNP位点。参考张晋华[15]的方法计算基因型频率、等位基因频率、期望杂合度(He)、有效等位基因数(Ne)、多态信息含量(PIC)、χ2 值等;根据SERROTE等[16]的方法判断基因多态性,即:PICgt;0.50为高度多态,0.50≥PIC≥0.25 为中度多态,PIClt;0.25 为低度多态。利用SPSS 23.0 软件一般线性模型中的单因素方差分析SNP 位点与蛋壳品质的关联性。运用离线软件haploview 对SNP 位点的连锁不平衡、单倍型和双倍型进行分析,当满足连锁不平衡系数(D′)gt;0.80 且相关系数(R2)gt;0.33时,SNP 位点处于连锁不平衡状态[17-18]。利用在线软件RNAfold (http://rna.tbi.univie.ac.at/cgibin/RNAWebSuite/RNAfold.cgi) 预测mRNA 的二级结构。
2 结果与分析
2.1 GRIN1 基因的SNP 位点
GRIN1 基因的3′ UTR 共发现4 个SNP 位点(图1),分别为g.30871Cgt;T、g.31017Agt;G、g.311-58Agt;C 和g.31166Ggt;C,且4 个SNP 位点均产生3种基因型。
2.2 GRIN1 基因SNP 位点的遗传特性
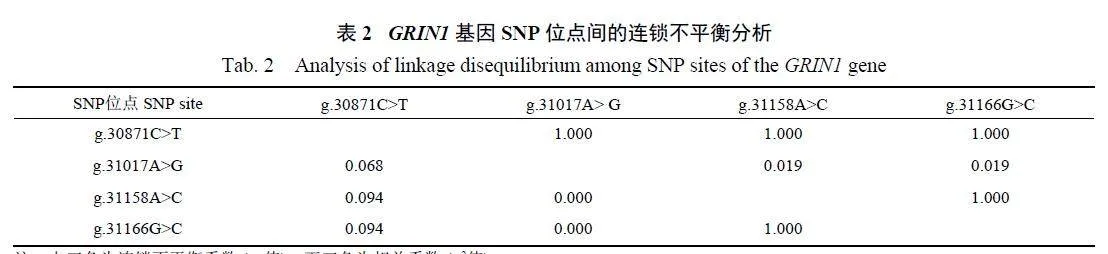
由表1 可知:g.30871Cgt;T 的优势基因型是CC,基因型频率为0.805,优势等位基因为C,等位基因频率为0.870;g.31017Agt;G 的优势基因型为AA,基因型频率为0.611,优势等位基因为A,等位基因频率为0.686;g.31158Agt;C 的优势基因型为AA,基因型频率为0.416,优势等位基因为A,等位基因频率为0.614;g.31166Ggt;C的优势基因型为GG,基因型频率为0.416,优势等位基因为G,等位基因频率为0.614。根据χ2检验结果, g.30871Cgt;T 和g.31017Agt;G 位点的χ2 值都大于χ20.01 (9.210),表明这2 个位点都极显著偏离哈代—温伯格平衡(Plt;0.01);g.31158Agt;C和g.31166Ggt;C 位点未偏离哈代—温伯格平衡(Pgt;0.05)。g.30871Cgt;T 的PIC 为0.226,为低度多态;而g.31017Agt;G、g.31158Agt;C 和g.31166Ggt;C 的PIC值分别为0.430、0.474 和0.474,皆为中度多态。
2.3 GRIN1 基因SNP 位点的连锁不平衡、单倍型和双倍型
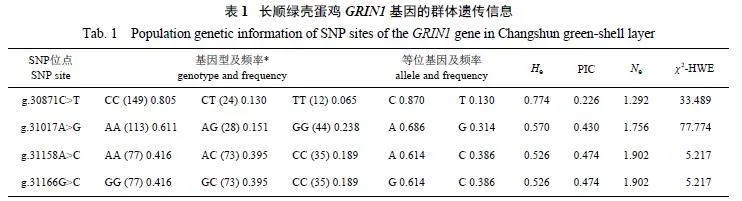
由表2 可知:仅g.31158Agt;C 和g.31166Ggt;C之间的D′值和R2 值满足D′gt;0.80 和R2 gt;0.33,即这2 个位点之间完全连锁;其余SNP 位点之间不满足此条件,不存在强连锁不平衡。
4 个SNP 位点之间存在5 种单倍型(H1、 H2、H3、 H4、 H5) 和8 种双倍型(H1H1、 H1H2、 H1H3、H2H2、H2H3、H2H4、H3H5、H4H4)。双倍型中,H1H1 的频率最高,为0.189;其次是H1H3,频率为0.168;H4H4 的频率最低,为0.065 (表3)。
2.4 GRIN1 基因SNP 位点与长顺绿壳蛋鸡蛋壳品质的关联性
由表4 可知:位于3' UTR 的4 个SNP 位点中,g.31017Agt;G 显著影响蛋质量,基因型AA的蛋质量显著高于基因型GG,另外3 个SNP 位点对蛋壳品质的影响均未达到显著水平。
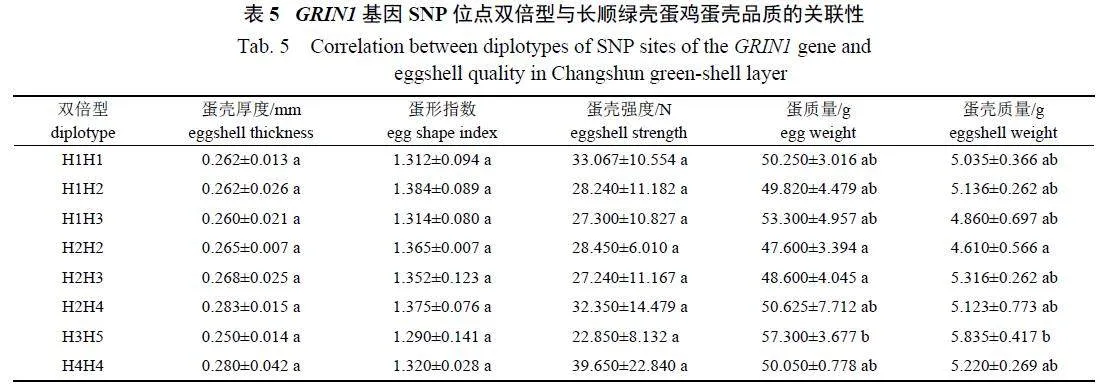
双倍型关联性分析结果(表5) 显示:H3H5的蛋质量显著大于H2H2 和H2H3, H3H5 的蛋壳质量显著大于H2H2,其他双倍型的各指标间无显著差异。因此,双倍型H3H5 为最优双倍型。
2.5 GRIN1 基因3' UTR SNPs 对mRNA 二级结构的影响
单倍型H1 (CACC),即原序列mRNA 的最小自由能为−440.70 kcal/mol;单倍型H2 (CAAG) 对应的mRNA 最小自由能为−440.50 kcal/mol;单倍型H3 (CGAG) 对应的mRNA 最小自由能为−443.70 kcal/mol;单倍型H4 (TAAG) 对应的mR-NA 最小自由能为−439.50 kcal/mol;单倍型H5 (CGCC)对应的mRNA 最小自由能为−443.90 kcal/mol(图2)。可见,各单倍型mRNA 的稳定性为H5gt;H3gt;H1gt;H2gt;H4。
3 讨论
蛋壳虽只占鸡蛋总质量的10%,却有着重要的功能,可为鸡蛋提供物理保护和微生物防御,从而保证鸡蛋的安全并提高鸡蛋孵化率[19]。段忠意[20]研究发现:蛋壳基质蛋白作为蛋壳的重要成分,参与蛋壳的形成,影响蛋壳品质。本研究分析GRIN1 基因的多态性及其与蛋壳品质的关联性,旨在从基因水平筛选蛋壳品质优良的个体[21]。
3' UTR 参与调控真核生物细胞的表型、生长和分化,是细胞内因子相互作用的重要区域[22]。有研究表明:3' UTR 可调节mRNA 稳定性[23-24]、亚细胞mRNA 定位[25]和mRNA 的翻译[26]。朱路路[27]研究认为:3' UTR 内的多态性可能是基因表达抑制或增强的潜在因素。本研究以长顺绿壳蛋鸡为对象,探究GRIN1 基因3' UTR 多态性对长顺绿壳蛋鸡蛋壳品质的影响,发现GRIN1 基因的3' UTR 有4 个突变位点,其中g.31017Agt;G、g.31158Agt;C 和g.31166Ggt;C 属于中度多态,有一定的遗传变异潜力,对分子遗传育种有一定价值[28];而g.30871Cgt;T 为低度多态,对于分子育种价值不大。根据χ2 检验,g.31158Agt;C 和g.311-66Ggt;C 位点处于哈代—温伯格平衡,表明它们未受到基因突变、人工选育、自然选择、遗传漂变等因素的影响,或是经过长时间的人工选择后重新处于平衡状态,也有可能是长时间未与其他种群之间进行基因交流所致[29]。这说明部分长顺绿壳蛋鸡受到人工选育或基因突变等因素的影响较小,环境适应性强,有利于优良基因的保种;而部分长顺绿壳蛋鸡受到人工选育或基因突变等因素的影响较大,环境适应性差,可根据保种需求将其淘汰。
基因突变产生的单倍型多样性和核苷酸多样性是衡量动物群体遗传变异的重要指标[30]。本研究中的4 个SNP 位点共产生5 种单倍型和8 种双倍型,而5 种单倍型理论上能够产生15 种双倍型,但另外7 种双倍型并未检测到,推测可能是由于人工选择的干预、样本数据不足、人工选育过程中被淘汰等原因所致。本研究在长顺绿壳蛋鸡GRIN1 基因3' UTR 上发现4个突变位点,转录为mRNA 后位于3' UTR 端,不翻译为蛋白质;但GRIN1 基因的3' UTR 序列与miRNA 互补,直接作用于mRNA 的表达[13],故仅是通过影响DNA 水平和mRNA 的稳定性间接影响蛋白质的表达丰度,产生一定差异[31]。而本研究中4 种单倍型的mRNA 二级结构和自由能均发生了变化,推测4个SNP 位点主要是通过影响mRNA的稳定性间接影响蛋白质水平[32-33],但其是否达到改变翻译结果的程度仍有待进一步验证。4 个SNP 位点与蛋壳品质的关联性分析结果显示:g.31017Agt;G 突变对蛋质量有显著影响,基因型GG 的蛋质量显著大于基因型AA,这一结果可为长顺绿壳蛋鸡的选育工作提供参考。本研究还表明:双倍型H3H5 个体的蛋质量显著高于H2H2和H2H3 个体,且 H3H5 个体的蛋壳质量显著高于H2H2 个体,可见,单个SNP 位点对蛋壳品质的影响小于双倍型,这一结果与谭光辉等[34]和游敏芳等[35]的研究结果一致。
4 结论
本研究以长顺绿壳蛋鸡GRIN1 基因为研究对象,发现4 个SNP 位点,其中g.31017Agt;G 对其蛋壳品质有显著影响,双倍型H3H5 对于蛋壳品质也有显著影响,它们可作为改善蛋壳品质的分子标记位点参考。
[ 参考文献 ]
[1]唐继高, 刘嘉, 苗小猛, 等. 瑶山鸡与长顺绿壳蛋鸡鸡蛋营养成分比较研究[J]. 四川农业大学学报, 2021, 39(5):652. DOI: 10.16036/j.issn.1000-2650.2021.05.013.
[2]李兴美, 李志惠, 候晓琪, 等. 长顺县绿壳蛋鸡产业发展现状及对策建议[J]. 安徽农学通报, 2019, 25(17): 63.DOI: 10.16377/j.cnki.issn1007-7731.2019.17.027.
[3]MARIE P, LABAS V, BRIONNE A, et al. Data set forthe proteomic inventory and quantitative analysis of chickenuterine fluid during eggshell biomineralization[J].Data in Brief, 2014, 1: 65. DOI: 10.1016/j.dib.2014.09.006.
[4]DOMINGUEZ G N, MUNOZ A, RODRIGUEZ N A B.Quality assessment of chicken eggshell cuticle by infraredspectroscopy and staining techniques: a comparativestudy[J]. British Poultry Science, 2017, 58(5): 517. DOI:10.1080/00071668.2017.1342219.
[5]张凤葵, 杨会文. 影响鸡蛋壳品质的因素[J]. 畜牧兽医科技信息, 2011(7): 105. DOI: 10.3969/J.ISSN.1671-6027.2011.07.083.
[6]江丹莉, 张焯深, 孙俊峰, 等. 蛋壳粉少量替代石粉对蛋鸭产蛋性能、蛋品质及钙代谢的影响[J]. 广东农业科学, 2020, 47(3): 117. DOI: 10.16768/j.issn.1004-874X.2020.03.016.
[7]卢亚亚, 丁宇, 姚如恩, 等. GRIN1突变相关发育迟缓患儿临床特征和基因突变特点分析[J]. 检验医学, 2021,36(2): 140. DOI: 10.3969/j.issn.1673-8640.2021.02.005.
[8]LU T X, ROTHENBERG M E. MicroRNA[J]. Journal ofAllergy and Clinical Immunology, 2018, 141(4): 1202.DOI: 10.1016/j.jaci.2017.08.034.
[9]XU X X, LUO J H. Mutations of N-methyl-D-aspartatereceptor subunits in epilepsy[J]. Neuroscience Bulletin,2018, 34(3): 549. DOI: 10.1007/s12264-017-0191-5.
[10]刘永萍. GRIN1基因表达的调控序列及相关SNPs与精神分裂症的关联和法医学意义研究[D]. 北京: 中国医科大学, 2021.
[11]LEMKE J R, GEIDER K, HELBIG K L, et al. Delineatingthe GRIN1 phenotypic spectrum: a distinct geneticNMDA receptor encephalopathy[J]. Neurology, 2016,86(23): 2171. DOI: 10.1212/WNL.0000000000002740.
[12]ROSSI M, CHATRON N, LABALME A, et al. Novelhomozygous missense variant of GRIN1 in two sibs withintellectual disability and autistic features without epilepsy[J]. European Journal of Human Genetics, 2017, 25(3):376. DOI: 10.1038/ejhg.2016.163.
[13]CHEN W J, SHIEH C, SWANGER S A, et al. GRIN1mutation associated with intellectual disability alters NMDAreceptor trafficking and function[J]. Journal of HumanGenetics, 2017, 62(6): 589. DOI: 10.1038/jhg.2017.19.
[14]NY/T 823—2020. 家禽生产性能名词术语和度量计算方法[S].
[15]张晋华. 乌珠穆沁羊生长性状基因遗传效应分析与育种应用[D]. 北京: 中国农业科学院, 2021.
[16]SERROTE C M L, REINIGER L R S, SILVA K B, et al.Determining the polymorphism information content of amolecular marker[J]. Gene, 2020, 726: 144175. DOI: 10.1016/j.gene.2019.144175.
[17]SLATKIN M. Linkage disequilibrium: understanding theevolutionary past and mapping the medical future[J]. NatureReviews Genetics, 2008, 9(6): 477. DOI: 10.1038/nrg2361.
[18]ARDLIE K G, KRUGLYAK L, SEIELSTAD M. Patternsof linkage disequilibrium in the human genome[J].Nature Reviews Genetics, 2002, 3(4): 299. DOI: 10.1038/nrg777.
[19] TUISKULA-HAAVISTO M, HONKATUKIA M, DU-NN I C, et al. Validated quantitative trait loci for eggshellquality in experimental and commercial laying hens[J]. Animal Genetics, 2018, 49(4): 329. DOI: 10.1111/age.12671.
[20]段忠意. 鸡蛋壳超微结构与晶体结构的测定及全基因组关联分析[D]. 北京: 中国农业大学, 2017.
[21]杨酸, 张依裕, 谭元成, 等. 三穗鸭SLC4A9基因表达量及其多态性对蛋壳品质的遗传效应分析[J]. 中国畜牧兽医, 2021, 48(6): 2082. DOI: 10.16431/j.cnki.1671-7236.2021.06.021.
[22]王海震, 王莹, 刘定干. 真核生物mRNA 3′非翻译区的功能[J]. 生物化学与生物物理进展, 2008, 35(9): 980.
[23]MEIJLINK F, CURRAN T, MILLER A D, et al. Removalof a 67-base-pair sequence in the noncoding region ofprotooncogene fos converts it to a transforming gene[J].Proceedings of the National Academy of Sciences, 1985,82(15): 4987. DOI: 10.1073/pnas.82.15.4987.
[24]SHAW G, KAMEN R. A conserved AU sequence fromthe 3' untranslated region of GM-CSF mRNA mediatesselective mRNA degradation[J]. Cell, 1986, 46(5): 659.DOI: 10.1016/0092-8674(86)90341-7.
[25]MACDONALD P M, STRUHL G. Cis-acting sequencesresponsible for anterior localization of bicoid mRNA inDrosophila embryos[J]. Nature, 1988, 336(6199): 595.DOI: 10.1038/336595a0.
[26]MAYR C. What are 3' UTRs doing[J]. Cold Spring HarborPerspectives in Biology, 2019, 11(10): a034728. DOI:10.1101/cshperspect.a034728.
[27]朱路路. SCRN1基因3' UTR遗传多态性位点与缺血性中风及其不同中医证候的关联研究[D]. 南宁: 广西医科大学, 2021.
[28]SANTOS C P, AGUIAR A F, GIOMETTI I C, et al.High final energy of gallium arsenide laser increases MyoDgene expression during the intermediate phase of mu-scle regeneration after cryoinjury in rats[J]. Lasers in MedicalScience, 2018, 33(4): 843. DOI: 10.1007/s10103-018-2439-3.
[29]覃媛钰, 张依裕, 罗华伦, 等. SFRP5基因遗传变异对长顺绿壳蛋鸡胸肌肌肉品质的影响[J]. 农业生物技术学报, 2019, 27(4): 703. DOI: 10.3969/j.issn.1674-7968.2019.04.014.
[30]SRINIVAS Y, PANDE A, GOLE S, et al. Mitochondrialphylogeography reveals high haplotype diversity andunique genetic lineage in Indian dugongs (Dugong dugon)[J]. Aquatic Conservation: Marine and FreshwaterEcosystems, 2021, 31(4): 818. DOI: 10.1002/aqc.3490.
[31]SAUNA Z E, KIMCHI-SARFATY C. Understanding thecontribution of synonymous mutations to human disease[J]. Nature Reviews Genetics, 2011, 12(10): 683. DOI:10.1038/nrg3051.
[32]LIU K, CAO H Y, DONG X Y, et al. Polymorphisms ofpro-opiomelanocortin gene and the association with reproductiontraits in chickens[J]. Animal ReproductionScience, 2019, 210: 106196. DOI: 10.1016/j.anireprosci.2019.106196.
[33]谭光辉, 张依裕, 吴磊, 等. 三穗鸭ORAI1基因SNPs筛查及生物信息学分析[J]. 河南农业科学, 2020, 49(4): 153.DOI: 10.15933/j.cnki.1004-3268.2020.04.022.
[34]谭光辉, 李杰章, 覃媛钰, 等. 三穗鸭ATF4基因多态性鉴定及其与蛋壳品质的关联分析[J]. 南方农业学报,2020, 51(3): 652. DOI: 10.3969/j.issn.2095-1191.2020.03.023.
[35]游敏芳, 吴磊, 廖朝美, 等. 长顺绿壳蛋鸡ITPR1基因RYDR-ITPR结构域的多态性对蛋壳品质的影响[J]. 河南农业科学, 2020, 49(8): 124. DOI: 10.15933/j.cnki.1004-3268.2020.08.015.
责任编辑:何謦成
基金项目:贵州省科技合作计划项目[ 黔科合LH 字(2016)7454 号 ]。

