慢性避水应激法建立大鼠肠易激综合征模型及其评价



[摘 要] 目的:探讨慢性避水应激 (WAS) 法建立肠易激综合征 (IBS) 大鼠模型的方法,并评价其可行性。方法:30只雄性清洁型Wistar大鼠,随机分为对照组 (n=10) 和模型组 (n=20),模型组大鼠每日采用WAS 法诱导1 h,连续干预造模10 d;对照组大鼠不进行任何干预。造模结束后,观察并记录2 组大鼠一般情况和体质量,采用高架十字迷宫(EPM) 实验检测2 组大鼠进入开放臂次数(OE) 百分率和进入开放臂时间(OT) 百分率,腹壁撤回反射(AWR) 实验检测2 组大鼠内脏敏感性,心电图检查2 组大鼠心率变异性(HRV),腹外斜肌肌电图(EMG) 检测2 组大鼠结直肠痛敏阈值,多通道生理信号记录仪检测2组大鼠结肠慢波频率。结果:2组大鼠在整个造模期间均无死亡情况,造模结束后,模型组大鼠均伴有精神状态欠佳、自主活动减少、少动、皮毛散乱且无光泽、易激惹和肛门口不净等情况;对照组大鼠精神状态、自主活动、皮毛和肛周无明显变化。与对照组比较,模型组大鼠体质量明显降低(Plt;0. 05)。EPM 实验,与对照组比较,模型组大鼠OE 百分率和OT 百分率均明显降低(Plt;0. 01)。AWR 实验,模型组中AWR 半定量评分≥3 分大鼠共12 只,内脏痛大鼠模型造模成功率为60%。与对照组比较,模型组大鼠低频信号(LF) 和LF/高频信号(HF) 比值均明显升高(Plt;0. 01),HF 明显降低(Plt;0. 05)。EMG 法,与对照组比较,模型组大鼠结肠痛敏阈值明显降低 (Plt;0. 01),结肠慢波频率明显升高 (Plt;0. 01)。结论:采用WAS法建立IBS大鼠模型,大鼠行为及精神情绪改变、内脏敏感性升高、结肠慢波频率加快和自主神经系统平衡性紊乱,WAS 法可作为一种有效的造模方式,用于观察和评价IBS 治疗的相关药物及干预方法。
[关键词] 肠易激综合征; 行为学; 内脏高敏感性; 结肠功能; 自主神经系统平衡性
[中图分类号] R574.4 [文献标志码] A
肠易激综合征(irritable bowel syndrome,IBS) 是临床常见慢性胃肠道功能紊乱疾病,发病原因可能与肠动力异常、内脏感知异常和精神心理刺激等有关。临床主要表现为腹痛、大便性状和排便习惯改变等肠道症状,并伴有心悸、头痛、抑郁和焦虑等肠外表现及精神症状[1-2]。IBS 的发病机制尚未完全阐明,但越来越多的证据[3-5] 表明IBS是一种生物-心理-社会障碍, 与抑郁或焦虑共病。IBS 病因和病理过程较为复杂,且临床治疗无特效药物,近年来开展了大量基础性研究,而基础研究的实验结果在较大程度上取决于动物病理模型的复制。IBS 是生物学、心理学和社会学等多因素及多学科之间复杂的相互作用所致,目前IBS 动物模型的建立多采用2 种或多种因素联合制备,多因素的造模方法能够更多地模拟IBS 的临床表现及其他发病因素[6-7], 但IBS 动物模型建立过程中模拟刺激致病因素的数量有待进一步实验验证。应激反应分为急性和慢性应激,急性应激由于仅对结肠动力和感觉等部分症状进行描述,无法模拟IBS 临床患者症状表现的慢性过程,因此应用较少[8-9]。慢性避水应激(water avoidance stress, WAS) 造模方法为自然致病因素诱导,重复性较好且简单易行。本研究模拟IBS 患者临床症状建立大鼠IBS 模型,阐明IBS 的发病机制,为IBS 干预治疗的药物和方法研究提供实验依据。
1 材料与方法
1. 1 实验动物、主要试剂和仪器
雄性清洁级Wistar 大鼠30 只, 体质量(200±20) g, 购自济南朋悦实验动物繁育有限公司, 动物生产许可证号:SCXK (鲁) 2019-0003。于清洁级实验室中饲养,保持室内安静,室内温度为(22±2) ℃,室内相对湿度为 35%~40%,12 h/12 h 昼夜节律循环,黑夜时间水和食物均可自由摄取。实验开始前,大鼠于标准实验环境中适应性饲养7 d,不予任何刺激。本实验获得实验动物福利伦理审查委员会批准(批准号:SDUTCM20200620001)。戊巴比妥钠购自合肥巴斯夫生物科技有限公司,液体石蜡购自生工生物工程(上海) 股份有限公司,甘油购自上海北诺生物科技有限公司,75% 乙醇购自山东利尔康医疗科技股份有限公司,生理盐水购自山东鲁抗辰欣药业有限公司。高架十字迷宫(elevated plus maze,EPM) 购自上海欣软信息科技有限公司,华佗牌针灸针购自苏州医疗用品厂有限公司,1. 5 mL 针头购自北京天厚医疗器械有限公司,Powerlab 实验数据采集分析系统购自澳大利亚AD Instruments 公司。
1. 2 实验动物分组和造模
实验按照随机化分组原则, 将大鼠分为对照组(n=10) 和模型组(n=20)。模型组大鼠采用WAS 法[10], 实验设备由透明收纳箱(50 cm×35 cm×30 cm)和自制铁盒平台(18 cm×10 cm×7 cm) 组成,铁盒放置于收纳箱中间底部, 向透明收纳箱注入室温水(22 ℃±2 ℃), 注入水的高度距离铁盒平台1 cm, 将大鼠放置于铁盒平台上避水应激1 h,连续干预造模10 d,干预造模时间为每日上午8:00~9:00;对照组大鼠置于无水观察箱内,不做任何干预。见图1。
1. 3 检测2组大鼠一般情况和体质量
WAS法造模过程中,每日观察大鼠的精神和自主活动、皮毛色情况及大鼠应对外界刺激的反应等一般情况。每日上午7:00 检测所有大鼠体质量并记录。
1. 4 EPM 实验检测 2 组大鼠进入开放臂次数(open arm entry,OE)百分率和进入开放臂时间(open arm time,OT)百分率
造模前和造模结束后,对每只大鼠进行EPM 实验。实验开始前,需抚摸大鼠2~3 min,减少抓握带来的应激。实验开始时,需手持大鼠,使其背对实验人员,将其放置在开臂和闭臂的结合处中心区域,使大鼠面对开放臂,且同一实验所有大鼠需要面对同一开放臂。放置好大鼠后,实验人员迅速远离,大鼠进入EPM的同时,另一名实验人员观察视频,记录5 min 内大鼠在EPM 内的活动情况。检测指标: ① OE;② OT; ③ 进入闭臂次数(close arm entry, CE);④ 进入闭臂时间(close arm time, CT)。 计算OE 百分率和OT 百分率。OE=OE/(OE+CE)×100%;OT=OT/ (OT+CT) ×100%。
1. 5 腹壁撤回反射(abdominal withdrawal reflex,AWR)实验检测2组大鼠内脏敏感性
大鼠行为学实验结束后第2 天,对模型组大鼠进行AWR 半定量评分[11]。实验开始前,为了减少大鼠粪便形成,大鼠禁食不禁水12 h,用自制的球囊在石蜡润滑后经导管缓慢置入直肠,深度为6~7 cm。大鼠置于透明并内部空间相对狭窄的观察箱,导管另一端使用三通管分别连接血压计和注射器,待大鼠在透明箱内适应并平静后,通过注射器缓慢向气囊注入空气, 给予大鼠直肠恒压40 mmHg (1 mmHg=0. 133 kPa) 刺激, 观察大鼠行为反应情况, 间隔5 min 后给予下一次刺激;每次刺激强度重复3 次,取平均值计算AWR 评分。AWR 评分≥3 分判定大鼠内脏痛模型制备成功。
按照参考文献[11] 中AWR 评分标准:对结肠扩张刺激无行为反应,评为0 分;给予刺激后大鼠有动作停顿并见短暂的头部运动行为, 评为1 分;刺激期间大鼠有腹部肌肉的收缩,评为2 分;刺激期间大鼠有腹部抬起行为,评为3 分;刺激期间大鼠身体拱起,并抬起盆腔和阴囊者,评为4 分。
1. 6 心电图检查 2 组大鼠心率变异性(heart ratevariability,HRV)
AWR 评分后次日对2 组大鼠进行心电图检查。大鼠腹腔注射1% 戊巴比妥钠进行轻度麻醉,待大鼠麻醉后将其取仰卧位,将大鼠固定在手术台上,采用1 寸针灸针分别插入双下肢和右上肢皮下,再将心电图电极连接对应针灸针,待心电图波形稳定后, 采用Powerlab 系统记录大鼠标准Ⅱ导联的心电图, 并分析2 组大鼠HRV 中低频信号(low frequency, LF) 和高频信号(highfrequency,HF) 特征。
1. 7 腹外斜肌肌电图(electromyography,EMG)检测 2组大鼠结直肠痛敏阈值
心电图检查完成后,沿大鼠腹正中线与髂前上棘连线处进行常规消毒,剪刀行纵向切口剪开皮肤并剥离开皮下脂肪,完全暴露腹直肌。将2 根电极丝植入到距腹正中线1. 5 cm 处。再将气囊经大鼠肛门插入6~7 cm 处,固定大鼠尾部和导管。向气囊缓慢注气后,通过置于腹直肌的2 根电极引出肌电信号, 通过放大器和AD 信号转换器连接电脑Powerlab 数据采集分析系统,观察并记录2 组大鼠结直肠痛敏阈值。腹直肌结直肠扩张刺激时腹直肌放电明显增加,大鼠腹部肌肉收缩,标记此时结直肠扩张压力值即为结直肠痛敏阈值(mmHg)。
1. 8 多通道生理信号记录仪检验 2组大鼠结肠慢波频率
EMG法检测结束后,大鼠深度麻醉,剪开腹部肌肉,暴露盲肠部,在距大鼠盲肠1~2 cm 处,即近端结肠植入一对平行电极, 使结肠段的2 根电极相距 3~5 mm, 2 根电极丝连接多通道生理信号记录仪, 结肠慢波波形稳定 30 min 后, 连续记录 2 h。 采用 Powerlab 数据采集分析系统, 每3 min 为一个时间段,分析 2 组大鼠结肠慢波频率(次·min-1)。
1. 9 统计学分析
采用 GraphPad Prism 9. 0软件进行统计学分析并绘制图像。2 组大鼠OT 百分率、结肠慢波频率和HRV 中LF 均符合正态分布且方差齐,以-x±s 表示,2 组间样本均数比较采用两独立样本t 检验;2 组大鼠OE 百分率、结肠痛敏阈值、HRV 中HF 和LF/HF 比值符合正态分布但方差不齐,以中位数(四分位数)[M (P25,P75)] 表示,2 组间比较采用非参数检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
2. 1 2组大鼠一般情况和体质量
2组大鼠在整个造模期间均无死亡情况,造模前2 组大鼠精神状态良好,自主活动较好,毛色光亮,口眼爪甲和肛周较为清洁。造模结束后,模型组大鼠均伴有精神状态欠佳、自主活动减少、少动、皮毛散乱且无光泽、易激惹和肛门口不净等情况;对照组大鼠精神状态、自主活动、皮毛和肛周无明显变化。造模结束后,与对照组(253. 3 g±6. 47 g) 比较,模型组大鼠体质量(243. 8 g±6. 91 g) 明显降低(Plt;0. 05)。
2. 2 2组大鼠OE百分率和OT百分率
与对照组(46. 18%±3. 49% 和43. 28%±5. 56%) 比较, 模型组大鼠OE 百分率(19. 41%±10. 90%) 和OT 百分率(18. 03%±3. 58%) 均明显降低(Plt;0. 01)。见图2。
2. 3 2组大鼠内脏敏感性和HRV
模型组中AWR半定量评分≥3 分大鼠共12 只,内脏痛大鼠模型造模成功率为60%。与对照组比较, 模型组大鼠HRV 中LF 和LF/HF 比值均明显升高(Plt;0. 01),HF 明显降低(Plt;0. 05)。见表1。
2. 4 2 组 大 鼠 结 直 肠 痛 敏 阈 值
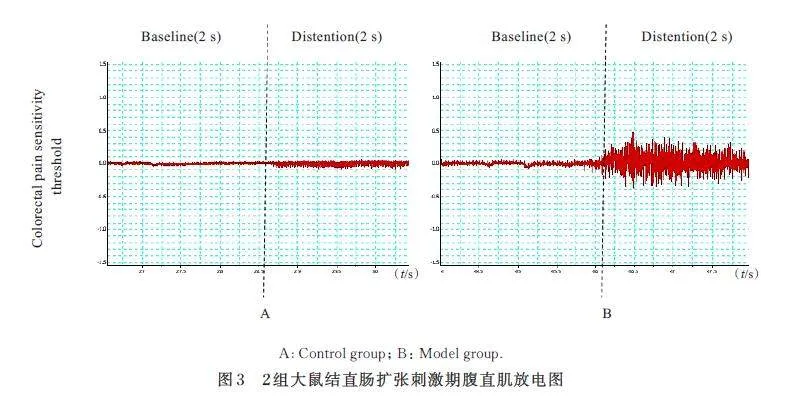
与 对 照 组(114. 70 mmHg±15. 68 mmHg) 比较, 模型组大鼠结肠痛敏阈值(63. 00 mmHg±5. 60 mmHg) 明显降低(Plt;0. 01)。见图3。
2. 5 2组大鼠结肠慢波频率
与对照组[(8. 34±1. 86) min-1] 比较, 模型组大鼠结肠节律发生紊乱,结肠慢波频率[(12. 02±1. 06) min-1] 明显升高(Plt;0. 01)。
3 讨 论
IBS 动物模型是分别以中枢(社会和心理因素) 和外周(感染和肠道炎症) 为靶点制备的动物模型,包括结直肠扩张刺激模型、慢性束缚应激模型、母婴分离刺激模型、理化刺激模型、食物过敏模型、多因素精神刺激模型和转基因模型等[12-13]。在多种造模方法中,单因素或多因素联合制备均存在优势和不足,与IBS 患者真实的临床过程和结肠的病理特征存在一定差异[14]。有研究[15-16] 采用WAS 法制备IBS 动物模型,仅从神经生物学角度分析IBS 动物模型结肠运动和感觉异常的原因。何苏月等[17] 研究发现: WAS 诱导 IBS 大鼠模型,大鼠结肠组织中机械门控Piezo1 离子通道被激活,导致IBS 模型大鼠结肠运动和感觉异常。余光等[18]研究发现:WAS 法诱导大鼠 10 d 后,IBS 模型大鼠血清P 物质(substance P,SP) 水平和结肠肌层结肠神经激肽/速激肽1 受体(neurokinin 1receptor,NK1R) 表达均存在异常,引起结肠动力的改变。
IBS 患者临床症状包括内脏敏感性和肠道功能异常,同时也伴有精神心理的异常,三者之间存在复杂的病理生理学关系[19-20]。IBS 的形成过程中,长期心理应激状态与IBS 的发生发展密切相关。EPM 可用于评估动物内在心理、外在情绪和行为,多数研究[21-22] 采用OT 百分率和OE 百分率作为焦虑动物模型是否制备成功的评价指标。本研究结果显示: WAS 实验后, IBS 模型大鼠OT 百分率和OE 百分率明显降低,活跃程度降低,情绪心理行为发生改变,与IBS 临床中患者伴有情绪异常的症状相似。
本研究采用结直肠扩张刺激时的AWR 半定量评分及结肠痛敏阈值作为对建立的IBS 大鼠模型内脏敏感性评价的核心指标。结直肠扩张刺激有助于评估内脏敏感性,在基础实验中被广泛应用[23-24]。但由于AWR 半定量评分具有主观性, 因此采用EMG 法检测大鼠结肠痛敏阈值,可以更加客观地评估大鼠内脏敏感性[25]。本研究结果显示: 模型组大鼠结肠痛敏阈值明显降低,表明WAS 法可以诱导IBS 大鼠模型内脏敏感性升高,即痛觉过敏,符合IBS 患者临床伴有腹部疼痛或腹部不适等症状。
研究[26] 显示:胃肠道动力紊乱与慢波电脉冲异常有关。慢波是相对比较规律的一种周期性电活动, 可作为一项电生理客观指标反映结肠功能异常[27]。本研究结果显示: 模型组大鼠结肠收缩频率发生异常,平均周期慢波频率明显升高,表明造模后的大鼠结肠慢波存在节律紊乱或者肠道收缩不协调,符合临床上IBS 患者肠道功能异常的症状。
HRV 是临床上评价自主神经功能的重要指标,其中LF 主要反映交感神经的兴奋性, HF 反映迷走神经的活性, LF/HF 比值反映自主神经之间的平衡性[28-29]。本研究结果显示:与对照组比较,模型组大鼠HRV 中LF 和LF/HF 比值均明显升高,HF 明显降低, 表明WAS 法可使大鼠的自主神经系统平衡性受到破坏,符合临床IBS 患者伴有自主神经紊乱症状。
本研究探讨WAS 诱导IBS 模型的评价方法,从IBS 模型大鼠行为学、内脏痛敏、结肠运动功能和心率频域的角度进行评估。提示WAS 诱导大鼠伴有心理情绪异常、内脏敏感增加、结肠慢波频率升高和自主神经功能紊乱等情况,与现代医学临床中IBS 患者的发病因素及部分症状的表现相似。目前现代医学基础研究关于动物造模的方法中,WAS 法造模的致病因素更接近于临床上IBS 患者的自然致病因素,造模成功率较高,并且具有造模方法操作简单、节约时间、较高拟合度和模型安全性好等特点,适用于现代医学基础研究中动物模型的建立,可用于观察和评价相关药物的作用。该造模方法存在不足之处:一方面未能与已有单纯评价同类型模型的研究进行比较;另一方面IBS 动物模型无法完全符合中医实验研究中病症结合动物模型的条件。目前国内研究[30-31] 表明:病症结合动物模型的建立更应该强调整体影响因素和注重疾病证型形成的自然状态,而非简单地将现代医学病理与传统医学病因模型相结合。因此,建立相对成熟和稳定性好的病症结合动物模型且具有规范的中医辨证标准的动物模型评价体系,不仅有助于传统医学对IBS 在生物细胞及分子水平机制的深入研究,同时又能真正地为传统医学研究和临床应用提供真实可靠的实验依据[32]。
综上所述, 采用WAS 法建立IBS 大鼠模型,大鼠行为及精神情绪改变、内脏敏感性升高、结肠慢波频率加快和自主神经系统平衡性紊乱,WAS 法可作为一种有效的造模方式,用于观察和评价IBS治疗的相关药物及干预方法。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:刘婷婷和张擎宇参与实验设计及实施、数据收集和统计分析及论文撰写和审校,赵香顺、石运来和于燕南参与实验实施, 陈少宗参与实验设计、论文撰写指导和审校,王正文、冯楚文和杨添淞参与论文撰写指导。
[参考文献]
[1] MAYER E A, RYU H J, BHATT R R. Theneurobiology of irritable bowel syndrome [J]. MolPsychiatry, 2023, 28(4): 1451-1465.
[2] DROSSMAN D A. Functional gastrointestinaldisorders: history, pathophysiology, clinical featuresand Rome Ⅳ[J]. Gastroenterology, 2016. DOI: 10.1053/j.gastro.2016.02.032.
[3] WU J, CHENG Y, ZHANG R, et al. P2Y1R isinvolved in visceral hypersensitivity in rats withexperimental irritable bowel syndrome [J]. World JGastroenterol, 2017, 23(34): 6339-6349.
[4] 管 洁, 邓 娜, 蔺晓源, 等. 腹泻型肠易激综合征及其中医病证结合动物模型的研究进展[J]. 中医药信息, 2023, 40(5): 73-78.
[5] 杨清瑞, 胡泽玉, 杜晓泉, 等. 腹泻型肠易激综合征中医病证结合动物模型研究[J]. 中国中医基础医学杂志, 2021, 27(12): 1981-1984.
[6] JOHNSON A C, FARMER A D, NESS T J, et al.Critical evaluation of animal models of visceral pain fortherapeutics development: a focus on irritable bowelsyndrome[J]. Neurogastroenterol Motil, 2020, 32(4):e13776.
[7] 赵迎盼, 唐旭东, 卞兆祥, 等. IBS-D肝郁脾虚型病证症结合大鼠模型的建立与评价的初步研究[J]. 中国中西医结合杂志, 2013, 33(11): 1507-1514.
[8] MAYER E A, BRADESI S, CHANG L, et al.Functional GI disorders: from animal models to drugdevelopment[J]. Gut, 2008, 57(3): 384-404.
[9] 张 方, 翁志军, 吴璐一, 等. 病因相关肠易激综合征动物模型研究进展[J]. 世界华人消化杂志, 2018,26(30): 1772-1777.
[10]TRAINI C, IDRIZAJ E, GARELLA R, et al.Otilonium Bromide treatment prevents nitrergicfunctional and morphological changes caused by chronicstress in the distal colon of a rat IBS model[J]. J CellMol Med, 2021, 25(14): 6988-7000.
[11]HONG K B, SEO H, LEE J S, et al. Effects ofprobiotic supplementation on post-infectious irritablebowel syndrome in rodent model[J]. BMC ComplementAltern Med, 2019, 19(1): 195.
[12]曾 威, 奚庆华, 吴至久男. 肠易激综合征动物模型的研制现状和进展[J]. 现代医药卫生, 2016, 32(17):2658-2661.
[13]贺 星, 刘 卫, 唐 郡, 等. 腹泻型肠易激综合征动物模型建立及评价[J]. 胃肠病学和肝病学杂志, 2020,29(12): 1386-1390.
[14]王 宁, 纪昌春, 万 鹏, 等. 病证结合模式下腹泻型肠易激综合征实验动物模型的研究进展[J]. 天津中医药大学学报, 2021, 40(4): 533-538.
[15]吴嫣然. 痛泻要方对慢性应激导致的内脏高敏感和肠道动力异常的作用及机制研究[D]. 武汉: 华中科技大学, 2016.
[16]胡 莹, 郑依玲, 梅全喜, 等. 痛泻要方破壁饮片对慢性避水应激大鼠内脏高敏感性的调节作用[J]. 中药新药与临床药理, 2021, 32(3): 322-331.
[17]何苏月, 马卓琳, 范昕然, 等. 机械敏感性离子通道Piezo1参与慢性避水应激肠易激综合征大鼠内脏高敏感性和5- 羟色胺代谢异常[J]. 中国病理生理杂志,2021, 37(4): 577-585.
[18]余 光, 全晓静, 唐勤彩, 等. P物质与慢性应激诱导的大鼠结肠动力紊乱的关系及其机制[J]. 武汉大学学报(医学版), 2016, 37(3): 407-410.
[19]MAYER E A, NALIBOFF B D, CHANG L, et al.V. Stress and irritable bowel syndrome[J]. Am J PhysiolGastrointest Liver Physiol, 2001, 280(4):G519-G524.
[20]白 涛, 宋 军, 侯晓华. 神经调控通路在肠易激综合征内脏高敏感发病机制中作用的研究进展[J]. 胃肠病学, 2016, 21(6): 362-365.
[21]CAO G P, GUI D, FU L D, et al. Anxiolytic andneuroprotective effects of the Traditional ChineseMedicinal formulation Dan-Zhi-Xiao-Yao-San in a ratmodel of chronic stress[J]. Mol Med Rep, 2016,14(2): 1247-1254.
[22]黄海阳, 冼绍祥, 杨忠奇. 温胆片对高架十字迷宫实验大鼠脑组织神经递质GABA、Glu含量的影响[J]. 中药新药与临床药理, 2015, 26(5): 631-635.
[23]YANG J M, XIAN Y F, IP P S, et al. Schisandrachinensis reverses visceral hypersensitivity in a neonatalmaternalseparated rat model[J]. Phytomedicine, 2012,19(5): 402-408.
[24]TAO E F, LONG G, YANG T, et al. Maternalseparation induced visceral hypersensitivity evaluated vianovel and small size distention balloon in post-weaningmice[J]. Front Neurosci, 2022, 15: 803957.
[25]GUARINO M P, BARBARA G, CICENIA A, et al.Supernatants of irritable bowel syndrome mucosalbiopsies impair human colonic smooth musclecontractility[J]. Neurogastroenterol Motil, 2017,29(2): 1-9.
[26]SZUCS K F, NAGY A, GROSZ G, et al. Correlationbetween slow-wave myoelectric signals and mechanicalcontractions in the gastrointestinal tract: advancedelectromyographic method in rats [J]. J PharmacolToxicol Methods, 2016, 82: 37-44.
[27]SHAFIK A, EL-SIBAI O, SHAFIK A A, et al.Electric activity of the colon in irritable bowel syndrome:the ‘ tachyarrhythmic’ electric pattern [ J].J Gastroenterol Hepatol, 2004, 19(2): 205-210.
[28]MAZURAK N, SEREDYUK N, SAUER H, et al.Heart rate variability in the irritable bowel syndrome: areview of the literature[J]. Neurogastroenterol Motil,2012, 24(3): 206-216.
[29]LIU Z M, CHEN T, WEI K M, et al. Similaritychanges analysis for heart rate fluctuation regularity as anew screening method for congestive heart failure[J].Entropy, 2021, 23(12): 1669.
[30]苏晓兰, 魏 玮. 肠易激综合征动物模型研究进展[J].山东中医杂志, 2013, 32(2): 133-135.
[31]任 杰, 陆 敏. 肠易激综合征动物模型的研究进展[J]. 中国医药导报, 2016, 13(27): 47-50.
[32]刘新明, 刘斯文, 刘书芹, 等. 病证结合的肠易激综合征动物模型研究进展[J]. 吉林中医药, 2022, 42(1):116-119.
[基金项目] 国家重点研发计划项目(2019YFC1712100);国家自然科学基金面上项目(82074539)

