EIF4A3 shRNA 慢病毒载体的构建及其稳定转染细胞系的建立


[摘 要] 目的:构建真核细胞翻译起始因子4A3(EIF4A3) -短发夹RNA(shRNA) 慢病毒载体,建立Neuro-2a-EIF4A3-shRNA稳定转染细胞系。方法:通过美国国家生物技术信息中心 (NCBI) 数据库检索EIF4A3 基因序列,设计并合成PCR 鉴定引物,并将其连接至经EcoR Ⅰ和Age Ⅰ酶切的慢病毒GV493 载体, 构建GV493-EIF4A3-shRNA 慢病毒质粒, PCR 筛选阳性克隆并测序鉴定。将GV493 空载质粒和GV493-EIF4A3-shRNA 重组质粒分别转染至HEK293T 细胞中,分别为GV493 对照慢病毒和GV493-EIF4A3-shRNA 慢病毒, 转染48 h 后收集慢病毒进行包装并测定病毒滴度。将Neuro-2a 细胞分为空白组、GV493 对照组和GV493-EIF4A3 shRNA 组,空白组不作处理,GV493 对照组和GV493-EIF4A3 shRNA 组分别采用相应慢病毒感染Neuro-2a 细胞, 慢病毒感染复数(MOI)为100,使用10 mg·L-1嘌呤霉素筛选成功感染慢病毒的Neuro-2a 细胞,荧光显微镜观察各组Neuro-2a细胞的生长状态和绿色荧光表达情况;实时荧光定量PCR (RT-qPCR) 法和Western blotting 法检测各组 Neuro-2a细胞中 EIF4A3 mRNA 及蛋白表达水平。结果:PCR 测序结果显示 GV493-EIF4A3-shRNA 重组质粒基因序列与设计合成的EIF4A3-shRNA 序列一致,成功构建GV493-EIF4A3 慢病毒载体。荧光显微镜观察可见HEK293T 细胞荧光表达强烈,生长状态良好,慢病毒包装成功。GV493-对照慢病毒和GV493-EIF4A3-shRNA 慢病毒的滴度均为2×108 TU·mL-1,GV493 对照组和GV493-EIF4A3 shRNA 组Neuro-2a 细胞生长状态良好且表达绿色荧光,表明慢病毒感染稳定细胞系构建成功。RT-qPCR 法, 与空白组和GV493 对照组比较, GV493-EIF4A3 shRNA 组Neuro-2a 细胞EIF4A3mRNA 表达水平明显降低(Plt;0. 01)。Western blotting 法,各组在相对分子质量49 000 处出现特异性条带,提示Neuro-2a 细胞中EIF4A3 蛋白表达成功;与空白组和GV493 对照组比较,GV493-EIF4A3shRNA 组 Neuro-2a 细胞中 EIF4A3 蛋白表达水平明显降低 (Plt;0. 01)。结论:成功构建 GV493-EIF4A3-shRNA 慢病毒载体,建立了Neuro-2a-EIF4A3-shRNA 稳定转染细胞系,为EIF4A3 在颅内动脉粥样硬化的作用机制研究提供了参考。
[关键词] 真核细胞翻译起始因子4A3; 短发夹RNA; 慢病毒; 稳定转染细胞系; Neuro-2a 细胞
[中图分类号] R392 [文献标志码] A
真核细胞翻译起始因子4A (eukaryotictranslation initiation factor 4A,EIF4A) 3 蛋白属于广泛的DEAD box RNA 解旋酶家族, 其成员凭借其RNA 结合能力和三磷酸腺苷(adenosinetriphosphate,ATP) 酶活性参与RNA 代谢的多个方面。EIF4A 蛋白主要有3 个类型, EIF4A1 和EIF4A2 主要在脊椎动物细胞质中表达, 而EIF4A3 则主要定位于细胞核。尽管3 个类型高度相似,但在mRNA 的生命周期中具有不同的作用,其特殊和多样的功能常被相互作用的伴侣蛋白调节及支配[1]。EIF4A1 和EIF4A2 均参与翻译的起始过程。EIF4A3 蛋白在RNA 代谢中起重要作用,包括mRNA 定位、导出及 mRNA 剪接和翻译的偶联[2-4]。EIF4A3 与EIF4A1 和EIF4A2 具有相同的ATP 酶活性,但EIF4A3 自身无解旋酶活性,也不参与翻译的启动[5]。EIF4A3 在多种人类恶性肿瘤中表达。研究[6] 显示:EIF4A3 刺激环状二磷酸腺苷核糖基化因子鸟苷酸激酶1 (circ adenosinediphosphate ribosylation factor guanylate kinase 1,ASAP1) 表达, 通过细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK) 信号通路促进胶质母细胞瘤的发展。在肝细胞癌中,EIF4A3 沉默抑制细胞增殖、迁移和上皮-间质转化(epithelial-mesenchymal transition, EMT)[7-8]。研究[9] 显示:在上皮性卵巢癌细胞中,EIF4A3 结合癌易感性候选基因2(cancer susceptibility candidate 2,CASC2) 增强细胞活性和细胞凋亡、迁移及侵袭,EIF4A3 敲低会增加细胞凋亡。在宫颈癌中,人类环状RNA (human_circ RNA,hsa_circ)_0101119 可促进细胞增殖、迁移和侵袭,并通过与EIF4A3 相互作用抑制宫颈癌的细胞凋亡,以抑制转录延伸因子A 样蛋白6 (transcription elongation factor A like 6,TCEAL6) 表达[10-11]。在心血管疾病方面,EIF4A3诱导的环状 B 淋巴细胞瘤2 (B-cell lymphoma-2,Bcl-2) /腺病毒 E1B 19 kDa 结合蛋白3 (Bcl-2/adenovirus E1B 19 kDa interacting protein 3,BNIP3),通过非编码单链微小RNA (micro RNA,miR)-27a-3p/BNIP3 通路加剧低氧诱导的心肌细胞损伤[12]。研究[13] 显示: hsa_circ_0030042 通过抑制EIF4A3 与重组人自噬效应蛋白1 (recombinanthuman autophagy-related protein, Beclin 1) 和人叉头框蛋白O1 (human forkhead Box protein O1,FOXO1) 结合,加剧小鼠斑块的不稳定性。研究[14]证实:EIF4A3 诱导的环状RNA (circ RNA,circ)_0086296 通过miR-576-3p/干扰素诱导蛋白与四肽重复1 (interferon induced protein with tetratricopeptiderepeats 1, IFIT1) /信号转导与转录激活因子1(signal transduction and activator of transcription 1,STAT1) 反馈回路增强人脐静脉内皮细胞(human umbilical vein endothelial cells, hUVECs)的动脉粥样硬化病变表型。但目前EIF4A3 在颅内动脉粥样硬化中的作用机制尚不明确。本研究构建EIF4A3-短发夹RNA (short hairpin RNA,shRNA)慢病毒载体, 建立Neuro-2a-EIF4A3-shRNA 稳定转染细胞系,为探讨 EIF4A3 在颅内动脉粥样硬化中的作用机制提供参考。
1 材料与方法
1. 1 细胞、主要试剂和仪器
小鼠神经瘤母细胞系(Neuro-2a) 购自武汉普诺赛生命科技有限公司,人胚肾细胞(HEK293T) 购自中国科学院上海细胞所。慢病毒载体质粒GV493 (hU6-MCS-CBhgcGFP-IRES-puromycin)、辅助质粒Helper1. 0 和辅助质粒Helper2. 0 均由上海吉凯基因公司提供,大肠杆菌菌株DH5α 购自北京Solarbio 公司, 限制性核酸内切酶EcoR Ⅰ 和Age Ⅰ 购自美国NEB 公司, Taq 聚合酶购自北京SinoBio 公司, 一步法克隆试剂盒购自美国Vazyme 公司,反转录试剂盒购自北京TaKaRa Bio 公司, Lipofectamine 2000 和TRIzol 购自美国Invitrogen 公司, 实时荧光定量PCR (real-time fluorescence quantitative PCR,RTqPCR)染料预混液购自北京GenStar 公司, BCA蛋白定量试剂盒购自美国Thermo Scientific 公司,DMEM、MEM 和Opti-MEN 培养基购自美国Gibco 公司,胶回收试剂盒、50×TAE 和质粒抽提试剂盒由北京TIANGEN 公司提供,胰蛋白胨、琼脂糖粉、酵母提取物和氯化钠购自美国Vetec 公司,抗EIF4A3 抗体和抗GAPDH 抗体均购自英国Abcam 公司。倒置光学显微镜和倒置荧光显微镜购自日本Olympus 公司, 荧光定量PCR 仪购自瑞士Roche 公司, 电泳仪购自美国Bio-Rad 公司, 化学发光检测仪购自美国Azure Biosystems 公司。
1. 2 细 胞 培 养
HEK293T 细 胞 常 规 培 养 于DMEM 培养基(含10% 胎牛血清和1% 青-链霉素), Neuro-2a 细胞培养于MEM 培养基(含10%胎牛血清和1% 青-链霉素), 置于37 ℃、5% CO2培养箱内培养,隔2~3 d 即可传代1 次,细胞状态良好且密度大于90% 时用0. 25% 胰蛋白酶消化传代。
1. 3 引物设计和合成
通过美国国家生物技术信息中心(National Center for BiotechnologyInformation, NCBI) 数据库检索EIF4A3 (GeneID: 9775) 序列, 结合引物设计原则和载体GV493 阅读框克隆位点, 设计引物。设计并合成EIF4A3 PCR 鉴定引物, 引物序列: 上游引物,5'-ATGGAAATTTGATACTCTATG-3', 下游引物, 5'-CATAGAGTATCAAATTTCCAT-3'。设计并合成EIF4A3 RT-qPCR引物,引物序列:上游引物,5'-GACCAAAGTGGAGTTCGAGACG-3',下游引物,5'-TGATAGCACGCTGCTGAATCGC-3'。引物均由生工生物工程(上海) 股份有限公司合成。
1. 4 EIF4A3慢病毒载体构建及鉴定
合成的基因引物经PCR 扩增,获得DNA 片段。PCR 扩增反应体系(50 μL): 上下游引物(10 μmol·L- 1) 各1 μL,DNA 模板1 μL,2. 5 mmol·L-1 dNTP 4 μL,5×Buffer 10 μL, Prime STAR HS DNApolymerase 0. 5 μL, ddH2O 50 μL。 扩增程序:98 ℃,5 min;98 ℃,10 s;55 ℃,10 s;72 ℃,90 s,共30 个循环,72 ℃延伸8 min,4 ℃保存。
采用EcoR Ⅰ和Age Ⅰ限制性内切酶对GV493进行酶切。酶切体系(50 μL) 为10×酶缓冲液 5 μL,GV493 DNA 2 μL, EcoR Ⅰ 1 μL, Age Ⅰ 1 μL,ddH2O 加入总体积50 μL, 吹打、混匀和离心后,在37 ℃下反应3 h 后过夜。采用酶切回收试剂盒初胶回收GV493 载体质粒。
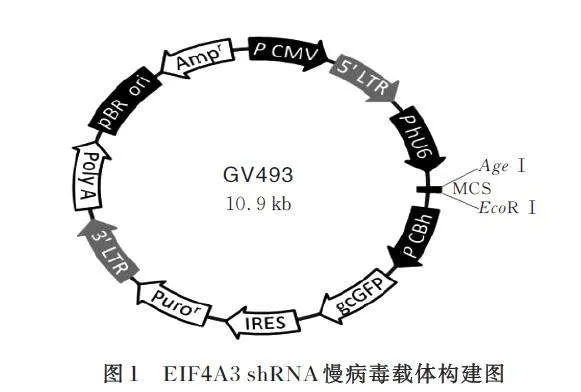
采用一步法克隆试剂盒将PCR 扩增的EIF4A3引物连接至携gcGFP/Puromycin 的慢病毒GV493载体,重组后载体见图1。反应体系(10 μL):5×酶缓冲液 2 μL,酶切GV493 DNA 2. 5 μL,纯化的扩增产物片段1 μL,外切酶Ⅱ 1 μL,总体积10 μL加入ddH2O;吹打离心后,在37 ℃下反应30 min,冰浴冷却5 min。
将10 μL GV493 空质粒和GV493-EIF4A3shRNA 重组质粒分别加入100 μL 感受态细胞DH5α中, 混合均匀; 冰上反应30 min, 42 ℃ 热激1. 5 min, 冰浴2 min; 37 ℃ 摇床培养60 min, 含500 μL LB 液。取培养后的菌液适量,均匀涂布于含100 mg·L-1 氨苄西林的LB 培养板上,倒置培养板37 ℃恒温培养12 h;次日,在平板上培养菌落,在含有100 mg·L-1 氨苄西林的3 mL LB 培养基摇床上取适量的细菌, 37 ℃摇床过夜, 吸附适量的细菌溶液, 并用甘油保菌, 其余的细菌溶液经PCR 和酶切鉴定。鉴定体系(20 μL): 2×Taq 聚合酶10 μL,扩增鉴定上游引物(10 μmo·l L-1) 0. 4 μL,扩增鉴定下游引物(10 μmol·L-1) 0. 4 μL, 适量甘油菌液,加入ddH2O 至总体积为20 μL,反应程序: 94 ℃ 变性3 min, 94 ℃ 、30 s, 55 ℃ 、30 s,72 ℃、30 s, 共22 个循环, 72 ℃延伸5 min, 4 ℃保存。如在基因片段57 bp 附近出现条带,则表明该重组菌是携带重组GV493-EIF4A3 shRNA 的阳性菌。对鉴定出的阳性菌进行克隆,送生工生物工程(上海) 股份有限公司进行测序。测序成功,则可用于后续实验。
1. 5 EIF4A3慢病毒包装及滴度测定
转染前1 d,将生长状况良好的HEK293T 细胞接种于100 mm细胞培养皿中,37 ℃、5% CO2 孵箱培养。当细胞密度达到80% 时,采用EIF4A3 慢病毒转染细胞。转染体系分为Mixture A 和Mixture B。Mixture A:10 μg GV493 空载质粒或GV493-EIF4A3-shRNA重组质粒+5 μg 辅助质粒Helper 1. 0 型+5 μg 辅助质粒Helper 2. 0 型+750 μL Opti-MEM;Mixture B:15 μL Lipofactamine 2000+750 μL Opti-MEM。Mixture A 和Mixture B 体系各自混匀,室温避光放置5 min,后2 个体系相互混匀,室温孵育20 min。将Mixture A 和Mixture B 的混合物加入 3 mLOpti-MEM 至100 mm 培养皿中, 轻轻摇动混合,在37 ℃的细胞培养箱中培养4 h。待转染结束后,将100 mm 培养皿中的培养液更换为正常生长的培养液,培养48 h。在荧光显微镜下,当细胞转染效率约90% 时, 收集培养皿上清液, 采用0. 45 μm滤膜过滤,低温超高速离心法去除上清液,磷酸盐缓冲液(phosphate buffered saline, PBS) 溶解沉淀。GV493 空载质粒转染后收集的慢病毒为GV493 对照慢病毒, GV493-EIF4A3 shRNA 重组质粒转染后收集的慢病毒为GV493-EIF4A3shRNA 慢病毒,将收集的病毒溶液进行滴度测定。
慢病毒滴度测定前1 d,将HEK293T 细胞铺入96 孔细胞培养板,每孔4×104个细胞。分别在3 个EP 管中采用90 μL 无血清培养基培养病毒, 分别标记为1E+1 μL 组(含10 μL 病毒溶液)、1E+0 μL 组(1E-1 μL 组病毒溶液10 倍稀释) 和1E-1 μL 组(1E+0 μL 组病毒溶液10 倍稀释)。荧光显微镜下观察病毒转染后HEK293T 细胞荧光表达情况。
1. 6 EIF4A3 shRNA慢病毒感染 Neuro-2a细胞及稳定转染细胞系构建
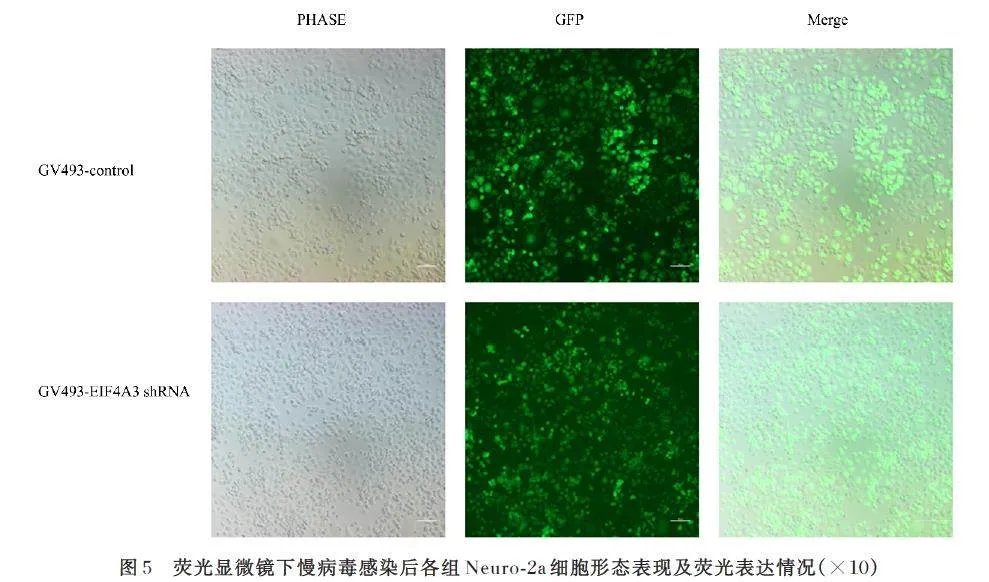
将 Neuro-2a细胞铺于 12孔细胞培养板,待细胞密度达到70%~80% 时,按最佳慢病毒感染复数(multiplicity of infection,MOI)为100, 取相应病毒量进行慢病毒感染实验。将Neuro-2a 细胞分为空白组、GV493 对照组和GV493-EIF4A3 shRNA 组。空白组不做处理,GV493 对照组和GV493-EIF4A3 shRNA 组分别采用GV493 对照慢病毒和GV493-EIF4A3 shRNA 慢病毒感染Neuro-2a 细胞,慢病毒感染24 h 后换液,继续培养48 h, 加入嘌呤霉素(10 mg·L-1) 进行筛选,1 d后换液,之后维持嘌呤霉素浓度在5 mg·L-1,培养2 周。在荧光显微镜下观察Neuro-2a 细胞,若细胞生长状态良好且表达绿色荧光,则提示慢病毒感染稳定细胞系构建成功。
1. 7 RT-qPCR 法 检 测 各 组 Neuro-2a 细 胞 中EIF4A3 mRNA表达水平
采用TRIzol法提取各组RNA,测纯度和浓度后,取1 000 ng RNA 逆转录合成cDNA。采用2×增强型染料RT-qPCR 预混液进行RT-qPCR 法检测, EIF4A3 PCR 引物: 上游引物,5'-GACCAAAGTGGAGTTCGAGACG-3';下游引物,5'-TGATAGCACGCTGCTGAATCGC-3'。反应体系(10 μL): 染料预混液5 μL, PCR 引物(10 μmol·L-1) 0. 2 μL, cDNA 1 μL, 加ddH2O 至10 μL。扩增条件: 95 ℃ 、10 s, 55 ℃ 、20 s,72 ℃、15 s,共40 个循环。溶解条件:65 ℃、60 s,95 ℃、1 s。以GAPDH 为内参,采用2—△△Ct法计算各组Neuro-2a 细胞中EIF4A3 mRNA 表达水平。
1. 8 Western blotting法检测各组Neuro-2a细胞中EIF4A3 蛋白表达水平
收集各组 Neuro-2a细胞,采用BCA 法进行蛋白定量, 恒压60 V、30 min,恒压100 V、90 min 电泳。采用湿法转膜,转膜条件为恒压100 V 、90 min。快速封闭液封闭膜30 min, 用TBST 溶液清洗膜3 次, 每次10 min。加入一抗,4 ℃孵育过夜,第2 天回收一抗,洗膜3 次, 二抗室温孵育60 min, 洗膜3 次, 采用化学发光试剂显影。于相对分子质量49 000 处出现一条特异性条带,表明EIF4A3 蛋白在Neuro-2a 细胞中成功表达。采用Image J 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 蛋白条带灰度值。
1. 9 统计学分析
采用 Graphpad Prism 6. 0 统计软件进行统计学分析。各组细胞中EIF4A3 mRNA和蛋白表达水平符合正态分布, 以-x±s 表示, 多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
2. 1 EIF4A3 shRNA 慢病毒载体的构建
将测序成功的DNA 序列与设计的EIF4A3 序列比较, 二者DNA 序列完全匹配, 表明EIF4A3 序列成功连接至GV493 载体中, 测序结果提示成功构建GV493-EIF4A3 慢病毒载体。见图2。
2. 2 EIF4A3 shRNA慢病毒感染 Neuro-2a细胞并建 立 稳 定 转 染 细 胞 系
将 GV493 空 载 质 粒 和GV493-EIF4A3 shRNA 重组质粒分别与辅助质粒共同转染HEK293T 细胞,荧光显微镜下观察可见HEK293T 细胞荧光表达强烈,生长状态良好,慢病毒包装成功。见图3 和4。GV493 对照慢病毒和GV493-EIF4A3-shRNA慢病毒滴度均为2×108 TU·mL-1。荧光显微镜下观察可见GV493 对照组和GV493-EIF4A3 shRNA组Neuro-2a 细胞生长状态良好且表达绿色荧光,表明慢病毒感染稳定细胞系构建成功。见图5。
2. 3 各组 Neuro-2a细胞中 EIF4A3 mRNA表达水平
与空白组(1. 00±0. 09) 和GV493 对照组(0. 78±0. 08) 比 较, GV493-EIF4A3 shRNA 组Neuro-2a 细胞中EIF4A3 mRNA 表达水平(0. 49±0. 10) 明显降低(Plt;0. 01)。
2. 4 各组 Neuro-2a 细胞中 EIF4A3 蛋白表达水平
Western blotting 法检测结果显示:各组在相对分子质量49 000处均出现特异性条带,提示Neuro-2a细胞中EIF4A3 蛋白表达成功。与空白组(1. 05±0. 11) 和 GV493 对照组 (0. 78±0. 07) 比 较,GV493-EIF4A3 shRNA 组Neuro-2a 细胞中EIF4A3蛋白表达水平(0. 35±0. 09) 明显降低(Plt;0. 01)。见图6。
3 讨 论
颅内动脉粥样硬化是全身动脉粥样硬化的一部分,可引起暂时性脑缺血发作、脑卒中和血管性痴呆等脑血管疾病。尽管不同部位的动脉粥样硬化病变程度并不平行,但晚期颅内动脉粥样硬化的病变程度与颅外动脉粥样硬化的病变程度相似[15]。颅内动脉粥样硬化是一种终生全身性和进行性疾病,是全世界缺血性卒中发生的主要原因。颅内动脉粥样硬化的发生发展涉及内皮功能障碍、炎症、氧化应激和细胞凋亡等多种机制[16]。
研究[17-18] 显示:EIF4A3 与动脉粥样硬化疾病的发生发展密切关联。hsa_circ_0030042 通过靶向EIF4A3 调节异常自噬并保护动脉粥样硬化斑块稳定性[13]。环状泛素特异性肽酶9×-连锁基因(circubiquitinspecific peptidase 9×-linked gene, circ-USP9×) 可与细胞质中的EIF4A3 蛋白结合, 并与其相互作用。此外, EIF4A3 的过表达消除了circ-USP9× 敲低诱导的氧化修饰低密度脂蛋白(oxidized low density lipoprotein, ox-LDL) 处理的hUVECs 焦亡。研究[17] 显示:circ-USP9×通过海绵作用抑制EIF4A3 的功能从而促进内皮细胞焦亡。细胞焦亡是一种炎症性细胞死亡。与细胞凋亡和坏死不同,细胞焦亡的特征是细胞膜破裂,导致细胞内容物释放,从而激活炎症反应。内皮焦亡也是动脉粥样硬化的重要病理机制[18]。研究[15] 证实: EIF4A3 蛋白诱导的circ_0086296 通过miR-576-3p/IFIT1/STAT1 通路反馈回路加重了hUVECs 的动脉粥样硬化病变表型。因此,EIF4A3 可能是动脉粥样硬化治疗的靶标。提示EIF4A3 可能在颅内动脉粥样硬化形成和发生发展过程中发挥重要作用。
Neuro-2a 细胞具有神经细胞特性,生长繁殖速度快,被广泛用于神经系统疾病方面的研究[19-20]。但目前尚未见EIF4A3 蛋白在Neuro-2a 细胞系中构建缺血缺氧疾病模型的报道, 因此本研究选用Neuro-2a 细胞作为病毒感染和观察的研究对象。本研究结果显示:GV493-EIF4A3 慢病毒表达载体成功构建,并成功感染Neuro-2a 细胞,Neuro-2a 细胞中EIF4A3 mRNA 和蛋白成功表达。
综上所述,本研究成功构建GV493-EIF4A3 慢病毒表达载体, 建立了稳定感染shRNA GV493-EIF4A3 慢病毒的Neuro-2a 细胞系, 为EIF4A3 在颅内动脉粥样硬化中的作用机制研究提供了参考。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:何嘉文参与论文设计、撰写和修改,廖科棋参与实验数据的获取和分析,李友和李胜男参与实验设计。
[参考文献]
[1] MCMAHON J J, MILLER E E, SILVER D L. Theexon junction complex in neural development andneurodevelopmental disease[J]. Int J Dev Neurosci,2016, 55: 117-123.
[2] MAZLOOMIAN A, ARAKI S, OHORI M, et al.Pharmacological systems analysis defines EIF4A3functions in cell-cycle and RNA stress granuleformation[J]. Commun Biol, 2019, 2: 165.
[3] FERRAIUOLO M A , LEE C S , LER L W , et al.A nuclear translation-like factor eIF4A Ⅲ is recruited tothe mRNA during splicing and functions in nonsensemediateddecay[J]. Proc Natl Acad Sci U S A, 2004,101(12): 4118-4123.
[4] FUKAO A, MISHIMA Y, TAKIZAWA N, et al.MicroRNAs trigger dissociation of eIF4AⅠ and eIF4AⅡfrom target mRNAs in humans[J]. Mol Cell, 2014,56(1): 79-89.
[5] GALICIA-VÁZQUEZ G, CHU J, PELLETIER J.eIF4A Ⅱ is dispensable for miRNA-mediated genesilencing[J]. RNA, 2015, 21(10): 1826-1833.
[6] WEI Y T, LU C F, ZHOU P, et al. EIF4A3-inducedcircular RNA ASAP1 promotes tumorigenesis andtemozolomide resistance of glioblastoma via NRAS/MEK1/ERK1-2 signaling[J]. Neuro Oncol, 2021,23(4): 611-624.
[7] YANG C J, HAWKINS K E, DORÉ S, et al.Neuroinflammatory mechanisms of blood-brain barrierdamage in ischemic stroke [J]. Am J Physiol CellPhysiol, 2019, 316(2): C135-C153.
[8] LIU Y C, SONG J, ZHANG H W, et al. EIF4A3-induced circTOLLIP promotes the progression ofhepatocellular carcinoma via the miR-516a-5p/PBX3/EMT pathway[J]. J Exp Clin Cancer Res, 2022,41(1): 164.
[9] ZHANG S X, LENG T Y, ZHANG Q, et al.Sanguinarine inhibits epithelial ovarian cancerdevelopment via regulating long non-coding RNACASC2-EIF4A3 axis and/or inhibiting NF- κB signalingor PI3K/AKT/mTOR pathway [J]. BiomedPharmacother, 2018, 102: 302-308.
[10]SUI X Z, WANG Y C, LIU H. hsa_circ_0101119facilitates the progression of cervical cancer via aninteraction with EIF4A3 to inhibit TCEAL6expression[J]. Mol Med Rep, 2021, 24(3): 654.
[11]LAFFONT I, TAKAHASHI M, SHIBUKAWA Y,et al. Apolipoprotein E activates Akt pathway in neuro-2ain an isoform-specific manner[J]. Biochem Biophys ResCommun, 2002, 292(1): 83-87.
[12]LI Y S, REN S H, XIA J W, et al. EIF4A3-inducedcirc-BNIP3 aggravated hypoxia-induced injury of H9c2cells by targeting miR-27a-3p/BNIP3[J]. Mol TherNucleic Acids, 2020, 19: 533-545.
[13]YU F P, ZHANG Y, WANG Z Z, et al. Hsa_circ_0030042 regulates abnormal autophagy and protectsatherosclerotic plaque stability by targeting eIF4A3[J].Theranostics, 2021, 11(11): 5404-5417.
[14]ZHANG M, ZHU Y Q, ZHU J, et al. circ_0086296induced atherosclerotic lesions via the IFIT1/STAT1feedback loop by sponging miR-576-3p[J]. Cell MolBiol Lett, 2022, 27(1): 80.
[15]RITZ K, DENSWIL N P, STAM O C G, et al. Causeand mechanisms of intracranial atherosclerosis [J].Circulation, 2014, 130(16): 1407-1414.
[16]WANG Y, MENG R, LIU G, et al. Intracranialatherosclerotic disease[J]. Neurobiol Dis, 2019, 124:118-132.
[17]XU S K, GE Y S, WANG X B, et al. Circ-USP9Xinteracts with EIF4A3 to promote endothelial cellpyroptosis by regulating GSDMD stability inatherosclerosis[J]. Clin Exp Hypertens, 2023, 45(1):2186319.
[18]YANG H Z, YANG W C, DAI W Q, et al.LINC00667 promotes the proliferation, migration, andpathological angiogenesis in non-small cell lung cancerthrough stabilizing VEGFA by EIF4A3[J]. Cell BiolInt, 2020, 44(8): 1671-1680.
[19]LAM M, SANOSAKA T, LUNDIN A, et al. Singlecellstudy of neural stem cells derived from human iPSCsreveals distinct progenitor populations with neurogenicand gliogenic potential[J]. Genes Cells, 2019, 24(12):836-847.
[20]MATSUI T K, TSURU Y, HASEGAWA K, et al.Vascularization of human brain organoids [J]. StemCells, 2021, 39(8): 1017-1024.
[基金项目] 国家自然科学基金项目(81571157);广东省卫生厅医学科研基金项目(A2022139,A2023193);湛江市科学技术局科技攻关计划项目(2021B01370)

