盐碱土壤中唐古特白刺内生真菌分离与鉴定
刘艳萍 张得芳 文怀秀


doi:10.7606/j.issn.1004-1389.2024.07.019
https://doi.org/10.7606/j.issn.1004-1389.2024.07.019
收稿日期:2023-03-28 修回日期:2023-08-04
基金项目:国家自然科学基金(32170239);青藏高原种质资源研究与利用实验室(2022-ZJ-Y01)。
第一作者:刘艳萍,女,硕士研究生,研究方向为微生物与植物互作。E-mail:1576354728@qq.com
通信作者:张得芳,女,博士,副研究员,研究方向为植物抗逆。E-mail:defangstart2011@163.com
文怀秀,女,博士,副研究员,研究方向为植物内生菌次级代谢产物及其功能。E-mail:whx@nwipb.cas.cn
摘 要 为探明唐古特白刺(Nitraria tangutorum Bobr.)的内生真菌种属及其组织分布特性,采用传统组织块法从生长于盐碱土壤的白刺中分离内生真菌,运用形态学和真菌ITS序列分析进行种属鉴定,并通过MEGA7.0构建系统发育树。结果显示,从白刺(根、茎、叶)分离得到23 株内生真菌,共鉴定出21 株,其中链格孢属(Alternaria)13 株,毛壳菌属(Chaetomium)1株,篮状菌属(Talaromyces)3 株,细基格孢属(Ulocladium)4 株,主要分布于唐古特白刺的根部,叶次之,茎则无。表明白刺内生真菌分布具有组织差异,根是其侵染和定殖的主要部位。
关键词 唐古特白刺;内生真菌;分离;鉴定;盐碱土壤
土壤盐碱化严重限制了林草植被及农作物生长发育,对农业生产力、生态环境健康和经济等构成极大威胁[1]。在长期的生物进化过程中,盐生植物通过形成独特的调节机制、适应盐土生境的形态和生理特性以应对盐碱胁迫[2]。研究表明,植物对胁迫的耐受性与其相关微生物有关[3],与根际细菌的相互作用相比,寄主植物与内生菌的相互作用可直接影响植物特性[4]。
植物内生真菌是指在其生活史的部分阶段或全部阶段寄生于健康的植物组织或器官内,且对植物不表现出明显病害症状的一类真菌[5]。内生真菌可以通过提供营养物质来促进宿主植物生长发育以及产生活性物质或信号转导增强宿主抗逆能力[6-7]。许多研究表明内生真菌具有一定的耐盐碱能力,内生菌可以通过促进盐碱胁迫下植物对土壤养分和水分的吸收以缓解盐害,从而提高植物生物量,维持植物正常生长发育[8]。内生真菌对盐碱胁迫下宿主植物的促生作用具体可表现在促进营养吸收[9]、诱导产生植物激素[10]、促进光合作用[11]等方面。此外,植物生理学的研究表明渗透胁迫、离子毒害和氧化胁迫是盐胁迫对植物的主要危害[12-14],而植物内生菌对盐碱胁迫的缓解机制通常表现在合成渗透调节物质、诱导抗氧化系统、维持离子平衡、诱导抗盐碱相关基因表达等方面[15-17]。
唐古特白刺(Nitraria tangutorum Bobr.)是蒺藜科(Zygophyllceae)白刺属(Nitraria L.)的一种落叶灌木,在中国主要分布于青海、新疆、甘肃、宁夏、内蒙古等西北部、北部地区[18]。由于其根系发达,具有很强的抗风沙、抗盐碱、抗旱耐热能力而被作为中国西北荒漠地区改良盐碱地、水土保持及防风固沙的先锋树种[19]。其果实有“沙漠樱桃”之美誉,是西部蒙、藏、维等少数民族的习性用药材,其入药记载于《中国沙漠地区药用植物》,具有健脾胃、滋补强壮、调经活血的功能,其叶则作为民间药用于治疗痉挛、神经痛和心律不齐等症[20]。
近年来,对唐古特白刺耐盐碱特性的研究主要集中在高盐碱地引种试验、白刺愈伤组织抗氧化酶活性、盐胁迫下白刺超微结构的改变、盐胁迫诱导的代谢图谱的变化以及响应盐胁迫的蛋白质组学分析等方面[21-25],为揭示唐古特白刺的耐盐碱机制奠定了基础。唐古特白刺作为典型的盐生植物可能与其内生真菌形成了某种互作机制以适应盐碱生境,因此了解白刺内生真菌组成将有助于更好地解释唐古特白刺的盐碱适应性和耐盐碱机制,但目前未见有关研究报道。
基于此,本试验采用传统的植物组织块法分离盐碱土壤中唐古特白刺内生真菌,运用形态学和ITS序析进行内生真菌种属鉴定并构建系统发育树,探讨白刺内生真菌的种类及分布特点,为下一步研究白刺内生真菌与其抗盐碱特性之间的关系提供重要参考依据,同时为盐碱地恢复与治理的菌剂开发提供物质基础。
1 材料与方法
1.1 供试材料
试验所用的2 a生野生白刺新鲜植物样本(包含根、茎、叶)于2021年7月在青海省海西蒙古族藏族自治州都兰县诺木洪农场附近盐碱地(东经94°44′~99°46′,北纬36°44′,海拔2 794 m)采集,采集时将白刺植株根部附近土壤连块挖出,并且避免伤到其根系组织。共采集样本10份,采集地土样pH为8.90,土壤电导率为727 μS/cm,样品采集完用信封密封后置于低温采样箱中,24 h内返回实验室,用流水冲洗根系表面土壤,无菌滤纸吸干表层水分以备后续菌株分离。
1.2 试验方法
1.2.1 植物组织表面消毒 将冲洗干净的白刺植物组织剪成3~5 cm的小段,用无菌去离子水浸泡1~2 h,放置滤纸上待水分吸干后移入无菌操作台中,按照以下步骤进行表面消毒处理:先用无菌镊子夹取样品在75%乙醇中浸泡3 min,无菌水冲洗4~5次,快速将其放入到8% NaClO溶液中浸泡3~5 min,将样品放入到无菌水中,充分洗涤4~5次,用无菌滤纸吸干组织表面残留的水分。
1.2.2 内生真菌的分离纯化 内生真菌分离采用传统的组织块培养法[26],根、茎、叶各14个平板,每个平板3个组织块,根、茎、叶各42个组织块。利用解剖刀切取植物组织,叶片切成0.5 cm2,茎和根切成0.5 cm3小块,接种到PDA培养基上,28 ℃恒温培养。采用组织印迹法和漂洗液检测法作为对照处理[27],以验证表面消毒是否彻底,分离出的真菌为内生真菌。培养1周后将具有明显菌落差异的真菌采用菌丝尖端切割法进行纯化[28]。
1.2.3 白刺内生真菌的鉴定 形态学鉴定:每天观察并记录PDA平皿中菌落的直径、颜色、形态、生长速度。采用插片培养法观察菌丝及孢子形态,用乳酸酚棉兰染液进行染色后盖上盖玻片在光学显微镜(尼康仪器 (上海) 有限公司)下进行镜检,并结合各个菌株的菌落形态,对照《真菌鉴定手册》[29]进行形态鉴定。分子生物学鉴定:按照真菌基因组DNA提取试剂盒说明,提取真菌基因组DNA,采用真菌通用引物ITS1(5′-TCCGATGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测后送上海捷瑞生物工程有限公司测序。
1.2.4 ITS序列分析及系统发育树构建 将测序所得ITS序列在美国国家生物技术信息中心(NCBI)数 据 库(https://blast.ncbi.nlm.nih.gov /Blast.Cgi)中进行Blast比对分析,选择相似度最大的序列,使用MEGA7.0软件采用邻接法(neighbor-joining method)构建系统进化树。kimura 2-parameter model计算进化距离,1 000 次重复检验发育树的可靠性。
2 结果与分析
2.1 内生真菌分离结果
从采自盐碱土壤的唐古特白刺中共分离得到23株菌株,其中根中分离到的最多,共22 株,1 株来自叶,茎中未分离到。分离培养时所设置的对照组均未出现菌落,说明消毒彻底,所培养得到菌株均为内生真菌。菌株编号见表1。
2.2 内生真菌形态学鉴定
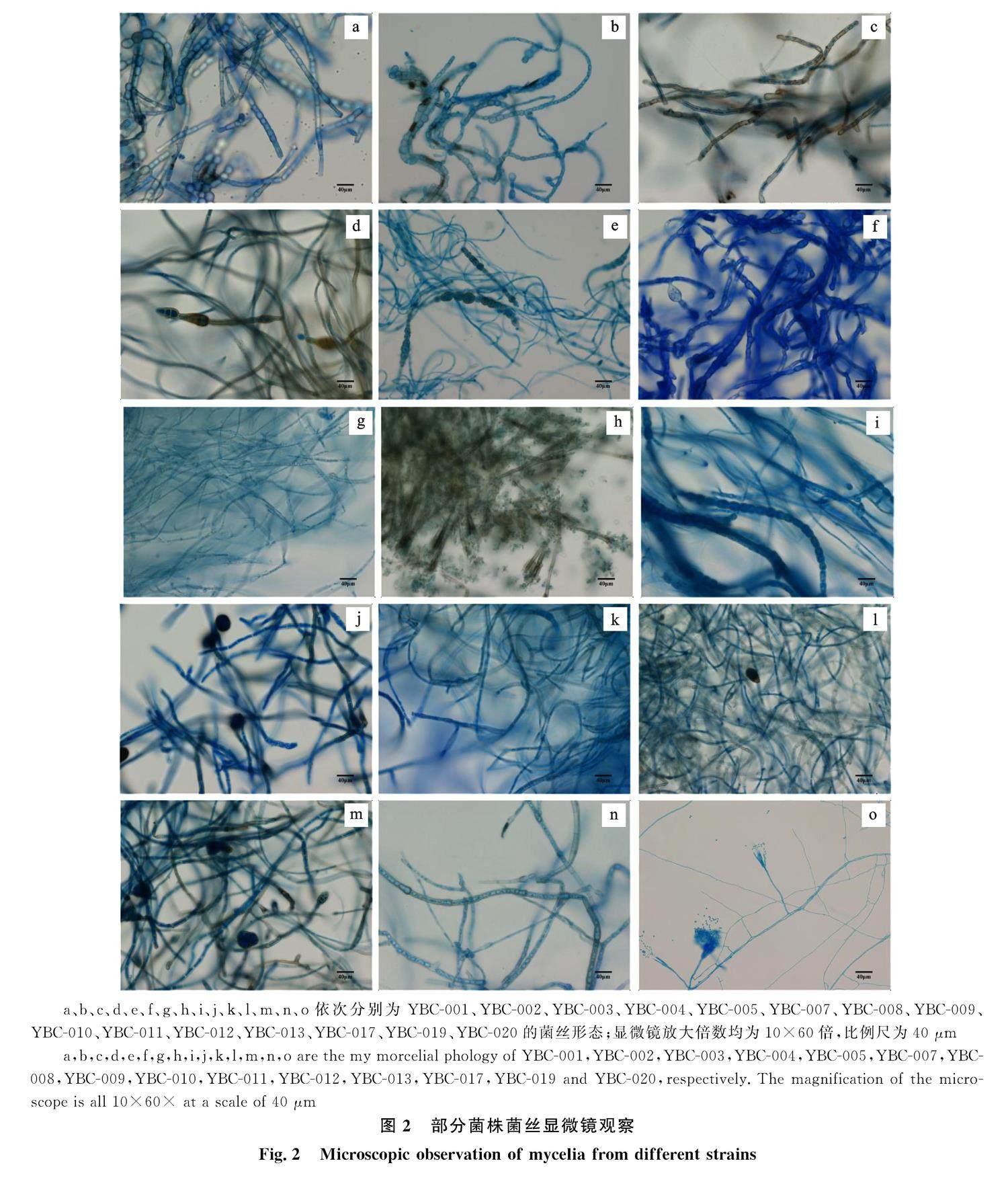
观察并记录菌株在培养过程中的形态特征,培养时间均为7 d,形态学特征如图1所示,菌丝显微特征见图2。将纯化菌株的菌落特征与菌丝特性的观察结果与《真菌鉴定手册》进行比较,初步鉴定分离所得内生真菌,形态学特征描述见 表2。通过菌落及显微镜菌丝形态初步鉴定 BC-001~BC-007等共13 株菌属于链格孢属,显微形态特征为菌丝细长、分枝、分隔,幼时无色或淡色,渐变为青褐色,褐色至暗色;分生孢子多数为倒棒状、倒梨形、卵形。其余几株菌株形态差异大,通过ITS序列分析进行分子生物学鉴定。
a、b、c、d、e、f、g、h、i、j、k、l、m、n、o、p、q、r、s、t、u、v、w依次分别为YBC-001、YBC-002、YBC-003、YBC-004、YBC-005、YBC-006、YBC-007、YBC-008、YBC-009、YBC-010、YBC-011、YBC-012、YBC-013、YBC-014、YBC-015、YBC-016、YBC-017、YBC-018、YBC-019、YBC-020、YBC-021、YBC-022、YBC-023的菌落形态a,b,c,d,e,f,g,h,i,j,k,l,m,n,o,p,q,r,s,t,u,v,w are the colony morphology of YBC-001,YBC-002,YBC-003,YBC-004,YBC-005,YBC-006,YBC-007,YBC-008,YBC-009,YBC-010,YBC-011,YBC-012,YBC-013,YBC-014,YBC-015,YBC-016,YBC-017,YBC-018,YBC-019,YBC-020 ,YBC-021,YBC-022,and YBC-023,respectively
2.3 唐古特白刺内生真菌ITS序列分析
将测序所得菌株ITS序列在NCBI数据库中进行BLAST比对,搜索较高同源性序列的GenBank登录号及序列相似度,下载与其相似度较高的菌株序列作为参考。已获得的21 条内生真菌的序列,与其相似序列的同源性均高于99%,同源性比对结果如表3所示。BC-001、BC-002、BC-003、BC-004、BC-005、BC-006、BC-007、BC-010、BC-013、BC-017、BC-018、BC-021、BC-022最接近链格孢属(Alternaria),BC-008最接近毛壳菌属(Chaetomium),BC-009、BC-015、BC-020最接近篮状菌属(Talaromyces),BC-011、BC-012、BC-014、BC-023最接近细基格孢属(Ulocladium)。
还有2 株尚未确定种属,能通过 ITS 序列鉴定的21 株内生真菌全部隶属于子囊菌门Ascomycota,分属于3 纲(座囊菌纲Dothideomycetes、散囊菌纲Eurotiomycetes 、粪壳菌纲Sordariomycetes)3 目(格孢腔菌目 Pleosporales、散囊菌目 Eurotiales、粪壳菌目 Sordariales)3 科(格孢腔菌科Pleosporaceae、毛壳菌科 Chaetomiaceae、发菌科Trichocomaceae)4 属(链格孢属Alternaria、毛壳菌属Chaetomium、篮状菌属Talaromyces、细基格孢属Ulocladium)。其中链格孢属(Alternaria)是白刺内生真菌的优势菌属,其余菌属的菌株数目相当,均为1~4 个。
2.4 唐古特白刺内生真菌的系统发育分析
根据前述BLAST比对分析结果,选取15 个近缘种的菌株,相似度均大于99%,21 个菌株全部隶属于子囊菌门(Ascomycota),因此选取担子菌门(Basidiomycota)的3个物种作为外类群,其物种信息见表4。利用聚类分析MEGA 7.0中的Neighbor-Joining程序构建系统发育树,分析白刺内生真菌各菌株的亲缘关系,见图3。
试验获得的菌种序列均与其相似菌株聚类在一起,表明这些菌株应为同一种属。从图1可见,根据亲缘关系可被分为Ⅰ(自检支持率99%)、Ⅱ(自检支持率99%)和Ⅲ(自检支持率99%)3枝,并且能够与外源菌株明显分开。系统发育树显示出各菌株与其相似菌株的关系与 BLAST 比对结果一致,21株菌株聚为4枝,分别为链格孢属Alternaria(13 株)、细基格孢属Ulocladium(4 株)、篮状菌属Talaromyces(3 株)、毛壳菌属Chaetomium(1 株),各菌株分类位置清晰。其中细基格孢属和链格孢属为相似属,细基格孢属被归至链格孢属,作为属下不同的组群,因此二者亲缘关系较近。
3 讨 论
本试验采用传统的组织块分离法从采自于盐碱地的白刺中分离培养出21 株内生真菌,经ITS序列分析鉴定均为子囊菌类,分别属于3 纲3 目4 属。其中链格孢属是白刺植株内生真菌的优势菌属,该属内生真菌也广泛分布于其他盐生植物中,如翅碱蓬、盐角草、黑果枸杞、芦苇、甘草等[30-34],这是由于链格孢属(Alternaria)种类多样,可作为腐生菌、寄生菌和内生菌,易侵染各种植物[35]。
本试验从白刺根、茎、叶中分离内生真菌,结果仅在白刺根、叶中分离出数量有限的内生真菌,除了与试验过程中分离培养条件、植物组织特性以及用于分离真菌的组织数目有关外,还可能与植物内生真菌分离的难易程度有关,植物体内存在的某些内生真菌由于不适合生长在某种培养基上而出现特性退化和消失[36]。因此今后在内生真菌分离中应采用多种选择性分离培养基,优化培养条件,尽可能多的分离获得内生真菌。此外,白刺内生真菌的分布具有一定的组织差异性,本研究中内生真菌对根的侵染频率最高,可能是因为在植物整个生命周期中,根部生长发育最早,发育时间也最长,有利于真菌的生长定殖,并且根部生境直接与土壤相接触,营养物质丰富,适宜真菌生长,土壤中存在的大量真菌亦可入侵根部组织从而演变为内生真菌[37]。
试验中分离到的白刺内生真菌大多数都是传统病原菌,易造成植物病害,如链格孢属(Alternaria)、细基格孢属(Ulocladium)可以引起植物叶片枯萎或长斑[38-40],造成一定的经济损失,篮状菌(Talaromyces)的某些种如马尔尼菲篮状菌则为人类和动物的机会病原菌[41]。但作为内生真菌定殖时对宿主植物具有有益作用,可以促进植物生长或提高耐盐性,链格孢属内生真菌定殖盐胁迫条件下的番茄植株具有更高的根茎生物量,同时还通过降低活性氧含量以应对盐胁迫[42]。细基格孢属能够在初始pH为10、盐浓度为10%的培养基中生长[43]。从藜麦中分离出的内生真菌篮状菌属真菌Talaromyces minioluteus在盐胁迫下能通过改善抗氧化酶和非酶系统来提高藜麦的耐盐能力[44]。可见某些真菌可能自身具有致病性,但由于成为内生真菌定殖于植物宿主,可转变为有益的真菌通过直接和间接的机制应对宿主所处的胁迫环境条件[45]。相关研究认为,真菌在植物体内的这种内生菌-病原菌生活方式,可能是因为某些真菌在植物组织不同生育期扮演不同的角色,在健康植物组织中可是内生真菌,但当寄主植物衰老、环境改变就会表现出其致病性,这是内生菌-宿主共存后随时间“协同进化”的体现[46-47]。
盐生植物生存的高盐环境对植物生长发育及其相关微生物具有明显的抑制作用,但植物自身可为相关微生物提供相应生态位,以减轻环境对微生物的胁迫,同时,内生真菌也可在不利环境中发挥功能作用,以协助寄主适应逆境和生长[48-49]。因此,笔者猜测,从生长于盐碱土壤的白刺中分离得到的这些内生真菌,与白刺本身具有的抗盐碱作用之间有一定的关联,可能是内生真菌在长期进化中获得了植物本身的部分特性,以适应特殊的生存环境,达到与植物共同进化的目的。而链格孢属(Alternaria)作为盐碱地上白刺内生真菌主要优势种属,其对白刺可能有着抗逆、促生等作用,相关假设有待深入研究验证。
4 结 论
本研究从生长于盐碱土壤的唐古特白刺中共分离并鉴定得到21 株内生真菌,结合形态学鉴定以及真菌ITS序列分析发现分属于4个属:链格孢属Alternaria(13 株)、细基格孢属Ulocladium(4 株)、篮状菌属Talaromyces(3 株)、毛壳菌属Chaetomium(1 株)。结果表明,唐古特白刺内生真菌的分布存在明显组织差异。
参考文献 Reference:
[1] DIAZ F J,SANCHEZ-HERNANDEZ J C,NOTARIO J S.Effects ofirrigation management on arid soils enzyme activities[J].Journal of Arid Environments,2021,185:104330.
[2]廖 岩,彭友贵,陈桂珠.植物耐盐性机理研究进展[J].生态学报,2007(5):2077-2089.
LIAO Y,PENG Y G,CHEN G ZH.Research advances in plants salt-tolerance mechanism[J].Acta Ecologica Sinica,2007,27(5):2077-2089.
[3]CHOUDHARY D K.Microbial rescue to plant under habitat-imposed abiotic and biotic stresses[J].Applied Microbiology and Biotechnology,2012,96(5):1137-1155.
[4]RASHID S,CHARLES T C,GLICK B R.Isolation and characterization of new plant growth-promoting bacterial endophytes[J].Applied Soil Ecology,2012,61(Complete):217-224.
[5]BACON C W,WHITE J F.Microbial Endophytes[M].New York,USA:Marcel Dekker,2000.
[6]TUTEJA N.Mechanisms of high salinity tolerance in plants[J].Methods in Enzymology,2007,428:419-438.
[7]GUO B,WANG Y,SUN X,et al.Bioactive natural products from endophytes:A review[J].Applied Biochemistry and Microbiology,2008,44(2):136-142.
[8]李 娥,胡华冉,李蛟男,等.内生真菌提高植物抵御盐胁迫的研究进展[J].生物技术通报,2019,35(11):169-178.
LI E,HU H R,LI J N,et al.Research progress on endophytic fungi improving plant resistance to salt stress[J].Biotechnology Bulletin,2019,35(11):169-178.
[9]MOLINA-MONTENEGRO M A,IAN S A R,CRISTIAN T D,et al.Antarctic root endophytes improve physiological performance and yield in crops under salt stress by enhanced energy production and Na+ sequestration[J].Scientific Reports,2020,10(1):5819.
[10] WAQAS M,KHAN A L,KAMRAN M,et al.Endophytic fungi produce gibberellins and indoleacetic acid and promotes host-plant growth during stress[J].Molecules,2012,17(9):10754-10773.
[11]YASMEEN R,SIDDIQUI Z S.Physiological responses of crop plants againstTrichoderma harzianum in saline environment[J].Acta Botanica Croatica,2017,76(2):154-162.
[12]WATAD A A,REUVENI M,BRESSAN R A,et al.Enhanced net K+ uptake capacity of NaCl-adapted cells[J].Plant Physiology,1991,95(4):1265-1269.
[13]聂佳俊,白璐嘉,韦云飞,等.盐胁迫过程中渗透胁迫和离子胁迫对水稻种子萌发的影响[J].分子植物育种,2022,20(3):959-966.
NIE J J,BAI L J,WEI Y F,et al.Effects of osmotic stress and ion stress on rice seed germination during salt stress[J].Molecular Plant Breeding,2022,20(3):959-966.
[14]HASANUZZAMAN M,BHUYAN M H M B,ANEE T I,et al.Regulation of ascorbate-glutathione pathway in mitigating oxidative damage in plants under abiotic stress[J].Antioxidants,2019,8(9):384-434.
[15]LI L,LI L,WANG X,et al.Plant growth-promoting endophyte Piriformospora indica alleviates salinity stress in Medicago truncatula[J].Plant Physiology and Biochemistry,2017,119:211-223.
[16]HANY A,FOUDA A,EID A M,et al.Biotechnological application of plant growth?偉cpromoting endophytic bacteria isolated from halophytic plants to ameliorate salinity tolerance of Vicia faba L[J]. Plant Biotechnology Reports,2021,15(6):819-843.
[17]PING Y,LE X,WANG S S,et al. Piriformospora indica improves salinity stress tolerance in Zea mays L.plants by regulating Na+ and K+ loading in root and allocating K+ in shoot[J].Plant Growth Regulation,2018,86(2):323-331.
[18]中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1998,43(1):122-123.
Editorial Committee of Chinese Botany.Chinese Flora [M].Beijing:Science Press,1998,43(1):122-123.
[19]杨秀清,冯鑫炜,乔帅帅,等.不同育苗方式对引进唐古特白刺成活及生长性状的影响[J].山西农业大学学报(自然科学版),2015,35(1):438-441.
YANG X Q,FENG X W,QIAO SH SH,et al.The influence of different seedling-raising ways on survival and growth traits of the introduced Nitraria tangutorum[J] .Journal of Shanxi Agricultural University(Natural Science Edition),2015,35(1):438-441.
[20]PAUL V.Inhibition of acute hyperammonemia-induced convulsions by systemically administered gamma aminobutyric acid in rats[J].Pharmacology Biochemistry and Behavior,2003,74(3):523-528.
[21]刘 尧,杨秀清,王 芳.白刺在山西引种试验初期的成活及生长表现[J].山西农业大学学报(自然科学版),2014,34(5):453-457.
LIU Y,YANG X Q,WANG F.Survival and growing performance of the introduced Nitraria species in Shanxi[J].Journal of Shanxi Agricultural University(Natural Science Edition),2014,34(5):453-457.
[22]YANG Y,SHI R,WEI X,et al.Effect of salinity on antioxidant enzymes in calli of the halophyte Nitraria tangutorum Bobr[J].Plant Cell Tissue and Organ Culture,2010,102(3):387-395.
[23]张慧芳,闫海冰,冯 帆,等.不同盐分处理对唐古特白刺超微结构及生长、生理指标的影响[J].干旱区资源与环境,2021,35(6):161-169.
ZHANG H F,YAN H B,FENG F,et al.Effects of salt stress on ultrastructure,growth and physiological indexes of Nitraria tangutorum[J].Journal of Arid Land Resources and Environment,2021,35(6):161-169.
[24]NI J W,YANG X Y,ZHU J F,et al.Salinity-induced metabolic profile changes in Nitraria tangutorum Bobr.suspension cells[J].Plant Cell,Tissue and Organ Culture,2015,122(1):239-248.
[25]CHENG T,CHEN J,ZHANG J,et al.Physiological and proteomic analyses of leaves from the halophyte Tangut Nitraria reveals diverse response pathways critical for high salinity tolerance[J].Frontiers in Plant Science,2015,6(30):30.
[26]CUI J L,GUO T T,REN Z X,et al.Diversity and antioxidant activity of culturable endophytic fungi from alpine plants ofRhodiola crenulata,R.angusta,and R.sachalinensis[J].PLoS One,2015,10(3):e0118204
[27]MCINROY J A,KLOEPPER J W.Studies on Indigenous Endophytic Bacteria of Sweet Corn and Cotton[M].Wiley-VCH Verlag GmbH,2007.
[28]周德庆.微生物学实验教程[M].第2版.北京:高等教育出版社,2006:26-372.
ZHOU D Q.Essential Microbiology[M].2rd ed.Beijing:Higher Education Press,2006:26-372.
[29]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
WEI J CH.Fungal Identification Manual[M].Shanghai:Shanghai Science and Technology Press,1979.
[30]钮旭光,宋立超,韩 梅,等.盐生植物翅碱蓬的内生真菌多样性分析[J].微生物学通报,2012,39(10):1388-1395.
NIU X G,SONG L CH,HAN M,et al.Diversity of endophytic fungi of Suaeda heteroptera Kitag[J].Microbiology China,2012,39(10):1388-1395.
[31]唐琦勇,朱 静,楚 敏,等.北疆盐角草内生真菌群落组成和分布[J].干旱区资源与环境,2021,35(5):137-143.
TANG Q Y,ZHU J,CHU M,et al.Community composition and distribution of endophytic fungi in Salicornia europaea from the northern Xinjiang[J].Journal of Arid Land Resources and Environment,2021,35(5):137-143.
[32]顾美英,张志东,唐光木,等.黑果枸杞不同组织内生真菌群落组成及生态功能分析[J].菌物学报,2022,41(8):1254-1267.
GU M Y,ZHANG ZH D,TANG G M,et al.Community composition and ecological function of endophytic fungi in different tissues of Lycium ruthenicum Murr[J].Mycosystema,2022,41(8):1254-1267.
[33]李海林,马 斌,张晓黎,等.滨海湿地植物芦苇可培养内生真菌的多样性[J].应用生态学报,2016,27(7):2066-2074.
LI H L,MA B,ZHANG X L,et al.Diversity of culturable endophytic fungi of common reed (Phragmites australis) in coastal wetland[J].Chinese Journal of Applied Ecology,2016,27(7):2066-2074.
[34]赵 翀,廖 萍,张瀚能,等.甘草内生真菌多样性及群落结构[J].草业科学,2016,33(7):1315-1323.
ZHAO CH,LIAO P,ZHANG H N,et al.Diversity and community structure of endophytic fungi from liquorice plants[J].Pratacultural Science,2016,33(7):1315-1323.
[35]冯中红,孙广宇.链格孢属及相关属分类研究新进展[J].菌物研究,2020,18(4):294-303.
FENG ZH H,SUN G Y.Advances in the classification ofAlternaria and related genera[J].Journal of Fungal Research,2020,18(4):294-303.
[36]杨志军,邓 毅,曼 琼,等.内生菌在天然药物研究中的研究进展[J].中国临床药理学杂志,2018,34(5):593-596.
YANG ZH J,DENG Y,MAN Q,et al.Progress in search for endophytes associated with natural medicine[J].The Chinese Journal of Clinical Pharmacology,2018,34(5):593-596.
[37]TAYLOR J E,HYDE K D,JONE E.Endophytic fungi associated with the temperate palm,Trachycarpus fortunei,within and outside its natural geographic range[J].New Phytologist,1999,142(2):335-346.
[38]WADUD A,DAS S,KHOKON M.Prevalence of the Alternaria blight of cumin (Cuminum cyminum L.) in Bangladesh:Morphology,phylogeny and pathogenic variation of Alternaria spp[J].Saudi Journal of Biological Sciences,2021,28(10):5865-5874.
[39]HEBBA F D,YOU M P,MOHAMMED A E,et al.Virulence variability across the Alternaria spp.population determines incidence and severity of alternaria leaf spot on rapeseed[J].Plant Pathology,2020,69(3):506-517.
[40]ESFAHANI M N.Identification of Ulocladium atrum causing potato leaf blight in Iran[J].Phytopathologia Mediterranea,2018,57(1):112-114.
[41]HIEN T V,LOC P P,HOA N T,et al.First case of disseminated Penicillium marneffei infection among patients with acquired immunodeficiency syndrome in Vietnam[J].Clinical Infectious Diseases,2001,32:78-80.
[42]AZAD K,KAMINSKYJ S.A fungal endophyte strategy for mitigating the effect of salt and drought stress on plant growth[J].Symbiosis,2016,68(1/3):73-78.
[43]JAOUANI A,NEIFAR M,PRIGIONE V,et al.Diversity and enzymatic profiling of halotolerant micromycetes from sebkha el melah,a saharan salt flat in southern tunisia[J].Biomed Research International,2014,2014(6):439197.
[44]GONZALEZ T M,CONTRERAS R A,ZUNIGA G E,et al. Synergistic association with root endophytic fungi improves morpho-physiological and biochemical responses of Chenopodium quinoa to salt stress[J].Frontiers in Ecology and Evolution,2022,9:1-12.
[45]ALSHARARI S S,GALAL F H,SEUFI A M.Composition and diversity of the culturable endophytic community of six stress-tolerant dessert plants grown in stressful soil in a hot dry desert region[J].Journal of Fungi,2022,8(3):241.
[46]PROMPUTTHA I,HYDE K D,MCKENZIE E H C, et al.Can leaf degrading enzymes provide evidence that endophytic fungi becoming saprobes?[J].Fungal Diversity,2010,41(1):89-99.
[47]熊 丹,欧 静,李林盼,等.黔中地区马尾松林下杜鹃根部内生真菌群落组成及其生态功能[J].生态学报,2020,40(4):1228-1239.
XIONG D,OU J,LI L P,et al.Community composition and ecological function analysis of endophytic fungi in the roots of Rhododenron simsii in Pinus massoniana forest in central Guizhou[J].Acta Ecologica Sinica,2020,40(4):1228-1239.
[48]JIA M,CHEN L,XIN H L,et al.A friendly relationship between endophytic fungi and medicinal plants:a systematic review[J].Frontiers in Microbiology,2016,7:906-920.
[49]SZYMANSKA S,PIERNIK A,BAUM C,et al.Metabolic profiles of microorganisms associated with the halophyte Salicornia europaea in soils with different levels of salinity[J].Ecoscience,2014,21:114-122.
Isolation and Identification of Endophytic Fungi in Nitraria tangutorum Bobr.in Saline Soil
LIU Yanping1,ZHANG Defang1,2 and WEN Huaixiu3
(1.Qinghai Academy of Agriculture and Forestry,Qinghai University,Xining 810016,China; 2.Laboratory for
Research and Utilization of Qinghai Plateau Germplasm Resources,Xining 810016,China; 3.Qinghai
Provincial Key Laboratory of Tibetan Medicine Research and Key Laboratory of Tibetan Medicine Research,
Northwest Institute of Plateau Biology,Chinese Academy of Sciences,Xining 810008,China)
Abstract To explore the species and tissue distribution charateristics of endophytic fungi in Nitraria tangutorum Bobr.,we isolated fungi from N.tangutorum Bobr.growing in saline soil by traditional tissue block method.The species were identified by morphology and fungal ITS sequence analysis,and a phylogenetic tree was constructed by MEGA 7.0.The results showed that 23 strains of endophytic fungi were isolated from different parts of N.tangutorum Bobr.(roots,stems,leaves),with 21 strains identified.These included thirteen strains of Alternaria, one strain of Chaetomiumthree strains of,Talaromyce,and four strains of Ulocladium.The predominant distribution was observed in,the roots of N.tangutorum Bobr. followed by leaves,and stems.The results suggest distinct tissue-based difference in the distribution of endophytic fungi,with the root being the most vulnerable infection and colonization.
Key words Nitraria tangutorum Bobr.; Endophytic fungi; Isolation; Identification; Saline alkali soil
Received 2023-03-28 Returned 2023-08-04
Foundation item The National Natural Science Foundation of China (No.32170239); Laboratory for Research and Utilization of Qinghai Tibet Plateau Germplasm Resources (No.2022-ZJ-Y01).
First author LIU Yanping,female,master student.Research area:interactions between microorganisms and plants.E-mail:1576354728@qq.com
Corresponding author ZHANG Defang,female,Ph.D,associate research fellow.Research area:plant stress resistance.E-mail:defangstart2011@163.com
WEN Huaixiu,female,Ph.D,associate research fellow.Research area:secondary metabolites of plant endophytes and their functions.E-mail:whx@nwipb.cas.cn
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)

