基于单细胞转录组学测序的巨噬细胞在肝硬化-肝癌疾病进展中的功能研究
任凌萱 卢子琪 齐威 冯志杰
基金项目:河北省自然科学基金资助项目(H2021206314);河北省省级科技计划资助项目(22377703D)
引用本文:任凌萱,卢子琪,齐威,等. 基于单细胞转录组学测序的巨噬细胞在肝硬化-肝癌疾病进展中的功能研究[J]. 中国全科医学,2024,27(29):3654-3663. DOI:10.12114/j.issn.1007-9572.2023.0596. [www.chinagp.net]
REN L X,LU Z Q,QI W,et al. Functional analysis of macrophages in the progression of liver cirrhosis and liver cancer[J]. Chinese General Practice,2024,27(29):3654-3663.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
【摘要】 背景 肝脏巨噬细胞在构建宿主防御机制及维持机体内环境稳定中发挥重要作用,也是参与肝脏损伤和修复的重要细胞成分。单核细胞来源的巨噬细胞在基因调控以及具体功能方面与肝脏固有巨噬细胞不尽相同。90%以上的原发性肝癌发生在肝硬化的基础上,巨噬细胞在肝硬化及肝癌疾病进展中的动态变化规律值得探讨。目的 解析不同来源肝脏巨噬细胞的转录组学差异,分析巨噬细胞在肝硬化-肝癌疾病进展中的动态变化规律,探索预防肝硬化进展为肝癌的潜在策略。方法 本研究通过从GEO数据库获取健康、肝硬化及肝癌组织的单细胞转录组学数据。健康及肝硬化数据来自GEO数据库GSE136103数据集,取自5例健康肝脏以及5例肝硬化肝脏的数据。肝癌数据来自GEO数据库GSE149614数据集,取自10例肝癌患者的数据。通过Seurat软件包分别对肝硬化及肝癌样本的数据进行聚类,鉴定各个细胞类型。将肝硬化样本中的3簇巨噬细胞亚群提取后,分析各个亚群前200个特异性表达基因,应用Metascape在线分析软件对各亚簇特异性表达基因进行功能分析。提取巨噬细胞亚群肝硬化特异性表达基因,通过KEGG功能分析探究巨噬细胞在肝硬化中的功能。将肝硬化以及肝癌单细胞转录组数据通过CellChat软件包进行细胞间相互作用分析,对比肝硬化与肝癌样本巨噬细胞的细胞通讯的差异。将健康对照、肝硬化以及肝癌三者不同来源的巨噬细胞通过Harmony软件包去批次效应,之后导入Monocle软件包进行伪时序分析,构建健康肝脏-肝硬化肝脏-肝癌巨噬细胞的演变轨迹。利用limma软件包找寻在健康肝脏-肝硬化肝脏-肝癌巨噬细胞的演变过程中连续上调以及下调的基因,并进行功能富集分析。结果 对所有细胞进行无监督聚类,根据标记基因表达情况,共提取出3个巨噬细胞亚簇(分别为Mac1,Mac2和Mac3)。其中Mac1起源于组织驻留巨噬细胞(Kupffer细胞),Mac2以及Mac3起源于血液单核细胞,并且其数量在肝硬化组织中明显增多。在肝硬化组织中的Mac1表现了适应性免疫系统相关功能的上调,Mac2以及Mac3亚群均表现出吞噬体相关功能以及抗原提呈功能的下调。肝硬化与肝癌样本中巨噬细胞与其他类型细胞的通讯存在巨大的差异。某些细胞间通讯仅发生于肝硬化巨噬细胞中,这包括干扰素Ⅱ(IFN-Ⅱ)以及CD40等信号通路的细胞通讯。经过去批次效应的处理后,对健康肝脏、肝硬化肝脏以及肝癌巨噬细胞进行伪时序分析,结果提示三组数据存在特定的时序关系。本研究发现81个在该过程中连续下调的基因,然而未发现在健康肝脏-肝硬化肝脏-肝癌巨噬细胞演变过程中连续上调的基因。功能分析提示连续下调基因存在对细菌免疫反应的功能富集。结论 肝硬化巨噬细胞可以分为3个亚群,其中Mac1来自肝脏固有Kupffer细胞,Mac2、Mac3来自血液单核细胞。肝硬化中诸多免疫相关细胞通讯例如IFN-Ⅱ以及CD40通路在肝癌中消失。健康肝脏-肝硬化肝脏-肝癌巨噬细胞演变过程存在对细菌免疫反应的持续下调,这可能加重了门脉高压造成的肠道菌群位移的危害。对于肝硬化患者,尽早地治疗门脉高压造成的肠漏,可能是重要的治疗策略。
【关键词】 巨噬细胞;肝硬化;肝纤维化;肝肿瘤;单细胞转录组学测序;细胞间相互作用
【中图分类号】 R 329.24 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0596
Functional Analysis of Macrophages in the Progression of Liver Cirrhosis and Liver Cancer
REN Lingxuan,LU Ziqi,QI Wei*,FENG Zhijie*
Department of Gastroenterology,the Second Hospital of Hebei Medical University/Hebei Key Laboratory of Gastroenterology/Hebei Institute of Gastroenterology/Hebei Clinical Research Center for Digestive Diseases,Shijiazhuang 050000,China
*Corresponding authors:FENG Zhijie,Chief physician/Professor;E-mail:26300056@hebmu.edu.cn
QI Wei,Associate chief physician;E-mail:28502620@hebmu.edu.cn
REN Lingxuan and LU Ziqi are co-first authors
【Abstract】 Background Hepatic macrophages play a vital role in the defense mechanisms and maintaining the internal environment stability of body,and are also major cellular components involved in liver injury and repair. Macrophages derived from hematopoietic stem cells exhibit distinct gene regulation patterns compared to resident macrophages in the liver. More than 90% of primary liver cancer occurs on the basis of cirrhosis,and the dynamic changes of macrophages in the progression of cirrhosis to hepatocellular carcinoma are worth exploring. Objective To analyze the transcriptomic differences of hepatic macrophages originating from diverse sources,analyze the dynamic pattern of macrophage changes in liver cirrhosis and liver cancer progression,and explore potential strategies for preventing the progression of liver cancer. Methods In this study,single-cell transcriptomics data of healthy,cirrhotic and hepatocellular carcinoma(HCC)tissues were obtained from the Gene Expression Omnibus(GEO)database. The healthy and liver fibrosis data were obtained from the GSE136103 dataset of the GEO database,which included samples from five healthy liver tissues and five liver cirrhosis tissues. The HCC data were obtained from the GSE149614 dataset of the GEO database,which consisted of 21 samples from ten HCC patients. Utilizing the Seurat package,a clustering analysis was conducted on the transcriptomic data derived from liver fibrosis and HCC samples to identify distinct cell types. Notably,three distinctive clusters of macrophage subtypes were identified within the fibrosis samples,from which the top 200 marker genes were extracted. Metascape online analysis software was applied to functionally analyze each subcluster-specific expressed gene. Subgroup-specific expressed genes in liver fibrosis were extracted,and the function of macrophages in cirrhosis was explored by KEGG functional analysis. The CellChat software package was utilized to analyze intercellular interactions within liver fibrosis and HCC single-cell transcriptome data,differences in macrophage communication between cirrhosis and HCC samples were compared. Additionally,normal,fibrotic and cancerous macrophages were extracted,and batch effect correction was performed using the Harmony package. Subsequently,the Monocle package was employed for pseudo-time analysis to construct the developmental trajectory of macrophages spanning from a healthy state to fibrosis and eventually to the HCC microenvironment. The limma package was utilized to find genes that are continuously up-regulated and down-regulated during the evolution of macrophages from healthy state to cirrhotic state and finally to HCC,and functional enrichment analysis was performed. Results Unsupervised clustering was performed,and a total of three macrophage subclusters(designated as Mac1,Mac2,Mac3)were identified based on the expression patterns of marker genes. Mac1 originates from tissue-resident macrophages(Kupffer cells). Mac2 and Mac3 derived from blood monocytes and their numbers were significantly increased in cirrhotic tissue. Mac1 in cirrhotic tissue showed up-regulation of adaptive immune system-related functions. Mac2 and Mac3 subgroups show down-regulation of phagosome-related functions and antigen presentation functions. There were significant differences in communication between macrophages and other cell types in cirrhotic tissue and HCC tissue. Certain intercellular communication occurs only in cirrhotic macrophages,including cell communication of signaling pathways such as IFN-Ⅱ and CD40. After batch effect correction,pseudo-time series analysis was performed on macrophages from healthy liver,liver cirrhosis and HCC,the results suggest that there is a specific temporal relationship between the three groups of macrophages. This study identified 81 genes that were continuously down-regulated during the process,however,no genes were identified that were continuously up-regulated during the evolution of healthy-cirrhotic-HCC macrophage. Functional analysis suggested that the continuously down-regulated genes are functionally enriched for immune responses to bacteria. Conclusion Cirrhotic macrophages can be divided into three subgroups,of which Mac1 derived from liver-resident Kupffer cells and Mac2 and Mac3 derive from blood monocytes. Many immune-related cell communications in liver cirrhosis,such as IFN-Ⅱ and CD40 pathways,disappear in HCC. There is a continuous down-regulation of immune responses to bacteria in the evolution of healthy -cirrhotic-HCC macrophages,which may exacerbate the destructive effect of portal hypertension-induced gut microbiota displacement. For patients with liver cirrhosis,early treatment of portal hypertension-induced intestinal leakage(leaky gut) may be an important treatment strategy.
【Key words】 Macrophages;Liver cirrhosis;Liver fibrosis;Liver neoplasms;Single-cell transcriptomic sequencing;Intercellular interactions
肝硬化是常见的消化系统疾病之一,以肝脏广泛的纤维化为特征。最近的研究表明,全世界有8.44亿人患有慢性肝病,每年有200万人死亡,发病率不断上升,但是目前还没有有效的抗纤维化的疗法[1]。更为重要的是,90%以上的原发性肝癌发生在肝硬化的基础上[2]。相较于其他实质脏器,肝脏中的巨噬细胞占肝内总免疫细胞比例最高,并且肝脏巨噬细胞在维持肝脏组织本身乃至整个机体的稳态方面具有关键作用。越来越多的证据表明,除免疫作用外,巨噬细胞还有其他作用,包括调节造血微环境、影响新陈代谢、介导组织修复和调控胚胎组织的成熟等功能[3]。已有研究表明,在硬化的肝脏中,与成纤维相关的巨噬细胞起源于血液单核细胞的募集分化,聚集于肝纤维化憩室(fibrotic niche),这些巨噬细胞被称为肝纤维化憩室相关巨噬细胞。肝纤维化憩室相关巨噬细胞高表达的基因包括SPP1、LGALS3、CCL2、CXCL8、PDGFB和VEGFA等[4-7]。单细胞转录组学测序(single-cell RNA sequencing,scRNA-seq)为临床对疾病发病机制的研究提供了一种新方法,允许应用新的分辨率对单个细胞群进行分析[8]。本研究使用scRNA-seq研究肝硬化中各个巨噬细胞亚群的转录组差异,并探讨肝硬化进展为肝癌的过程中巨噬细胞相关基因及通路的动态变化。
1 材料与方法
1.1 单细胞数据的获取
从GEO(Gene Expression Omnibus)数据库获取健康、肝硬化及肝癌组织的单细胞数据,健康及肝硬化数据来自GEO数据库GSE136103数据集,包括5例健康肝脏、5例肝硬化肝脏样本;肝癌数据来自GEO数据库GSE149614数据集,包括10例肝癌患者的数据。
1.2 对单细胞数据进行预处理:质控和标准化
将下载的健康肝脏、肝硬化肝脏以及肝癌的单细胞转录组数据,分别导入Seurat软件包,进行细胞类型的鉴定。首先对单细胞数据进行质控,使用PercentageFeatureSet函数计算线粒体比例,过滤掉线粒体比例超过20%的细胞。然后用NormalizeDate函数对数据进行标准化,使用全局缩放归一化方法“LogNormalize”,用总表达量对每个细胞的基因表达式进行归一化,再乘以一个缩放因子(默认为10 000),然后对结果进行log转换。接下来,计算数据集中表现出细胞间变异的特征基因。用FindVariableFeatures函数实现,每个数据集返回2 000个高变基因,这些将用于下游主成分分析(PCA)。ScaleData函数实现线性变换,是在PCA降维之前的一个标准预处理步骤。接下来,对缩放的数据执行PCA。使用JackStraw和Elbow plot命令确定数据的维度。应用KNN算法进行聚类,然后进行非线性降维(t-distributed stochastic neighbor embedding,tSNE),利用FindMarkers命令,可以找到各个细胞类型中与其他类别的差异表达基因,作为该细胞类型的生物学标志基因。对比CellMakers网站各细胞标记基因进行细胞注释。应用Subset函数提取出后续要进行分析的巨噬细胞。
1.3 差异基因的功能分析
在肝硬化巨噬细胞中特异性上调以及下调的基因在应用org.Hs.eg.db进行基因ID转换后,应用clusterProfiler进行KEGG功能富集分析。应用limma软件包分析肝硬化-肝癌疾病进展特异性上调以及下调的基因。
1.4 肝硬化、肝癌巨噬细胞与其他细胞间的通讯分析
CellChat是一个能够从单细胞RNA测序(scRNA-seq)数据中定量推断和分析细胞间通信网络的R包,其需要细胞的基因表达数据作为输入,并通过整合基因表达与信号配体、受体及其辅助因子之间的相互作用的先验知识来建立细胞-细胞交流的概率,进而对细胞间通讯做出预测,并提供多种可视化方法。分别对肝硬化组织中Mac1、Mac2、Mac3以及肝癌组织巨噬细胞与其他细胞进行细胞间通讯分析,得到巨噬细胞在肝硬化与肝癌组织和各种细胞通讯的通路,对比肝硬化以及肝癌组织的特异性通路。
1.5 健康、肝硬化、肝癌组织巨噬细胞的伪时序分析
将健康、肝硬化、肝癌组织巨噬细胞数据整合,经Harmony包去批次效应后,将整合数据导入Monocle包,应用DDRTree函数进行降维,得出细胞转化顺序。并用differentialGeneTest函数寻找各组随伪时间变化的
基因。
1.6 基于在线分析软件的功能富集分析
Metascape是一个功能强大的基因功能注释分析工具,可进行批量基因和蛋白质的分析并实现对基因功能分析。本研究应用Metascape在线分析软件对特异性富集基因进行功能分析。
2 结果
2.1 巨噬细胞亚聚类及其功能分析
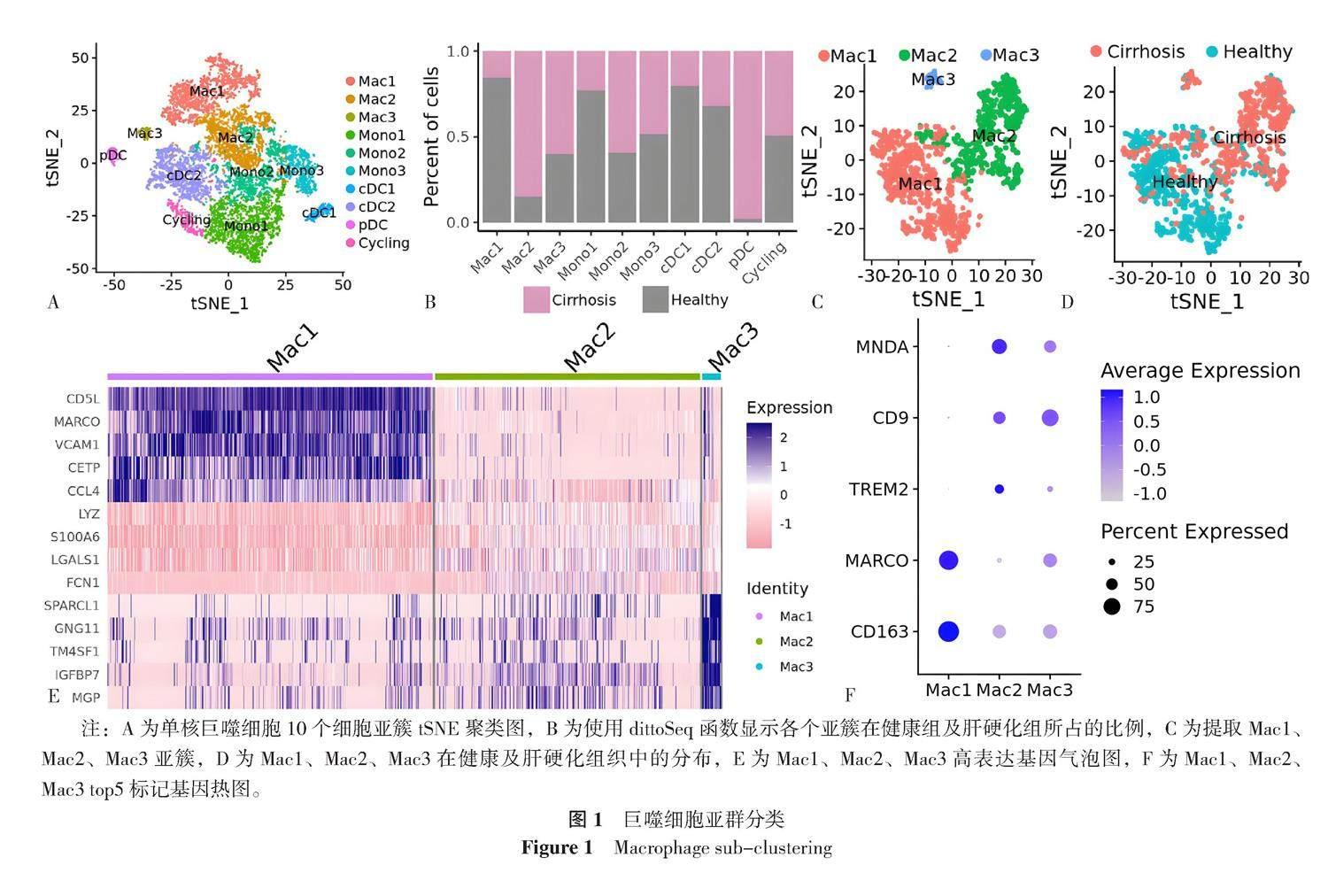
提取单核巨噬细胞数据,分为10个细胞簇,分别为单核细胞(Mono1,Mono2,Mono3),巨噬细胞(Mac1,Mac2,Mac3),树突状细胞(cDC1,cDC2,pDC)(图1A),并使用dittoSeq函数显示各个亚簇在健康组及肝硬化组所占的比例(图1B),其中Mac1在健康组织中比例较高,Mac2、Mac3在肝硬化组织中所占比例较高。提取3簇巨噬细胞(图1C、1D),并显示各个亚簇top5标记基因(图1E)。在3簇巨噬细胞中,Mac1高表达基因CD163和MARCO,倾向于组织驻留巨噬细胞(Kupffer细胞),Mac2以及Mac3高表达TREM2,CD9和MNDA,倾向于单核细胞起源的巨噬细胞(图1F)。
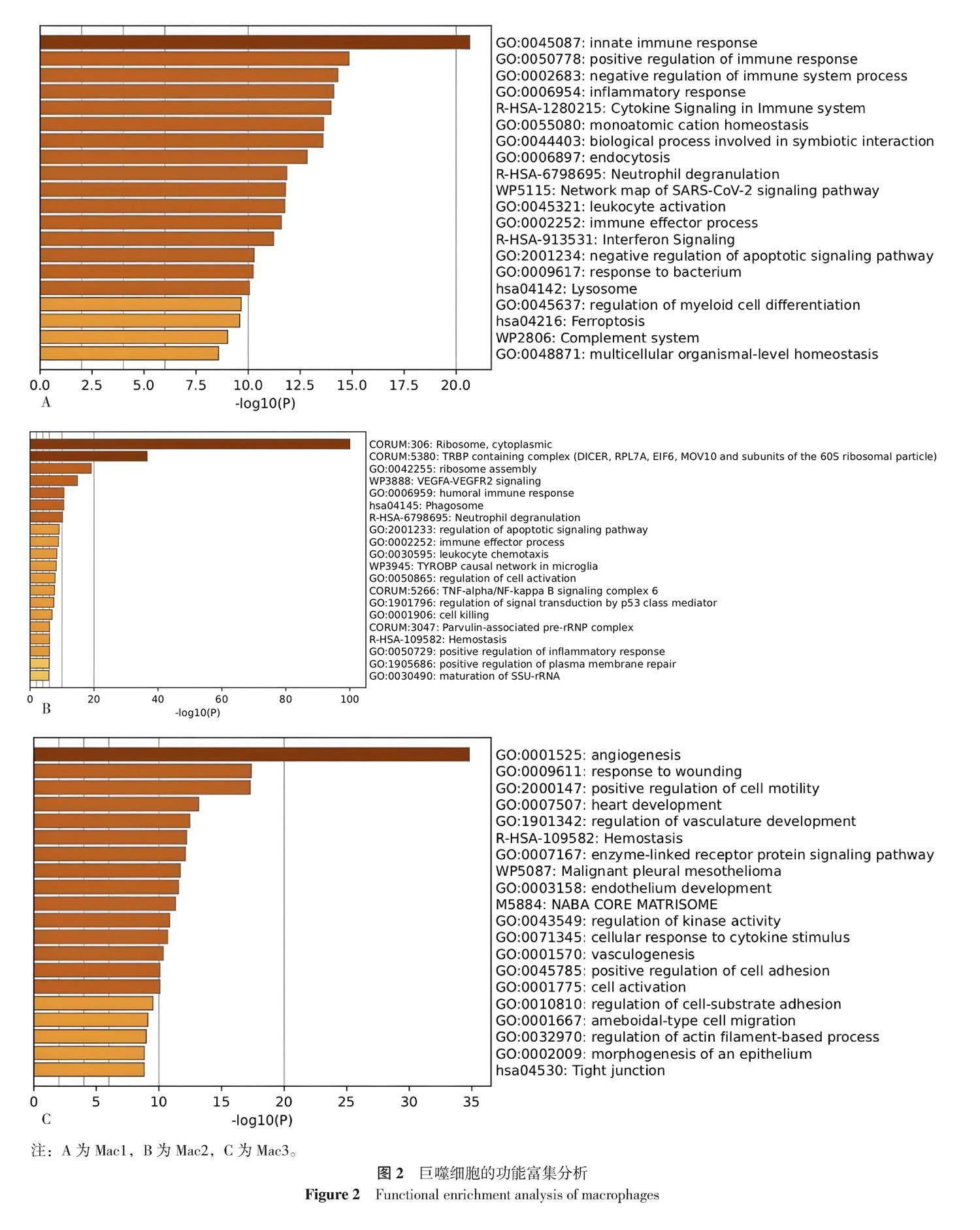
提取的Mac1、Mac2以及Mac3亚群各自top200标记基因,导入网页分析工具Metascape中做功能富集分析探究各簇巨噬细胞功能(图2)。Mac1的功能主要为“固有免疫反应”“免疫反应调节”以及“炎症反应”。Mac2的功能主要为“核糖体,细胞质”“含有TRBP的复合物(DICER、RPL7A、EIF6、MOV10和60S核糖体颗粒的亚基)”以及“核糖体组装”。Mac3的功能主要为“血管生成”“伤口反应”以及“细胞运动的正向调节”。
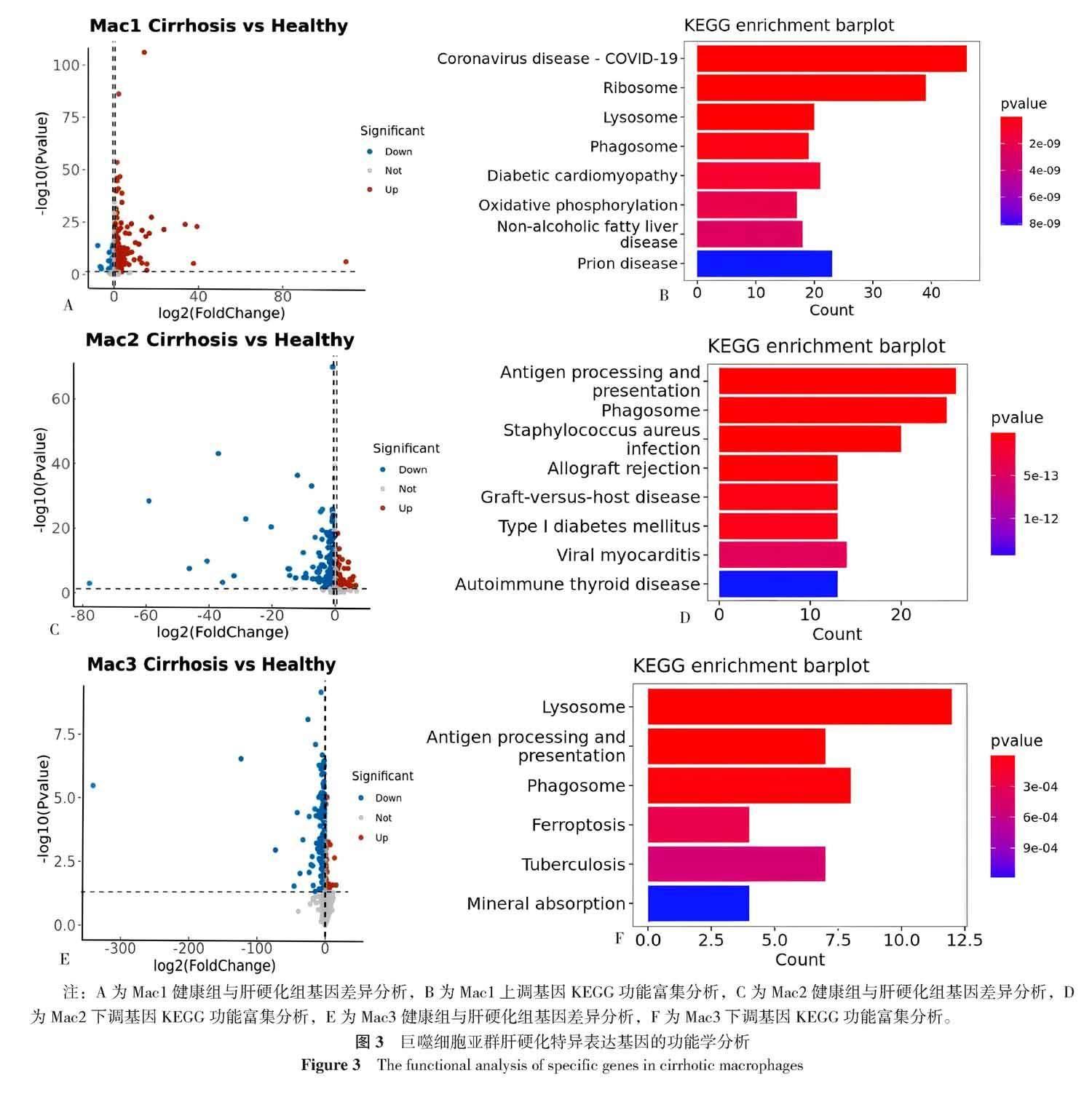
将Mac1、Mac2以及Mac3亚群中肝硬化组织特异性上调以及下调的基因进行分析。结果发现Mac1亚群的差异基因主要为上调基因,Mac2以及Mac3亚群的差异基因主要是下调基因。后续对Mac1中的上调基因,以及Mac2和Mac3亚群的下调基因进行KEGG功能富集分析(图3)。根据KEGG的结果,在肝硬化组织中的Mac1表现了适应性免疫系统(adaptive immune system)的相关功能的上调。Mac2以及Mac3亚群均表现出吞噬体(phagosome)相关功能以及抗原提呈功能的下调。提示肝硬化中Mac2以及Mac3亚群巨噬细胞可能存在免疫功能的衰退。
2.2 肝硬化以及肝癌中巨噬细胞亚群细胞通讯分析
肝硬化与肝癌样本中巨噬细胞与其他类型细胞的通讯存在巨大的差异(图4A、4B)。某些细胞间通讯仅发生于肝硬化巨噬细胞中,这包括干扰素(IFN)-Ⅱ以及CD40等信号通路的细胞通讯(图4C、4D)。在肝硬化样品中,IFN-Ⅱ信号从T细胞以及自然杀伤细胞(NK细胞)发出,并且Mac1、Mac2以及Mac3通过IFNGR1以及IFNGR2接收相关信号。而CD40信号的通讯仅存在于单核细胞起源的Mac2以及Mac3,信号由T细胞发出,由ITGA5、ITGB1、ITGAM以及ITGB2接收。而上述信号通信均没有出现在肝癌的样品中,这反映了从肝硬化到肝癌巨噬细胞亚群细胞通讯存在剧烈的变化,IFN-Ⅱ以及CD40等免疫相关信号通路减弱,这同样也是巨噬细胞存在免疫功能衰退的又一个证据。
2.3 巨噬细胞在肝硬化-肝癌疾病进展中的伪时序分析
肝硬化-肝癌疾病进展常经过数年的时间,本研究充分利用伪时序分析的技术对上述动态过程进行了分析。经过去批次效应后,健康肝脏、肝硬化肝脏以及肝癌巨噬细胞单细胞转录组学数据进行了联合分析(图5A)。通过基因表达的梯度构建了健康肝脏、肝硬化肝脏以及肝癌巨噬细胞的伪时序分析(图5B、5C)。整体上说,健康肝脏、肝硬化肝脏巨噬细胞的时序较为接近,而肝癌巨噬细胞距离前两个较遥远。
2.4 肝硬化-肝癌疾病进展中巨噬细胞的功能分析
健康肝脏、肝硬化肝脏以及肝癌巨噬细胞的变化可以考虑为同一个病理生理过程,将健康肝脏与肝硬化肝脏巨噬细胞的差异基因,肝硬化肝脏与肝癌巨噬细胞的差异基因分别提取并取交集(图6A、6B)。结果未发现任何连续上调的基因。连续下调的基因有81个(图6C),其功能富集分析提示与细菌的免疫反应高度相关(图6D)。由于肝硬化患者门脉压力上升造成肠道菌群移位,通过门静脉进入肝脏的细菌以及毒素的增加,进一步加重了肝脏的慢性炎症以及肝硬化的进程。而本研究分析发现一系列巨噬细胞存在免疫功能衰退的现象,可能会进一步加重上述过程。
3 讨论
早期阶段的肝硬化常伴随炎症反应,这时的巨噬细胞主要扮演着清除细菌和细胞垃圾的角色。此外,研究还发现巨噬细胞能够分泌多种细胞因子,如肿瘤坏死因子α(TNF-α)和白介素(IL)-6等,这些细胞因子可以促进肝细胞的生长和修复[9]。肝硬化的中期阶段,随着炎症反应的加剧,巨噬细胞逐渐转化为促炎细胞,释放大量的炎症因子和细胞因子,如IL-1β和IL-18等。这些因子能够引起肝脏细胞的凋亡和纤维化,从而加速肝硬化的发展[10]。在肝硬化晚期阶段,巨噬细胞成为肝脏内纤维化细胞的主要来源之一。巨噬细胞可以通过分泌转化生长因子β(TGF-β)等细胞因子,促进肝脏中成纤维细胞的增生和转化,从而形成肝脏内的纤维化病变[11-13]。
有文献证实具有血管生成潜力的单核细胞在肝再生部位积累[14]。并且有研究发现在慢性肝病期间,巨噬细胞通过分泌促血管生成生长因子协助形成复杂的血管网络[15]。本研究结果印证了上述观点,Mac2以及Mac3巨噬细胞亚群作为单核细胞来源的巨噬细胞,在功能富集分析中提示了血管生成(angiogenesis)相关的功能富集。Mac2亚群富集了VEGFA-VEGFR2的信号,而Mac3亚群功能富集分析中排名第一位的即为血管生成。而Mac1亚群作为肝脏固有的Kupffer细胞,主要发挥了固有免疫(innate immune)的相关功能。
肝硬化伴随着肠肝轴功能的异常,门脉压力上升造成的肠道水肿导致了肠道菌群失调、肠道屏障受损和细菌转位增加[16]。巨噬细胞作为一种具备抗原提呈功能的细胞[17],增加的细菌转位可能会导致肝硬化组织中巨噬细胞抗原提呈功能的变化。本研究中发现,肝硬化中的巨噬细胞确实表现出抗原提呈功能的富集,但是单核细胞起源的Mac2以及Mac3巨噬细胞亚群中出现了抗原提呈功能的下调。
肝硬化-肝癌疾病进展中巨噬细胞伪时序以及后续的功能分析提示了门脉压力上升造成的肠漏(leaky gut)与巨噬细胞功能的改变可能具有协同的效应。巨噬细胞中连续下调的基因有81个,其功能富集分析提示与细菌的免疫反应高度相关。目前已经有研究提示了肝硬化患者门脉压力上升造成了肠道菌群移位[18-19]。肝硬化患者肠道菌群的改变与患者的死亡率相关,并且经颈静脉肝内门体分流术降低门脉压力后,肠道菌群可以被重构[20-21]。巨噬细胞在肝硬化-肝癌疾病进展中免疫功能逐渐消退,“守门员”功能失守,可能是肝硬化形成以及进一步进展为肝癌的一个标志性事件。
在肝硬化进展至肝癌过程通常需要数年的时间,由于巨噬细胞存在众多持续表达下调的基因,这可能提示肝癌中巨噬细胞表型可能在数年前的肝硬化阶段已经存在。并且这种早期出现衰退的巨噬细胞表型,由于显著地富集了针对细菌免疫反应的功能,可能与门脉高压之下肠肝轴的异常状态有关。经颈静脉肝内门体分流术是一种潜在的可以通过降低门脉压力从而减轻肠漏的技术手段,但是该技术是否可以通过早期干预肠道菌群移位减缓肝硬化进展至肝癌仍需要更多的研究以及探讨。
综上所述,本研究通过生物信息学的技术手段,对公共数据库中健康肝脏、肝硬化肝脏以及肝癌样本数据的分析,探讨了巨噬细胞在肝硬化-肝癌疾病进展中的功能。通过细胞通讯,伪时序分析等技术充分挖掘了肝硬化-肝癌疾病进展中巨噬细胞表型的变化,为以肝脏巨噬细胞为靶点预防肝硬化进展为肝癌的潜在策略提供了思路。健康肝脏-肝硬化肝脏-肝癌巨噬细胞演变过程存在对细菌免疫反应的持续下调,这可能与门脉高压造成的肠道菌群位移不断通过门静脉进入肝脏具有协同作用,促进了肝脏的慢性炎症以及肝硬化的进展。对于肝硬化患者,尽早地治疗门脉高压造成的肠漏并切断其与巨噬细胞免疫功能衰退的协同作用可能是重要的治疗策略。
作者贡献:任凌萱提出研究思路,设计研究方案,进行数据分析,绘图,撰写初稿;卢子琪负责数据收集、筛选,共同进行研究命题的提出、设计及论文书写;齐威提出研究思路,设计研究方案,负责论文起草;冯志杰提出研究思路,设计研究方案,负责最终版本修订,对论文负责。
本文无利益冲突。
参考文献
CHUNG B K,?GAARD J,REIMS H M,et al. Spatial transcriptomics identifies enriched gene expression and cell types in human liver fibrosis[J]. Hepatol Commun,2022,6(9):2538-2550. DOI:10.1002/hep4.2001.
KIM E,VIATOUR P. Hepatocellular carcinoma:old friends and new tricks[J]. Exp Mol Med,2020,52(12):1898-1907. DOI:10.1038/s12276-020-00527-1.
TACKE F,ZIMMERMANN H W. Macrophage heterogeneity in liver injury and fibrosis[J]. J Hepatol,2014,60(5):1090-1096. DOI:10.1016/j.jhep.2013.12.025.
RAMACHANDRAN P,DOBIE R,WILSON-KANAMORI J R,et al. Resolving the fibrotic niche of human liver cirrhosis at single-cell level[J]. Nature,2019,575(7783):512-518. DOI:10.1038/s41586-019-1631-3.
MARCELLIN P,KUTALA B K. Liver diseases:a major,neglected global public health problem requiring urgent actions and large-scale screening[J]. Liver Int,2018,38(Suppl 1):2-6. DOI:10.1111/liv.13682.
ANGULO P,KLEINER D E,DAM-LARSEN S,et al. Liver fibrosis,but no other histologic features,is associated with long-term outcomes of patients with nonalcoholic fatty liver disease[J]. Gastroenterology,2015,149(2):389-397.e10. DOI:10.1053/j.gastro.2015.04.043.
RAMACHANDRAN P,HENDERSON N C. Antifibrotics in chronic liver disease:tractable targets and translational challenges[J]. Lancet Gastroenterol Hepatol,2016,1(4):328-340. DOI:10.1016/S2468-1253(16)30110-8.
LIANG W C,FENG Z J,RAO S T,et al. Diarrhoea may be underestimated:a missing link in 2019 novel coronavirus[J]. Gut,2020,69(6):1141-1143. DOI:10.1136/gutjnl-2020-320832.
DICK S A,WONG A,HAMIDZADA H,et al. Three tissue resident macrophage subsets coexist across organs with conserved origins and life cycles[J]. Sci Immunol,2022,7(67):eabf7777. DOI:10.1126/sciimmunol.abf7777.
YAN J,ZHANG Y M,YU H R,et al. GPSM1 impairs metabolic homeostasis by controlling a pro-inflammatory pathway in macrophages[J]. Nat Commun,2022,13(1):7260. DOI:10.1038/s41467-022-34998-9.
GUILLIAMS M,BONNARDEL J,HAEST B,et al. Spatial proteogenomics reveals distinct and evolutionarily conserved hepatic macrophage niches[J]. Cell,2022,185(2):379-396.e38. DOI:10.1016/j.cell.2021.12.018.
AIZARANI N,SAVIANO A,SAGAR,et al. A human liver cell atlas reveals heterogeneity and epithelial progenitors[J]. Nature,2019,572(7768):199-204. DOI:10.1038/s41586-019-1373-2.
ASHBURNER M,BALL C A,BLAKE J A,et al. Gene ontology:tool for the unification of biology. The Gene Ontology Consortium[J]. Nat Genet,2000,25(1):25-29. DOI:10.1038/75556.
SCHAUER D,STARLINGER P,ZAJC P,et al. Monocytes with angiogenic potential are selectively induced by liver resection and accumulate near the site of liver regeneration[J]. BMC Immunol,2014,15:50. DOI:10.1186/s12865-014-0050-3.
RAMIREZ-PEDRAZA M,FERN?NDEZ M. Interplay between macrophages and angiogenesis:a double-edged sword in liver disease[J]. Front Immunol,2019,10:2882. DOI:10.3389/fimmu.2019.02882.
ALBILLOS A,MARTIN-MATEOS R,VAN DER MERWE S,et al. Cirrhosis-associated immune dysfunction[J]. Nat Rev Gastroenterol Hepatol,2022,19(2):112-134. DOI:10.1038/s41575-021-00520-7.
UNANUE E R. Antigen-presenting function of the macrophage[J]. Annu Rev Immunol,1984,2:395-428. DOI:10.1146/annurev.iy.02.040184.002143.
GEDGAUDAS R,BAJAJ J S,SKIECEVICIENE J,et al. Circulating microbiome in patients with portal hypertension[J]. Gut Microbes,2022,14(1):2029674. DOI:10.1080/19490976.2022.2029674.
SCHIERWAGEN R,ALVAREZ-SILVA C,MADSEN M S A,et al. Circulating microbiome in blood of different circulatory compartments[J]. Gut,2019,68(3):578-580. DOI:10.1136/gutjnl-2018-316227.
LI M H,LI K,TANG S H,et al. Restoration of the gut microbiota is associated with a decreased risk of hepatic encephalopathy after TIPS[J]. JHEP Rep,2022,4(5):100448. DOI:10.1016/j.jhepr.2022.100448.
GITTO S,VIZZUTTI F,BALDI S,et al. Transjugular intrahepatic Porto-systemic shunt positively influences the composition and metabolic functions of the gut microbiota in cirrhotic patients[J]. Dig Liver Dis,2023,55(5):622-628. DOI:10.1016/j.dld.2022.11.017.
(收稿日期:2023-10-13;修回日期:2024-01-03)
(本文编辑:贾萌萌)

