胃癌术后化疗患者消化道症状群核心症状及影响因素研究
邹炎铃 王晓庆 李洵 张紫嫣 李易 杨丽华 高娟 管慧芸 段培蓓

基金项目:江苏省中医药科技发展计划项目(ZD202005);2023年度南丁格尔专项课题(Y23017)
引用本文:邹炎铃,王晓庆,李洵,等. 胃癌术后化疗患者消化道症状群核心症状及影响因素研究[J]. 中国全科医学,2024,27(29):3641-3647. DOI:10.12114/j.issn.1007-9572.2023.0576. [www.chinagp.net]
ZOU Y L,WANG X Q,LI X,et al. Analysis of gastrointestinal core symptoms and influencing factors in postoperative chemotherapy patients with gastric cancer[J]. Chinese General Practice,2024,27(29):3641-3647.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
【摘要】 背景 胃癌术后化疗患者消化道症状多且相互作用,缺乏有效的干预靶点。近年来,网络分析成为研究识别干预靶点的热点。目的 构建胃癌术后患者化疗期间消化道症状网络,识别核心症状及分析核心症状的影响因素,为精准症状管理提供参考。方法 采用便利抽样法,选取2022年3—12月江苏省苏南、苏中和苏北的4所三级甲等中医院(江苏省中医院、苏州市中医院、无锡市中医院、徐州市中医院)肿瘤内外科病区的胃癌术后化疗患者作为研究对象。采用安德森症状测评量表胃癌特异性模块评估胃癌术后化疗患者消化道症状严重程度,评估患者的中医体质分类。通过R语言构建消化道症状网络,分析中心性指标;采用单因素分析及多元线性回归分析探讨胃癌术后化疗患者消化道核心症状的影响因素。结果 本研究共收集电子问卷362份,有效问卷355份,有效回收率为98.1%。胃癌术后化疗患者消化道症状中发生率排名前三的为食欲下降(83.1%)、味觉改变(81.7%)、恶心(71.0%),症状严重程度排名前三为食欲下降(2.77分)、味觉改变(2.50分)、恶心(2.27分)。网络分析显示,味觉改变的强度最大(rS=1.27),紧密中心性最高(rC=1.50);呕吐的中介中心性最大(rB=1.76)。多元线性回归分析结果显示,性别(B=0.809,95%CI=0.319~1.298)、吸烟史(B=0.706,95%CI=0.185~1.228)及痰湿质(B=1.703,95%CI=0.538~2.868)为胃癌术后化疗患者味觉改变症状严重程度得分的影响因素(P<0.05)。结论 味觉改变是胃癌术后化疗患者消化道症状群的核心症状,性别、吸烟史及痰湿质为患者味觉改变的影响因素。护理人员可基于核心症状及其影响因素制订干预措施,提高胃癌患者化疗期消化道症状管理效能。
【关键词】 胃肿瘤;化疗;核心症状;胃肠道;网络分析;味觉改变
【中图分类号】 R 735.2 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0576
Analysis of Gastrointestinal Core Symptoms and Influencing Factors in Postoperative Chemotherapy Patients with Gastric Cancer
ZOU Yanling1,2,WANG Xiaoqing2,LI Xun1,ZHANG Ziyan1,LI Yi1,YANG Lihua2,GAO Juan2,GUAN Huiyun2,DUAN Peibei3*
1.School of Nursing,Nanjing University of Chinese Medicine,Nanjing 210000,China
2.Affiliated Hospital of Nanjing University of Chinese Medicine,Nanjing 210000,China
3.Department of Nursing,Affiliated Hospital of Nanjing University of Chinese Medicine,Nanjing 210000,China
*Corresponding author:DUAN Peibei,Chief superintendent nurse;E-mail:yfy0033@njucm.edu.cn
【Abstract】 Background Gastrointestinal symptoms in gastric cancer patients treated with postoperative chemotherapy are diverse and interconnected,without effective intervention targets. In recent years,network analysis has emerged as a prominent approach to identify intervention targets. Objective To construct a network of gastrointestinal symptoms in gastric cancer patients treated with postoperative chemotherapy,identify core symptoms and analyze the factors influencing core symptoms,so as to provide a reference for precise symptom management. Methods Postoperative chemotherapy patients with gastric cancer were selected in the medical oncology and surgical oncology department of four tertiary A-level Chinese medicine hospitals(Jiangsu Provincial Hospital of Traditional Chinese Medicine,Suzhou Hospital of Traditional Chinese Medicine,Wuxi Hospital of Traditional Chinese Medicine,and Xuzhou Hospital of Traditional Chinese Medicine) in South,Central,and North of Jiangsu Province,from March to December 2022 via convenience sampling method,as the study subjects. The MD Anderson Symptom Inventory Gastrointestinal Cancer(MDASI-GI)was used for evaluating gastrointestinal symptoms and their severity among patients receiving postoperative chemotherapy for gastric cancer,as well as assessing the classification of traditional Chinese medicine constitution among patients. The network of gastrointestinal symptoms was constructed using an R package to identify the centrality indexes. The univariate analysis and multiple linear regression analysis were conducted to investigate factors influencing core gastrointestinal symptoms in patients undergoing postoperative chemotherapy for gastric cancer. Results A total of 362 electronic questionnaires were collected,355 were valid,with a valid recovery rate of 98.1%. The highest incidence of gastrointestinal symptoms in patients with postoperative chemotherapy for gastric cancer was lack of appetite(83.1%),taste alteration(81.7%)and nausea(71.0%),and the top three in terms of severity were lack of appetite(2.77 points),taste alteration(2.50 points)and nausea(2.27 points). Network analysis showed that taste alteration had the highest intensity(rS=1.27)and the highest tight centrality(rC=1.50);vomiting had the highest betweenness centrality(rB=1.76). The results of multiple linear regression analysis showed that gender(B=0.809,95%CI=0.319-1.298),smoking history(B=0.706,95%CI=0.185-1.228) and phlegm-damp constitution(B=1.703,95%CI=0.538-2.868) were the factors influencing the severity of taste alteration symptoms in patients with gastric cancer after chemotherapy(P<0.05). Conclusion Taste alteration is the core symptom of gastrointestinal symptoms in gastric cancer patients undergoing postoperative chemotherapy. Gender,smoking history,and phlegm-damp constitution are influential factors contributing to taste alteration. Nursing staff can develop intervention strategies based on these core symptoms and their influencing factors to enhance the efficacy of managing gastrointestinal symptoms during chemotherapy in gastric cancer patients.
【Key words】 Stomach neoplasms;Chemotherapy;Core symptoms;Gastrointestinal Tract;Network analysis,Taste alteration
胃癌是全球癌症相关死亡的第三大原因[1],目前主要采用手术与术后辅助化疗方式来治疗该疾病[2]。然而,手术治疗会改变患者的消化道生理结构,辅助化疗会进一步加重患者的消化道症状[3],从而严重影响其生活质量[4],甚至可能导致化疗中断,降低患者的远期生存率[5]。课题组前期已经识别了胃癌术后化疗患者常见的消化道症状群有恶心、呕吐、食欲下降等9个症状[6]。但群内症状较多、相互作用,缺乏干预靶点,导致干预精准度低,未体现症状群的干预优势[7]。近年来,基于机器学习技术的症状网络分析方法逐渐成为该领域研究的热点,该方法可以通过构建症状网络,通过定量分析网络中的中心性指标,识别核心症状,为临床症状管理提供干预靶点,达到有效管理症状群的效果[8]。本研究在课题组前期研究基础上,采用便利抽样的方法,通过网络分析,识别消化道症状群的核心症状,并探讨不同特征胃癌术后化疗患者核心症状的影响因素,为胃癌患者核心症状干预及个性化症状管理提供一定的参考。
1 对象与方法
1.1 调查对象
采用便利抽样法,选取2022年3—12月在江苏省苏南、苏中和苏北的4所三级甲等中医院(江苏省中医院、苏州市中医院、无锡市中医院、徐州市中医院)肿瘤内外科病区的胃癌术后化疗患者作为研究对象。纳入标准:(1)确诊为原发性胃癌的患者;(2)接受术后化疗;(3)年龄≥18周岁、意识清楚且能够正常交流与阅读;(4)知情同意、自愿参加。排除标准:(1)严重认知功能障碍或有精神疾病的患者;(2)合并严重心、脑等脏器功能障碍的患者;(3)不知病情者。由于所采用的量表包括9个症状,构建网络模型需要估计的阈值参数为9个,成对关联参数为36个[9×(9-1)/2)][9],总参数为45个。为保证模型的可靠性,每个参数按3~5例计算样本量[10],考虑20%的脱落率,所需样本量为169~282例,调查对象均知情同意,自愿参加。本研究通过南京中医药大学附属医院伦理委员会批准(2021NL-089-03),分中心单位遵照各自医院科技处安排,备案管理。
1.2 调查工具
1.2.1 一般资料调查表:通过医院科研数据采集及管理系统结构化问卷收集一般资料:性别、年龄、婚姻状况、居住地、文化程度、医疗支付方式、饮酒史(个体曾经有饮酒的行为,无论其当前是否已停止饮酒,在本研究中均为有饮酒史)、吸烟史(个体曾经有吸烟的行为,无论其现在是否已戒烟,均判定为有吸烟史)、肿瘤分期、化疗方案、中医体质。
1.2.2 安德森症状测评量表胃癌特异性模块(MDASI-GI):WANG等[11]在汉化版安德森症状评估量表13个核心症状的基础上[12],增加5种消化道肿瘤患者的特异性症状,共18个条目,用于评估胃肠道肿瘤患者症状的严重程度。该量表用于评估患者过去24 h的症状。具有良好的内部一致性信度0.84~0.90[13]。本研究遵循原始研究的指导,基于Likert 11级评分,分数越高表示受试者的症状越严重。
1.2.3 中医体质分类:本研究参考王琦院士提出的中医体质分类标准,该标准已被中华中医药学会认定为学会标准[14],该标准分为9种体质。先计算子量表的原始得分,原始分数为每个条目分值相加,再换算为转化分数,转化分数=(原始分-条目数)×100/(条目数×4)。转化分数越高,该体质类型倾向越明显。本研究中所有研究对象的中医体质类型由高年资主治医师进行判定。
1.3 资料收集方法
本研究涉及4个分中心,进行统一人员培训并结构化调查用语。每个分中心设立1个负责人进行分中心的质控。每个中心由4名调查员在化疗第2天向患者说明本研究的目的,取得患者的知情同意后开展调查,患者在医院数据收集平台进行填写。同时,项目组采用每周微信群反馈总结研究过程中发现的问题,及时分析,解决相关问题,并定期进行质量督查,以检查每个分中心的研究质量和规范性。最终数据从医院临床研究数据采集及管理系统中导出,经两名研究生共同整理,将18个症状整理成Excel表格,并将其中消化道症状群中的9个症状(恶心、食欲下降、口干、呕吐、便秘、腹泻、吞咽困难、味觉改变、饱胀感)数据提取。
1.4 统计学方法
本研究采用R软件中的qgraph包、bootnet包和ggplot2包,调用EBICglasso函数,基于Spearman秩相关性分析构建症状网络图,症状为节点,节点之间的连线为边,边越粗代表两种症状相关性越强。同时使用centralityPlot函数绘制图表,包括强度(Strength)、紧密中心性(Closeness)和中介中心性(Betweenness)指标,用来评估节点在网络中的重要性、接近度和作为桥梁症状的可能性。其中强度反映网络中节点的重要性,可以通过边的相关系数权重绝对值的总和来衡量,数值越大说明该症状对其他症状的影响越大,重要性越高。紧密中心性反映节点与其他节点的接近程度,可以通过计算两个节点之间距离和的倒数来测量,数值越大表明该症状与其他症状越接近,越有可能处于网络的中心。中介中心性指标可用于评估节点在网络中充当桥梁的可能性,并且可以通过计算节点在任何两个其他节点之间的最短路径上的次数来测量,数字越大表示该症状越有可能是桥梁症状[15]。使用corstability函数,进行bootstrap分析,计算稳定性。通过计算边权重值的95%置信区间(CI)评估估计网络连接的强度、接近度和中介度的稳定性。相关稳定系数最好>0.5,但至少应>0.25[16]。
本研究使用SPSS 25.0软件对胃癌术后化疗患者消化道症状发生率、严重程度及核心症状的相关影响因素进行分析。计数资料以相对数表示。由于胃癌消化道症状群内症状严重程度得分不符合正态分布,使用M(P25,P75)表示,均数作为辅助评价工具。对于核心症状的影响因素,符合正态分布的计量资料以(x-±s)表示,两组间比较采用t检验,多组间比较采用方差分析;非正态分布的计量资料以M(P25,P75)表示,多组间比较采用秩和检验。采用多元线性回归分析探讨核心症状的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 调查对象的一般资料
本研究共收集电子问卷362份,因问卷填写不完整剔除7份,本研究共收集问卷355份,其中,问卷有效率为98.1%。男265例(74.6%),女90例(25.4%);年龄28~82岁,平均年龄(61.0±10.4)岁;已婚343例(96.6%);医保支付333例(93.8%);城市人口219例(61.7%);学历初中及以下212例(59.7%);肿瘤分期Ⅲ期193例(54.4%);偏颇体质341例(96.0%)。
2.2 消化道症状的发生率和严重程度分析
胃癌术后化疗患者消化道症状中发生率排名前三的为食欲下降(83.1%)、味觉改变(81.7%)、恶心(71.0%),症状严重程度排名前三为食欲下降、味觉改变、恶心。具体见表1。
表1 胃癌术后化疗患者消化道症状群内症状发生率、严重程度(n=355)
Table 1 Incidence and severity of core gastrointestinal symptoms in postoperative chemotherapy patients with gastric cancer
项目 发生率
[例(%)] MDASI-GI评分(分)
M(P25,P75) (x-±s)
恶心 252(71.0) 2(0,3) 2.27±2.21
食欲下降 295(83.1) 2(1,4) 2.77±2.22
口干 208(58.6) 1(0,3) 1.57±1.81
呕吐 208(58.6) 1(0,3) 1.95±2.37
便秘 150(42.3) 0(0,2) 1.19±1.79
腹泻 149(42.0) 0(0,2) 1.07±1.59
吞咽困难 82(23.1) 0(0,0) 0.57±1.29
味觉改变 290(81.7) 2(1,3) 2.50±2.06
饱胀感 232(65.4) 2(0,3) 1.79±1.87
注:MDASI-GI=安德森症状测评量表胃癌特异性模块。
2.3 胃癌术后化疗患者消化道症状的网络分析
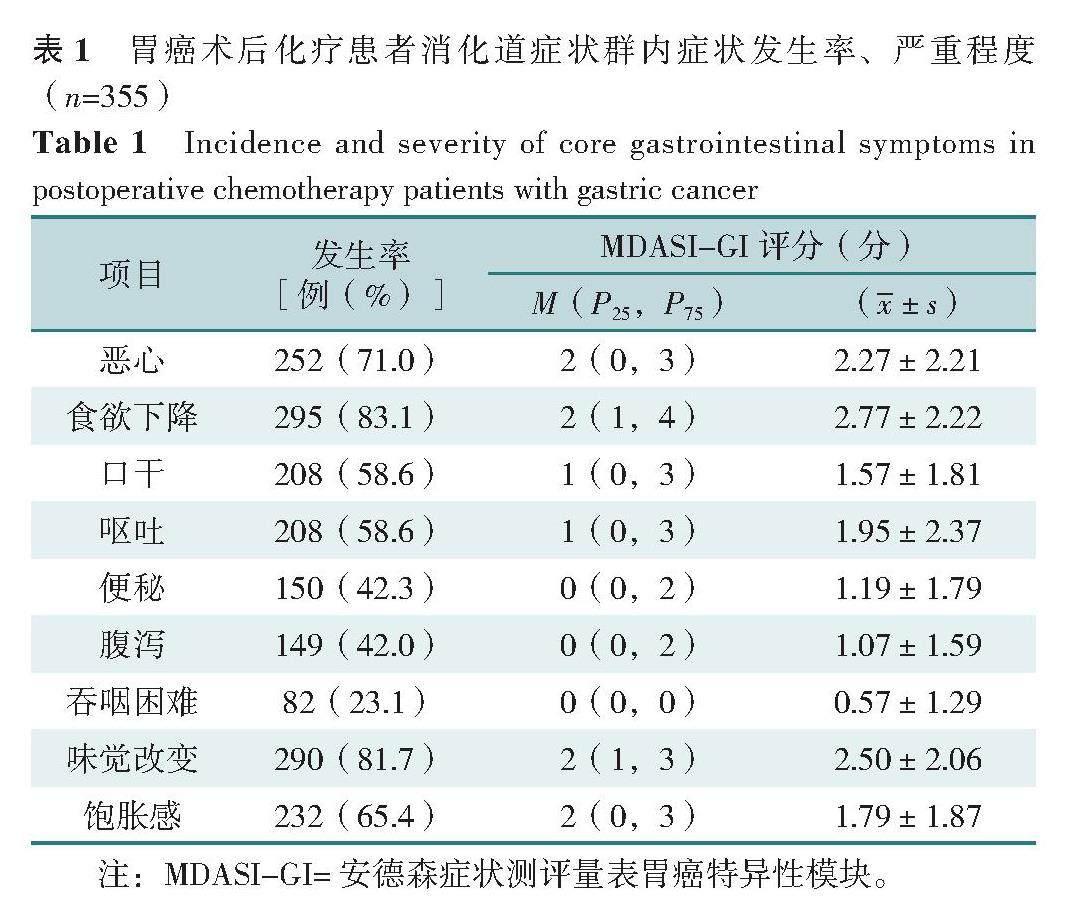
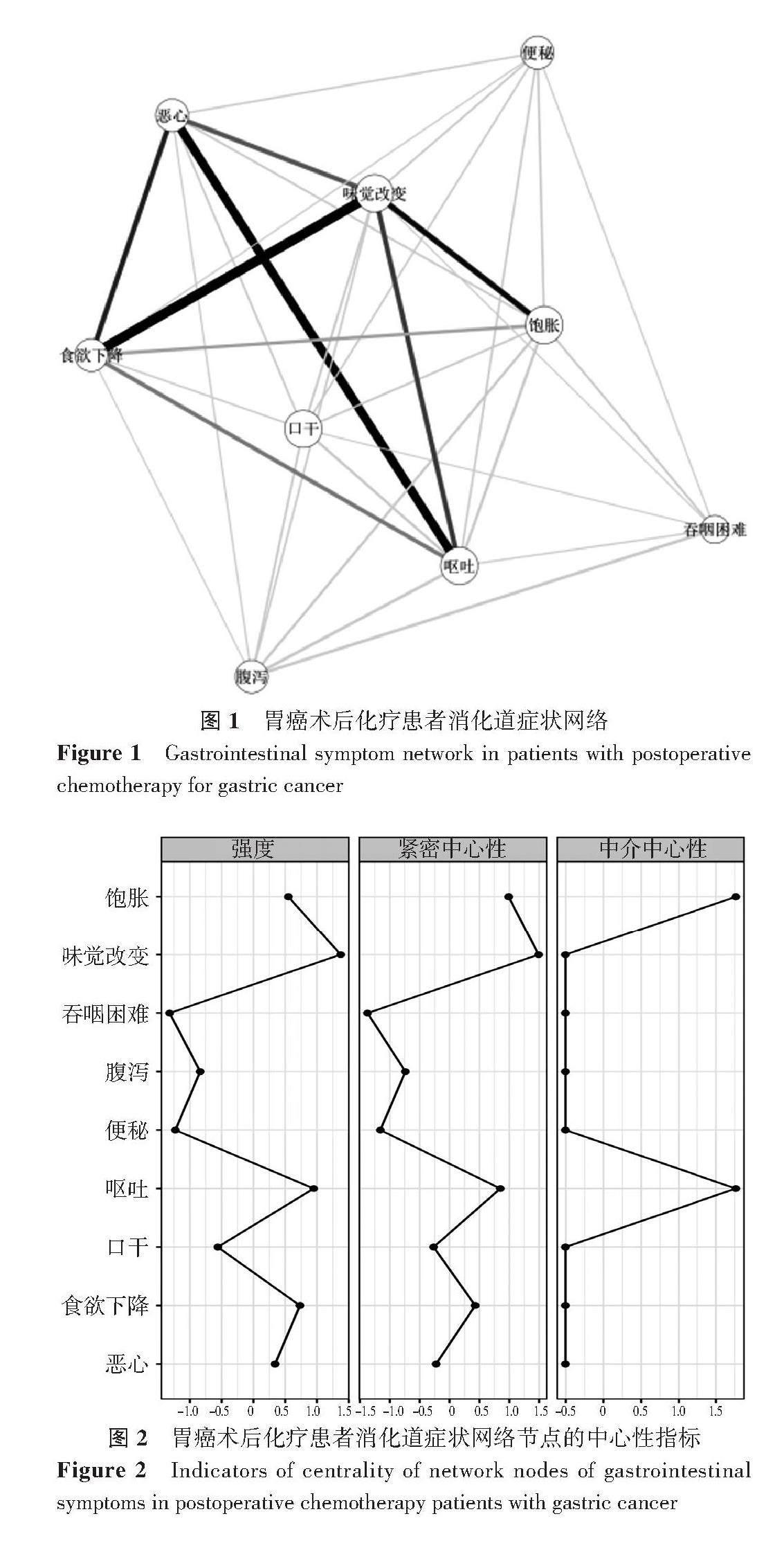
根据症状网络中边的粗细,症状间相关性较强的前3对症状对分别为:味觉改变-食欲下降(r=0.80)、恶心-呕吐(r=0.76)、味觉改变-饱胀(r=0.60),见图1。根据中心性指标,强度前3的症状为:味觉改变(rS=1.27)、呕吐(rS=0.95)和食欲下降(rS=0.74);紧密中心性前3的症状为:味觉改变(rC=1.50)、呕吐(rC=0.65)和食欲下降(rC=0.48);中介中心性前2的症状为:呕吐(rB=1.76)、饱胀(rB=1.76),见图2。进一步检测症状网络的稳定性,强度、紧密中心性和中介中心性的相关稳定系数分别为0.825、0.672、0.668,表明强度和紧密中心性指标的稳定性较好,中介中心性指标的稳定性最差。故本研究选择强度和紧密中心性指标作为核心症状的主要判定指标[17]。
2.4 胃癌术后化疗患者味觉改变影响因素的单因素分析结果
不同年龄、婚姻状况、居住地、文化程度、医疗支付方式、饮酒史、肿瘤分期、化疗方案组别胃癌术后化疗患者味觉改变评分比较,差异均无统计学意义(P>0.05);不同性别、吸烟史、中医体质的胃癌术后化疗患者味觉改变评分比较,差异均有统计学意义(P<0.05),见表2。
2.5 胃癌术后患者化疗期间味觉改变影响因素的多因素分析
分别以单因素分析中差异有统计学意义的变量为自变量,以化疗期味觉改变症状评分为因变量进行多元线性回归分析,结果显示,性别、吸烟史及痰湿质为胃癌术后化疗患者味觉改变症状严重程度得分的影响因素(P<0.05),见表3。
表3 胃癌术后化疗患者味觉改变症状影响因素的多元线性回归分析
Table 3 Multivariable linear regression analysis of the factors affecting taste alteration in postoperative chemotherapy patients with gastric cancer
自变量 B(95%CI) SE β t值 P值
性别 0.809(0.319~1.298) 0.249 0.171 3.248 0.001
吸烟史 0.706(0.185~1.228) 0.265 0.141 2.665 0.008
痰湿质 1.703(0.538~2.868) 0.592 0.267 2.874 0.004
注:R2=0.160,调整R2=0.136;F=6.551,P<0.001。自变量赋值:男=1,女=2;无吸烟史=0,有吸烟史=1;中医体质类型:以平和质为参照设置哑变量,气虚质(0,1,0,0,0,0,0,0,0),阳虚质(0,0,1,0,0,0,0,0,0),阴虚质(0,0,0,1,0,0,0,0,0),痰湿质(0,0,0,0,1,0,0,0,0),湿热质(0,0,0,0,0,1,0,0,0),瘀血质(0,0,0,0,0,0,1,0,0),气郁质(0,0,0,0,0,0,0,1,0),特禀质(0,0,0,0,0,0,0,0,1)。
3 讨论
3.1 味觉改变是消化道症状中强度和紧密度最高的症状,是消化道症状群中的核心症状
本研究结果显示,在症状网络分析中,味觉改变的强度与紧密中心性最大,处于中心位置(rC=1.50、rS=1.27),味觉改变与其他症状密切相关且具有最强的影响力,是消化道症状中的核心症状。味觉改变是一种味觉的失真或反常,会对患者的营养摄入造成负面影响[18-19]。有研究显示,味觉改变发生率高达66%~93%,是化疗期内常见的症状之一[20]。原因分析为化疗药物直接或间接杀死快速增殖的味蕾细胞,加剧了患者的味觉改变[21]。有研究显示铂类是易引起味觉改变的化疗方案[19],此药物为本研究中的常用化疗方案用药。WEI等[22]发现,味觉改变是胃癌术后化疗期间神经毒性症状群的核心症状。HAN等[23]在持续3周的纵向研究中发现,味觉改变是胃肠道肿瘤患者化疗症状群中稳定存在的症状,是化疗症状群的核心症状。UKOVIC等[24]发现,味觉与癌症患者预后改善相对应。由此可见味觉改变会对患者的生理、心理健康造成一定的影响。因此医护人员一方面要重视味觉改变在消化道症状网络中的作用,加强医护人员的知识培训,及时评估患者的症状变化,同时鼓励患者主动报告,指导患者进行自我饮食管理[25]、情绪调节[26]等可改善患者胃口的措施,并跟踪患者症状管理效果,及时反馈,循证完善症状管理体系;另一方面,需要进一步开展对胃癌术后患者味觉改变核心作用的研究,探索其发生机制及与血液等客观指标的关联,以提升胃癌症状管理干预的效率和精确性。
本研究发现,食欲下降在胃癌患者中最为常见且严重,与味觉改变密切相关。食欲下降是发生率、严重程度最高的症状,与王旭[27]、RHA等[28]、PAPACHRISTOU等[15]、王潇[6]研究结果一致,可能是手术应激或化疗药物刺激所致,导致神经递质和炎性递质分泌异常,胃肠道黏膜损伤引起。食欲下降与味觉改变关联度(r=0.80)最强,是消化道症状群内关联度最紧密的症状对,与朱宇等[29]、张莉[30]研究结果一致。可能是由于味觉改变会影响患者饮食行为和情绪状态,导致食欲下降,营养不良,电解质失调,甚至会阻碍进一步治疗,严重威胁患者的健康[31-32]。护理人员应关注化疗患者的食欲变化,关注患者的饮食行为,积极探索个性化干预策略;同时对化疗间歇期居家患者加强电话随访,以提高患者自我管理效能。
3.2 胃癌术后患者化疗期间味觉改变的影响因素分析
3.2.1 性别:本研究发现,女性患者术后化疗期间味觉改变症状的严重程度高于男性患者,为味觉改变的高危人群。本研究与BARAJAS GALINDO等[33]、MCGREEVY等[34]研究一致,这可能与男女体内性激素水平差异相关,从而导致患者的味觉、嗅觉等感觉功能下降。有研究显示女性的黏液样味蕾和味孔比男性多,因此味觉敏感度更高[35];也有可能是女性患病后的心理负担比男性更重,焦虑和抑郁在女性中更常见,而味觉改变和焦虑、抑郁密切相关[36]。因此,关注女性患者的心理状态在护理过程中至关重要。通过指导家属和朋友与患者进行交流,提供同伴支持,共同进餐等方法,可以增加患者的归属感和心理支持。除了关注女性患者心理状态外,医护人员也需要关注女性患者的社会角色转变、不同文化背景对治疗的影响。
3.2.2 吸烟:本研究显示,吸烟的胃癌化疗患者味觉改变症状更严重,提示胃癌患者化疗期间应戒烟。本研究与VENNEMANN等[37]、KAIZU等[38]、YOSHIMOTO等[39]研究一致,可能的原因是烟草内容物可能会损害嗅觉与味觉细胞,从而干扰味觉和嗅觉。此外,吸烟会恶化口腔卫生,甚至导致牙周炎等口腔疾病,限制患者的饮食摄入,从而导致患者营养不良的风险增加。根据《“健康中国2030”规划纲要》[40]提出的戒烟措施,医护人员要深入开展戒烟宣传教育,向胃癌化疗患者强调吸烟的危害,并提供相关的戒烟信息和支持,增强患者戒烟意识和决心;积极推进无烟医院环境建设,在病区张贴“请勿吸烟”醒目警示标识是有效措施之一,可以提醒患者和访客遵守无烟规定;医院积极开展戒烟门诊创建工作,比如成立戒烟支持小组、提供电话咨询服务、实施戒烟奖励计划等,提高患者戒烟成功率。
3.2.3 痰湿质:本研究显示,相较于平和质,痰湿质的胃癌化疗患者味觉改变更严重,痰湿质是味觉改变的高危偏颇体质。痰湿质是指因水液内停而导致的痰湿凝结,有舌苔厚腻、呕吐清水痰涎的表现[41-42]。许鹏[43]发现在胃癌患者化疗期间痰湿质所占偏颇体质比例最多约为24%,且痰湿质在口腔黏膜炎、恶心呕吐等胃肠道症状的表现,呈现出高于其他症状的显著特征;张佩等[44]发现痰湿质是胃癌患者化疗后存在的主要偏频体质之一,对患者预后有一定影响。王琦[41]提出“体病相关”“体质可调”的理论,提出体质是预测疾病发展、预后的重要依据。随着“未病先防、既病防变”的中医思想深入,国家卫健委在《健康中国行动(2019—2030年)》中提出下一步目标是完善肿瘤防治体系,推动肿瘤防控关口前移[45]。有研究发现尽早介入中医药治疗能缓解胃癌患者化疗期间味觉改变等不良反应[46]。提示医护人员需尽早评估患者的体质,对痰湿质的患者开展积极的体质干预,如穴位按摩[47]、耳穴压豆[48]等中医操作来改善体质弱势,阻断体质因素对味觉改变的不利影响,使机体处于并保持健康的状态,达到“正气存内,邪不可干”的目的。
4 小结
本研究主要采用症状网络分析的方法,构建胃癌术后化疗患者的消化道症状网络,发现味觉改变处于最核心的位置,强度及紧密连接度均较强,但是现有研究关注度不够。性别、吸烟、痰湿质是味觉改变的影响因素,因此,肿瘤科医护人员应早期识别介入化疗期间味觉改变的高危患者,通过精准管理,预防介入化疗期间味觉改变的发生。由于本研究为横断面调查,未来仍需要根据胃癌患者的化疗周期进行纵向研究。
作者贡献:邹炎铃、段培蓓负责文章构思与整体框架设计;邹炎铃、李洵、张紫嫣、李易负责数据收集、整理和录入;邹炎铃、王晓庆、杨丽华、高娟负责结果的分析与解释;邹炎铃、管慧芸负责英文的修订;王晓庆、杨丽华、段培蓓负责论文的修订;段培蓓负责文章的质量控制及审校,并对文章整体负责,监督管理。
本文无利益冲突。
参考文献
AJANI J A,D'AMICO T A,BENTREM D J,et al. Gastric cancer,version 2.2022,NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw,2022,20(2):167-192. DOI:10.6004/jnccn.2022.0008.
ZHANG Q Q,QIAN Y,YIN Y. Comparison of S-1-based vs. capecitabine-based adjuvant chemotherapy for patients with gastric cancer:a systematic review and meta-analysis[J]. Eur J Clin Pharmacol,2021,77(12):1791-1804. DOI:10.1007/s00228-021-03187-w.
HOSHI H. Management of gastric adenocarcinoma for general surgeons[J]. Surg Clin North Am,2020,100(3):523-534. DOI:10.1016/j.suc.2020.02.004.
MIASKOWSKI C,BARSEVICK A,BERGER A,et al. Advancing symptom science through symptom cluster research:expert panel proceedings and recommendations[J]. J Natl Cancer Inst,2017,109(4):djw253. DOI:10.1093/jnci/djw253.
常雪松,朱燕娟,彭建军,等. 针刺改善胃癌术后辅助化疗期间患者症状负荷疗效观察[J]. 中国针灸,2022,42(11):1226-1232. DOI:10.13703/j.0255-2930.20211106-k0004.
王潇. 胃癌术后化疗患者症状群及其亚组识别的纵向研究[D]. 南京:南京中医药大学,2019.
夏超,段培蓓,杨玲,等. 166例胃癌术后化疗患者症状群内前哨症状的调查[J]. 护理学报,2021,28(8):44-49. DOI:10.16460/j.issn1008-9969.2021.08.044.
杨中方,朱政,胡雁,等. 症状网络在症状管理中的应用进展[J]. 护理学杂志,2022,37(5):91-94. DOI:10.3870/j.issn.1001-4152.2022.05.091.
EPSKAMP S,BORSBOOM D,FRIED E I. Estimating psychological networks and their accuracy:a tutorial paper[J]. Behav Res Methods,2018,50(1):195-212. DOI:10.3758/s13428-017-0862-1.
毛毳,李媛媛,张云雪,等. 护理专业大学生述情障碍与认知情绪调节策略的关系:网络分析模型[J]. 中国临床心理学杂志,2021,29(4):753-757. DOI:10.16128/j.cnki.1005-3611.2021.04.018.
WANG X S,WILLIAMS L A,ENG C,et al. Validation and application of a module of the M. D. Anderson Symptom Inventory for measuring multiple symptoms in patients with gastrointestinal cancer(the MDASI-GI)[J]. Cancer,2010,116(8):2053-2063. DOI:10.1002/cncr.24920.
CLEELAND C S,MENDOZA T R,WANG X S,et al. Assessing symptom distress in cancer patients:the M.D. Anderson Symptom Inventory[J]. Cancer,2000,89(7):1634-1646. DOI:10.1002/1097-0142(20001001)89:7<1634:aid-cncr29>3.0.co;2-v.
WANG X S,WANG Y,GUO H,et al. Chinese version of the M. D. Anderson Symptom Inventory:validation and application of symptom measurement in cancer patients[J]. Cancer,2004,
101(8):1890-1901. DOI:10.1002/cncr.20448.
北京中医药大学. 中医体质分类与判定[S]. 中华中医药学会,2009.
PAPACHRISTOU N,BARNAGHI P,COOPER B,et al. Network analysis of the multidimensional symptom experience of oncology[J]. Sci Rep,2019,9(1):2258. DOI:10.1038/s41598-018-36973-1.
ZHU Z,SUN Y L,KUANG Y,et al. Contemporaneous symptom networks of multidimensional symptom experiences in cancer survivors:a network analysis[J]. Cancer Med,2023,12(1):663-673. DOI:10.1002/cam4.4904.
叶艳欣,秦岚,曾凯,等. 癌症患者治疗间歇期核心症状及症状群的识别[J]. 护理学杂志,2022,37(1):20-24. DOI:10.3870/j.issn.1001-4152.2022.01.020.
张丽燕,国仁秀,梁亚茹,等. 消化道肿瘤患者化疗相关性味觉改变及对营养和生活质量的影响[J]. 护理学杂志,2019,34(21):80-82. DOI:10.3870/j.issn.1001-4152.2019.21.080.
张婷婷,张丽燕. 肿瘤患者化疗相关性味觉改变干预的研究进展[J]. 护理学杂志,2020,35(12):99-102. DOI:10.3870/j.issn.1001-4152.2020.12.099.
CAMPAGNA S,GONELLA S,SPERLINGA R,et al. Prevalence,severity,and self-reported characteristics of taste alterations in patients receiving chemotherapy[J]. Oncol Nurs Forum,2018,45(3):342-353. DOI:10.1188/18.ONF.342-353.
LARSEN A K,THOMSEN C,SANDEN M,et al. Taste alterations and oral discomfort in patients receiving chemotherapy[J]. Support Care Cancer,2021,29(12):7431-7439. DOI:10.1007/s00520-021-06316-4.
WEI L Z,LV F,LUO C F,et al. Study on sentinel symptoms and influencing factors of postoperative chemotherapy in patients with gastric cancer[J]. Eur J Oncol Nurs,2023,64:102318. DOI:10.1016/j.ejon.2023.102318.
HAN C J,REDING K,COOPER B A,et al. Stability of symptom clusters in patients with gastrointestinal cancers receiving chemotherapy[J]. J Pain Symptom Manage,2019,58(6):989-1001.e10. DOI:10.1016/j.jpainsymman.2019.07.029.
UKOVIC B,PORTER J. Nutrition interventions to improve the appetite of adults undergoing cancer treatment:a systematic review[J]. Support Care Cancer,2020,28(10):4575-4583. DOI:10.1007/s00520-020-05475-0.
SPENCER A S,DA SILVA DIAS D,CAPELAS M L,et al. Managing severe dysgeusia and dysosmia in lung cancer patients:a systematic scoping review[J]. Front Oncol,2021,11:774081. DOI:10.3389/fonc.2021.774081.
ZHAO C X,LAI L Z,ZHANG L,et al. The effects of acceptance and commitment therapy on the psychological and physical outcomes among cancer patients:a meta-analysis with trial sequential analysis[J]. J Psychosom Res,2021,140:110304. DOI:10.1016/j.jpsychores.2020.110304.
王旭. 胃癌术后患者症状群及其影响因素的研究[D]. 唐山:华北理工大学,2018.
RHA S Y,LEE J. Stable symptom clusters and evolving symptom networks in relation to chemotherapy cycles[J]. J Pain Symptom Manage,2021,61(3):544-554. DOI:10.1016/j.jpainsymman.2020.08.008.
朱宇,王维利,周利华,等. 胃肠道肿瘤患者术后一周内症状群的调查研究[J]. 中国全科医学,2015,18(21):2568-2572. DOI:10.3969/j.issn.1007-9572.2015.21.016.
张莉. 足反射疗法联合音乐疗法对胃癌术后患者症状群及生活质量的影响[D]. 呼和浩特:内蒙古医科大学,2020.
PELLEGRINI M,MERLO F D,AGNELLO E,et al. Dysgeusia in patients with breast cancer treated with chemotherapy-a narrative review[J]. Nutrients,2023,15(1):226. DOI:10.3390/nu15010226.
DE KRUIF A J,WESTERMAN M J,WINKELS R M,et al. Exploring changes in dietary intake,physical activity and body weight during chemotherapy in women with breast cancer:a mixed-methods study[J]. J Hum Nutr Diet,2021,34(3):550-561. DOI:10.1111/jhn.12843.
BARAJAS GALINDO D E,VIDAL-CASARIEGO A,CALLEJA-FERN?NDEZ A,et al. Appetite disorders in cancer patients:impact on nutritional status and quality of life[J]. Appetite,2017,114:23-27. DOI:10.1016/j.appet.2017.03.020.
MCGREEVY J,ORREVALL Y,BELQAID K,et al. Characteristics of taste and smell alterations reported by patients after starting treatment for lung cancer[J]. Support Care Cancer,2014,22(10):2635-2644. DOI:10.1007/s00520-014-2215-2.
DE VRIES Y C,HELMICH E,KARSTEN M D,et al. The impact of chemosensory and food-related changes in patients with advanced oesophagogastric cancer treated with capecitabine and oxaliplatin:a qualitative study[J]. Support Care Cancer,2016,24(7):3119-3126. DOI:10.1007/s00520-016-3128-z.
CHENG H T,HO M C,HUNG K Y. Affective and cognitive rather than somatic symptoms of depression predict 3-year mortality in patients on chronic hemodialysis[J]. Sci Rep,2018,8(1):5868. DOI:10.1038/s41598-018-24267-5.
VENNEMANN M M,HUMMEL T,BERGER K. The association between smoking and smell and taste impairment in the general population[J]. J Neurol,2008,255(8):1121-1126. DOI:10.1007/s00415-008-0807-9.
KAIZU M,KOMATSU H,YAMAUCHI H,et al. Characteristics of taste alterations in people receiving taxane-based chemotherapy and their association with appetite,weight,and quality of life[J]. Support Care Cancer,2021,29(9):5103-5114. DOI:10.1007/s00520-021-06066-3.
YOSHIMOTO N,INAGAKI M,SEKIGUCHI Y,et al. Chemotherapy alters subjective senses of taste and smell but not dietary patterns in Japanese lung cancer patients[J]. Support Care Cancer,2020,28(4):1667-1674. DOI:10.1007/s00520-019-04958-z.
新华社. 中共中央 国务院印发《“健康中国2030”规划纲要》[J]. 中华人民共和国国务院公报,2016,62(32):5-20.
王琦. 前言——中医体质学的科学范式及基础与应用的原创性研究:首届国际体质医学论坛——中华中医药学会第十次全国中医体质学术年会[C]. 北京,2012.
王皓月. 基于数据分析的胃癌患者中医证素分布及证型研究[D]. 济南:山东中医药大学,2022.
许鹏. 胃癌化疗毒性与中医体质之间关系[J]. 吉林中医药,2018,38(6):648-651. DOI:10.13463/j.cnki.jlzyy.2018.06.008.
张佩,余明红,何丽波,等. 胃癌化疗患者中医体质分型与化疗期间感染和免疫功能及胃肠道菌群的关系[J]. 中华医院感染学杂志,2023,33(3):386-390.
健康中国行动(2019—2030年)[J]. 中国数字医学,2019,14(11):17.
南晓红,王晞星. 王晞星教授辨治化疗毒副反应经验[J]. 中国继续医学教育,2015,7(18):200-201.
谢燕芬,陈银崧,吴静文. 中药热奄包联合穴位按摩治疗脾虚痰湿证肿瘤化疗所致恶心呕吐临床观察[J]. 中国中医药现代远程教育,2020,18(24):103-105. DOI:10.3969/j.issn.1672-2779.2020.24.042.
李岩,高惠贤,吴涛涛,等. 基于CiteSpace的国内痰湿体质知识图谱可视化分析[J]. 世界中医药,2023,18(8):1152-1159. DOI:10.3969/j.issn.1673-7202.2023.08.016.
(收稿日期:2023-07-14;修回日期:2023-11-04)
(本文编辑:贾萌萌)

