中国汉族成年人群单不饱和脂肪酸摄入量与非酒精性脂肪性肝病风险关系的回顾性病例对照研究
付伟 程国彬 吕麟亚 丁瑶 王瑶 赵俊龙
基金项目:国家自然科学基金面上项目(82173082,82373270);中国博士后科学基金(2021M639344);中国博士后(站中)特别资助(2022T150792);联勤保障部队第925医院院内课题(No.2023[3],No.2022[3],No.2022[4])
引用本文:付伟,程国彬,吕麟亚,等. 中国汉族成年人群单不饱和脂肪酸摄入量与非酒精性脂肪性肝病风险关系的回顾性病例对照研究[J]. 中国全科医学,2024,27(29):3623-3628. DOI:10.12114/j.issn.1007-9572.2024.0147. [www.chinagp.net]
FU W,CHENG G B,LYU L Y,et al. Association of monounsaturated fatty acid intake with nonalcoholic fatty liver disease risk in Chinese Han adults:a retrospective case-control study[J]. Chinese General Practice,2024,27(29):3623-3628.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
【摘要】 背景 尽管单不饱和脂肪酸(MUFA)摄入与非酒精性脂肪性肝病(NAFLD)的关联已受到关注,但在中国人群中的研究较少。目的 探讨中国人群MUFA每日摄入量与NAFLD发病率之间的关联,并确定MUFA摄入量对NAFLD风险的潜在阈值。方法 本研究数据从Dryad数据库获取并严格遵守Dryad的服务条款(https://doi.org/10.5061/dryad.8nn2j46)。选取2015年4月—2017年8月在福建医科大学附属南平第一医院治疗的534例NAFLD患者作为病例组,选取同期534例体检健康者作为对照组。使用半定量食物频率问卷(SQFFQ)收集参与者的典型食物消费信息,并计算MUFA每日摄入量。采用综合分析策略,包括基线特征、多变量统计、非线性关系及亚组探究,探讨MUFA每日摄入量与NAFLD发病率的关联,同时考虑多种混杂因素如年龄、性别、生活方式和其他饮食成分,以确定MUFA对NAFLD风险的潜在阈值。结果 在调整模型中,MUFA每日摄入量是NAFLD风险的影响因素(OR=1.04,95%CI=1.02~1.07,P<0.001)。将MUFA每日摄入量转换为分类变量后,在调整模型中,随着MUFA每日摄入量的增加,NAFLD风险呈增加趋势(P趋势<0.001)。非线性分析表明,当MUFA每日摄入量达到39.04 g/d时,其与NAFLD风险的关系发生显著变化(P=0.045)。MUFA每日摄入量<39.04 g/d时,NFALD风险为1.08(95%CI=1.04~1.11,P<0.001)。亚组分析结果显示,性别、年龄、能量每日摄入量与NAFLD风险间存在交互作用(P交互<0.05)。结论 增加MUFA每日摄入量与较高的NAFLD风险相关,并在特定阈值(39.04 g/d)后呈现非线性关系。这一发现强调了在NAFLD管理中考虑饮食脂肪的质量和数量的重要性。
【关键词】 非酒精性脂肪性肝病;单不饱和脂肪酸;饮食脂肪;风险因素;非线性关系
【中图分类号】 R 575.5 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2024.0147
Association of Monounsaturated Fatty Acid Intake with Nonalcoholic Fatty Liver Disease Risk in Chinese Han Adults:a Retrospective Case-control Study
FU Wei1,CHENG Guobin1,LYU Linya1,DING Yao1,WANG Yao1,ZHAO Junlong2*
1.Department of Gastroenterology,925th Hospital of PLA Joint Logistics Support Force,Guiyang 550009,China
2.Department of Medical Genetics and Developmental Biology,School of Basic Medicine,Fourth Military Medical University,Xi'an 710032,China
*Corresponding author:ZHAO Junlong,Associate professor;E-mail:bio_junlongzhao@163.com
【Abstract】 Background While the connection between monounsaturated fatty acid(MUFA) intake and non-alcoholic fatty liver disease(NAFLD) has received attention,research in Chinese populations remains scarce. Objective This study aims to evaluate the association between daily MUFA intake and the prevalence of NAFLD in a Chinese population and to estimate the probable threshold of MUFA intake for NAFLD risk. Methods This case-control study employed data from the Dryad database(https://doi.org/10.5061/dryad.8nn2j46),complying with Dryad's terms of service. We collected data from 534 NAFLD patients and 534 healthy controls who underwent medical tests at the First Hospital of Nanping Affiliated to Fujian Medical University between April 2015 and August 2017. A semi-quantitative food frequency questionnaire(SQFFQ) was used to collect individuals' typical food consumption information,and daily MUFA intake was computed. A thorough analytical technique,including baseline characteristics,multivariate statistics,non-linear relationship analysis,and subgroup research,was applied to study the correlation between daily MUFA intake and NAFLD prevalence. Multiple confounding factors,such as age,sex,lifestyle,and other dietary components,were evaluated to estimate the theoretical threshold of MUFA intake for NAFLD risk. Results In the adjusted model,daily MUFA intake was a significant risk factor for NAFLD(OR=1.04,95%CI=1.02-1.07,P<0.001). After transforming daily MUFA intake into a categorical variable,the adjusted model demonstrated an increased trend of NAFLD risk with increasing daily MUFA intake(Ptrend<0.001). At 39.04 g/d,non-linear analysis revealed a significant change in the relationship between daily MUFA intake and NAFLD risk. When daily MUFA intake was <39.04 g/d,the risk of NAFLD was 1.08(95%CI=1.04-1.11,P<0.001). Subgroup analysis revealed significant interactions between sex,age,daily engery intake,and NAFLD risk(Pinteraction<0.05). Conclusion Increased daily MUFA intake was related to a greater risk of NAFLD,demonstrating a non-linear relationship after a certain threshold(39.04 g/d). This finding shows the need for evaluating both the quality and quantity of dietary fat in NAFLD management.
【Key words】 Non-alcoholic fatty liver disease;Monounsaturated fatty acids;Dietary fat;Risk factors;Nonlinear relationship
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是全球性的重大健康问题,有约25%的成年人患病,且在各大洲有很高的发病率[1-2]。在过去的20年,中国的NAFLD患病率倍增,特别是在城市居民中,患病率高达27%[3]。据预测,到2030年,中国NAFLD患者人数将达到3.14亿[4]。尽管NAFLD如此普遍,但患者和保健医生对其的了解和认识却不足[5-6]。即使在NAFLD同样高发的美国,成年患者对肝病的了解也很差[6]。研究证实,向心性肥胖、饱和脂肪和果糖摄入过多、2型糖尿病、阻塞性睡眠呼吸暂停、肠道菌群失调和肌肉减少症与NAFLD的发生有关[7]。中国人群的生活方式、饮食习惯以及遗传特征,可能在NAFLD的形成机制和风险因素方面产生不同的影响。
脂肪酸对维持人体健康具有不可或缺的作用,不仅为人体提供必要的能量,还在细胞信号转导中发挥重要的调控作用,影响细胞的增殖与存活[8-9]。按照化学结构,脂肪酸主要分为饱和脂肪酸(saturated fatty acid,SFA)、单不饱和脂肪酸(monounsaturated fatty acids,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)[10-11]。在众多脂肪酸中,MUFA因其独特的化学特性而备受关注。油酸作为MUFA的代表,在调节血脂和降低血胆固醇方面效果显著,显示出其在心血管健康维护方面的巨大潜力[12]。此外,油酸还能通过影响免疫细胞的功能来增强免疫反应,进一步凸显其在维护整体健康中的重要作用[13]。大量研究一致表明,MUFA和PUFA对预防心血管疾病具有显著益处[14-16]。值得注意的是,MUFA不仅具有抗炎作用,而且摄入高比例的MUFA饮食还有助于预防心血管、动脉粥样硬化和血栓形成等疾病[17]。有研究表明,MUFA可能通过特定的生化途径减少肝脏脂肪变性,从而预防NAFLD的发展[18-19]。关于MUFA与NAFLD之间的临床研究目前相对较少,本研究旨在深入探讨总MUFA摄入量与NAFLD风险之间是否存在独立关联,并努力寻找MUFA摄入量的阈值,以更准确地揭示两者之间的关联,期望为改善中国人的膳食结构和营养指导提供科学依据,为NAFLD的预防和治疗提供新的视角和策略。
1 对象与方法
1.1 研究对象
本研究数据从Dryad数据库获取并严格遵守了Dryad的服务条款(https://doi.org/10.5061/dryad.8nn2j46)。选取2015年4月—2017年8月在福建医科大学附属南平第一医院治疗的534例NAFLD患者作为病例组,选取同期534例体检中心体检健康者作为对照组[对照组纳入标准与病例组相同(NAFLD除外),并根据年龄(±5岁)、性别、民族和出生地与病例组进行频率匹配]。
纳入标准:南平市汉族居民,年龄17~70岁,NAFLD的诊断符合2010年发布的指南[20],并由经过专业培训的检测人员根据标准利用特征性回声图案对肝脂肪变性进行诊断。
排除标准:每日高饮酒量(男性超过40 g/d,女性超过20 g/d)、患有其他肝病史、服用降脂或减肥药和极端能量摄入。
本研究遵守赫尔辛基宣言和STROBE声明,已获得福建医科大学伦理委员会批准并取得参与者知情同意(伦理编号2014096)[21]。
1.2 研究方法
经过培训的调查人员对每位参与者进行全面的医疗史询问,并且使用半定量食物频率问卷(Semi-quantitative Food Frequency Questionnaire,SQFFQ)收集参与者的典型食物消费信息,具体是通过与3 d称重饮食记录(weighed dietary records,WDRs)比较,确保其有效性。问卷包含110种食物/食谱,覆盖7个食物频率类别,用于评估能量、宏量营养素、膳食纤维、维生素和矿物质摄入,SQFFQ适用于中国地区中年人群的半定量食物频率问卷,目标人群具有适度有效性[22]。
MUFA的计算是依据中国食物成分表和日本标准食物成分表,根据每种食物含有独特的MUFA和PUFA浓度,计算方法是将食物摄入量(g)×每克食物中的营养素含量。
1.3 统计学方法
使用统计软件R语言(版本4.2)和风锐统计(1.9)分析所有数据。连续变量符合正态分布时,采用(±s)表示,两组间比较采用独立样本t检验;偏态分布的计量资料采用M(P25,P75)表示,两组间比较采用Kruskal-Wallis检验。分类变量采用频率或百分比表示,组间比较采用χ2检验。采用多因素Logistic回归分析探讨MUFA每日摄入量与NAFLD发生风险的关系,并根据基线数据进行调整。同时进行协变量筛选和交互作用检验,比较各模型效果,在将其添加至模型时,匹配比至少改变10%,并结合临床意义和既往参考文献筛选。使用广义加性模型(generalized additive models,GAM)识别非线性关系。若存在非线性相关性,则基于平滑图实施两段式线性回归模型,计算MUFA每日摄入量对NAFLD风险的阈值效果。非线性在平滑曲线中,递归方法会自动计算拐点,并采用最大模型似然比较。以P<0.05为差异有统计学意义。
2 结果
2.1 基线特征比较
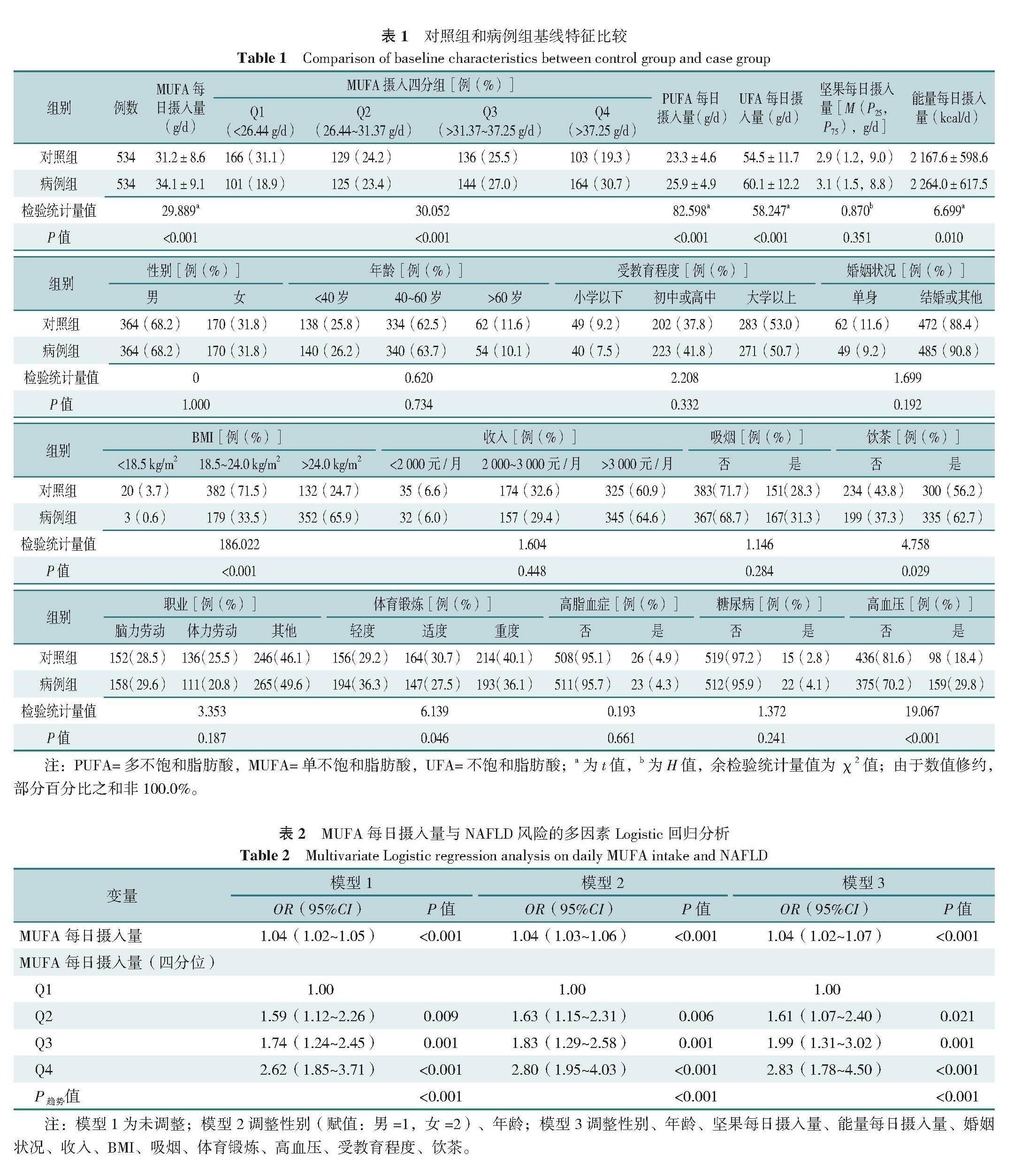
病例组和对照组坚果每日摄入量、性别、年龄、受教育程度、婚姻状况、收入、吸烟所占比例、职业、高脂血症所占比例、糖尿病所占比例比较,差异均无统计学意义(P>0.05);两组MUFA每日摄入量、MUFA摄入四分组、PUFA每日摄入量、不饱和脂肪酸(UFA)每日摄入量、能量每日摄入量、BMI、饮茶、体育锻炼、高血压比较,差异均有统计学意义(P<0.05),见表1。
2.2 MUFA与NAFLD关系的多因素Logistic回归
分析
以是否发生NAFLD为因变量(赋值:是=1,否=0),以MUFA每日摄入量为自变量,在未经调整的模型中,MUFA每日摄入量是NAFLD风险的影响因素(OR=1.04,95%CI=1.02~1.05,P<0.001)。在调整性别、年龄后,MUFA每日摄入量仍是NAFLD风险的影响因素(OR=1.04,95%CI=1.03~1.06,P<0.001)。在完全调整模型中,MUFA每日摄入量仍是NAFLD风险的影响因素(OR=1.04,95%CI=1.02~1.07,P<0.001)。以是否发生NAFLD为因变量(赋值:是=1,否=0),将MUFA摄入量转换为分类变量(四分位数)后,在各个模型中,随着MUFA每日摄入量的增加,NAFLD风险呈正相关(P趋势<0.001),见表2。
2.3 MUFA每日摄入量与NAFLD的非线性关系
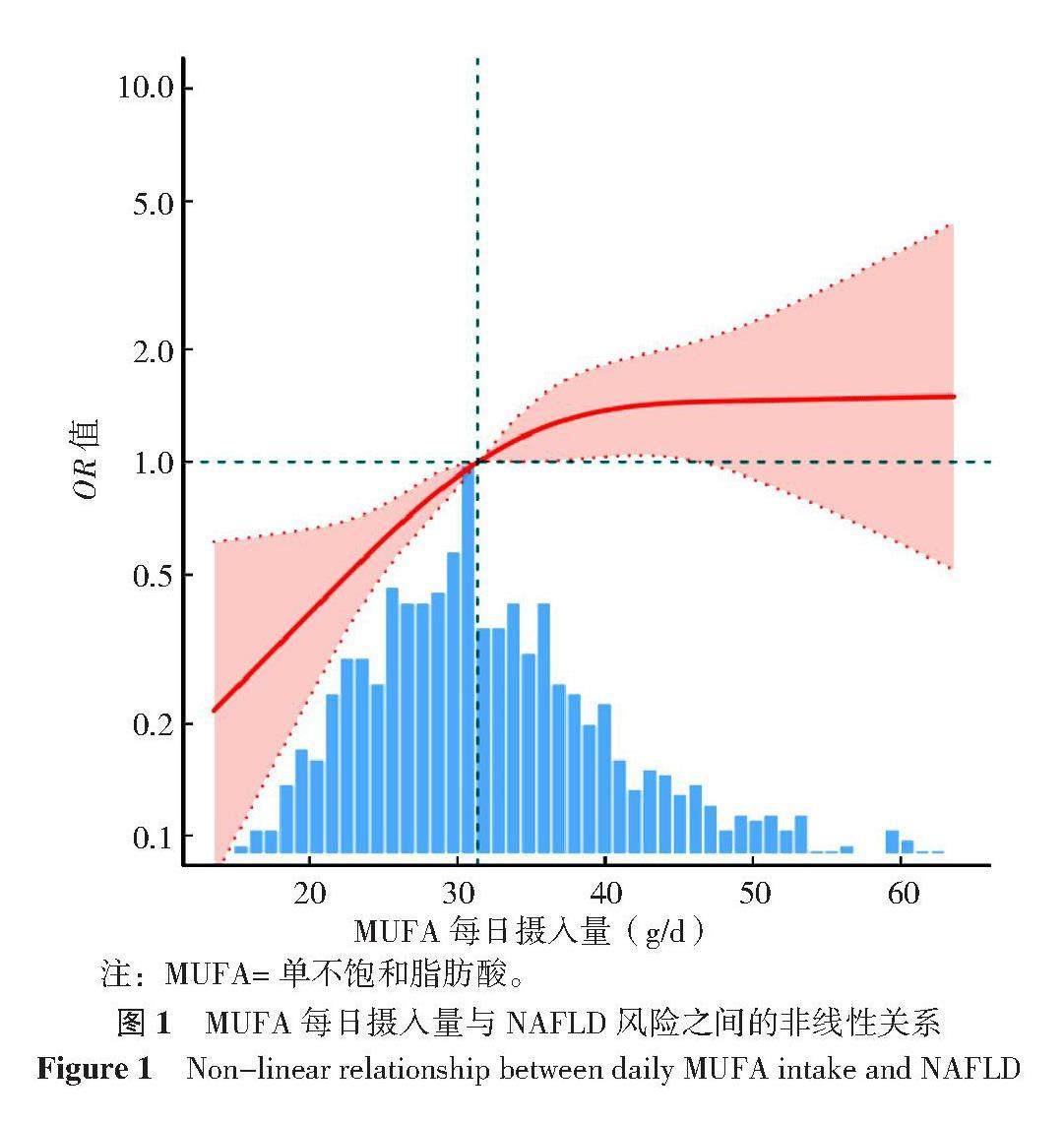
由于MUFA每日摄入量是一个连续变量,可以进行与NAFLD风险之间的非线性分析。图1所示,即使在调整了性别、年龄、坚果每日摄入量、能量每日摄入量、婚姻状况、收入、BMI、吸烟、体育锻炼、高血压、受教育程度、饮茶因素后,MUFA每日摄入量与NAFLD风险之间的关系仍然是非线性的(P=0.045)。使用双线性回归模型,计算出39.04 g/d的拐点。MUFA每日摄入量<39.04 g/d时,NFALD风险为1.08(95%CI=1.04~1.11,P<0.001);MUFA每日摄入量≥39.04 g/d时,与NAFLD风险无关(OR=1.02,95%CI=0.96~1.09,P=0.50);似然比检验P=0.041。
注:MUFA=单不饱和脂肪酸。
图1 MUFA每日摄入量与NAFLD风险之间的非线性关系
Figure 1 Non-linear relationship between daily MUFA intake and NAFLD
2.4 不同基本特征的患者与NAFLD风险的亚组分析
BMI、婚姻与NAFLD风险间不存在交互作用(P>0.05);性别、年龄、能量每日摄入量与NAFLD风险间存在交互作用(P交互<0.05),其中女性的NAFLD风险较高,40~60岁的患者NAFLD风险较高,低能量每日摄入量的患者NAFLD风险较高,见表3。
3 讨论
本研究深入探讨了MUFA每日摄入量与NAFLD风险的关系,并确定了MUFA每日摄入量的阈值。结果表明,MUFA每日摄入量与NAFLD风险呈正相关。并计算出39.04 g/d的拐点,当MUFA每日摄入量<39.04 g/d时,NFALD风险为1.08(95%CI=1.04~1.11,P<0.001);MUFA每日摄入量≥39.04 g/d时,与NAFLD风险无关(OR=1.02,95%CI=0.96~1.09,P=0.50)。这一发现对于理解MUFA每日摄入量与NAFLD风险的关系至关重要,并为NAFLD的预防和治疗提供新的证据。
脂肪酸可分为SFA和UFA,后者进一步细分为MUFA和PUFA[23]。研究表明SFA以及MUFA和PUFA低水平对代谢的负性影响,而这些影响可通过补充n-3 PUFA和MUFA得到改善[24]。因此,MUFA通过调节代谢综合征(metabolic syndrome,MetS)和NAFLD获得健康益处。在动物实验中,用茶籽油中的MUFA替代SFA或PUFA可以减少小鼠肝脏中的脂滴累积和脂肪组织[25]。富含α-亚麻酸和MUFA的饮食也可减轻肝脏脂肪变性并改变肥胖大鼠的肝脏磷脂脂肪酸谱[26]。此外,高MUFA饮食与降低总胆固醇(TC)水平和低密度脂蛋白胆固醇(LDL-C)水平相关,而地中海饮食更有效地增加了高密度脂蛋白胆固醇(HDL-C)水平并降低了TC/HDL-C比率[27]。补充特级初榨橄榄油和鱼油也可降低LDL-C水平、TC/HDL-C和LDL-C/HDL-C的比率[28]。
但是也有研究表明,富含SFA、反式脂肪酸和MUFA的西方饮食,已被认为是NAFLD的一个重要风险因素[29]。一种包含多种有益饮食成分的多因素饮食,与仅用MUFA替换SFA比较,能更有效减少诱导肝脏脂肪[30]。在研究MUFA与NAFLD风险之间的非线性关系提示可能随着MUFA摄入量的增加呈现更复杂的变化模式。这种关系可能受到多种因素的影响,包括MUFA的来源、整体饮食模式、个体的代谢状态和其他生活方式因素。临床医生和营养师在推荐MUFA摄入时,不仅要考虑总量,还要考虑拐点值的摄入量。相互作用显示在中年低摄入女性中,随着MUFA的摄入增高会增加NAFLD的风险,提示需要在特殊人群中重点关注MUFA的摄入量。
同时本研究也存在一些不足。第一,采用的病例对照设计可能导致潜在偏倚。第二,缺乏与其他研究的比较验证以及相关基础研究的支持。第三,研究样本局限于中国汉族成年人,限制了结果的普适性。第四,NAFLD的诊断标准是腹部超声检查而非肝活检,可能未准确反映MUFA比例对其的影响。目前的结果仅为初步探索。尽管MUFA是必需营养素,适量摄入有益于多个系统,但关于最大摄入量、MUFA各主要成分的研究尚不完善。因此,有必要在更大规模、多中心及不同人群中进行进一步研究。深入了解MUFA摄入的阈值及其对肝脏健康的潜在机制,有助于制订更精确的饮食建议,降低NAFLD的发病率。
4 小结
本研究提示中国汉族成年人MUFA每日摄入量与NAFLD发病风险呈倒L型非线性关系,当MUFA每日摄入量<39.04 g/d时,MUFA每日摄入量与NAFLD发病风险呈正相关,而≥39.04 g/d存在饱和阈值效应,NAFLD风险不再显著增加。这些发现强调了控制MUFA摄入对预防NAFLD患病的重要性。
作者贡献:付伟进行文献综述的构思与设计,结果的分析与解释,统计学处理及论文撰写;程国彬、吕麟亚、丁瑶进行研究的实施与论文的修订;王瑶进行数据收集与整理;赵俊龙负责文章的质量控制及审校,对文章整体进行监督管理。
本文无利益冲突。
付伟:https://orcid.org/0000-0001-8155-431X
赵俊龙:https://orcid.org/0000-0002-6148-5641
参考文献
YOUNOSSI Z M,KOENIG A B,ABDELATIF D,et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence,incidence,and outcomes[J]. Hepatology,2016,64(1):73-84. DOI:10.1002/hep.28431.
SHEKA A C,ADEYI O,THOMPSON J,et al. Nonalcoholic steatohepatitis:a review[J]. JAMA,2020,323(12):1175-1183. DOI:10.1001/jama.2020.2298.
YOUNOSSI Z M. Non-alcoholic fatty liver disease - a global public health perspective[J]. J Hepatol,2019,70(3):531-544. DOI:10.1016/j.jhep.2018.10.033.
MAHADY S E,GEORGE J. Predicting the future burden of NAFLD and NASH[J]. J Hepatol,2018,69(4):774-775. DOI:10.1016/j.jhep.2018.06.025.
SINGH A,DHALIWAL A S,SINGH S,et al. Awareness of nonalcoholic fatty liver disease is increasing but remains very low in a representative US cohort[J]. Dig Dis Sci,2020,65(4):978-986. DOI:10.1007/s10620-019-05700-9.
ALQAHTANI S A,PAIK J M,BISWAS R,et al. Poor awareness of liver disease among adults with NAFLD in the United States[J]. Hepatol Commun,2021,5(11):1833-1847. DOI:10.1002/hep4.1765.
KO E,YOON E L,JUN D W. Risk factors in nonalcoholic fatty liver disease[J]. Clin Mol Hepatol,2023,29(Suppl):S79-85. DOI:10.3350/cmh.2022.0398.
ZHU S L,ZHANG J W,JIANG X,et al. Free fatty acid receptor 4 deletion attenuates colitis by modulating Treg cells via ZBED6-IL33 pathway[J]. EBioMedicine,2022,80:104060. DOI:10.1016/j.ebiom.2022.104060.
WANG C,SHI M,JI J,et al. Stearoyl-CoA desaturase 1(SCD1)facilitates the growth and anti-ferroptosis of gastric cancer cells and predicts poor prognosis of gastric cancer[J]. Aging,2020,
12(15):15374-15391. DOI:10.18632/aging.103598.
OGATA B N,HAYES D. Position of the academy of nutrition and dietetics:nutrition guidance for healthy children ages 2 to 11 years[J]. J Acad Nutr Diet,2014,114(8):1257-1276. DOI:10.1016/j.jand.2014.06.001.
XIANG F,WU K,LIU Y L,et al. Omental adipocytes enhance the invasiveness of gastric cancer cells by oleic acid-induced activation of the PI3K-Akt signaling pathway[J]. Int J Biochem Cell Biol,2017,84:14-21. DOI:10.1016/j.biocel.2016.12.002.
KRIS-ETHERTON P M,PEARSON T A,WAN Y,et al. High-monounsaturated fatty acid diets lower both plasma cholesterol and triacylglycerol concentrations[J]. Am J Clin Nutr,1999,70(6):1009-1015. DOI:10.1093/ajcn/70.6.1009.
SALES-CAMPOS H,SOUZA P R,PEGHINI B C,et al. An overview of the modulatory effects of oleic acid in health and disease[J]. Mini Rev Med Chem,2013,13(2):201-210.
SHAHIDI F,AMBIGAIPALAN P. Omega-3 polyunsaturated fatty acids and their health benefits[J]. Annu Rev Food Sci Technol,2018,9:345-381. DOI:10.1146/annurev-food-111317-095850.
HOOPER L,MARTIN N,JIMOH O F,et al. Reduction in saturated fat intake for cardiovascular disease[J]. Cochrane Database Syst Rev,2020,5(5):CD011737. DOI:10.1002/14651858.CD011737.pub2.
HAMLEY S. The effect of replacing saturated fat with mostly n-6 polyunsaturated fat on coronary heart disease:a meta-analysis of randomised controlled trials[J]. Nutr J,2017,16(1):30. DOI:10.1186/s12937-017-0254-5.
RAVAUT G,L?GIOT A,BERGERON K F,et al. Monounsaturated fatty acids in obesity-related inflammation[J]. Int J Mol Sci,2020,22(1):330. DOI:10.3390/ijms22010330.
FEDERICO A,DALLIO M,CAPRIO G G,et al. Qualitative and quantitative evaluation of dietary intake in patients with non-alcoholic steatohepatitis[J]. Nutrients,2017,9(10):1074. DOI:10.3390/nu9101074.
SILVA FIGUEIREDO P,CARLA INADA A,MARCELINO G,et al. Fatty acids consumption:the role metabolic aspects involved in obesity and its associated disorders[J]. Nutrients,2017,9(10):1158. DOI:10.3390/nu9101158.
FAN J G,JIA J D,LI Y M,et al. Guidelines for the diagnosis and management of nonalcoholic fatty liver disease:update 2010:(published in Chinese on Chinese Journal of Hepatology 2010;18:163-166)[J]. J Dig Dis,2011,12(1):38-44. DOI:10.1111/j.1751-2980.2010.00476.x.
CHEN B B,HAN Y,PAN X T,et al. Association between nut intake and non-alcoholic fatty liver disease risk:a retrospective case-control study in a sample of Chinese Han adults[J]. BMJ Open,2019,9(9):e028961. DOI:10.1136/bmjopen-2019-028961.
LI K,TOSHIRO T,SONG F Y,et al. Relative validity of a semi-quantitative food frequency questionnaire versus 3 day weighed diet records in middle-aged inhabitants in Chaoshan area,China[J]. Asian Pac J Cancer Prev,2005,6(3):376-381.
ZHENG J Y,SUN D,LI X X,et al. The effect of fatty acid chain length and saturation on the emulsification properties of pork myofibrillar proteins[J]. LWT,2021,139:110242. DOI:10.1016/j.lwt.2020.110242.
MOLENDI-COSTE O,LEGRY V,LECLERCQ I A. Dietary lipids and NAFLD:suggestions for improved nutrition[J]. Acta Gastroenterol Belg,2010,73(4):431-436.
TUNG Y T,HSU Y J,CHIEN Y W,et al. Tea seed oil prevents obesity,reduces physical fatigue,and improves exercise performance in high-fat-diet-induced obese ovariectomized mice[J]. Molecules,2019,24(5):980. DOI:10.3390/molecules24050980.
HANKE D,ZAHRADKA P,MOHANKUMAR S K,et al. A diet high in α-linolenic acid and monounsaturated fatty acids attenuates hepatic steatosis and alters hepatic phospholipid fatty acid profile in diet-induced obese rats[J]. Prostaglandins Leukot Essent Fatty Acids,2013,89(6):391-401. DOI:10.1016/j.plefa.2013.09.009.
CHOWDHURY R,WARNAKULA S,KUNUTSOR S,et al. Association of dietary,circulating,and supplement fatty acids with coronary risk:a systematic review and meta-analysis[J]. Ann Intern Med,2014,160(6):398-406. DOI:10.7326/M13-1788.
VENTURINI D,SIM?O A N C,URBANO M R,et al. Effects of extra virgin olive oil and fish oil on lipid profile and oxidative stress in patients with metabolic syndrome[J]. Nutrition,2015,31(6):834-840. DOI:10.1016/j.nut.2014.12.016.
ODDY W H,HERBISON C E,JACOBY P,et al. The Western dietary pattern is prospectively associated with nonalcoholic fatty liver disease in adolescence[J]. Am J Gastroenterol,2013,
108(5):778-785. DOI:10.1038/ajg.2013.95.
DELLA PEPA G,VETRANI C,BRANCATO V,et al. Effects of a multifactorial ecosustainable isocaloric diet on liver fat in patients with type 2 diabetes:randomized clinical trial[J]. BMJ Open Diabetes Res Care,2020,8(1):e001342. DOI:10.1136/bmjdrc-2020-001342.
(收稿日期:2024-01-10;修回日期:2024-06-06)
(本文编辑:贾萌萌)

