妊娠期糖尿病孕妇不同孕周阴道菌群变化及对妊娠结局的影响:前瞻性队列研究
杨昕晖 彭笑笑 马丽丽 赵国玉 马秀华 郭晶
引用本文:杨昕晖,彭笑笑,马丽丽,等. 妊娠期糖尿病孕妇不同孕周阴道菌群变化及对妊娠结局的影响:前瞻性队列研究[J]. 中国全科医学,2024,27(29):3587-3594. DOI:10.12114/j.issn.1007-9572.2024.0191. [www.chinagp.net]
YANG X H,PENG X X,MA L L,et al. Title vaginal microbiota changes of gestational diabetes mellitus pregnant women at different gestational weeks and the impact on pregnancy outcome:a prospective cohort study[J]. Chinese General Practice,2024,27(29):3587-3594.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
【摘要】 背景 妊娠期糖尿病(GDM)是妊娠期常见并发症,既往研究表明,GDM孕妇生殖道感染性疾病的患病风险较高,但相关队列研究少见。目的 了解GDM孕妇不同孕周阴道菌群变化特点,对比GDM孕妇与非GDM孕妇阴道菌群差异,观察阴道菌群异常对妊娠结局的不良影响。方法 本研究采用连续抽样法,选取2022年3月—2023年3月在首都医科大学大兴教学医院建立档案并规范保健的孕妇,在妊娠24~28周行75 g口服糖耐量试验(OGTT)检查,诊断是否为GDM。采用倾向得分匹配法(PSM)进行GDM组与非GDM组1∶1匹配,于妊娠24~28周(A阶段)、妊娠32~35周(B阶段)和妊娠37~40周(C阶段)分别采集阴道分泌物,进行3次阴道微生态检测,并进一步分为GDM阴道菌群正常组、GDM阴道菌群异常组、非GDM阴道菌群正常组及非GDM阴道菌群异常组,随访至分娩后7 d以评估妊娠结局。结果 本研究最初纳入426名参与者,141例发生GDM。经过PSM匹配,GDM组和非GDM组成功匹配122对,作为研究队列。本研究中有9例GDM孕妇和5例非GDM孕妇发生早产(妊娠<37周),故最终有113例GDM孕妇和117例非GDM孕妇进入C阶段。A阶段阴道菌群优势菌为乳杆菌所占比例高于C阶段,阴道pH值、阴道菌群异常发生率、细菌性阴道病(BV)及外阴阴道假丝酵母菌病(VVC)发生率均低于C阶段(P<0.05)。A阶段GDM组优势菌为乳杆菌所占比例高于非GDM组,阴道菌群异常和VVC发生率均低于非GDM组(P<0.05)。C阶段GDM组优势菌乳杆菌比例低于非GDM组,阴道菌群异常发生率高于非GDM组(P<0.05)。GDM阴道菌群异常组(n=65)不良妊娠结局发生率高于GDM阴道菌群正常组(n=57)(P<0.05);GDM阴道菌群异常组不良妊娠结局的发生风险是GDM阴道菌群正常组的1.830倍(RR=1.830,95%CI=1.293~2.590,P<0.001)。结论 GDM孕妇在妊娠37~40周时,阴道菌群异常发生率高于妊娠24~28周。相比于非GDM孕妇,GDM孕妇在妊娠24~28周时阴道菌群异常发生率低,而在妊娠37周后,阴道菌群异常发生风险升高。妊娠期阴道菌群异常是发生不良妊娠结局的危险因素,建议加强妊娠期阴道微生态的检测与管理。
【关键词】 妊娠期糖尿病;妊娠中期;妊娠晚期;阴道菌群;妊娠结局;队列研究
【中图分类号】 R 714.256 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2024.0191
Title Vaginal Microbiota Changes of Gestational Diabetes Mellitus Pregnant Women at Different Gestational Weeks and the Impact on Pregnancy Outcome:a Prospective Cohort Study
YANG Xinhui1,PENG Xiaoxiao2,MA Lili3,ZHAO Guoyu3,MA Xiuhua3*,GUO Jing1
1.Department of General Medicine,Beijing Friendship Hospital,Capital Medical University,Beijing 100050,China
2.Department of General Medicine,Daxing Teaching Hospital of Capital Medical University,Beijing 102600,China
3.Department of Gynecology and Obstetrics,Daxing Teaching Hospital of Capital Medical University,Beijing 102600,China
*Corresponding author:MA Xiuhua,Chief physician/Professor/Doctoral supervisor;E-mail:mxhdxqyy@126.com
【Abstract】 Background Gestational diabetes mellitus(GDM) is a common complication of pregnancy,and previous studies have shown that pregnant women with GDM have a higher risk of developing infectious diseases of the reproductive tract than healthy pregnant women,but relevant cohort studies are rare. Objective To investigate the variation characteristics of vaginal microbiota in pregnant women with GDM at different gestational weeks,to compare the differences of vaginal microbiota between GDM and non-GDM women,and to observe the effects of vaginal microbiota changes on pregnancy outcomes. Methods In this study,we used a consecutive sampling method to recruit pregnant women who established their records and regulated health care at Daxing Teaching Hospital of Capital Medical University from March 2022 to March 2023. They underwent 75 g oral glucose tolerance test(OGTT) at 24-28 weeks of gestation to diagnose GDM. The GDM group was matched 1∶1 with the non-GDM group using propensity score matching method(PSM). Sample of vaginal secretions were collected at 24-28 weeks(stage A),32-35 weeks(stage B) and 37-40 weeks(stage C) for three vaginal microecological examination,respectively. Based on the results,participants were further divided into the GDM normal vaginal flora subgroup,GDM abnormal vaginal flora subgroup,non-GDM normal vaginal flora subgroup and non-GDM abnormal vaginal flora subgroup,and were followed up until 7 d after delivery to assess pregnancy outcome. Results A total of 426 participants were initially enrolled in this study,and GDM occurred in 141 cases. After PSM mathing,the GDM and non-GDM groups were successfully matched in 122 pairs. In this study,because 9 women with GDM and 5 women without GDM had preterm birth(<37 weeks of gestation),113 women with GDM and 117 women without GDM ended up in stage C. The proportion of the dominant vaginal flora of Lactobacillus was higher in stage A than in stage C. Moreover,the vaginal pH,the incidence of vaginal flora abnormalities,and the incidence of BV and VVC were lower than those in stage C(P<0.05). The proportion of dominant bacteria as Lactobacillus in the GDM group was higher than that in the non-GDM group,and the incidence of abnormal vaginal flora and VVC was lower than that in the non-GDM group in stage A(P<0.05). In contrast,the proportion of the dominant bacterium Lactobacillus was lower in the GDM group than in the non-GDM group,and the incidence of abnormal vaginal flora was higher than in the non-GDM in stage C(P<0.05). The incidence of adverse pregnancy outcomes was higher in the GDM abnormal vaginal flora subgroup(n=65)than in the GDM normal vaginal flora subgroup(n=57)(P<0.05). In more details,the risk of adverse pregnancy outcomes in the GDM abnormal vaginal flora group was 1.830 times higher than that in the GDM normal vaginal flora group(RR=1.830,95%CI=1.293-2.590,P<0.001). Conclusion Compared with non-GDM pregnant women,GDM pregnant women had a lower incidence of vaginal flora abnormalities at 24-28 weeks of gestation and an increased risk of vaginal flora abnormalities after 37 weeks of gestation. GDM pregnant women with abnormal flora have higher risk of adverse pregnancy outcomes,so we recommend enhanced testing and management of vaginal microecology during pregnancy.
【Key words】 Gestational diabetes mellitus;Pregnancy trimester,second;Pregnancy trimester,third;Vaginal microbiota;Pregnancy outcome;Cohort study
妊娠期糖尿病(gestational diabetes mellitus,GDM)是由于妊娠期糖代谢异常而首次发生或发现的一类糖尿病,与多种不良妊娠结局相关,全球患病率为14.0%[1],我国患病率为14.8%[2]。随着生育政策调整,孕妇年龄及孕产次增加,GDM发病率呈逐年增长趋势。
阴道菌群的动态平衡对维持女性生殖健康具有积极作用。孕妇的阴道菌群结构和功能与非妊娠期有所不同,健康孕妇的阴道菌群是以乳杆菌为优势菌的相对稳定的菌群结构,有利于抑制致病菌的增殖,减少生殖道感染的发生,保证胎儿的健康发育[3-5]。GDM孕妇由于葡萄糖代谢功能异常,阴道上皮糖原堆积,局部免疫屏障破坏,阴道微生态失衡,同健康孕妇相比阴道菌群结构可能存在差异,菌群异常是否增加其不良妊娠结局的发生风险,有待于在队列研究中进一步明确。因此,本研究进行前瞻性队列研究,了解GDM孕妇不同孕周阴道菌群变化特点,分析其与非GDM孕妇的差异,并观察菌群异常是否增加不良妊娠结局的发生风险。
1 对象与方法
1.1 伦理原则
本研究开始前,获得首都医科大学大兴教学医院伦理委员会的批准(No.20220215LLKYLX-1-01)。研究者向研究对象充分告知本研究相关内容,取得知情同意,签署知情同意书。
1.2 研究对象
采用连续抽样法,选取2022年3月—2023年3月在首都医科大学大兴教学医院建立档案并规范保健的426例孕妇。
1.2.1 纳入标准:(1)在首都医科大学大兴教学医院建档、正常妊娠期保健及分娩;(2)自然受孕;(3)单胎妊娠;(4)年龄20~45岁;(5)22周≤妊娠周数<24周;(6)精神正常,能正常沟通交流;(7)对本研究的目的和意义均知情,并同意参与本研究。
1.2.2 排除标准:(1)孕前糖尿病合并妊娠;(2)未在妊娠24~28周完成75 g口服糖耐量试验(oral glucose tolerance test,OGTT)检查;(3)存在严重的重要器官疾病及恶性肿瘤疾病;(4)采集标本前1周内有性生活;(5)采集标本前1个月内使用过抗菌药物;(6)采集标本前1个月内进行过阴道冲洗或灌洗治疗。
1.2.3 样本量计算:查阅文献,我国非GDM孕妇阴道菌群异常发生率为33.50%,GDM孕妇阴道菌群异常发生率为56.99%[6]。根据队列研究样本量计算公式:n1=n2=(μα +μ2β)2/(p1-p0 )2,本研究中,p0=33.50%、p1=56.99%,双侧α=0.05,β=0.10,采用PASS 15.0软件进行计算得出:n1=n2=90。假定研究对象的失访率为20%,则两组分别至少纳入113例。
1.3 研究方法
1.3.1 GDM诊断标准:既往未诊断糖尿病的孕妇,在妊娠24~28周行OGTT检查,空腹、口服葡萄糖后1、2 h的任一时点血糖值达到或超过5.1、10.0、8.5 mmol/L即诊断为GDM[7]。
1.3.2 匹配方法:426例孕妇中,在妊娠24~28周诊断GDM孕妇141例,失访7例;非GDM孕妇285例,失访21例。以“检测孕周、年龄、孕前BMI、孕产次、有无流产史”为匹配项,设定匹配容差0.02,利用SPSS 25.0软件倾向得分匹配(propensity score matching,PSM)方法进行GDM组与非GDM组1∶1匹配,成功匹配122对。
1.3.3 研究队列:以GDM为暴露因素,分为GDM组和非GDM组,持续进行随访研究,依据妊娠进展分为A、B、C 3个阶段,对应妊娠24~28周、妊娠32~35周、妊娠37~40周,主要结局指标为孕妇阴道微生态情况。规定在任一孕周阶段发生阴道菌群异常即判定为妊娠期阴道菌群异常,以妊娠期阴道菌群异常为暴露因素,进一步分为GDM阴道菌群正常组、GDM阴道菌群异常组、非GDM阴道菌群正常组及非GDM阴道菌群异常组,随访至分娩后7 d以评估妊娠结局。
由于本研究中有9例GDM孕妇和5例非GDM孕妇发生早产(妊娠<37周),故最终有113例GDM孕妇和117例非GDM孕妇进入C阶段。
1.3.4 试验方法:在A、B、C 3个阶段分别进行第1、2次及第3次阴道分泌物样本采集。使孕妇在有保护措施情况下,取膀胱截石位,研究者使用无菌棉签拭子采集受检者阴道后穹隆部位的阴道分泌物,将拭子在后穹隆处旋转并停留20 s,拭子标本置于无菌试管内,立即送本院妇产科阴道微生态检验室进行检测。研究标本检测采用江苏硕世生物科技股份有限公司生产的全自动阴道微生态评价检测设备[阴道炎自动检测工作站(bPR-2014A)、自动生物显微镜(SS-AMIA3)、自动染色仪(SAD-80)、阴道炎多项检测试剂盒(七联检)]。机器通过人工智能技术自动输出阴道微生态检测结果,检验专业技术人员对机器输出结果进行人工复核。
1.4 结局指标
1.4.1 阴道微生态检测指标:形态学指标包括密集度、多样性、Nugent评分、优势菌及病原微生物等;功能学指标包括pH值、H2O2、LE及其他生物化学指标[8]。
检测结论包括:(1)正常菌群;(2)菌群正常,功能下降;(3)菌群抑制;(4)菌群增殖过度;(5)外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC);(6)细菌性阴道病(bacterial vaginosis,BV);(7)滴虫性阴道炎(trichomonal vaginitis,TV);(8)需氧性阴道炎(aerobic vaginitis,AV);(9)优势菌为非乳杆菌类G+杆菌[9]。本研究中,将结论(1)和(2)判定为阴道菌群正常,余结果归类为阴道菌群异常。
1.4.2 妊娠结局:主要观察的妊娠结局有早产、胎膜早破、绒毛膜羊膜炎、产后出血、胎儿窘迫、产后贫血。
1.5 统计学方法
采用SPSS 25.0软件进行数据统计分析,非正态分布的计量资料采用M(P25,P75)表示,组间比较采用Mann-Whitney检验(U检验)或Kruskal-Wallis检验(H检验)。计数资料采用例数(%)表示,组间比较采用χ2检验或Fisher's确切概率法;多组间两两比较采用χ2分割法,P值经Bonferroni法校正,调整后的检验水准α'=2α/k(k-1) (k是检验的组数)。多个配对样本检验中,若结局变量为连续数值变量,则采用Friedman检验;若结局变量为二分类变量,则采用Cochran's Q检验,事后两两比较采用Dunn's检验(经Bonferroni法校正)。采用Spearman秩相关分析进行非正态变量的相关性分析。根据公式,RR=
p1/p0 (p1为暴露组发病率,p0为对照组发病率),计算各因素对应的RR及其95%CI。以P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料
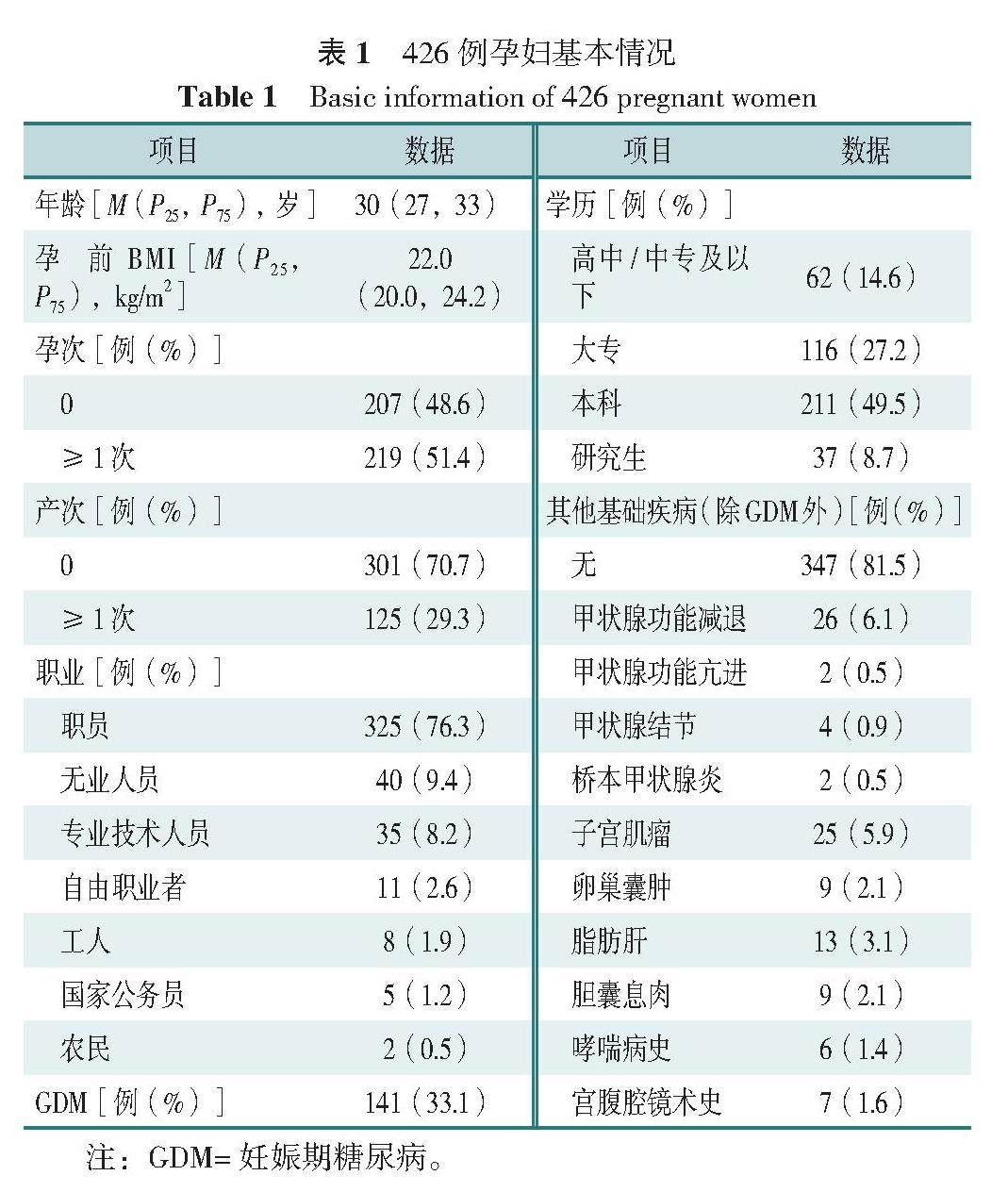
本研究最初纳入426例孕妇,年龄20~44岁,中位年龄30岁;孕前BMI中位数为22.0 kg/m2;初产妇301例,经产妇125例;职业以职员为主;学历以本科为主;诊断GDM 141例;除GDM以外,存在其他基础疾病者79例,具体疾病类型及占比情况详见表1。经过PSM匹配,GDM组和非GDM组成功匹配122对,作为研究队列。
2.2 GDM孕妇不同孕周阴道微生态特点
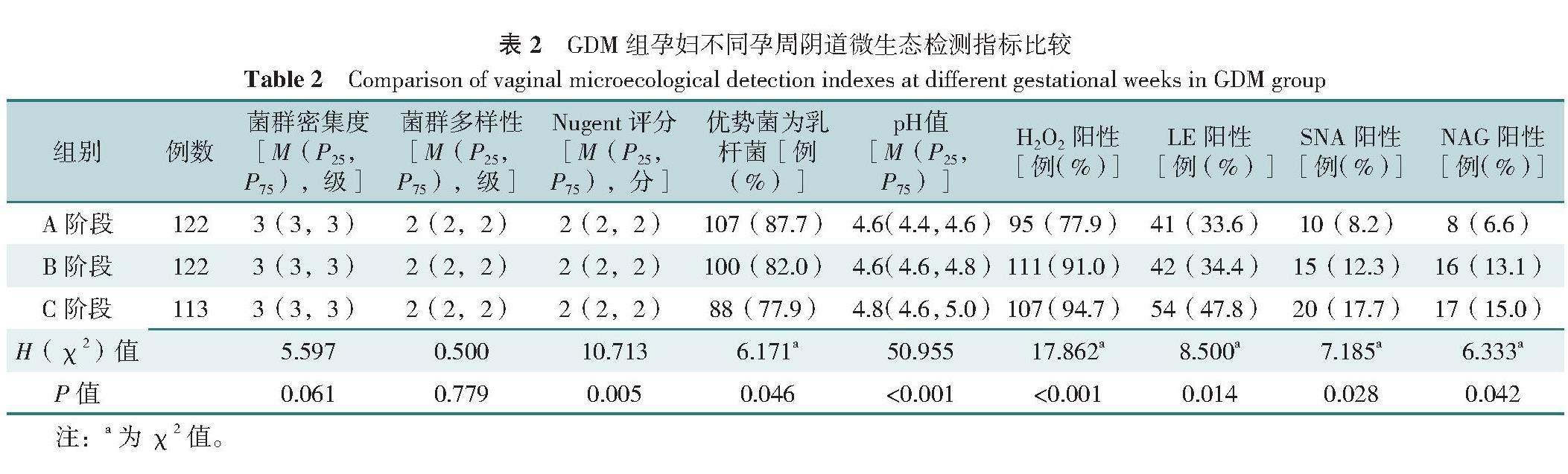
2.2.1 GDM孕妇不同孕周阴道微生态检测指标比较:形态学检测指标方面,GDM组Nugent评分、优势菌为乳杆菌所占比例在3个孕周阶段比较,差异均有统计学意义(P<0.05);使用Bonferroni法进一步两两比较,调整后检验水准α'=0.05/3=0.016 7,结果显示,不同孕周阶段Nugent评分比较,差异均无统计学意义(P>
0.016 7);A阶段阴道菌群优势菌为乳杆菌所占比例高于C阶段,差异有统计学意义(P=0.013)。GDM组阴道菌群密集度、多样性在3个孕周阶段比较,差异均无统计学意义(P>0.05)。
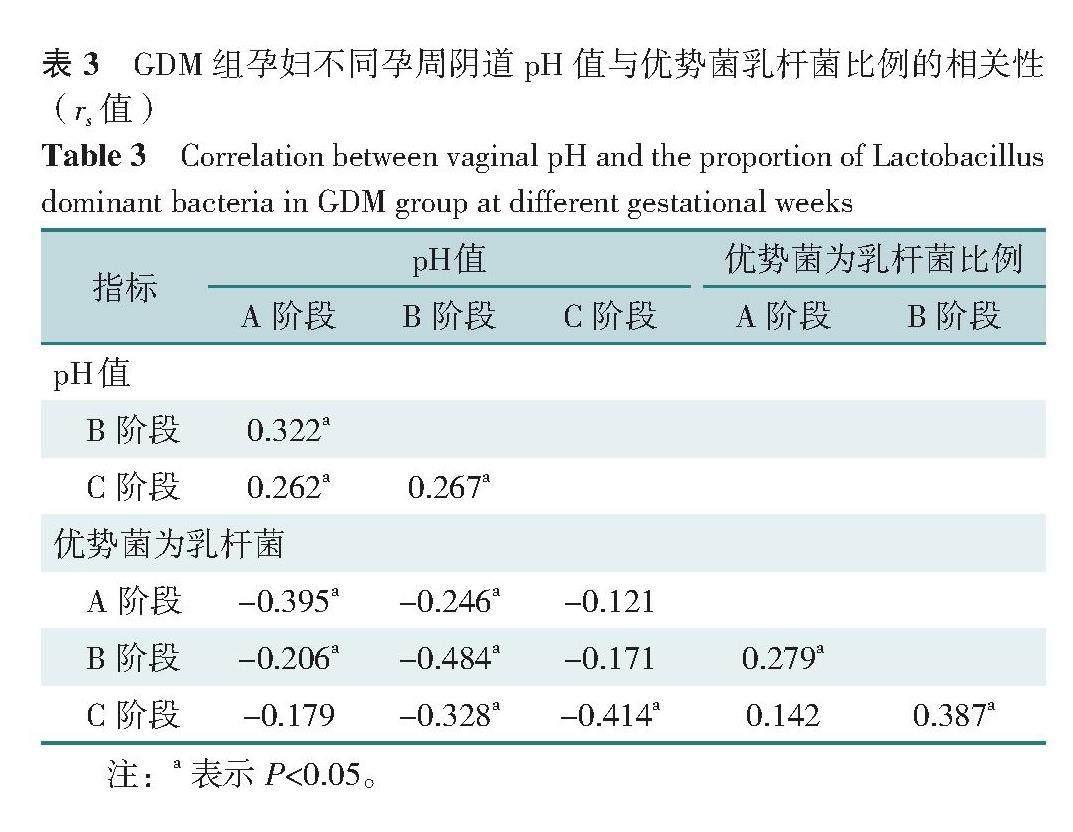
功能学检测指标方面,GDM组阴道分泌物pH值在3个孕周阶段比较,差异有统计学意义(P<0.001),且与孕周阶段呈正相关(P<0.05),与优势菌为乳杆菌的比例呈负相关(P<0.001)。GDM组H2O2阳性率、LE阳性率、SNA阳性率、NAG阳性率比较,差异均有统计学意义(P<0.05);其中B和C阶段H2O2阳性率高于A阶段(P=0.003,P<0.001),C阶段LE阳性率高于A和B阶段(均P=0.012),C阶段SNA和NAG阳性率高于A阶段(P=0.010,P=0.012),差异均有统计学意义,见表2、3。
2.2.2 GDM孕妇不同孕周阴道微生态差异性分析:GDM组阴道菌群异常发生率在A、B、C 3个孕周阶段分别为17.2%(21/122)、25.4%(31/122)、32.7%(37/113),不同孕周阶段阴道菌群异常发生率比较,差异均有统计学意义(P=0.006);两两比较结果显示,C阶段阴道菌群异常发生率高于A阶段,差异有统计学意义(P=0.002)。GDM组孕妇不同孕周阶段BV中间型、BV+VVC发生率比较,差异均无统计学意义(P>0.05)。GDM组孕妇不同孕周阶段BV及VVC发生率比较,差异均有统计学意义(P<0.05);其中C阶段BV发病率高于A阶段和B阶段,差异均有统计学意义(P=0.001,P=0.009),C阶段VVC发病率高于A阶段,差异有统计学意义(P=0.008),见表4。
2.3 GDM与非GDM孕妇阴道微生态差异性分析
A阶段GDM组优势菌为乳杆菌比例高于非GDM组,阴道分泌物LE和SNA阳性率低于非GDM组,VVC发病率低于非GDM组,差异均有统计学意义(P<0.05)。GDM组阴道菌群异常的发生风险低于非GDM组(RR=0.583,95%CI=0.362~0.939,P=0.023)。
B阶段GDM组与非GDM组阴道菌群异常发生率比较,差异无统计学意义(P>0.05)。
C阶段GDM组优势菌为乳杆菌比例低于非GDM组,H2O2和NAG阳性率高于非GDM组,差异均有统计学意义(P<0.05)。GDM组阴道菌群异常的发生风险高于非GDM组(RR=2.016,95%CI=1.236~3.288,P=0.004),见表5。
2.4 妊娠结局
GDM阴道菌群异常组不良妊娠结局发生率高于GDM阴道菌群正常组,差异有统计学意义(P<0.05);GDM阴道菌群异常组不良妊娠结局的发生风险是GDM阴道菌群正常组的1.830倍(RR=1.830,95%CI=1.293~2.590,P<0.001)。
从不良妊娠结局类型上看,GDM阴道菌群异常组早产、胎膜早破发生率均高于GDM阴道菌群正常组,差异有统计学意义(P<0.05),见表6。非GDM阴道菌群异常组早产、胎膜早破、绒毛膜羊膜炎、产后贫血发生率均高于非GDM阴道菌群正常组,差异有统计学意义(P<0.05),见表7。
3 讨论
3.1 GDM孕妇阴道菌群在不同孕周阶段具有不同特点
生理状态下,阴道内存在的多种微生物共生和相互拮抗,维持阴道内环境动态平衡[3,8]。女性在妊娠期阶段,体内雌激素激增、局部血液循环增加、饮食运动等行为习惯发生改变,与非妊娠期相比,阴道菌群存在一定差异,且随着妊娠期间多种激素水平发生变化,阴道菌群在不同妊娠阶段表现出不同的特点。本研究表明,在妊娠24~28周、妊娠32~35周及妊娠37~40周3个孕周阶段,随孕周进展,GDM孕妇阴道菌群优势菌为乳杆菌的比例下降,阴道内环境H2O2浓度下降,pH值趋于升高,阴道分泌物NAG阳性率、SNA阳性率及LE阳性率呈现上升趋势,功能学指标变化间接反映厌氧菌、白色假丝酵母菌及其他致病微生物在阴道内繁殖增加,阴道菌群发生变化,同时,研究还发现,妊娠37~40周较妊娠24~28周和妊娠32~35周,GDM孕妇阴道菌群异常发生率升高,感染类型以VVC为首位,BV次之。
乳杆菌是维持阴道菌群稳态的重要益生菌,尤其是产H2O2的乳杆菌,其利用阴道上皮细胞内的糖原代谢产生乳酸,维持阴道弱酸环境,产生H2O2、细菌素、类细菌素等抗菌物质,并与其他过氧化物、卤化物联合作用抑制致病菌生长,竞争黏附上皮细胞形成生物保护膜抵抗致病微生物入侵,从而达到维持正常阴道微生态环境,预防生殖道感染的目的[10-12]。对于妊娠期女性,其阴道乳杆菌占比从孕前到妊娠晚期总体呈下降趋势[13-15]。
雌激素水平、乳杆菌、pH值及局部免疫系统是阴道微生态的重要组成部分,也是维持其平衡的重要因素[16]。妊娠期女性体内雌激素水平在整个妊娠阶段是持续增长的[17-18]。一方面,妊娠期女性在这种持续高雌激素水平影响下,阴道上皮细胞糖原积累增多,乳酸增加,虽然阴道酸性环境在一定程度上利于乳杆菌生长,但过酸的阴道微环境也会使得适宜酸性环境的厌氧性病原体大量繁殖,尤其是假丝酵母菌,由于其胞浆内有雌激素受体,高水平的雌激素可直接刺激该菌生长[19];另一方面,妊娠晚期,由于阴道黏膜充血水肿、通透性增加、屏障功能减弱及阴道分泌物增多,孕妇外阴常处于湿润状态,这些因素均利于致病菌繁殖[12,20]。再者,由于阴道pH值和乳杆菌之间是相互影响的,致病菌繁殖增加,代谢产物破坏了阴道正常酸碱平衡,不利于乳杆菌正常生长,乳杆菌优势地位被取代,导致阴道微生态失衡,阴道黏膜受损,引发炎症反应,增加孕妇妊娠晚期生殖道感染的风险。既往研究表明,妊娠期女性阴道内乳杆菌含量随孕周增加逐渐减少,而阴道pH值逐渐升高,两者呈负相关[21-22]。本研究在GDM孕妇人群中也观察到这一特征,相比于非GDM孕妇,GDM孕妇胎盘组织中雌激素受体α表达上调且雌二醇浓度有升高趋势[23-24],这可能是导致上述GDM孕妇阴道菌群变化特征更为突出的一个重要因素。
关于不同孕周阴道菌群结构特点的研究,既往研究对象多集中于健康孕妇,在GDM中鲜有报道。根据阴道菌群的形态学特征,本研究对GDM孕妇阴道菌群进行表型分类,结果显示,在妊娠24~28周、妊娠32~35周、妊娠37~40周3个孕周阶段,阴道菌群以乳杆菌为优势菌群,尚未发现菌群密集度及多样性在不同孕周存在显著差异。王艳[13]在34例育龄期女性及孕妇的横截面研究中发现,相比于非孕期,孕早期和产后期的阴道菌群结构表现出显著性差异,以厌氧菌为优势菌,且菌属多样性上升。LI等[14]对12名健康孕妇孕前、妊娠早、中、晚期和产褥期阴道菌群进行测序分析,发现与孕前和产褥期阴道菌群呈现特征性菌群结构,而妊娠期菌群多样性和结构无显著改变,同WALTHER-ANT?NIO等[15]研究结论一致。
3.2 GDM与非GDM孕妇阴道菌群存在差异
本研究对GDM与非GDM孕妇不同孕周阶段的阴道微生态检测结果进行比较,结果显示,在妊娠24~28周,GDM孕妇阴道菌群的绝对优势菌为乳杆菌,阴道炎症反应较弱,体内致病菌并未处于繁殖高水平,阴道菌群异常发生率、VVC及BV发病率均低。妊娠32~35周时,GDM孕妇阴道内环境趋于紊乱,优势菌为乳杆菌比例逐渐下降,阴道菌群异常发生率逐渐升高。直至妊娠37~40周,相比同期非GDM孕妇,GDM孕妇阴道内乳杆菌数量显著减少,产H2O2功能下降,致病菌数量相对增加,阴道菌群异常发生率显著升高。
由于GDM孕妇葡萄糖代谢功能异常,导致阴道上皮糖原堆叠,过度酸性环境利于致病菌滋生;其次,因高糖状态及胰岛素受体敏感性下降,机体存在免疫异常,外周血CD4+、CD4+/CD8+及NK细胞水平降低,阴道局部免疫功能亦发生改变,微生态失衡,生殖道感染风险增加[12,25-27]。
分子生物学研究结果表明,GDM孕妇阴道菌群中厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)增加[28],嗜酸乳杆菌(L.acidophilus)和詹氏乳杆菌(L.jensenii)丰度上升,卷曲乳杆菌(L.crispatus)和惰性乳酸杆菌(L.iners)丰度相对下降,李氏乳杆菌(L.listeri)、生物嗜淀粉乳杆菌(L.amylovorus)和噬果糖乳杆菌(L.fructivorans)是存在于GDM孕妇阴道中的特有菌群[6]。DI PAOLA等[29]对意大利佛罗伦萨10例妊娠28~32周GDM孕妇阴道细菌群落结构进行聚类分析,发现与非GDM孕妇相比,GDM孕妇表现出更高的菌群多样性。但这是有争议的,也有研究发现两组人群阴道菌群的差异性并不显著[30],王艳[13]对54例GDM孕妇的阴道菌群进行分析,发现厌氧菌为主的阴道群落状态类型(CST Ⅳ)占比增加,可能提示BV患病率上升,但尚未发现与非GDM孕妇间的菌群差异。从表观形态学水平上来看,有研究指出,相比于非GDM孕妇,GDM孕妇阴道菌群密集度Ⅰ级或Ⅳ级、多样性Ⅰ级或Ⅳ级的发生率高,阴道pH较高,更易发生阴道微生态异常,生殖道感染发生率升高[31-32]。本研究不同孕周阶段均未发现GDM与非GDM孕妇阴道菌群密集度及多样性的显著差异。
胰岛素抵抗(insulin resistance,IR)和妊娠期雌孕激素参与了GDM的发生发展[33-34],这种暂时性IR状态在妊娠24~28周快速上升,妊娠32~36周达峰,分娩后逐渐消失[24]。IR的快速增强,导致GDM孕妇体内糖原水平高于同期非GDM孕妇,乳杆菌维持阴道酸性环境,产生H2O2等抗菌物质,抑制致病菌生长,此时适宜的酸性环境有利于乳杆菌的生长[10-11],这种良性循环的存在可能是GDM孕妇在妊娠24~28周阴道微生态相对稳定的重要原因。
而随着妊娠期进展,受持续高糖状态的影响,GDM孕妇体内多糖活性菌类繁殖大量增多,黏附阴道上皮,占据乳杆菌的位置,使乳杆菌含量相对下降,削弱了对致病菌的抑制作用,阴道自净能力下降[35];持续的糖代谢紊乱使免疫球蛋白减少,引起免疫功能失调,机体难以抵抗致病菌侵入[36],导致妊娠晚期时,相比于非GDM,GDM孕妇阴道内乳杆菌数量明显减少,致病菌数量相对增加,阴道菌群异常发生率显著升高,阴道感染风险增加。
3.3 妊娠期阴道菌群异常是发生不良妊娠结局的危险因素
本研究结果显示,相比妊娠期阴道菌群正常者,阴道菌群异常的孕妇其早产、胎膜早破、绒毛膜羊膜炎发生率升高,且妊娠期阴道菌群异常是不良妊娠结局的独立危险因素。STOUT等[37]研究发现,与足月妊娠分娩组相比,早产组妊娠期阴道菌群的多样性、稳定性显著降低。国内也有研究指出早产孕妇的阴道菌群密集度高于足月孕妇[38],表明阴道菌群变化与早产密切相关。妊娠期阴道黏膜免疫系统发生改变,在局部炎症免疫应答反应下,羊膜处胶原蛋白分解,内源性前列腺素释放,引起子宫肌层收缩、宫颈拉伸和宫颈管缩短,如果引发规律性宫缩,进入产程,那么早产将不可避免[12,39]。丁燕玲等[40]对胎膜早破孕妇分娩前的阴道分泌物标本进行检测,发现93.5%的胎膜早破产妇存在阴道微生态失衡,乳酸杆菌比例失调的孕妇发生胎膜早破的危险性较乳杆菌比例正常者增加6.36倍,表明乳杆菌比例下降和胎膜早破相关。
GDM孕妇的不良妊娠结局和死亡风险高,这一点已得到国内外专家共识[41]。本研究结果显示,GDM孕妇在妊娠期间出现阴道菌群异常,较GDM阴道菌群正常者,早产及胎膜早破发生率显著升高,同时,本研究发现妊娠期阴道菌群异常的GDM孕妇发生不良妊娠结局的风险大约是菌群正常的GDM孕妇的1.830倍,表明阴道菌群异常会增加GDM孕妇不良妊娠结局发生风险,推测GDM合并菌群异常孕妇发生宫内感染率较高,尤其是厌氧菌,致病菌群产生磷脂酶A2,诱导宫内局部组织细胞膜磷脂分解,花生四烯酸水平增高,导致前列腺素合成增加,进而增加了早产风险;并且生殖道感染上行易导致胎膜张力下降,出现胎膜早破[32],发生不良妊娠结局的风险增加。
3.4 研究局限性
本研究为单中心研究,且受疫情的影响,研究时间短。本研究仅在表观形态学水平上对阴道菌群进行分类研究,还需要在分子生物学水平上进一步延伸。此外,未对GDM组孕妇妊娠中晚期的血糖达标情况进行亚组分析,还需在后续研究中进一步补充完善。
4 小结
GDM孕妇是产科高危妊娠管理的重点人群,也是全科医生开展社区妇女健康教育、产前检查及其他保健工作的重点特殊人群。本研究在一组GDM和非GDM孕妇的前瞻性队列中,发现GDM孕妇阴道菌群在不同孕周阶段具有不同特点,与非GDM孕妇阴道菌群具有差异性,且妊娠期阴道菌群异常可能会增加不良妊娠结局的风险。因此,建议GDM孕妇有必要在妊娠期不同阶段进行阴道微生态检测,筛查有无生殖道感染,早发现、早诊断、合理干预,以期能减少不良妊娠结局的发生概率。
作者贡献:马秀华提出主要研究目标,负责文章的质量控制与审查,监督管理;杨昕晖负责研究方案设计、实施,撰写报告;赵国玉、郭晶负责数据收集和统计学分析;彭笑笑、马丽丽进行论文修订。
本文无利益冲突。
杨昕晖:https://orcid.org/0009-0003-2015-7398
参考文献
WANG H,LI N H,CHIVESE T,et al. IDF diabetes atlas:estimation of global and regional gestational diabetes mellitus prevalence for 2021 by international association of diabetes in pregnancy study group's criteria[J]. Diabetes Res Clin Pract,2022,183:109050. DOI:10.1016/j.diabres.2021.109050.
GAO C,SUN X,LU L,et al. Prevalence of gestational diabetes mellitus in mainland China:a systematic review and meta-analysis[J]. J Diabetes Investig,2019,10(1):154-162. DOI:10.1111/jdi.12854.
RAVEL J,GAJER P,ABDO Z,et al. Vaginal microbiome of reproductive-age women[J]. Proc Natl Acad Sci USA,2011,108(Suppl 1):4680-4687. DOI:10.1073/pnas.1002611107.
朱艳宾. 妊娠期需氧菌性阴道炎与妊娠结局及母婴B族链球菌感染的相关性研究[D]. 天津:天津医科大学,2013.
SERRANO M G,PARIKH H I,BROOKS J P,et al. Racioethnic diversity in the dynamics of the vaginal microbiome during pregnancy[J]. Nat Med,2019,25(6):1001-1011. DOI:10.1038/s41591-019-0465-8.
ZHANG X H,LIAO Q P,WANG F Y,et al. Association of gestational diabetes mellitus and abnormal vaginal flora with adverse pregnancy outcomes[J]. Medicine,2018,97(34):e11891. DOI:10.1097/MD.0000000000011891.
中华医学会妇产科学分会产科学组,中华医学会围产医学分会,中国妇幼保健协会妊娠合并糖尿病专业委员会. 妊娠期高血糖诊治指南(2022)[第一部分][J]. 中华妇产科杂志,2022,57(1):3-12. DOI:10.3760/cma.j.cn112141-20210917-00528.
中华医学会妇产科学分会感染性疾病协作组. 阴道微生态评价的临床应用专家共识[J]. 中华妇产科杂志,2016,51(10):721-723. DOI:10.3760/cma.j.issn.0529-567x.2016.10.001.
廖秦平. 女性阴道微生态图谱[M]. 北京:人民卫生出版社,2014.
SMITH S B,RAVEL J. The vaginal microbiota,host defence and reproductive physiology[J]. J Physiol,2017,595(2):451-463. DOI:10.1113/JP271694.
BORGES S,SILVA J,TEIXEIRA P. The role of lactobacilli and probiotics in maintaining vaginal health[J]. Arch Gynecol Obstet,2014,289(3):479-489. DOI:10.1007/s00404-013-3064-9.
杨昕晖,马秀华,张琦. 妊娠期女性阴道菌群变化与妊娠结局相关性的研究进展[J]. 中国医刊,2022,57(11):1184-1188. DOI:10.3969/j.issn.1008-1070.2022.11.007.
王艳. 妊娠期阴道微生物群落的分布特点与GDM孕妇妊娠结局的相关性分析[D]. 广州:南方医科大学,2016.
LI D,CHI X Z,ZHANG L,et al. Vaginal microbiome analysis of healthy women during different periods of gestation[J]. Biosci Rep,2020,40(7):BSR20201766. DOI:10.1042/BSR20201766.
WALTHER-ANT?NIO M R S,JERALDO P,BERG MILLER M E,et al. Pregnancy's stronghold on the vaginal microbiome[J]. PLoS One,2014,9(6):e98514. DOI:10.1371/journal.pone.0098514.
林小能,唐袁婷,于凡,等. 妊娠期妇女阴道微生态状况和生殖道感染特征分析[J]. 现代临床医学,2021,47(3):199-201. DOI:10.11851/j.issn.1673-1557.2021.03.012.
唐超人,韩宇春,马双凤,等. 妊娠妇女不同孕周的外周血雌二醇动态水平分析[J]. 海南医学,2016,27(7):1067-1069. DOI:10.3969/j.issn.1003-6350.2016.07.013.
黄嘉昱,杜伯涛. 联合雌、孕激素、β-hCG水平对早期妊娠结局的预测及治疗指导[J]. 中国生育健康杂志,2018,
29(3):274-276. DOI:10.3969/j.issn.1671-878X.2018.03.023.
张镇松,刘秀卿,陈昌龄. 妊娠期外阴阴道假丝酵母菌感染对妊娠结果影响分析[J]. 河北医学,2011,17(4):498-500. DOI:10.3969/j.issn.1006-6233.2011.04.033.
肖冰冰,杨慧霞. 妊娠晚期阴道微生态的改变与围产结局的关系[J]. 实用妇产科杂志,2018,34(10):725-726.
马云燕,钟梅,曹虹,等. 妊娠期阴道乳杆菌含量变化的研究[J]. 实用妇产科杂志,2009,25(12):727-729. DOI:10.3969/j.issn.1003-6946.2009.12.011.
陈进萍,吴开锋,邹晶晶. 产前阴道乳酸杆菌变化及其对早产儿早期肠道菌群的影响分析[J]. 现代诊断与治疗,2019,30(16):2825-2827.
周玉彬,李超,乔炳龙,等. 妊娠期糖尿病患者胎盘组织中雌激素与雌激素受体α水平变化及相关因素分析[J]. 中华糖尿病杂志,2017,9(11):688-692. DOI:10.3760/cma.j.issn.1674-5809.2017.11.005.
谭晶,蒋双玲. 妊娠期糖尿病患者血清性激素水平变化及对糖代谢和胰岛功能的影响[J]. 贵州医药,2019,43(7):1127-1129. DOI:10.3969/j.issn.1000-744X.2019.07.052.
范书红. 妊娠期糖尿病对孕妇及新生儿免疫系统的影响[J]. 实用糖尿病杂志,2017,13(3):28-29.
翁科娜,李璐,张洁琼,等. 妊娠期糖尿病合并生殖道感染危险因素及其免疫状态[J]. 中华医院感染学杂志,2021,31(6):910-914. DOI:10.11816/cn.ni.2021-201928.
陆静尔,王苏华,庞林荣. 2型糖尿病合并感染患者机体免疫功能的变化研究[J]. 现代实用医学,2018,30(11):1473-1475. DOI:10.3969/j.issn.1671-0800.2018.11.024.
CORTEZ R V,TADDEI C R,SPARVOLI L G,et al. Microbiome and its relation to gestational diabetes[J]. Endocrine,2019,
64(2):254-264. DOI:10.1007/s12020-018-1813-z.
DI PAOLA M,SERAVALLI V,PACCOSI S,et al. Identification of vaginal microbial communities associated with extreme cervical shortening in pregnant women[J]. J Clin Med,2020,9(11):3621. DOI:10.3390/jcm9113621.
WANG J F,ZHENG J Y,SHI W Y,et al. Dysbiosis of maternal and neonatal microbiota associated with gestational diabetes mellitus[J]. Gut,2018,67(9):1614-1625. DOI:10.1136/gutjnl-2018-315988.
刘丹,李敏. 妊娠期糖尿病产妇妊娠晚期阴道微生态改变与围产结局的相关性分析[J]. 中国微生态学杂志,2021,33(5):577-580. DOI:10.13381/j.cnki.cjm.202105017.
周芳芳,史娜娜. 妊娠期糖尿病孕妇阴道微生态变化及其对妊娠结局的影响[J]. 中华妇幼临床医学杂志(电子版),2020,16(6):714-719. DOI:10.3877/cma.j.issn.1673-5250.2020.06.014.
徐进芳,冯鑫,徐艺,等. 妊娠晚期糖尿病患者的血清25-羟维生素D3水平和胰岛素抵抗及骨代谢指标的相关性[J]. 医学临床研究,2017,34(5):993-995. DOI:10.3969/j.issn.1671-7171.2017.05.056.
韩云,郑艳莉,吴爱民,等. 妊娠期糖尿病患者胎盘超微结构改变及其影响因素[J]. 山东医药,2016,56(35):59-61. DOI:10.3969/j.issn.1002-266X.2016.35.019.
李亚妮,肖景华,计静,等. 妊娠期糖尿病患者孕晚期阴道微生态状况、血清网膜素、促代谢因子水平变化及临床意义[J]. 陕西医学杂志,2022,51(11):1372-1375,1380. DOI:10.3969/j.issn.1000-7377.2022.11.012.
李丽红,肖泽兰,莫培晖,等. 糖尿病患者妊娠期感染及免疫状态变化观察[J]. 中华医院感染学杂志,2016,26(17):4047-4049. DOI:10.11816/cn.ni.2016-160796.
STOUT M J,TUULI M G,MACONES G A,et al. 30:diversity of the vaginal virome is associated with preterm birth[J]. Am J Obstet Gynecol,2018,218(1):S23. DOI:10.1016/j.ajog.2017.10.441.
李娜,李娇,朱敏玲,等. 孕妇早产与妊娠期阴道微生态环境变化的关系研究[J]. 中国医学前沿杂志(电子版),2020,12(12):130-134. DOI:10.12037/YXQY.2020.12-27.
刘楼,许涵洁,陈道桢,等. 阴道微生态在早产中的研究进展[J]. 中国微生态学杂志,2020,32(5):598-600,605. DOI:10.13381/j.cnki.cjm.202005023.
丁燕玲,傅锦坚,吴宇碧,等. 阴道微生态失衡对胎膜早破影响的调查研究[J]. 现代预防医学,2018,45(19):3533-3536,3540.
王彬苏,周秋明,盛望望,等. 中国妊娠期糖尿病危险因素及妊娠结局的调查分析[J]. 中国医刊,2019,54(9):1014-1019. DOI:10.3969/j.issn.1008-1070.2019.09.028.
(收稿日期:2024-04-10;修回日期:2024-06-11)
(本文编辑:贾萌萌)

