茶树STOP基因家族的鉴定及表达模式分析
龙露 汤丹丹 陈玮 谭礼强 陈盛相 唐茜

摘要:STOP(Sensitive to proton rhizotoxicity)是一类C2H2型锌指结构转录因子,在植物多种胁迫耐受机制中发挥重要调控作用。基于茶树(Camellia sinensis)全基因组数据共鉴定出6个STOP家族基因,并运用生物信息学和实时荧光定量PCR(qRT-PCR)等方法对其进行分析。结果表明,6个CsSTOPs基因编码376~505个氨基酸,蛋白质分子量为42.17~56.36 kDa,理论等电点为5.53~8.85,均为不稳定蛋白;蛋白质保守结构域分析发现,它们均含zf-C2H2保守结构域;系统进化分析显示,茶树的STOP基因与拟南芥、甜橙、烟草的同源性较高;启动子顺式作用元件分析发现,CsSTOPs具有许多与生长发育、激素响应及非生物胁迫相关的作用元件;茶树各器官的转录组数据分析结果表明,CsSTOP1在根、果实、成熟叶片中的表达量较高,CsSTOP2在幼嫩叶片中的表达量较高,CsSTOP3在老叶中的表达量较高,而CsSTOP4和CsSTOP5在各个器官中的表达都较低。CsSTOPs基因能够被PEG诱导的干旱胁迫、盐胁迫、茉莉酸甲酯胁迫和冷胁迫处理诱导表达,说明CsSTOPs基因参与调控茶树生长发育和响应非生物胁迫过程。qRT-PCR检测发现,CsSTOPs、CsGS1s和CsGDHs基因在高NH4+浓度处理(4.5 mmol·L-1)的峨眉问春茶树叶和根中的表达量均高于对照处理(CK),尤其是叶中CsSTOPs、CsGS1.1、CsGS1.3和CsGDH2在高NH4+浓度处理下的表达量显著高于对照。研究结果初步解析了CsSTOPs的基本特征和功能,发现CsSTOPs可响应高NH4+浓度处理,可能与CsGS1s和CsGDHs协同调控茶树适应高NH4+环境的过程。
关键词:茶树;STOP基因家族;生物信息学分析;基因表达
中图分类号:S571.1;Q52 文献标识码:A 文章编号:1000-369X(2024)03-386-13
Identification and Expression Pattern Analysis of STOP Gene Family in Tea Plants (Camellia sinensis)
LONG Lu1, TANG Dandan1,2*, CHEN Wei1,2, TAN Liqiang1,2, CHEN Shengxiang1,2, TANG Qian1,2*
1. College of Horticulture, Sichuan Agricultural University, Chengdu 611130, China;
2. Tea Refining and Innovation Key Laboratory of Sichuan Province, Chengdu 611130, China
Abstract: STOP (Sensitive to proton rhizotoxicity) is a type of C2H2 zinc finger transcription factor, and it plays an important regulatory role in various stress tolerance mechanisms in higher plants. A total of 6 STOP genes were identified based on the whole genome data of tea plant (Camellia sinensis), and analyzed by bioinformatics and real-time fluorescence quantitative PCR. The results show that the six CsSTOP genes encoded 376-505 amino acids, their molecular weights were 42.17-56.36 kDa, and their theoretical isoelectric points were 5.53-8.85, all of which were unstable proteins. Conserved domain analysis of the proteins shows that they all contained zf-C2H2 conserved domain. Phylogenetic analysis shows that tea plant has high homology with Arabidopsis, Citrus sinensis and Nicotiana tabacum. Cis-acting element analysis of the promoter shows that CsSTOPs contain many elements related to growth and development, hormone response and abiotic stress. Transcriptome data analysis of different tissues shows that the expression level of CsSTOP1 was the higher in roots, fruits and mature leaves, the expression level of CsSTOP2 was the higher in young leaves, the expression level of CsSTOP3 was the higher in old leaves, and the expression levels of CsSTOP4 and CsSTOP5 were low in all tissues. The expressions of different CsSTOP genes were induced by PEG-induced drought stress, salt stress, methyl jasmonate stress and cold stress, indicating that CsSTOP genes were involved in the regulation of growth and development of tea plants and response to abiotic stress. Fluorescence quantitative PCR detection shows that the expression levels of CsSTOPs, CsGS1s and CsGDHs in leaves and roots of 'Emeiwenchun' treated with high NH4+ concentration (4.5 mmol·L-1) were higher than those in the control treatment (CK). Particularly, the expression levels of CsSTOPs, CsGS1.1, CsGS1.3 and CsGDH2 were significantly higher than CK in leaves treated with high NH4+ concentration. In this study, the basic characteristics and functions of CsSTOPs were preliminarily analyzed, and it was found that CsSTOPs could coordinate with CsGS1s and CsGDHs genes to regulate the process of tea plant adaptation to high NH4+ environmental availability.
Keywords: tea plant, STOP gene family, bioinformatics analysis, gene expression
STOP(Sensitive to proton rhizotoxicity)是一类C2H2型锌指类转录因子,在植物响应酸铝、盐碱、水分、缺氧等多种胁迫中发挥重要调控作用[1]。STOP1最早是通过图位克隆从拟南芥(Arabidopsis thaliana)EMS突变体库中筛选得到[2]。目前,STOP1基因已经在水稻(Oryza sativa)[3]、烟草(Nicotiana tabacum)[4]、小麦(Triticum aestivum)[5]、大豆(Glycine max)[6]、紫花苜蓿(Medicago sativa)[7]、柱花草(Stybsanthes guianensis)[8]、葡萄(Vitis vinifera)[9]等植物中被克隆鉴定。Kobayashi等[10]在拟南芥中发现,AtSTOP1的同源基因AtSTOP2受AtSTOP1调控并在质子胁迫中起作用。研究发现,STOP1可通过诱导包括ALMT1在内的一系列抗铝毒基因的表达,响应拟南芥酸铝胁迫过程[2]。STOP1通过介导拟南芥中类钙调磷酸酶B亚基蛋白(CBL)相互作用的CIPK23蛋白激酶的表达来调节盐和干旱耐受[11]。在低氧环境下,STOP1可以通过激活HsfA2和GDHs的表达调控植物的低氧耐受性[12]。STOP也参与调控植物耐受铵态氮(NH4+)过程,在外界NH4+浓度达到毒性水平时,STOP1可以直接结合CIPK23启动子区域并激活其表达,下调AMT1转运蛋白的活性,从而避免NH4+过度吸收引起的NH4+毒害作用[13]。由此可知,STOP对植物逆境响应的调控并不局限于酸铝胁迫、低氧胁迫等,其在氮的吸收利用中也发挥着重要的调控作用,推测STOP1可能是一类能介导多种胁迫响应的核心转录因子。
茶树(Camellia sinensis)是我国重要的叶用经济作物,相比其他植物,氮素对其生长发育及品质形成过程更加重要[14]。NH4+作为植物可获取的主要氮素形态之一,大多数植物对NH4+敏感,当其作为唯一或占主导地位的氮素时,多数植物会表现出整体生长受抑制、叶片失绿萎黄、叶面积减小、主根变短侧根增加、根冠比降低等症状,导致产量和品质下降[15-17]。茶树具有偏NH4+利用的营养特性[18]。在施用较多NH4+的条件下,茶树仍然生长良好,而且茶叶品质和产量较佳[14,19-20],即茶树可能有一套独特的适应高NH4+环境的调控机制,其调控机制可能与STOP基因有关。因此,研究STOP在茶树中的表达模式及其对高NH4+环境的响应情况,对进一步探究STOP在茶树适应高NH4+环境中的调控机制具有重要意义。
目前,对茶树STOP(CsSTOP)的研究已有部分报道。李勇[21]研究发现,CsSTOP1可能参与茶树耐铝聚铝的调控;李营营[22]从茶树基因组数据中筛选了4个STOP基因,推测CsSTOP2a和CsSTOP2b在茶树响应酸铝胁迫过程中,可能在调控茶树根中茶氨酸合成等相关基因表达方面发挥着重要作用。目前CsSTOP家族基因在茶树基因组中尚未被鉴定,其在应对环境胁迫中的生物学作用缺乏深入研究,特别是STOP在响应NH4+方面的研究未见报道。因此,本研究基于茶树基因组数据库,对CsSTOP家族基因进行全基因组鉴定,利用生物信息学方法解析CsSTOP家族基因特性,并分析CsSTOP家族成员在茶树不同器官中,以及高NH4+浓度等不同胁迫处理下的表达模式,为进一步探究CsSTOP家族基因在茶树响应高NH4+浓度等不同胁迫环境中的作用提供理论基础。
1 材料与方法
1.1 材料与处理
试验材料为四川省当地特早生茶树品种峨眉问春的一年生扦插茶苗,来源于四川省雅安市名山茶苗繁育基地,试验于四川农业大学水培室进行。
NH4+处理:取生长良好、大小一致的茶苗,根系用蒸馏水清洗后定植于塑料盆中,每盆6株,加入4 L营养液,在纯净水中避光通气预水培一周。随后移至营养液中通气培养,依次用1/16、1/8、1/4、1/2、完全营养液各培养14 d,营养液每周更换1次。营养液配方参照文献[23],大量元素(mmol·L-1)分别为N(1.50)、P(0.10)、K(1.00)、Ca(0.80)、Mg(0.40),微量元素(μmol·L-1)分别为Zn(1.00)、Cu(0.20)、Mn(1.50)、B(10.00)、Mo(0.50)、EDTA-Fe(6.25),并且加入0.07 mmol·L-1的Al。营养液pH约为5.0,用通气泵全天24 h通气。培养温室条件为光周期14L∶10D,温度25 ℃,相对湿度70%~75%。待茶苗长势良好时,进行氮饥饿处理5 d,以消耗幼苗中贮存的氮。预处理结束后转入以(NH4)2SO4为主要氮源的营养液中培养7 d,NH4+浓度设置为4.5 mmol·L-1(HN),以含有2 mmol·L-1 NH4+的营养液处理作为对照组(CK),每个处理3次生物学重复。在处理结束后对茶树的成熟叶与根进行随机取样,用液氮冷冻固样后置于﹣80 ℃保存备用。
1.2 试验方法
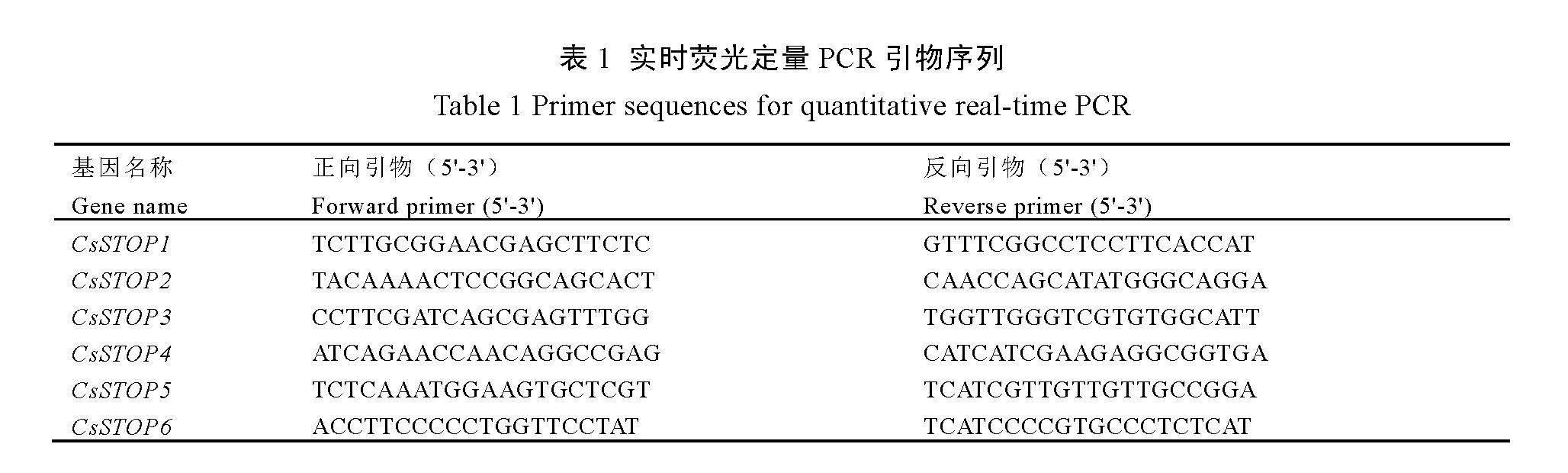
1.2.1 CsSTOPs基因家族成员序列的获取
分别从茶树基因组数据库TPIA2(http://tpia.teaplants.cn)和拟南芥基因组数据库TAIR(www.arabidopsis.org)中获取舒茶早(ShuchazaoV2)和拟南芥的全基因组数据信息。以拟南芥STOP蛋白序列为参考,在茶树基因组数据库中进行BLASTP比对,阈值设定为E<1e-5,经过筛选后获得潜在的CsSTOPs基因家族蛋白序列。将筛选出的CsSTOPs序列用NCBI-BLASTP(https://blast.ncbi.nlm.nih.
gov/Blast.cgi)再比对一次,验证两次比对结果是否一致,再利用NCBI-CDD(www.ncbi.
nlm.nih.gov/Structure/cdd/wrpsb.cgi)、HMMER(www.ebi.ac.uk/Tools/hmmer)、SMART(http://
smart.embl-heidelberg.de)等工具对蛋白序列的保守结构域zf-C2H2(Pfam:PF00096)进行验证,经过整理并去除冗余序列后获得最终的CsSTOPs家族基因序列。
1.2.2 CsSTOPs理化性质和亚细胞定位预测
利用ExPASy protparam(https://web.expasy.
org/protparam)在线工具预测分析CsSTOPs编码蛋白质的分子量(Mw)和等电点(pI)等理化特性。利用Plant-mPLoc(www.csbio.
sjtu.edu.cn/bioinf/plant-multi)在线工具预测分析CsSTOPs编码蛋白亚细胞定位。
1.2.3 CsSTOPs基因家族的系统进化树构建
从NCBI数据库中分别下载拟南芥、烟草、水稻、小麦、甜橙(Citrus sinensis)、苹果(Malus domestica)、桃(Prunus persica)、梨(Pyrus pyrifolia)、樱桃(Prunus dulcis)、玉米(Zea mays)、大豆、花生(Arachis hypogaea)、圭亚那笔花豆(Stylosanthes guianensis)、辣椒(Capsicum annuum)等的STOP序列。利用MEGA 7.0软件中的Clustal W工具将CsSTOPs与这些物种的STOP进行多序列比对,分析CsSTOPs家族的进化关系,并使用邻接法(Neighbor-joining,NJ)构建进化树[24],设置校验参数Bootstrap为1 000次重复,使用Evolview(https://evolgenius.info//evolview-
v2/#login)在线工具进行可视化处理。
1.2.4 CsSTOPs基因结构、蛋白质基序和保守结构域分析
通过在线工具MEME(http://meme-suite.
org)对CsSTOPs的氨基酸序列保守基序进行预测分析,motif数目设置为15个,宽度设置为6~50个氨基酸。从NCBI-CDD数据库(www.ncbi.nlm.nih.gov)提取CsSTOPs序列中相关保守结构域,利用Clustal W进行多序列比对,并结合CsSTOPs基因组DNA序列和CDS序列,利用TBtools软件绘制保守基序图、结构域图及茶树基因结构图[25]。
1.2.5 CsSTOPs染色体分布情况分析
从茶树基因组数据库TPIA2(http://tpia.
teaplants.cn)中获取舒茶早(Shuchazao 2)中CsSTOPs在染色体上的起始位置信息,利用TBtools软件基于基因注释信息对同源关系进行可视化[25]。
1.2.6 CsSTOPs启动子顺式作用元件分析
利用TBtools软件提取CsSTOPs家族基因起始密码子上游2 000 bp序列,通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)在线软件对启动子区顺式作用元件进行预测,利用TBtools软件对整理的结果进行可视化[25]。
1.2.7 CsSTOPs表达模式分析
从茶树基因组数据库TPIA2(http://tpia.
teaplant.org)下载茶树不同器官,以及茶树在干旱胁迫(PEG诱导)、盐胁迫、冷胁迫和茉莉酸甲酯(Methyl jasmonate,MeJA)处理后的CsSTOPs转录组数据(TPM值),利用TBtools软件对数据进行可视化处理[25]。
1.2.8 CsSTOPs在高NH4+浓度下的表达特性分析
按照RNAprep pure多糖多酚植物总RNA提取试剂盒[天根生化科技(北京)有限公司]的要求分别提取不同NH4+浓度处理下茶树成熟叶和根的总RNA,通过凝胶电泳和核酸浓度检测验证其完整性、纯度和浓度。使用PrimeScript? RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒[宝日医生物技术(北京)有限公司]将总RNA逆转录合成cDNA。利用Primer Premier 5软件设计CsSTOPs的qRT-PCR扩增引物(表1),CsGSs和CsGDHs的qRT-PCR引物参照文献等[26-27]方法,选用CsGADPH作为内参基因,引物由北京擎科生物科技有限公司合成。使用Taq SYBR? Green qPCR Premix[兰博利德生物科技(北京)有限公司]试剂盒及BIORAD-CFX96 PCR仪进行qRT-PCR分析。每个样品设置3次重复,采用方法进行基因的相对表达量分析[28]。利用IBM SPSS软件对试验数据进行统计分析,最后使用Origin 2021软件绘图。
2 结果与分析
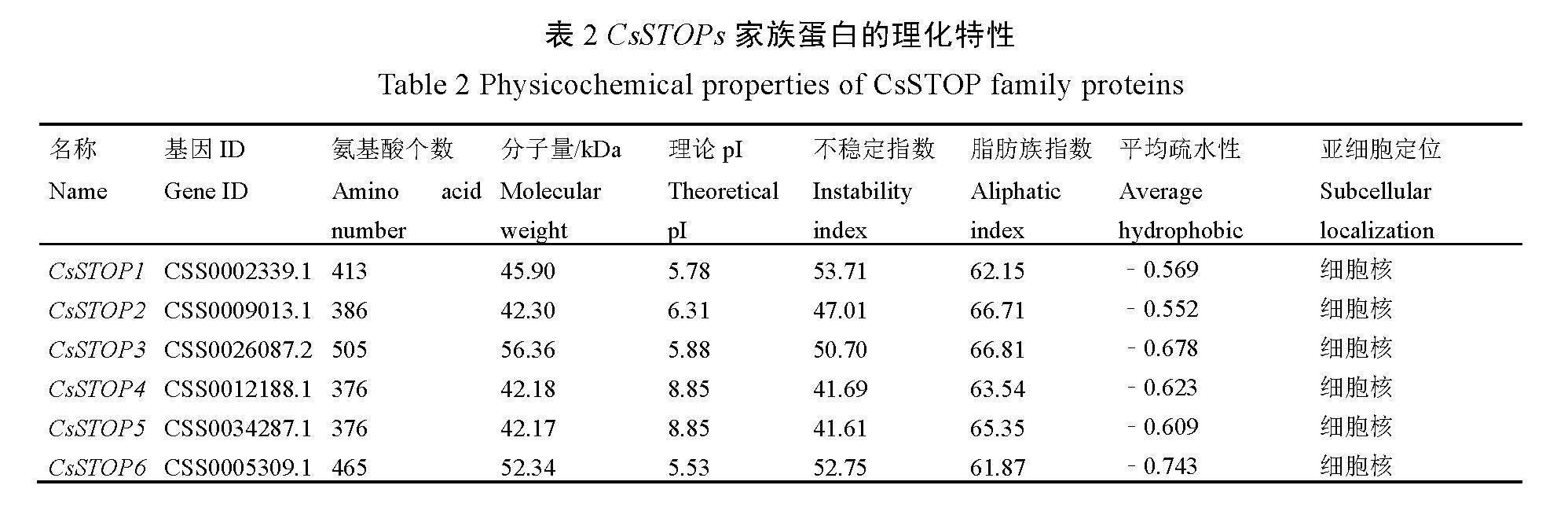
2.1 CsSTOPs家族的鉴定与分析
在茶树基因组中共鉴定出6个CsSTOPs家族成员(表2),分别根据它们在染色体上的分布情况进行命名。蛋白的理化特性分析结果表明,CsSTOPs编码376~505个氨基酸,蛋白的分子量为42.17~56.36 kDa;理论等电点(pI)为5.53~8.85;不稳定性指数为41.61~53.71,均高于40,为不稳定蛋白;脂肪族指数为61.87~66.81;平均疏水性为﹣0.743~
﹣0.552,均为负值,属于亲水性蛋白。亚细胞定位预测分析结果表明,CsSTOPs均分布
于细胞核。
2.2 CsSTOPs系统进化树、基因结构和保守基序分析
将茶树与拟南芥、烟草、水稻、小麦等的STOP蛋白序列构建进化树。结果表明(图1),CsSTOP1与GhSTOP1、CisSTOP1、GmSTOP1等处于同一分支,亲缘关系较近;CsSTOP2、CsSTOP3、CsSTOP6与AtSTOP1、NtSTOP1、CaSTOP1、SgSTOP1等亲缘关系较为密切;CsSTOP4与CsSTOP5在氨基酸序列上具有高度相似性(相似度达99%),并且在进化树上成对出现,与AtSTOP2、PrpSTOP1和PpSTOP1亲缘关系较近。
CsSTOPs的保守基序组成和数目分析结果表明(图2A和2B),CsSTOPs中共鉴定到7个比较保守的基序(motif 1~7),其中motif 1、motif 2和motif 4存在于6个CsSTOPs中,且6个CsSTOPs均含zf-C2H2保守结构域。
2.3 CsSTOPs染色体定位和启动子顺式作用元件分析
利用TBtools软件将鉴定到的6个CsSTOPs进行染色体定位,结果表明(图3),CsSTOPs不均等地定位到4条染色体上(1号、4号、9号、11号),其中CsSTOP1、CsSTOP2、CsSTOP3分别定位到1号、4号、9号染色体上,CsSTOP4、CsSTOP5均定位到11号染色体上。
对CsSTOPs启动子顺式作用元件进行分析,结果表明(图4),CsSTOPs除了具有典型核心启动子元件TATA-box及启动子和增强子区域中常见元件CAAT-box外,还包含光响应元件、生长发育元件、激素响应元件和非生物胁迫响应元件。光响应相关元件主要包括G-box、MRE、Box4、ATCT-motif、TCT-motif、GT1-motif;参与植物生长发育相关的元件包含一些组织特异性元件,例如分生组织表达(CAT-box)、种子特异调控(RY-element)、玉米醇溶蛋白代谢调节(O2-site);激素类响应元件主要涉及生长素(AuxRR-core)、脱落酸(ABRE)、赤霉素(GARE-motif,TATC-box,P-box)、水杨酸(TCA-element)、茉莉酸甲酯(TGACG-motif,CGTCA-motif),其中生长素响应元件只分布于CsSTOP3,脱落酸响应元件只分布于CsSTOP1;非生物胁迫的响应元件主要包括干旱诱导响应元件(MRE)、厌氧诱导必需元件(ARE)、低温诱导响应元件(LTR)及防御和应激反应元件(TC-rich repeats),其中厌氧诱导必需元件分布于每个CsSTOPs;除了CsSTOP2,干旱诱导响应元件在其他5个CsSTOPs中都有分布;低温诱导响应元件仅分布于CsSTOP2和CsSTOP6。
2.4 CsSTOPs在不同器官及不同胁迫下的表达模式
2.4.1 CsSTOPs在茶树不同器官中的表达模式
CsSTOPs在茶树顶芽、嫩叶、成熟叶、老叶、根、茎、花和果实的表达情况如图5所示,CsSTOP1、CsSTOP2、CsSTOP3在各个器官中的表达量相对较高,尤其是CsSTOP1表达水平明显高于其他5个基因。CsSTOP1在果实、成熟叶、根中的表达量较高,CsSTOP2在顶芽、嫩叶、老叶、根和茎中的表达水平均较高,CsSTOP3在老叶和茎中的表达量较高,CsSTOP4、CsSTOP5、CsSTOP6均在根中的表达量相对较高。
2.4.2 CsSTOPs在不同胁迫下的表达模式
为了探究CsSTOPs在茶树响应不同胁迫过程中的调控作用,本研究分别对CsSTOPs在PEG诱导的干旱胁迫处理(0、24、48、72 h)、盐胁迫处理(0、24、48、72 h)、茉莉酸甲酯处理(0、12、24、48 h),以及冷处理(非驯化CK、完全驯化CA1、去驯化CA3)后的转录组数据进行分析。
在干旱胁迫下(图6A),除了CsSTOP5,其余CsSTOPs均被不同程度地诱导表达,其中CsSTOP1、CsSTOP3、CsSTOP6的表达量随干旱处理时间增加逐渐增加,在72 h时表达量最高。CsSTOP2、CsSTOP4在干旱处理24 h后表达量急剧增加,但处理48 h后表达量有所下降,CsSTOP2表达量在处理72 h后达到最高,CsSTOP4在处理72 h后表达水平略有升高。
在盐胁迫处理下(图6B),除了CsSTOP5,其余CsSTOPs均被不同程度地诱导表达,其中CsSTOP1、CsSTOP3的表达量随盐胁迫处理时间延长逐渐增加,在72 h时表达水平最高。CsSTOP2、CsSTOP6在盐胁迫处理24 h后表达量明显提高,在处理48 h后表达水平降低,CsSTOP2、CsSTOP6在处理72 h后表达量略有升高,CsSTOP4的表达量在盐胁迫处理24 h后略有上调,在48、72 h后逐渐下降。
在茉莉酸甲酯诱导下(图6C),CsSTOP1、CsSTOP2、CsSTOP3、CsSTOP4、CsSTOP6的表达量在MeJA处理12 h和24 h时被不同程度地抑制,其中CsSTOP1、CsSTOP2、CsSTOP3、CsSTOP4在MeJA处理48 h被诱导上调表达,CsSTOP6仍被抑制表达。CsSTOP5在MeJA处理12 h时被诱导上调表达,而后表达量逐渐下降。
在冷处理下(图6D),CsSTOP2、CsSTOP4、CsSTOP5、CsSTOP6的表达量在CA1处理下急剧上调,CsSTOP3的表达量在CA1处理下略有上调,在CA3处理下被抑制表达。而CsSTOP1在CA1处理下的表达量没有明显变化,在CA3处理下的表达量急剧增加。
2.5 CsSTOPs对高NH4+浓度处理的响应分析
选取茶树中参与NH4+同化的关键基因—谷氨酰胺合成酶编码基因(GS)和谷氨酸脱氢酶编码基因(GDH),通过qRT-PCR分析高NH4+浓度处理下CsGS1s、CsGDH及6个CsSTOPs在茶树成熟叶及根中的表达情况。结果显示(图7和图8),茶树成熟叶中,几乎所有CsSTOPs在高NH4+处理下的表达水平较对照显著上调,大部分CsGS1s和CsGDHs的表达水平也显著高于对照。在根中,高NH4+处理下CsSTOP1的表达水平略高于对照,大部分CsSTOPs的表达水平与对照差异不大,CsGDHs和CsGS1s的表达水平均略高于对照,其中CsGDH1和CsGS1.3差异较为明显。
3 讨论
STOP转录因子在植物生长发育及多种胁迫耐受机制中发挥重要作用,参与调节营养元素的吸收,也参与调控植物响应酸铝、盐碱、水分、缺氧等各种逆境胁迫过程[1]。目前,STOP1已在多个植物中被克隆与分析,但多集中于模式植物拟南芥及草本植物,在木本植物中的相关研究较少,并且对STOP1功能研究多集中于植物耐酸铝胁迫方面。研究发现,转录因子STOP1在高NH4+浓度环境下可以通过直接促进CIPK23蛋白激酶的表达而负调控AMT1的活性,从而避免过度吸收NH4+带来的毒害作用[13,29]。由此说明,转录因子STOP1在植物适应高NH4+浓度环境中可能起着重要的调控作用。
本研究基于茶树全基因组数据共鉴定出6个CsSTOPs,系统进化分析表明,CsSTOPs与AtSTOP1、AtSTOP2、GhSTOP1、CisSTOP1、NtSTOP1等进化关系较近。AtSTOP参与植物多种逆境胁迫过程,说明CsSTOPs基因可能具有相似的功能。6个CsSTOPs具有典型的C2H2锌指结构蛋白,启动子区域中包含许多激素响应元件和非生物胁迫响应元件,说明CsSTOPs可能在茶树的生长发育过程及逆境胁迫响应中发挥重要作用。顺式作用元件参与基因表达的调控,与基因功能密切相关,有研究发现,NH4+升高可以显著加速组织内源ABA的积累,ABA通过增强抗氧化酶活性来降低NH4+诱导的氧化损伤[30]。本研究发现,ABA响应元件(ABRE)仅存在于CsSTOP1的启动子中,说明CsSTOP1可能与茶树适应高NH4+环境密切相关。基因的组织表达特征可以在一定程度上反映基因的功能,研究指出,GmSTOP1-1、GmSTOP1-2和GmSTOP1-3在根中的表达量较高,超量表达GmSTOP1-3能够提高转基因株系的根表面积、总根长和侧根长[6,31]。本研究发现,CsSTOPs在不同器官中的表达具有明显的特异性,其中CsSTOP1在果实、成熟叶、根中的表达量最高,CsSTOP2在嫩叶中的表达量最高,CsSTOP3在老叶中的表达量最高,CsSTOP4、CsSTOP5、CsSTOP6均在根中的表达量最高。这些结果表明,CsSTOPs可能在茶树的果实、花、叶片、根、茎中发挥不同作用,而CsSTOP1在3个器官中有较高的表达水平,其可能参与茶树多个器官的生长发育及相关生物学功能的调控。本研究分析发现,CsSTOPs能够响应多种胁迫过程,可能在茶树响应非生物胁迫过程中发挥重要作用。
研究显示,植物耐NH4+性和其NH4+同化能力有很大的关系,转录因子STOP1在植物耐NH4+性中起着重要作用[13]。GS和GDH是植物NH4+同化过程的关键基因,它们的表达和NH4+浓度的变化有很大关联[26]。在拟南芥[32]和番茄[33]中,高NH4+浓度条件下,植株可以提高GS与GDH活性来增强对NH4+的利用。此外,在拟南芥铝抗性研究中,STOP1能激活GDH表达,尤其是GDH2[34]。由此推测,STOP1可能与NH4+同化基因共同调控茶树适应高NH4+浓度环境过程。为进一步探究CsSTOPs与茶树适应高NH4+浓度环境的关系,本研究对茶树根及成熟叶中CsSTOPs及NH4+同化关键基因CsGS1s和GsGDHs在高NH4+浓度处理下的表达量进行分析,发现茶树成熟叶中CsSTOPs、CsGS1s和CsGDHs的表达量均显著高于对照,表明它们可能在茶树适应高NH4+浓度环境的过程中发挥重要作用。高NH4+浓度处理下的茶树成熟叶中CsGS1s和CsGDHs的变化趋势与前人研究结果基本一致[26,35]。高NH4+浓度处理下,CsSTOP1在茶树叶和根中的表达趋势与CsGS1.1和CsGDH2基本一致,表明三者可能在调控茶树适应高NH4+浓度环境的机制中存在一定的相关性,为茶树在NH4+浓度过高的环境中仍能保持正常生长提供支撑。
参考文献
14马哲宇, 高可可, 李桂新, 等. STOP1介导多种逆境响应分子机制的研究进展[J]. 植物生理学报, 2023, 59(4): 773-781.
Ma Z Y, Gao K K, Li G X, et al. Research progress of the molecular mechanisms of STOP1 in various stress responses [J]. Plant Physiology Journal, 2023, 59(4): 773-781.
15Iuchi S, Koyama H, Iuchi A, et al. Zinc finger protein STOP1 is critical for proton tolerance in Arabidopsis and coregulates a key gene in aluminum tolerance [J]. Proceedings of the National Academy of Sciences, 2007, 104(23): 9900-9905.
16Yamaji N, Huang C F, Nagao S, et al. A zinc finger transcription factor ART1 regulates multiple genes implicated in aluminum tolerance in rice [J]. Plant Cell, 2009, 21(10): 3339-3349.
17Yoshinao O, Hiroki I, Yuriko K, et al. Characterization of AtSTOP1 orthologous genes in tobacco and other plant species [J]. Plant Physiology, 2013, 162(4): 1937-1946.
18Luísa G A, César B, Pilar P, et al. Molecular characterization of TaSTOP1 homoeologues and their response to aluminium and proton (H+) toxicity in bread wheat (Triticum aestivum L.) [J]. BMC Plant Biology, 2013, 13(1): 134. doi: 10.1186/1471-2229-13-134.
19丛亚辉, 王婷婷, 柳聚阁, 等. 大豆耐铝毒候选基因GmSTOP1的克隆与表达分析[J]. 作物学报, 2015, 41(12):1802-1809.
Cong Y H, Wang T T, Liu J G, et al. Cloning and expression analysis of tolerance to aluminum-toxicity candidate gene GmSTOP1 in soybean [J]. Acta Agronomica Sinica, 2015, 41(12): 1802-1809.
20张宝云. 紫花苜蓿铝胁迫响应基因MsMATE与MsSTOP1的功能与表达调控研究[D]. 重庆: 重庆大学, 2017.
Zang B Y. Function and expression regulation of aluminum-responsive genes MsMATE and MsSTOP1 in Medicago sativa [D]. Chongqing: Chongqing University, 2017.
21罗佳佳, 向晨莹, 刘攀道, 等. 柱花草SgSTOP1和SgSTOP2基因的克隆与表达分析[J]. 草业科学, 2019, 36(3): 704-712.
Luo J J, Xiang C Y, Liu P D, et al. Cloning and expression analysis of SgSTOP1 and SgSTOP2 in Stylosanthes guianensis [J]. Pratacultural Science, 2019, 36(3): 704-712.
22张永福, 徐仕琴, 陈姣, 等. 葡萄耐铝毒基因STOP1的克隆与表达分析[J]. 西南农业学报, 2022, 35(3): 588-595.
Zhang Y F, Xu S Q, Chen J, et al. Cloning and expression analysis of tolerance to aluminum-toxicity gene STOP1 in Vitis [J]. Southwest China Journal of Agricultural Sciences, 2022, 35(3): 588-595.
23Kobayashi Y, Ohyama Y, Kobayashi Y, et al. STOP2 activates transcription of several genes for Al- and low pH-tolerance that are regulated by STOP1 in Arabidopsis [J]. Molecular Plant, 2014, 7(2): 311-322.
24Sadhukhan A, Enomoto T, Kobayashi Y, et al. Sensitive to proton rhizotoxicity1 regulates salt and drought tolerance of Arabidopsis thaliana through transcriptional regulation of CIPK23 [J]. Plant and Cell Physiology, 2019, 60(9): 2113-2126.
25Enomoto T, Tokizawa M, Ito H, et al. STOP1 regulates the expression of HsfA2 and GDHs that are critical for low-oxygen tolerance in Arabidopsis [J]. Journal of Experimental Botany, 2019, 70(12): 3297-3311.
26田文昊. 拟南芥STOP1蛋白协同氮磷营养的分子机制研究[D]. 杭州: 浙江大学, 2021.
Tian W H. Mechanisms of nitrogen and phosphorus acquisition coordinated by STOP1 in Arabidopsis [D]. Hangzhou: Zhejiang University, 2021.
27方翔, 胡国策, 孙琪璐, 等. 氮素形态对茶树叶片品质及其氮代谢相关基因的影响[J]. 西北农林科技大学学报(自然科学版), 2020, 48(2): 52-59.
Fang X, Hu G C, Sun Q L, et al. Effects of nitrogen forms on tea quality and nitrogen metabolism related genes in tea leaves [J]. Journal of Northwest A & F University (Natural Science Edition), 2020, 48(2): 52-59.
28Britto D T, Kronzucker H J. NH4+ toxicity in higher plants: a critical review [J]. Journal of Plant Physiology, 2002, 159(6): 567-584.
29Bittsánszky A, Pilinszky K, Gyulai G, et al. Overcoming ammonium toxicity [J]. Plant Science, 2015, 231(1): 184-190.
30范子晗. 柑橘铵毒害产生机制及缓解措施研究[D]. 重庆: 西南大学, 2021.
Fan Z H. Study on the mechanism and relative alleviation measures of ammonium toxicity to citrus [D]. Chongqing: Southwest University, 2021.
31Tang D D, Liu M Y, Zhang Q F, et al. Preferential assimilation of NH4+ over NO3- in tea plant associated with genes involved in nitrogen transportation, utilization and catechins biosynthesis [J]. Plant Science, 2020, 29: 110369. doi: 10.1016/j.plantsci.2019.110369.
32Wang Y, Wang Y M, Lu Y T, et al. Influence of different nitrogen sources on carbon and nitrogen metabolism and gene expression in tea plants (Camellia sinensis L.) [J]. Plant Physiology and Biochemistry: PPB, 2021, 167(1): 561-566.
33胡国策, 蒋家月, 田坤红, 等. 氮素形态和水平对茶树生理特性的影响[J]. 安徽农业大学学报, 2018, 45(4): 588-593.
Hu G C, Jang J Y, Tian K H, et al. Effects of nitrogen forms and nitrogen levels on the physiological characteristics of tea plants [J]. Journal of Anhui Agricultural University, 2018, 45(4): 588-593.
34李勇. 茶树响应铝的遗传变异及铝富集候选基因挖掘[D]. 武汉: 华中农业大学, 2017.
Li Y. The genetic variation of tea plant [Camellia sinensis (L.) O. Ktze.] in response to aluminum and candidate genes related to its Al accumulation [D]. Wuhan: Huazhong Agricultural University, 2017.
35李营营. 茶树根系酸铝胁迫与茶氨酸合成积累的相关性研究[D]. 合肥: 安徽农业大学, 2019.
Li Y Y. Study on the correlation between aluminum stress under acidic conditions and theanine synthesis and accumulation in roots of tea plant (Camellia sinensis L.) [D]. Hefei: Anhui Agricultural University, 2019.
36Ruan J Y, Gerendas J, H?rdter R, et al. Effect of root zone pH and form and concentration of nitrogen on accumulation of quality-related components in green tea [J]. Journal of the Science of Food and Agriculture, 2007, 87(8): 1505-1516.
37Newman L, Duffus A L J, Lee C. Using the free program MEGA to build phylogenetic trees from molecular data [J]. The American Biology Teacher, 2016, 78(7): 608-612.
38Chen C J, Chen H, Zhang Y, et al. TBtools: an integrative toolkit developed for interactive analyses of big biological data [J]. Molecular Plant, 2020, 13(8): 1194-1202.
39Tang D D, Jiao Z X, Zhang Q F, et al. Glutamate dehydrogenase isogenes CsGDHs cooperate with glutamine synthetase isogenes CsGSs to assimilate ammonium in tea plant (Camellia sinensis L.) [J]. Plant Science, 2021, 312: 111031. doi: 10.1016/j.plantsci.2021.111031.
40汤丹丹. 茶树胞质型谷氨酰胺合成酶基因CsGS1s的克隆及其对不同氮源的响应[D]. 北京: 中国农业科学院, 2018.
Tang D D. Isolation of cytosolic glutamine synthetase genes CsGS1s and their experssion in tea plant (Camellia sinensis L.) under different nitrogen forms [D]. Beijing: Chinese Academy of Agricultural Sciences, 2018.
41Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the method [J]. Methods, 2001, 25(4): 402-408.
42Tian W H, Ye J Y, Cui M Q, et al. A transcription factor STOP1-centered pathway coordinates ammonium and phosphate acquisition in Arabidopsis [J]. Molecular Plant, 2021, 14(9): 1554-1568.
43Sun L, Di D W, Li G, et al. Endogenous ABA alleviates rice ammonium toxicity by reducing ROS and free ammonium via regulation of the SAPK9-bZIP20 pathway [J]. Journal of Experimental Botany, 2020, 71(15): 4562-4577.
44彭文婷. 大豆GmSTOP1s基因家族的克隆和功能研究[D]. 广州: 华南农业大学, 2016.
Peng W T. Isolation and function analysis of GmSTOP1s gene family [D]. Guangzhou: South China Agricultural University, 2016.
45韩庆芬, 陈海飞, 张振华. 不同生态型拟南芥耐铵毒害差异的生理机制[J]. 植物营养与肥料学报, 2019, 25(7): 1185-1193.
Han Q F, Chen H F, Zhang Z H, et al. Physiological mechanisms of tolerance to ammonium toxicity in different ecotypes of Arabidopsis thaliana [J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(7): 1185-1193.
46Vega-Mas I, Rossi M T, Gupta K J, et al. Tomato roots exhibit in vivo glutamate dehydrogenase aminating capacity in response to excess ammonium supply [J]. Journal of Plant Physiology, 2019, 239(1): 83-91.
47Tokizawa M, Enomoto T, Ito H, et al. High affinity promoter binding of STOP1 is essential for early expression of novel aluminum-induced resistance genes GDH1 and GDH2 in Arabidopsis [J]. Journal of Experimental Botany, 2021, 72(7): 2769-2789.
48Liu M Y, Tang D D, Shi Y Z, et al. Short-term inhibition of glutamine synthetase leads to reprogramming of amino acid and lipid metabolism in roots and leaves of tea plant (Camellia sinensis L.) [J]. BMC Plant Biology, 2019, 19(1): 425. doi: 10.1186/s12870-019-2027-0.

