禾本科杂粮作物养分高效机理及指标研究进展
王京新 赵宇 夏雪岩 崔纪菡 魏志敏 李顺国

摘要: 我国耕地中低产田面积大,养分缺乏始终是限制作物产量的一个主要因素。谷子、糜子和高粱为我国传统的禾谷类杂粮作物,具有光合效率高,耐旱耐瘠薄的特点,较大宗粮食作物更适应干旱、贫瘠的土壤。然而,养分利用效率研究主要集中在玉米、小麦等主粮作物,小杂粮作物研究进展相对缓慢。本文系统总结了谷子、糜子和高粱氮、磷、钾高效利用的研究结果,归纳了几种杂粮作物养分高效的筛选指标,形态指标包括地上部干重、穗粗、穗重、草重、产量等,生理指标包括氮同化酶活性、磷积累量、光合养分效率等,养分吸收效率主要指标包括根系大小、根系长度、侧根分支和根直径,及可能参与养分高效的候选基因如NRT1、PHR1、钾转运蛋白HAK 和钾离子通道蛋白Shaker 等。未来可从以下几方面推进杂粮作物养分高效的研究:杂粮作物光合效率高和根系耐旱耐贫瘠的特点;利用转录组学方法深入分析引起杂粮作物光合作用和养分吸收效率的种间和种内变异的机理,特别是与氮组分、磷组分变化相关的机制;分析杂粮作物的根系形态及其主导的根系微生物互作特征对养分高效吸收的影响。这些研究将为培育养分高效高产的杂粮品种和高效栽培技术提供理论基础和指导。
关键词: 谷子; 糜子; 高粱; 养分高效; 光合; 根系
在植物必需的18 种必需营养元素中,除碳、氢、氧可直接从空气中得到外,其余均主要来自土壤。对几乎所有植物而言,氮素均为需求量大且容易缺乏的元素,农业上需要施用氮肥满足作物的生长发育需求,而氮肥的大量施用会导致空气污染、土壤酸化等问题。磷是植物生长发育的第二大必需营养元素,由于极易被土壤固定和移动性差,土壤中可利用有效磷含量较低,过量施用磷肥不仅会造成水体富营养化等环境问题,还可能导致磷矿资源的耗竭。钾在植物细胞渗透势和酶活化等过程中的作用无可替代,我国土壤缺钾趋势日益显现,但钾肥资源不足。培育氮、磷、钾高效的作物品种,以较低的化肥投入获得高产,满足日益增长的粮食需求,是农业绿色发展的迫切需求。谷子(Setariaitalica)、糜子[Panicum miliaceum (L.)] 和高粱[Sorghum bicolor (L.) Moench] 是我国的主要杂粮作物,谷子起源于我国,耐旱耐贫瘠,它的基因组较小,是C4 禾谷类作物研究的模式植物[1]。糜子也起源于中国,有上万年的种植历史,具有抗旱、抗高温、耐贫瘠的特性,是一种中国北方冷凉地区的战略储备作物[2]。高粱在我国已有3000 年的种植史,既是重要的粮食作物,又是饲草作物,通常种植在低肥力的边际土壤,具有耐瘠薄的特性[3]。谷子、糜子和高粱均为C4 作物,有更高的光合效率和氮素利用效率[4],是研究作物养分高效利用的理想材料。本文对谷子、糜子和高粱的氮、磷、钾高效利用研究进展进行综述。
1 禾本科杂粮作物养分高效的种质资源鉴定
1.1 氮高效种质资源的鉴定指标筛选
谷子氮效率研究主要集中于不同氮效率资源的鉴定和初步的生理分析。不同生态型的谷子氮效率存在差异,春谷氮高效型的比例较高,而华北夏谷氮低效型的比例最高[5]。谷子品种的氮效率或低氮耐性也有差异,低氮时谷子幼苗株高、生物量等指标均降低,基因型间幼苗相对干物重差异较大,可以作为谷子苗期氮效率筛选的一个指标[5?8]。谷子从出苗至抽穗期对低氮的影响均较敏感,低氮降低谷子产量[9],因此,产量是衡量谷子氮效率的最终指标。黄兴东[ 7 ]和张立媛等[ 9 ]发现,成熟期谷子穂粗、穗重、穗粒重、草重也可以作为谷子耐低氮品种筛选的重要指标。秦娜等[10]发现,谷子产量与吸氮量、氮利用效率极显著相关,与光合速率、氮代谢相关酶活性等指标呈正相关,与茎秆和根氮含量呈显著负相关,氮高效型谷子通常具有较高的氮吸收量和较低的根、茎氮含量,因此,谷子成熟期穗部性状也可用于判断谷子品种的耐低氮性。
增加氮的供应,糜子叶绿素含量、株高、产量等均增加[11?12]。氮缺乏时,糜子旗叶的净光合速率降低导致生物量降低,叶片中碳氮比增加加速了叶片的衰老,降低了氮的吸收和利用效率,导致产量也随之降低[13]。张美俊等[14]通过氮磷钾肥效田间试验,发现氮肥用量是影响糜子产量的关键因素,氮磷钾肥适量配施使糜子增产显著。张永清等[15]研究却表明,磷对黍子根系的影响最大,是影响生土地黍子产量和品质的首要因素。Liu 等[16]对耐低氮和低氮敏感糜子进行生理分析,发现耐低氮糜子品种在低氮胁迫时的氮吸收和利用效率更高,光合能力更强。氮积累量、干物质量、根冠比和地上部氮利用率可作为糜子苗期耐低氮评价的主要指标。陈凌等[17]在大田条件下对100 份糜子品种的耐低氮能力进行评价,结果表明单株穗重、秸秆重和氮吸收量可以作为耐低氮糜子筛选的首选指标,榆糜3 号、2058、榆黍1 号、雁黍7 号4 个品种的耐低氮能力最强。糜子苗期和成熟期籽粒的氮、磷积累量在品种间差异显著,并且与产量呈正相关[18]。
施氮量也是影响高粱产量和品质的重要因素,随着施氮量增加,高粱籽粒产量增加,籽粒蛋白质含量提高,而淀粉含量降低[19]。刘鹏等[20]发现,耐低氮型高粱有着较高的相对氮利用效率,叶片中氮同化酶活性较高是耐低氮的生理基础。杨广东[21]以田间产量为指标,筛选耐低氮和低氮敏感型高粱品种,发现低氮敏感基因型高粱对氮素的响应更显著,叶绿素b、支链淀粉对低氮较敏感;硝酸盐转运体基因NRT 在耐低氮基因型中更丰富,可作为提高高粱氮素利用效率的候选基因。3 种杂粮作物已报道的氮磷钾高效的农学和生理学性状指标见表1。
1.2 磷高效种质资源的鉴定和筛选
低磷影响粟类作物的生长和籽粒产量[22]。低磷时谷子植株的生长高度和种子产量均降低,侧根数目和长度增加,引起根系的增大,同时磷转运蛋白SiPHT1 的表达量增加[23?25]。不同谷子基因型间的低磷响应存在差异,Ceasar 等[26]比较了54 个谷子基因型对低磷的响应,发现大田低磷条件下谷子的株高、叶片数目和产量,以及温室低磷条件下谷子的根毛数目、根和地上部干重等在不同基因型间差异较大。该研究主要是利用国外的谷子品种,我国生产的谷子占世界的80%,国内谷子品种的耐低磷和磷高效研究也有了一定进展。邱双等[27?28]利用盆栽试验,比较了不同谷子品种营养期的耐低磷能力,筛选出磷高效的谷子品种,将磷高效划分为磷吸收、转运、利用效率高效和综合型高效,分析不同磷效率谷子的生理特性表明谷子根长对磷效率的影响较大。通过分析谷子苗期和成熟期的磷效率筛选指标,结果表明苗期的地上部磷积累量、地上部干物质重,以及成熟期的籽粒产量和籽粒磷积累量在不同谷子品种间对低磷的敏感性差异较大[29]。一些研究分别通过盆栽和水培试验,鉴定了谷子核心种质资源的耐低磷能力,采用综合指标对谷子的耐低磷特性进行评价,筛选出低磷耐受和低磷敏感型谷子品种,并且发现施磷影响谷子的品质[30?33]。综上,虽然磷高效谷子不同时期有多项筛选指标,但根长对磷效率的影响较大,应加强研究不同时期谷子根系与磷效率的关系。
高粱产量与磷水平密切相关[34?35],磷主要分布于高粱的穗和籽粒中[36],高粱的苗期、生殖期(拔节到开花)、结实阶段(开花到成熟期) 均需磷肥供应[37]。低磷胁迫时,高粱幼苗形态指标均受到影响,其中地上部干重和含磷量所受影响较大,可作为高粱苗期耐低磷筛选的指标[35, 38]。高粱的生殖期和结实期需磷量远大于苗期[37],以产量为指标筛选磷高效高粱很有必要,研究表明磷吸收效率是耐低磷型高粱维持较高产量的主要原因[23]。Leiser 等[34]的研究也表明,西部和中部非洲地区(WCA) 农家种能够生长在低磷的土壤中,主要是由于较高的磷吸收效率,同时发现磷吸收效率与光周期敏感性相关。磷高效高粱还可以通过体内有机磷、无机磷的分配实现植株体内磷的高效利用,以补偿较低的磷吸收效率[39]。水稻蛋白激酶基因OsPSTOL1 (PHOSPHORUS-STARVATIONTOLERANCE1) 在高粱中的同源基因SbPSTOL1 与低磷条件下高粱的根长、根表面积相关,可通过改变根系的形态和结构,实现低磷条件下的籽粒增产,因此较高的磷吸收效率是高粱适应低磷土壤的主要原因[40]。高粱中耐受铝毒的基因SbMATE 同时调控低磷条件下的产量,通过影响柠檬酸分泌活化固定于土壤中的磷[41],或者通过增强耐受铝毒基因型中的根发育来增加磷的吸收[42]。综上,通过改变高粱的根系提高磷吸收效率是提高其磷效率的重要途径。
1.3 钾高效种质资源的鉴定和筛选
钾在植物生理过程中起着重要作用,如气孔孔径调节、酶激活、渗透调节、蛋白质和淀粉合成等[43]。低钾显著抑制谷子的生长,影响株高、叶面积、生物量、产量等,原因在于低钾使气孔导度降低、光合色素减少、电子传递受阻、光合关键酶活性降低,从而降低净光合速率[44?47]。万凯旋[47]筛选出耐低钾品种张杂谷13 和低钾敏感品种大白谷,低钾条件下张杂谷13 能够保持较高的光合钾利用率和发达的根系;初步明确了谷子苗期耐低钾品种筛选的主要指标包括相对地上部干重、相对地下部鲜重、相对总根长等。施用钾肥能够提高谷子的生物量、水分利用效率(WUE) 和产量,还能够促进谷子对N、P、Fe 等的吸收,抑制Ca、Mg、Mn 的吸收[ 4 6 , 4 8 ? 5 0 ]。谷子转录因子基因SiNAC45 被低钾和ABA 诱导表达,通过调控钾离子转运体基因的表达提高低钾耐受性[51]。SiHAK1 是谷子中的高亲和钾转运蛋白基因,参与了谷子低钾时的钾平衡维持[52]。
梁诗涵[53]采用水培试验研究280 份糜子种质资源的耐低钾能力,提出株高、地上部干重等8 个性状可作为苗期糜子钾高效的筛选指标,筛选出钾高效糜子品种Var189 和Var87,低钾敏感品种Var116,钾高效糜子品种的根系较发达,光合色素含量更高,钾吸收效率是糜子钾利用效率差异的主要因素。由此看来,钾高效的谷子和糜子根系发达、光合效率高。
钾主要分布于高粱的茎秆中[36],生殖期前需钾量最高,钾肥对高粱增产效果明显,并且能显著改善高粱的品质,降低单宁含量[54]。氮、磷、钾合理配施对高粱的增产效应较显著[36]。Zhu 等[55]发现高粱缺氮导致叶片黄化和生长迟缓,缺磷引起叶片直立,而缺钾引起叶片下垂和叶尖坏死,氮磷钾同时缺乏的表型与缺氮相似,如叶片黄化、生长迟缓;缺氮和缺磷均对根冠比和根长有较强影响,而缺钾并不影响根冠比,缺氮、缺磷和缺钾均导致地上部干重降低,缺钾时根干重最低,缺磷对根干重影响不大,氮磷钾同时缺乏对根冠比和干重的影响较单缺一种养分更强。表1 总结了已报道的杂粮作物的氮磷钾高效指标。
2 利用分子技术挖掘杂粮作物养分高效基因
发掘养分高效的种质资源,培育高产高效的作物品种是实现绿色节肥农业的有效途径。解析杂粮作物养分高效的遗传机制,挖掘养分高效的主效基因位点,将为精准育种提供理论基础。国内外在谷子、糜子和高粱养分高效遗传解析、基因定位等方面取得了一系列进展。
QTL (quantitative trait locus) 是鉴定控制目标性状基因的有力工具,开发重要QTLs 的分子标记能够提高育种效率。谷子中已对产量、籽粒重、开花时间等性状进行QTL 定位,然而尚缺乏耐低磷、耐低氮性状基因的QTL 定位。其它小粒粟类中已有耐低磷QTL 报道,手指粟中已鉴定出低磷相关性状,如根长、地上部干重、磷含量等的QTL 位点[56?57];珍珠粟中也已报道秸秆的磷浓度、籽粒磷浓度、磷吸收、磷利用效率等QTL 位点[58]。
GWAS (genome wide association study) 是一种利用全基因组SNPs 标记剖析复杂农艺性状遗传结构的有效方法。Bandyopadhyay 等[59]利用GWAS 鉴定出谷子中氮依赖的籽粒数目基因位点。苑乂川[31]对不同磷浓度下287 份谷子核心种质的性状及各性状的耐低磷系数进行了全基因组关联分析(GWAS),筛选出与耐低磷性状极显著关联的SNP 标记,预测了耐低磷候选基因。李萍[32]对谷子苗期的17 个性状进行全基因组关联分析,筛选出磷代谢相关的基因Si7g32390,并对其在部分种质中进行单倍型分析。
组学(转录组学、蛋白组学、代谢组学等) 已经成为多种作物鉴定重要农艺性状的候选基因/QTL 的工具。Chen 等[60]通过转录组学分析表明,低氮耐受品种济谷20 低氮响应的差异表达基因(DEG) 更多,而且这些低氮响应基因主要集中在糖酵解、光合、氨基酸合成等方面。Xing 等[ 6 1 ]利用转录组学分析谷子的低磷响应分子机制,鉴定出大量低磷响应基因,其中包括植物低磷响应的关键转录因子基因PHR1 (PHOSPHATE STARVATION RESPONSE 1)。谷子低氮响应机制的转录组学分析也有一定进展,发现低氮胁迫谷子中的转录因子MYB、NF-YA6、磷酸酶PP2C 基因和细胞自噬基因SiATG8a 家族受低氮诱导表达,超表达植株的低氮抗性增强[62?65]。耐低钾谷子品种“Yugu28”中共鉴定出4254 个差异表达基因,其中MYB 转录因子所占比重较高;将筛选出的ABA 信号途径基因SiSnRK2 在水稻中超表达,可增加其根长和数目,增强转基因水稻的低钾耐受力[66]。遗传图谱的缺乏阻碍了糜子的QTL 鉴定,目前仅检测出穗长、株高等少数性状的QTL 位点[67],但尚无养分高效相关位点的报道。利用转录组学研究糜子缺氮的响应机制的研究表明,硝酸转运蛋白基因和光合相关基因是影响糜子氮效率的候选基因[16]。
利用基因组相关的SNP 图谱,187 个西非高粱基因型在磷缺乏和磷充足条件下籽粒产量的QTL 位点已被鉴定[34]。Gelli 等[68]利用氮低效高粱品种CK60和氮高效品种China17 构建F7 重组基因系(RILs),定位不同供氮条件下高粱农艺性状的QTL 位点,之前利用RNA sequencing 所测定的高粱耐低氮的差异表达基因(DEGs) 多数接近该区间。低氮敏感品种CK60 和耐低氮品种San Chi San 构建F7 重组基因系(RILs),定位响应低氮的QTL 位点,并将之前利用RNA-seq 所测定的高粱耐低氮的差异表达基因(DEGs)向该区间进行覆盖,寻找高粱耐低氮的候选基因[69]。
Gladman 等[70]利用转录组学和表观遗传学相结合的方法,分析了高粱低磷响应的根系统结构的调控网络,发现甲基化水平降低、表达量显著变化的基因大部分位于侧根根尖。对耐低磷和低磷敏感的基因型进行RNA-Seq 分析,结果表明氧化还原酶活性、植物激素信号转导相关基因等参与高粱的低磷胁迫,苹果酸影响低磷条件下高粱的初生根长度和根尖数量[35]。转录组学分析表明MYB 转录因子、高亲和力硝酸盐转运蛋白(NRT2.2, NRT2.3, NRT2.5,NRT2.6) 和赖氨酸组氨酸转运蛋白(LHT1, lysinehistidine transporter 1)、miRNA 在高粱耐低氮中发挥重要作用[20, 71?72]。Zhu 等[55]利用RNA-Seq 对高粱氮、磷、钾单元素和三元素缺乏响应的转录组变化进行分析,缺氮的地上部差异表达基因最多,且与光合和蛋白运输相关的基因较多;缺磷的根差异表达基因最多,与养分响应和磷脂代谢相关基因较多;缺钾的差异表达基因相对较少。
在玉米、小麦等作物中,利用转录组学、蛋白组学、代谢组学或生理分析联合解析氮高效的分子机制[ 7 3 ? 7 5 ]。吴年隆[ 3 3 ]利用代谢组学分析低磷敏感和低磷耐受谷子的代谢物差异,并分别对其不同供磷条件下代谢途径进行富集分析;谷子中含有多种高质量的脂肪酸,Zhang 等[76]利用脂质组学和转录组学联合分析,系统比较分析了两个谷子品种JG35 和JG39 的脂质成分和代谢通路。然而,在杂粮作物中,未有结合转录组、蛋白组、代谢组等多组学系统探究养分高效机制、挖掘养分高效相关基因的研究报道。
3 禾本科杂粮作物养分高效的影响因素
3.1 光合养分高效
虽然禾本科杂粮作物耐低磷、低氮或低钾的研究并不少见,但多数研究尚处于耐逆种质资源的初步鉴定和分析,且对养分效率的研究标准不统一,尚未明确影响养分效率的关键生理生化过程,应根据禾本科杂粮作物的生理特性进行深入分析。光合作用是作物产量的基础,作物的籽粒干重大部分来源于吐丝期光合作用的贡献[77],谷子、糜子、高粱均为C4 作物,光合速率较高,养分利用效率也较高[4],推测它们的光合养分利用效率是其养分高效的关键因素,光合养分利用效率是指单位叶片养分的光合速率。目前,玉米、小麦等主粮作物的光合养分高效机制已取得一系列研究进展,叶片结构(气孔等)、生化成分是影响光合养分高效利用的主要因素[78?79]。本文将从光合酶(如Rubisco) 活性、养分在叶片内的分配(氮组分/磷组分) 等方面分析作物光合养分高效的机制。
3.1.1 光合氮高效
近几十年来,我国多数作物的产量显著提升,而农田氮肥利用率仅为30%~40%,光合氮利用效率(PNUE) 是氮利用效率的重要体现,是同时实现作物高产和氮高效的可行途径。另外,高产作物的籽粒氮含量通常较低,较高的PNUE 也是允许叶片向籽粒转移更多的氮而不减产的实现路径[77]。影响叶片光合氮效率的因素主要包括:叶片单位叶面积质量(LMA)、叶片内氮分配等[80]。不同物种的光合氮利用效率差异较大,即光合氮利用效率存在种间差异,如多种作物和草本植物的PNUE 比常绿木本植物高[81];C4 植物的光合氮利用效率高于C3 植物,是由于C4 植物CO2 的富集,以及将更多的氮投入类囊体组件[ 8 2 ];耐低氮物种的PNUE 较低,是由于LMA 较大,使向细胞壁分配更多的氮,向光合酶分配的氮减少,同时增加了CO2 扩散的阻力,导致光合碳同化速率降低[83?84]。禾本科杂粮作物光合氮效率较高的原因,可能是CO2 富集使光合速率较高,由于其为一年生草本植物,推测LMA 不高,不是其光合氮高效的原因,但仍有待验证。光合氮利用效率同样存在种内基因型差异,主要是氮在不同细胞组分中的分配差异引起的,包括氮在光合组件和其它组分的分配,或在捕光复合体和碳同化酶之间的分配[85],在卡尔文循环中的酶如Rubisco,以及CO2 浓缩系统中的酶PEPC 之间的分配[ 8 6 ]。对比1950 s 至2010 s 间选育的5 个小麦品种,发现现代小麦品种的净光合速率(Pn) 增加幅度低于叶片含氮量(LNC),从而PNUE 降低,较低的Rubisco 激活活性是PNUE 降低的主要原因,未来提高Rca 的含量和活性是提高Pn 和PNUE,实现叶片低氮条件下作物增产和氮高效的有效途径[87]。关于C4 杂粮作物光合氮效率种内变异的研究较少,且主要停留在施氮对光合特性的影响[88?90],刘春娟[91]研究表明短期缺氮糜子的光合受气孔因素限制,而长期低氮则受非气孔限制;田倩[92]研究了高粱施氮与光合速率的关系,表明施氮影响甜高粱叶片氮组分的分配,提高叶绿素氮的比例,进而提高净光合速率和生物量。C4 杂粮作物的光合效率和氮利用效率均较高,今后应重点关注氮组分对不同基因型杂粮作物光合氮效率的影响和调控机制,探究其光合氮高效的生理和分子机制,为其他作物光合氮效率的提升提供借鉴。
3.1.2 光合磷高效
磷和含磷代谢物参与光合作用过程中的多个反应,如ATP 的生成、RUBP 的再生等,光合磷利用效率(photosynthetic P-use efficiency,PPUE) 是指叶片光合作用的瞬时光饱和速率,高的PPUE 与叶片磷浓度、相对生长速率以及单位面积叶片质量(leaf mass per area,LMA) 有关[93]。PPUE 存在种间变异,C4 植物的PPUE 高于C3 植物,主要是由于C4 植物的CO2 富集,光合速率较高[94];生长在贫磷土壤中的山龙科植物PPUE 相对较高,主要通过增加磷在叶肉细胞的分配及优化叶片磷组分的分配来实现[94?95]。磷组分主要包括无机磷Pi、磷脂磷、核酸磷和代谢磷几类,其中代谢磷库主要指磷酸酯类小分子代谢物,如ATP 等。低磷时磷高效植物通过减少对非代谢磷组分(如脂质磷、核酸磷) 的投入,以降低叶片磷浓度[96?98];代谢磷含量并不降低,可以保持卡尔文代谢中底物的浓度,以减少酶的补偿效应,进而减少rRNA 磷的投入[99]。目前尚无报道禾本科杂粮C4 作物PPUE 的研究,推测其相较于其他物种光合磷高效的原因,主要是光合效率较高,因已有研究表明单子叶植物叶肉细胞的磷含量较高[100?101],但应进一步用实验验证叶片磷浓度、叶肉细胞磷含量和光合速率在光合磷效率中的作用。目前,PPUE 种内变异的研究较少,Hayes 等[102]研究表明磷高效水稻通过减少磷脂的投入保持较高的PPUE,Wen 等[103]研究发现PPUE 较高基因型鹰嘴豆的叶片中磷浓度较低,并且对Pi 和代谢磷的分配较少。目前,关于禾本科杂粮作物光合磷效率的种内变异尚未见报道,仅涉及施磷量或者低磷处理对光合效率的影响[ 1 0 4 ? 1 0 5 ]。今后的研究应关注PPUE 在C4 杂粮作物的种内变异,筛选优异种质资源,探究磷组分在杂粮作物光合磷高效方面发挥的作用,挖掘磷组分的主效基因位点,构建磷组分调控光合磷效率的分子网络。
3.1.3 光合钾高效
钾在光合作用的叶绿素合成、光合产物运输以及光合酶活化中起着重要作用,缺钾植物中叶片的光合速率降低[106?107]。由于钾在气孔开闭中的重要作用,气孔关闭是缺钾影响CO2 扩散的关键原因[108]。Lu 等[109]研究表明轻度、中度和重度缺钾时,光合的首要限制因素分别是叶肉导度(gm)、气孔导度(gs) 和生化成分的分布,然而,缺钾抑制光合的机制尚不清楚[109?110]。多种作物的钾效率存在种内变异,钾高效基因型的叶面积较大,有利于光合作用中光的接收,从而提高整体光合[109];钾高效作物叶片(特别是下位叶) 的光合速率较高,是由于气孔导度和Rubisco 酶活性较高[106]。杂粮作物中钾高效的研究取得一定进展,低钾条件下,钾高效糜子叶绿素a、类胡萝卜素和光合色素含量降低量显著低于低钾敏感糜子;钾高效糜子的光合效率下降不明显,因此苗期糜子光合受非气孔因素限制[53]。
叶片光合作用与产量密切相关,筛选并培育高光效的C4 作物品种可以作为作物高产育种的材料,快速鉴定并筛选光合高效作物的指标主要包括:Pn、气孔导度、小维管束的密度等[111?114]。科学家们提出将C4 途径引入C3 作物提高产量的设想,解析C4作物光合高效的机制将为提高作物的光合效率乃至产量提供理论依据。C4 杂粮作物中光合机制的解析已取得了一定进展。Luo 等[115]利用低CO2 浓度培养箱筛选谷子C4 光合“花环”结构的突变体,为深入探究C4 光合机制奠定基础;Tang 等[116]分析了谷子EMS突变体的叶绿素含量、气孔导度和光合速率,鉴定出多个遗传系,为解析C4 光合高效的机制提供了材料。超表达谷子的PEPC 基因可增加水稻的光合速率和产量[ 1 1 7 ]。代修茹[ 1 1 8 ]利用RNA-Seq 和ATACSeq,分析了谷子、高粱和玉米的C4 光合途径相关基因的转录调控机制。目前的研究尚处于构建突变材料或高通量测序筛选目标基因阶段,缺乏具体基因功能的研究报道。
虽然禾本科杂粮作物的光合养分利用效率较高,但尚无关于其机制的研究报道。深入解析谷子、高粱和糜子光合养分高效机制,不仅有助于杂粮作物的高产高效,还将为实现主粮作物的减肥增产提供借鉴。今后,应充分利用我国优质的杂粮种质资源,比较光合养分效率在种间和种内的基因型差异,挖掘主效基因位点,构建杂粮作物养分高效的调控网络。
3.2 根系在作物养分高效中的作用
根系是植物养分吸收的器官,植物主要通过改变根系形态和根构型提高养分吸收效率。根系形态指根系的形态学特征,主要包括根的数量和总根长等参数;根构型指土壤中根系的组织结构和空间分布。根系是作物产量形成的关键,探究养分高效作物的根系特征及遗传机制,将为促进根系在作物育种中的作用奠定基础。根系对谷子的生长发育、抗倒伏、籽粒品质有重要作用,是产量形成的重要因素[119?120]。苗期和拔节期谷子、糜子和高粱的根长和根干重呈明显的“T”字型结构,抽穗期根长在不同土层分布则近似“8”字型,抽穗期深层根对黍子的影响大于拔节期,因此,深层根系对产量的影响较大[15, 121?122]。推测谷子、糜子和高粱的根构型是其抗旱性较强的主要原因,三者又同为耐贫瘠作物,根构型是否与它们的耐贫瘠性有关有待深入研究。目前的研究主要是养分缺乏时根系生物量或形态的改变,如Ahmad 等[25]发现低磷胁迫时根系减小,低氮却使根系增大。苑乂川等[31]研究表明低磷时根表面积、根体积、根总长和侧根数均增大,耐低磷品种的根系相对发达。
3.2.1 根系磷吸收
根系是植物吸收磷的主要部位,可从根系的形态、生理和微生物互作3 个方面促进磷的获取效率。根系形态改变主要为增加对磷的利用范围,如植物的根冠比增加[123],侧根和根毛密度、长度增加[124?126],而主根的生长却被抑制,这可能与磷主要分布在土壤的浅层有关[127]。另外,磷供应减少时,部分植物的比根长增加,即根系的直径降低,单位根重量所提供的根表面积增加[128?129]。根际生理生化的改变则指缺磷时,根系会分泌有机酸或磷酸酶,从矿物磷或有机磷中活化出有效磷[130?132]。已有的研究表明,禾本科植物的根际分泌能力比豆科植物弱[133],Wen 等[134]的研究表明低磷时谷子根系分支强度和1 级细根根长增加,整根比根长显著增加;根鞘有机酸分泌和酸性磷酸酶活性均较低,高粱的低磷根际响应也较弱。因此,推测杂粮作物可能主要通过改变根系形态适应低磷,而不是根际生理变化,这仍需要进一步实验验证。植物还可通过与丛枝菌根共生间接吸收磷,根外菌丝使植物可以获取根系磷耗竭区以外的土壤磷库[135?137];细根与关联菌根存在互补性,粗根比细根的菌根侵染率高[138?139],细根植物响应土壤磷的根形态属性可塑性较强[134],因此,推测菌根侵染可能不是杂粮作物应对磷胁迫的主要途径。磷的移动性较差,短而密的侧根有利于磷的获取,耐旱杂粮作物所生长的土壤缺水,养分移动性也较差,应关注杂粮作物种间或种内关于地下磷获取策略,包括根系和根际微生物属性差异,进而探究根属性变异的分子机制,为作物根系改良提供理论支撑。
3.2.2 根系氮吸收
根系形态和构型是植物氮吸收效率的关键,缺氮条件下植物的根冠比增加[140],主根长度增加[141?142],而缺氮对侧根的影响取决于缺氮的程度,在拟南芥和作物中,中度缺氮促进侧根的生长,严重缺氮抑制侧根生长[143]。杂粮作物多采用水培方式研究根系氮营养,低氮时谷子和高粱的根干重和根长均增加;谷子的侧根数量增加,而高粱的根系增粗,分支减少[144?145]。强大的根系是氮高效作物品种的重要特征之一,氮素在土壤中的流动性较强,长而稀疏的根系是氮吸收的理想根构型[146],由于旱作农业中水分的缺乏,氮素移动比较困难,根系深扎有利于氮和水的获取,阻止硝酸盐向土壤深层的淋失[147]。今后应采用盆栽或田间方式,分析杂粮作物根系大小、根长度、侧根分支和根直径对低氮的响应,并归纳氮高效杂粮作物的根系特征。NO3?是土壤溶液中的最主要氮素形态,NO3?通过低亲和力(LATS) 和高亲和力(HATS) 吸收系统进入根细胞,负责的转运蛋白分别属于NRT1 (NPF) 和NRT2 家族[148?149]。目前,已鉴定出谷子和糜子中的NRT1 和NRT2 基因,推测可能在硝酸盐吸收中发挥重要作用,为培育氮高效的谷子和糜子品种提供了候选基因[91, 150]。由于杂粮作物多种于干旱地区,土壤氮难以溶解,氮浓度较低且分布不均一,因此,在实际生产中仅通过提高NRT 基因表达提高氮效率实现难度较大。缓解缺水是作物的首要任务,因此,根系深扎有利于水和氮的获取,根系形态和分布在氮吸收中起关键作用,应重点通过改变根系来提高杂粮作物的氮效率。
3.2.3 根系钾吸收
钾对形成强壮的根系至关重要,缺钾造成多种植物的根长、根粗、根干重均降低,而根毛长度增加[151]。耐低钾自交系的根系强于钾敏感自交系,如根干重、根数量和总根长等,但根直径显著小于钾敏感自交系[152]。低钾条件下,耐低钾谷子和糜子的总根长、总根表面积和根体积均增加,而钾敏感基因型则降低[47, 53]。KT/KUP/HAK 家族和Shaker 蛋白家族分别是植物中最大的钾转运体蛋白家族和钾通道蛋白家族[153?154],代书桃等[155]鉴定出谷子HAK/KUP/KT 钾转运蛋白家族基因29 个,并分析了其低钾响应性;欧阳浩等[156]鉴定出高粱中的9 个钾离子通道Shaker 基因。
4 展望
根系大、深、密是抗旱作物的基本特征[157],根的体积和表面积对养分吸收至关重要,瘠薄等土壤环境首先伤害作物的根系,谷子、糜子、高粱均具有耐旱、养分利用率高的特性,推测根系在它们水、肥高效利用方面起了关键作用,研究其根系特征有助于解析作物的养分有效性机制[158]。然而,目前的研究多是关于低氮、低磷响应的根系特征的初步分析,而养分高效基因型根系特征的形成机制研究较少,应通过转录组、蛋白组学等手段,或者根系性状的主效基因定位,分析养分供应对根系发育的基因调控机制,应重点关注植物激素在该过程中发挥的重要作用。
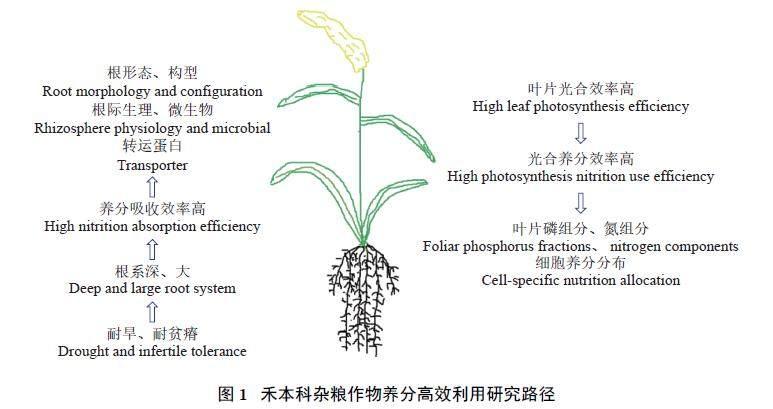
谷子、糜子和高粱的养分高效研究尚处于资源的鉴定和生理特征初步分析阶段,分析养分胁迫表达谱的研究相对较少,养分胁迫的QTL 定位、基因功能分析方面也相对不足。根据禾本科杂粮作物耐旱和C4 作物光合速率高的特性,本文提出应从根系养分吸收效率和光合养分利用效率两个方面(图1)着手,挖掘其养分高效的关键基因位点,以期为杂粮作物和其它作物育种提供参考。
参 考 文 献:
[ 1 ]贾冠清, 刁现民. 谷子(Setaria italica (L.) P. Beauv.)作为功能基因组研究模式植物的发展现状及趋势[J]. 生命科学, 2017, 29(3):292?301.
Jia G Q, Diao X M. Current status and perspectives of researches onfoxtail millet (Setaria italica (L.) P. Beauv.): A potential model of plant functional genomics studies[J]. Chinese Bulletin of LifeSciences, 2017, 29(3): 292?301.
[ 2 ]Zhang Y Y, Han H K, Zhang D Z, et al. Effects of ridging andmulching combined practices on proso millet growth and yield insemi-arid regions of China[J]. Field Crops Research, 2017, 213:65?74.
[ 3 ]李顺国, 刘猛, 刘斐, 等. 中国高粱产业和种业发展现状与未来展望[J]. 中国农业科学, 2021, 54(3): 471?482.
Li S G, Liu M, Liu F, et al. Current status and future prospectiveof sorghum production and seed industry in China[J]. ScientiaAgricultura Sinica, 2021, 54(3): 471?482.
[ 4 ]何新华, 李明启. C3和C4禾本科作物的氮素利用效率[J]. 植物学通报, 1995, 12(3): 20?27.
He X H, Li M Q. The efficiency of nitrogen utilization in C3 and C4cereals[J]. Chinese Bulletin of Botany, 1995, 12(3): 20?27.
[ 5 ]陈二影, 杨延兵, 秦岭, 等. 谷子苗期氮高效品种筛选及相关特性分析[J]. 中国农业科学, 2016, 49(17): 3287?3297.
Chen E Y, Yang Y B, Qin L, et al. Evaluation of nitrogen efficientcultivars of foxtail millet and analysis of the related characters atseedling stage[J]. Scientia Agricultura Sinica, 2016, 49(17): 3287?3297.
[ 6 ]时丽冉, 郝洪波, 李明哲. 不同基因型谷子幼苗期对低氮胁迫的响应[J]. 作物杂志, 2014, (4): 75?79.
Shi L R, Hao H B, Li M Z. Biological response of in seedling stagedifferent foxtail millet genotypes to low nitrogen stress[J]. Crops,2014, (4): 75?79.
[ 7 ]黄兴东. 谷子耐低氮胁迫品种资源的筛选与鉴定[D]. 山西晋中:山西农业大学硕士学位论文, 2017.
Huang X D. Screening and identification of resistance to lownitrogen varieties of foxtail millet[D]. Jinzhong, Shanxi: MS Thesisof Shanxi Agricultural University, 2017.
[ 8 ]梁兴萍, 冯唯欣, 秦鹏飞, 等. 谷子耐低氮品种的筛选[J]. 山西农业科学, 2016, 44(12): 1747?1750.
Liang X P, Feng W X, Qin P F, et al. Screening of resistance to lownitrogen varieties of millet[J]. Journal of Shanxi AgriculturalSciences, 2016, 44(12): 1747?1750.
[ 9 ]张立媛, 琦明玉, 李志光, 等. 不同谷子品种氮素吸收与利用差异的研究[J]. 东北农业科学, 2021, 46(1): 13?16.
Zhang L Y, Qi M Y, Li Z G, et al. Study on the difference ofnitrogen uptake and utilization in different millet varieties[J].Journal of Northeast Agricultural Sciences, 2021, 46(1): 13?16.
[10]秦娜, 马春业, 朱灿灿, 等. 谷子氮高效基因型筛选及相关特性分析[J]. 河南农业科学, 2019, 48(5): 22?29.
Qin N, Ma C Y, Zhu C C, et al. Screening of foxtail millet genotypewith high nitrogen use efficiency and analysis of related characters[J]. Journal of Henan Agricultural Sciences., 2019, 48(5): 22?29.
[ 11 ]Soratto R P, Lima E V, Silva T R B, et al. Nitrogen fertilizationof fall panicum cultivars (Panicum dichotomiflorum Michx.):biochemical and agronomical aspects[J]. Scientia Agricola, 2004,61: 82–87.
[ 12 ]Eduardo D, Tiago R, Rog?rio P, et al. Relationship betweenchlorophyll meter accepted manuscript readings and total N in fallpanicum leaves (Panicum miliaceum L.) as affected by nitrogentopdressing[J]. Revista Brasileira De Ciencia Do Solo, 2007, 6(2):149?158.
[ 13 ]Gong X W, Li J, Ma H C, et al. Nitrogen deficiency induced adecrease in grain yield related to photosynthetic characteristics,carbon–nitrogen balance and nitrogen use efficiency in proso millet(Panicum miliaceum L.)[J]. Archives of Agronomy and Soil Science, 2019, 66(3): 398?413.
[ 14 ]张美俊, 杨武德, 乔治军, 等. 不同糜子品种萌发期对干旱胁迫的响应及抗旱性评价[J]. 草地学报, 2013, 21(2): 302?307.
Zhang M J, Yang W D, Qiao Z J, et al. Resistance evaluation andresponse of 16 millet varieties at germination stage to droughtstress[J]. Acta Agrestia Sinica, 2013, 21(2): 302?307.
[ 15 ]张永清, 苗果园. 生土施肥对黍子根系生长及生理生态效应的影响[J]. 水土保持学报, 2006, 20(3): 158?161.
Zhang Y Q, Miao G Y. Effects of fertilizing in immature soil tobroomcorn millet root growing and its physiological ecology[J].Journal of Soil and Water Conservation, 2006, 20(3): 158?161.
[ 16 ]Liu C J, Yuan Y H, Liu J J, et al. Comparative transcriptome andphysiological analysis unravel proso millet (Panicum miliaceum L.)source leaf adaptation to nitrogen deficiency with high nitrogen useefficiency[J]. Environmental and Experimental Botany, 2022, 199:104891.
[ 17 ]陈凌, 王君杰, 王海岗, 等. 耐低氮糜子品种的筛选及农艺性状的综合评价[J]. 中国农业科学, 2020, 53(16): 3214?3225.
Chen L, Wang J J, Wang H G, et al. Screening of broomcorn milletvarieties tolerant to low nitrogen stress and the comprehensiveevaluation of their agronomic traits[J]. Scientia Agricultura Sinica,2020, 53(16): 3214?3225.
[ 18 ]张磊, 杨天育, 刘天鹏, 等. 半干旱条件下糜子氮磷积累、分配及利用效率的差异[J]. 甘肃农业大学学报, 2020, 55(3), 62?70: 77.
Zhang L, Yang T Y, Liu T P, et al. Accumulation, distribution andutilization efficiency of nitrogen and phosphorus in broomcornmillet varieties under semi-arid condition[J]. Journal of GansuAgricultural University, 2020, 55(3): 62?70, 77.
[ 19 ]尹新华, 曹翠玉, 史瑞和. 不同施氮水平对夏高粱产量和品质的影响[J]. 南京农业大学学报, 1990, 13(4): 126?128.
Yin X H, Cao C Y, Shi R H. Effects of different nitrogen applicationlevels on yield and quality of summer sorghum[J]. Journal ofNanjing Agricultural University, 1990, 13(4): 126?128.
[ 20 ]刘鹏, 南江宽, 平俊爱, 等. 不同基因型高粱的氮效率及对低氮胁迫的生理响应[J]. 中国农业科学, 2018, 51(16): 3074?3083.
Liu P, Nan J K, Ping J A, et al. Nitrogen use efficiency andphysiological responses of different sorghum genotypes influencedby nitrogen deficiency[J]. Scientia Agricultura Sinica, 2018, 51(16):3074?3083.
[ 21 ]杨广东. 高寒地区不同基因型高粱氮素响应机制研究[D]. 辽宁沈阳: 沈阳农业大学博士学位论文, 2020.
Yang G D. Study on nitrogen response mechanism of differentgenotypes of sorghum in alpine region[D]. Shenyang, Liaoning:PhD Dissertation of Shenyang Agricultural University, 2020.
[ 22 ]Maharajan T, Ceasar S A, Krishna T P A, Ignacimuthu S. Phosphatesupply influenced the growth, yield and expression of PHT1 familyphosphate transporters in seven millets[J]. Planta, 2019, 250: 1433?1448.
[ 23 ]Ceasar S A, Hodge A, Baker A, et al. Phosphate concentration andarbuscular mycorrhizal colonisation influence the growth, yield andexpression of twelve PHT1 family phosphate transporters in foxtailmillet (Setaria italica)[J]. PLoS ONE, 2014, 9(9): e108459.
[ 24 ] Ceasar S A, Baker A, Ignacimuthu S. Functional characterization of the PHT1 family transporters of foxtail millet with development of anovel agrobacterium-mediated transformation procedure[J].Scientific Report, 2017, 7(1): 14064.
[ 25 ]Ahmad Z, Nadeem F, Wang R F, et al. A larger root system iscoupled with contrasting expression patterns of phosphate andnitrate transporters in foxtail millet [Setaria italica (L.) Beauv.]under phosphate limitation[J]. Frontiers in Plant Science, 2018, 9:390355.
[ 26 ]Ceasar S A, Ramakrishnan M, Vinod K K, et al. Phenotypicresponses of foxtail millet (Setaria italica) genotypes to phosphatesupply under greenhouse and natural field conditions[J]. PLoSONE, 2020, 15(6): e0233896.
[ 27 ]邱双, 闫双堆, 刘利军. 不同谷子品种耐低磷能力研究[J]. 作物杂志, 2017, (2): 139?144.
Qiu S, Yan S D, Liu L J. Tolerance to low phosphorus by differentfoxtail millet varieties[J]. Crops, 2017, (2): 139?144.
[ 28 ]邱双, 刘利军, 闫双堆, 等. 低磷胁迫下谷子的磷吸收利用效率[J].山西农业科学, 2016, 44(6): 786?789.
Qiu S, Liu L J, Yan S D, et al. Study on the phosphorus absorptionand utilization efficiency in millet under low phosphorus stress[J].Journal of Shanxi Agricultural Sciences, 2016, 44(6): 786?789.
[ 29 ]邱双. 谷子不同磷效率品种筛选及其生理特性研究[D]. 山西晋中: 山西农业大学硕士学位论文, 2017.
Qiu S. Research on different phosphorus efficiency of foxtail milletscreening and its physiological characters[D]. Jinzhong, Shanxi: MSThesis of Shanxi Agricultural University, 2017.
[ 30 ]李明明. 磷水平对谷子产量及主要营养品质的影响[D]. 山西晋中: 山西农业大学硕士学位论文, 2021.
Li M M. Effects of phosphorus level on yield and main nutritionalquality of foxtail millet[D]. Jinzhong, Shanxi: MS Thesis of ShanxiAgricultural University, 2021.
[ 31 ]苑乂川. 谷子苗期耐低磷种质资源挖掘及其相关性状的GWAS分析[D]. 山西晋中: 山西农业大学硕士学位论文, 2019.
Yuan Y C. Excavation of germplasm resources for low phosphorustolerance at seedling stage and GWAS of its related traits in foxtailmillet[D]. Jinzhong, Shanxi: MS Thesis of Shanxi AgriculturalUniversity, 2019.
[ 32 ]李萍. 谷子耐低磷种质的评价及其相关性状的全基因组关联分析[D]. 山西晋中: 山西农业大学硕士学位论文, 2020.
Li P. Evaluation of foxtail millet germplasm with low phosphorustolerance and genome-wide association analysis of related characters[D]. Jinzhong, Shanxi: MS Thesis of Shanxi Agricultural University,2021.
[ 33 ]吴年隆. 谷子苗期耐低磷种质资源的筛选及其代谢物特征分析[D]. 山西晋中: 山西农业大学硕士学位论文, 2021.
Wu N L. Screening of low phosphorus tolerant germplasm in foxtailmillet at seedling stage and analysis of its metabolites[D]. Jinzhong,Shanxi: MS Thesis of Shanxi Agricultural University, 2021.
[ 34 ]Leiser W L, Rattunde H F, Weltzien E, et al. Phosphorus uptakeand use efficiency of diverse West and Central African sorghumgenotypes under field conditions in Mali[J]. Plant and Soil, 2014,377: 383?394.
[ 35 ] Zhang J L, Jiang F F, Shen Y X, et al. Transcriptome analysis reveals candidate genes related to phosphorus starvation tolerance insorghum[J]. BMC Plant Biology, 2019, 19: 306.
[ 36 ]李景琳, 苗桂珍, 李淑芬. 高粱籽粒产量和氮磷钾施用量的研究[J]. 国外农学: 杂粮作物, 1994, (5): 37?40.
Li J L, Miao G Z, Li S F. Study on the grain yield and nitrogen,phosphorus, and potassium application of sorghum[J]. Rain FedCrops, 1994, (5): 37?40.
[ 37 ]郭有. 谈谈杂交高粱追肥[J]. 新农业, 1978, (13): 5?6.
Guo Y. Talk about fertilization of hybrid sorghum[J]. New Agriculture,1978, (13): 5?6.
[ 38 ]马建华, 王玉国, 孙毅, 等. 低磷胁迫对不同品种高粱苗期形态及生理指标的影响[J]. 植物营养与肥料学报, 2013, 19(5): 1083?1091.
Ma J H, Wang Y G, Sun Y, et al. Effects of low phosphorous stresson the morphologies and physiological indices of different sorghumcultivars at seedling stage[J]. Journal of Plant Nutrition and Fertilizers,2013, 19(5): 1083?1091.
[ 39 ]Wieneke J. Phosphorus efficiency and phosphorus remobilization intwo sorghum (Sorghum bicolor (L.) Moench) cultivars[J]. Plant andSoil, 1990, 123: 139?145.
[ 40 ]Hufnagel B, De Sousa S M, Assis L, et al. Duplicate and conquer:Multiple homologs of PHOSPHORUS-STARVATION TOLERANCE1enhance phosphorus acquisition and sorghum performance on lowphosphorussoils[J]. Plant Physiology, 2014, 166(2): 659?677.
[ 41 ]Drouillon M, Merckx R. The role of citric acid as a phosphorusmobilization mechanism in highly P-fixing soils[J]. GayanaBotanica, 2003, 60(1): 55?62.
[ 42 ]Magalhaes J V, Liu J, Guimar?es C T, et al. A gene in the multidrugand toxic compound extrusion (MATE) family confers aluminumtolerance in sorghum[J]. Nature Genetics, 2007, 39(9): 1156?1161.
[ 43 ]Cochrane T T, Cochrane T A. The vital role of potassium in theosmotic mechanism of stomata aperture modulation and its link withpotassium deficiency[J]. Plant Signaling & Behavior, 2009, 4(3):240?243.
[ 44 ]李艳芬, 郑君岗, 尹美强, 等. 低钾胁迫对谷子幼苗叶片光合作用的影响[J]. 西北植物学报, 2022, 42(6): 1012?1021.
Li Y F, Zheng J G, Yin M Q, et al. Effect of potassium stress onleaf photosynthesis of millet seedlings[J]. Acta Botanica Boreali-Occidentalia Sinica, 2022, 42(6): 1012?1021.
[ 45 ]宋淑贤. 不同施钾量对谷子干物质及产量的影响[J]. 现代农业科技, 2015, (19): 9?10.
Song S X. Effect of different potassium fertilization amount on drymaterial and yield of millet[J]. Modern Agricultural Science andTechnology, 2015, (19): 9?10.
[ 46 ]宋淑贤, 田伯红, 王建广, 等. 不同施钾量对谷子生长及产量的影响[J]. 辽宁农业科学, 2015, (6): 6?8.
Song S X, Tian B H, Wang J G, et al. Effects of different potassiumapplication rates on the growth and yield of millet[J]. LiaoningAgricultural Sciences, 2015, (6): 6?8.
[ 47 ]万凯旋. 谷子耐低钾品种筛选及其生理生化研究[D]. 山西晋中:山西农业大学硕士学位论文, 2020.
Wan K X. Screening of foxtail foxtail millet varieties with toleranceto low-potassium and study on its physiological and biochemical mechanis[D]. Jinzhong, Shanxi: MS Thesis of Shanxi AgriculturalUniversity, 2020.
[ 48 ]王文忠, 张珠玉. 不同施钾量对谷子吸收N P K Ca Mg Fe Mn CuZn的影响[J]. 山西农业大学学报(自然科学版), 1991, 11(3):208?212.
Wang W Z, Zhang Z Y. Effect of different potassium application onthe absorption of N P K Ca Mg Fe Mn Cu Zn by millet[J]. Journalof Shanxi Agricultural University (Natural Science Edition), 1991,11(3): 208?212.
[ 49 ]张亚琦, 李淑文, 付巍, 文宏达. 施氮对杂交谷子产量与光合特性及水分利用效率的影响[J]. 植物营养与肥料学报, 2014, 20(5):1119?1126.
Zhang Y Q, Li S W, Fu W, Wen H D. Effects of nitrogenapplication on yield, photosynthetic characteristics and water useefficiency of hybrid millet[J]. Journal of Plant Nutrition andFertilizers, 2014, 20(5): 1119?1126.
[ 50 ]任月梅, 杨忠, 郭瑞锋, 等. 不同施肥水平对大同34号谷子产量的影响[J]. 北方农业学报, 2016, 44(4): 27?30.
Ren Y M, Yang Z, Guo R F, et al. Effects of different fertilizationlevels on yield of Datong 34 millet[J]. Journal of Northern Agriculture,2016, 44(4): 27?30.
[ 51 ]王二辉. 谷子转录因子基因SiNAC45与SiMYB9的克隆及功能验证[D]. 陕西杨凌: 西北农林科技大学硕士学位论文, 2015.
Wang E H. The cloning and functional analysis of transcriptionfactor gene SiNAC45 and SiMYB9 from foxtail millet[D]. Yangling,Shaanxi: MS Thesis of Northwest A&F University, 2015.
[ 52 ]Zhang H W, Xiao W, Yu W W, et al. Foxtail millet SiHAK1 excitesextreme high-affinity K+ uptake to maintain K+ homeostasis underlow K+ or salt stress[J]. Plant Cell Reports, 2018, 37: 1533?1546.
[ 53 ]梁诗涵. 糜子钾高效种质资源筛选评价及生理机制研究[D]. 陕西杨凌: 西北农林科技大学硕士学位论文, 2022.
Liang S H. Stress screening of potassium-efficient germplasmresources of proso millet (panicum miliaceum L.) and study onphysiological mechanism[D]. Yangling, Shaanxi: MS Thesis ofNorthwest A&F University, 2022.
[ 54 ]安景文, 王潇. 高粱需钾特性及施钾效果研究[J]. 国外农学: 杂粮作物, 1998, 18(3): 34?36.
An J W, Wang X. Study on potassium requirement characteristicsand potassium application effect of sorghum[J]. Rain Fed Crops,1998, 18(3): 34?36.
[ 55 ]Zhu J X, Li D, Wang P, et al. Transcriptome and ionome analysis ofnitrogen, phosphorus and potassium interactions in sorghumseedlings[J]. Theoretical and Experimental Plant Physiology, 2020,32(4): 271?285.
[ 56 ]Ramakrishnan M, Ceasar S A, Vinod K K. Identification of putativeQTLs for seedling stage phosphorus starvation response in fingermillet (Eleusine coracana L. Gaertn.) by association mappingand cross species synteny analysis[J]. PLoS ONE, 2017, 12(8):e0183261.
[ 57 ]Maharajan T, Ajeesh Krishna T P, Rakkammal K, et al.Identification of QTL associated with agro-morphological andphosphorus content traits in finger millet under differentialphosphorus supply via linkage mapping[J]. Agriculture, 2023,13(2): 262.
[ 58 ]Gemenet D, Leiser W, Zangre R, et al. Association analysis of lowphosphorustolerance in West African pearl millet using DArTmarkers[J]. Molecular Breeding, 2015, 35: 171.
[ 59 ]Bandyopadhyay T, Swarbreck S M, Jaiswal V, et al. GWASidentifies genetic loci underlying nitrogen responsiveness in theclimate resilient C4 model Setaria italica (L.)[J]. Journal ofAdvanced Research, 2022, 42: 249?261.
[ 60 ]Chen E Y, Qin L, Li F, et al. Physiological and transcriptomicanalysis provides insights into low nitrogen stress in foxtail millet(Setaria italica L.)[J]. International Journal of Molecular Sciences.2023, 24(22): 16321.
[ 61 ]Xing G F, Jin M S, Yue P Y, et al. Role of SiPHR1 in the responseto low phosphate in foxtail millet via comparative transcriptomicand co-expression network analyses[J]. International Journal ofMolecular Sciences, 2023, 24(16): 12786.
[ 62 ]Ge L H, Dou Y N, Li M M, et al. SiMYB3 in foxtail millet (Setariaitalica) confers tolerance to low-nitrogen stress by regulating rootgrowth in transgenic plants[J]. International Journal of MolecularSciences, 2019, 20(22): 5741.
[ 63 ]方广宁, 胡利芹, 王二辉, 等. 谷子转录因子SiNF-YA6的过表达提高转基因植株对低氮胁迫的抗性[J]. 中国农业科学, 2015, 48(20):3989?3997.
Fang G N, Hu L Q, Wang E H, et al. Overexpression of atranscription factor gene SiNF-YA6 from millet (Setaria italica)enhanced the resistance of transgenic plants to nitrogen starvation[J]. Scientia Agricultura Sinica, 2015, 48(20): 3989?3997.
[ 64 ]薛飞洋. 谷子苗期低氮胁迫转录组测序及蛋白磷酸酶2C (PP2C)基因家族的特性分析[D]. 陕西杨凌: 西北农林科技大学硕士学位论文, 2013.
Xue F Y. Transcriptome sequencing of seedling foxtail milletresponse to low nitrogen stress and characteristics analysis ofprotein phosphatase 2C (PP2C) gene family in foxtail millet[D].Yangling, Shaanxi: MS Thesis of Northwest A&F University, 2013.
[ 65 ]Li W W, Chen M, Wang E H, et al. Genome-wide analysis ofautophagy-associated genes in foxtail millet (Setaria italica L.) andcharacterization of the function of SiATG8a in conferring toleranceto nitrogen starvation in rice[J]. Genomics, 2016, 17: 797.
[ 66 ]Ma X Q, Khan N U, Dai S T, et al. Transcriptome analysis andidentification of the low potassium stress-responsive gene SiSnRK2.6in foxtail millet (Setaria italica L.)[J]. 2024, 137(1): 22.
[ 67 ]Rajput S G, Santra D K, Schnable J. Mapping QTLs for morphoagronomictraits in proso millet (Panicum miliaceum L.)[J].Molecular Breeding, 2016, 36: 37.
[ 68 ]Gelli M, Mitchell S E, Liu K, et al. Mapping QTLs and associationof differentially expressed gene transcripts for multiple agronomictraits under different nitrogen levels in sorghum[J]. BMC PlantBiology, 2016, 16: 16.
[ 69 ]Gelli M, Konda A R, Liu K, et al. Validation of QTL mapping andtranscriptome profiling for identification of candidate genesassociated with nitrogen stress tolerance in sorghum[J]. BMC PlantBiology, 2017, 17(1): 123.
[ 70 ] Gladman N P, Hufnagel B, Regulski M, et al. Sorghum root epigenetic landscape during limiting phosphorus conditions[M].New York: Cold Spring Harbor Laboratory Press, 2021.
[ 71 ]Gelli M, Duo Y C, Konda A R, et al. Identification of differentiallyexpressed genes between sorghum genotypes with contrastingnitrogen stress tolerance by genome-wide transcriptional profiling[J]. BMC Genomics, 2014, 15: 179.
[ 72 ]马建华. 高粱低磷低氮形态生理特征及低氮响应的microRNA研究[D]. 山西晋中: 山西农业大学博士学位论文, 2014.
Ma J H. The morphological and physiological characteristics underlow phosphorus of sorghum and the study of sorghum MicroRNAunder low nitrogen stress[D]. Jinzhong, Shanxi: PhD Dissertation ofShanxi Agricultural University, 2014.
[ 73 ]Amiour N, Imbaud S, Clement G, et al. The use of metabolomicsintegrated with transcriptomic and proteomic studies for identifyingkey steps involved in the control of nitrogen metabolism in cropssuch as maize[J]. Journal of Experimental Botany, 2012, 63(14):5017?5033.
[ 74 ]Meng X D, Wang X C, Zhang Z Y, et al. Transcriptomic,proteomic, and physiological studies reveal key players in wheatnitrogen use efficiency under both high and low nitrogen supply[J].Journal of Experimental Botany, 2021, 72(12): 4435?4456.
[ 75 ]He K H, Xu S T, Zhang X H, et al. Mining of candidate genes fornitrogen use efficiency in maize based on genome-wide associationstudy[J]. Molecular Breeding, 2020, 40: 83.
[ 76 ]Zhang H Y, Wang J Y, Wang J, et al. Integrated lipidomic andtranscriptomic analysis reveals lipid metabolism in foxtail millet(setaria italica)[J]. Frontiers in Genetics, 2021, 12: 758003.
[ 77 ]Chen Y L, Xiao C X, Chen X C, et al. Characterization of the planttraits contributed to high grain yield and high grain nitrogenconcentration in maize[J]. Field Crops Research, 2014, 159: 1?9.
[ 78 ]Chen Y L, Xiao C X, Wu D L, et al. Effects of nitrogen applicationrate on grain yield and grain nitrogen concentration in two maizehybrids with contrasting nitrogen remobilization efficiency[J].European Journal of Agronomy, 2015, 62: 79?89.
[ 79 ]Mu X H, Chen Q W, Chen F J, et al. Dynamic remobilization of leafnitrogen components in relation to photosynthetic rate during grainfilling in maize[J]. Plant Physiology and Biochemistry, 2018, 129:27?34.
[ 80 ]Moon M, Kang K S, Park I K, et al. Effects of leaf nitrogenallocation on the photosynthetic nitrogen-use efficiency of seedlingsof three tropical species in Indonesia[J]. Journal of the KoreanSociety for Applied Biological Chemistry, 2015, 58: 511?519.
[ 81 ]Pons T L, Westbeek M H M. Analysis of differences in photosyntheticnitrogen-use efficiency between four contrasting species[J].Physiologia Plantarum, 2004, 122(1): 68?78.
[ 82 ]Makino A, Sakuma H, Sudo E, Mae T. Differences between maizeand rice in N-use efficiency for photosynthesis and protein allocation[J]. Plant and Cell Physiology, 2003, 44(9): 952?956.
[ 83 ]Hanba Y T, Miyazawa S I, Terashima I. The influence of leafthickness on the CO2 transfer conductance and leaf stable carbonisotope ratio for some evergreen tree species in Japanese warmtemperateforests[J]. Functional Ecology, 1999, 13(5): 632?639.
[ 84 ] Hidaka A, Kitayama K. Divergent patterns of photosynthetic phosphorus-use efficiency versus nitrogen-use efficiency of treeleaves along nutrient-availability gradients[J]. Journal of Ecology,2009, 97(5): 984?991.
[ 85 ]Pons T L, van der Werf A, Lambers H. Photosynthetic nitrogen useefficiency of inherently low- and fast-growing species: Possibleexplanations for observed differences[M]. A whole plant perspectiveon carbon–nitrogen interactions. New York: SPB AcademicPublishing, 1994.
[ 86 ]Meinzer F C, Zhu J. Nitrogen stress reduces the efficiency of theC4 CO2 concentrating system, and therefore quantum yield, inSaccharum (sugarcane) species[J]. Journal of Experimental Botany,1998, 49: 1227?1234.
[ 87 ]Tian Z, Chai H, Guo H, et al. Genetic improvement of photosyntheticnitrogen use efficiency of winter wheat in the Yangtze River Basinof China[J]. Field Crops Research, 2024, 305: 109199.
[ 88 ]薛盈文, 苗兴芬, 王玉凤. 施氮对谷子光合特性及产量和品质的影响[J]. 黑龙江八一农垦大学学报, 2019, 31(4): 1?7.
Xue Y W, Miao X F, Wang Y F. Effects of nitrogen application onphotosynthetic, yield and quality of foxtail millet[J]. Journal ofHeilongjiang Bayi Agricultural University, 2019, 31(4): 1?7.
[ 89 ]王君杰, 王海岗, 陈凌, 等. 谷子EMS矮秆突变体的产量性状分析[J]. 核农学报, 2022, 36(12): 2330?2337.
Wang J J, Wang H G, Chen L, et al. Analysis of yield charactersof EMS dwarf mutant in foxtail millet[J]. Journal of NuclearAgricultural Sciences, 2022, 36(12): 2330?2337.
[ 90 ]王佳旭, 张旷野, 张飞, 等. 施氮方式及用量改善高粱光合特性及土壤微生物群落特征[J]. 山西农业大学学报(自然科学版), 2022,42(5): 17?26.
Wang J X, Zhang K Y, Zhang F, et al. Effects of nitrogenapplication methods and amounts on photosynthetic characteristicsand soil microbial community characteristics of sorghum[J]. Journalof Shanxi Agricultural University (Natural Science Edition), 2022,42(5): 17?26.
[ 91 ]刘春娟. 糜子对低氮胁迫的响应及耐低氮基因挖掘研究[D]. 陕西杨凌: 西北农林科技大学博士学位论文, 2021.
Liu C J. Response of proso millet to low nitrogen stress andexcavation of low nitrogen tolerant genes[D]. Yangling, Shaanxi:PhD Dissertation of Northwest A&F University, 2021.
[ 92 ]田倩. 施氮量对甜高粱叶片氮分配及其干物质生产的影响[D]. 江苏南京: 南京农业大学硕士学位论文, 2019.
Tian Q. Effects of nitrogen application on leaf nitrogen partioningand dry matter production in sweet sorghum[D]. Nanjing, Jiangsu:MS Thesis of Nanjing Agricultural University, 2019.
[ 93 ]Lambers H, Poorter H. Inherent variation in growth rate betweenhigher plants: A search for physiological causes and ecologicalconsequences[J]. Advances in Ecological Research, 1992, 23:187?261.
[ 94 ]Ghannoum O, Paul M J, Ward J L, et al. The sensitivity ofphotosynthesis to phosphorus deficiency differs between C3 and C4tropical grass[J]. Functional Plant Biology, 2008, 35(3): 213?221.
[ 95 ]Guilherme Pereira C, Clode P L, Oliveira R S, Lambers H. Eudicotsfrom severely phosphorus-impoverished environments preferentiallyallocate phosphorus to their mesophyll[J]. New Phytologist, 2018,218(3): 959?973.
[ 96 ]Warren C R. How does P affect photosynthesis and metaboliteprofiles of Eucalyptus globulus?[J]. Tree Physiology, 2011, 31(7):727?739.
[ 97 ]Hidaka A, Kitayama K. Relationship between photosyntheticphosphorus-use efficiency and foliar phosphorus fractions intropical tree species[J]. Ecology and Evolution, 2013, 3(15):4872?4880.
[ 98 ]Han Y, Hong W T, Xiong C Y, et al. Combining analyses ofmetabolite profiles and phosphorus fractions to explore highphosphorus utilization efficiency in maize[J]. Journal ofExperimental Botany, 2022, 73(12): 4184?4203.
[ 99 ]Lambers H, Finnegan P M, Jost R, et al. Phosphorus nutrition inProteaceae and beyond[J]. Nature Plants, 2015, 1(8): 15109.
[100]Karley A J, Leigh R A, Sanders D. Differential ion accumulationand ion fluxes in the mesophyll and epidermis of barley[J]. PlantPhysiology, 2000, 122(3): 835?844.
[101]Conn S, Gilliham M. Comparative physiology of elementaldistributions in plants[J]. Annals of Botany, 2010, 105(7): 1081?1102.
[102]Hayes P E, Adem G D, Pariasca-Tanaka J, et al. Leaf phosphorusfractionation in rice to understand internal phosphorus-use efficiency[J]. Annals of Botany, 2022, 129(3): 287?302.
[103]Wen Z H, Pang J Y, Wang X, et al. Differences in foliar phosphorusfractions, rather than in cell-specific phosphorus allocation, underliecontrasting photosynthetic phosphorus use efficiency amongchickpea genotypes[J]. Journal of Experimental Botany, 2023,74(6): 1974?1989.
[104]霍剑锋, 车文春, 孟宪瑞. 栽培措施对谷子叶片光合效率的影响[J]. 内蒙古农牧学院学报, 1993, 14(2): 43?49.
Huo J F, Che W C, Meng X R. Effects of agronomic practices onleaf net photosynthetic assimilation rate of leaves of millet (Setariaitalica Beauv)[J]. Journal of Inner Mongola Institute of Agricultureand Animal Husbandry, 1993, 14(2): 43?49.
[105]杨艳君, 赵红梅, 曹玉风, 李洪燕. 施肥和密度对张杂谷5号叶绿素荧光特性的影响[J]. 华北农学报, 2015, 30(6): 201?208.
Yang Y J, Zhao H M, Cao Y F, Li H Y. Effects of fertilizer anddensity on chlorophyll fluorescence characteristics in foxtail millethybrid Zhangzagu 5[J]. Acta Agriculturae Boreali-Sinica, 2015,30(6): 201?208.
[106]Yang X E, Liu J X, Wang W M, et al. Potassium internal useefficiency relative to growth vigor, potassium distribution andcarbohydrate allocation in rice genotypes[J]. Journal of PlantNutrition, 2004, 27(5): 837?852.
[107]Gupta S A, Berkowitz G A, Pier P A. Maintenance of photosynthesisat low leaf water potential in wheat: role of potassium status andirrigation history[J]. Plant Physiology, 1989, 89(4): 1358?1365.
[108]Tsonev T, Velikova V, Yildiz-Aktas L, et al. Effect of water deficitand potassium fertilization on photosynthetic activity in cottonplants[J]. Plant Biosystems, 2011, 145(4): 841?847.
[109]Lu Z F, Lu J W, Pan Y H, et al. Genotypic variation in photosyntheticlimitation responses to K deficiency of Brassica napus is associatedwith potassium utilisation efficiency[J]. Functional Plant Biology,2016, 43(9): 880?891.
[110]Gerardeaux E, Saur E, Constantin J, et al. Effect of carbonassimilation on dry weight production and partitioning duringvegetative growth[J]. Plant and Soil, 2009, 324: 329?343.
[111]Vijayalakshmi D, Raveendran M. Physiological analysis of C3 rice[Oryza sativa (L.)] and C4 millet [Setaria italica (L.)] to identifyphotosynthetically efficient plants[J]. Indian Journal of PlantPhysiology, 2018, 23: 193?200.
[112]再吐尼古丽·库尔班, 吐尔逊·吐尔洪, 涂振东, 艾克拜尔·伊拉洪.不同施肥对干旱区高粱叶片光合特性及产量的影响[J]. 华北农学报, 2021, 36(2): 127?134.
Zaituniguli K, Tuerxun T, Tu Z D, Aikebaier Y. Effects of differentfertilizers on photosynthetic characteristics and yield of Sorghumleaves in Arid areas[J]. Acta Agricuture Boreali-Sinica, 2021, 36(2):127?134.
[113]唐玉劼, 郭容秋, 王鼐, 等. 高粱光合特性、水分利用效率鉴定及产量综合性分析[J]. 分子植物育种, 2023, 21(13): 4486?4494.
Tang Y J, Guo R Q, Wang N, et al. Identification of photosyntheticcharacteristics, water use efficiency and comprehensive analysis ofyield in Sorghum[J]. Molecular Plant Breeding, 2023, 21(13):4486?4494.
[137]Ryan M H, Kidd D R, Sandral G A, et al. High variation in thepercentage of root length colonised by arbuscular mycorrhizal fungiamong 139 lines representing the species subterranean clover(Trifolium subterraneum)[J]. Applied Soil Ecology, 2016, 98:221?232.
[138]Liu B T, Li H B, Zhu B, et al. Complementarity in nutrient foragingstrategies of absorptive fine roots and arbuscular mycorrhizal fungiacross 14 coexisting subtropical tree species[J]. New Phytologist,2015, 208(1): 125?136.
[139]Li H B, Liu B T, McCormack M L, et al. Diverse belowgroundresource strategies underlie plant species coexistence and spatialdistribution in three grasslands along a precipitation gradient[J].New Phytologist, 2017, 216(4): 1140?1150.
[140]Tian Q Y, Chen F J, Zhang F S, Mi G H. Genotypic differencein nitrogen acquisition ability in maize plants is related to thecoordination of leaf and root growth[J]. Journal of Plant Nutrition,2006, 29(2): 317?330.
[141]Tian Q Y, Sun P, Zhang W H. Ethylene is involved in nitratedependent root growth and branching in Arabidopsis thaliana[J].New Phytologist, 2009, 184(4): 918?931.
[142]Gao K, Chen F J, Yuan L X, et al. A comprehensive analysis of rootmorphological changes and nitrogen allocation in maize in responseto low nitrogen stress[J]. Plant Cell & Environment, 2015, 38(4):740?750.
[143]Sun X C, Chen F J, Yuan L X, Mi G H. The physiologicalmechanism underlying root elongation in response to nitrogendeficiency in crop plants[J]. Planta, 2020, 251: 1?14.
[144]王宇珅, 张敏, 孟晓伟, 韩渊怀. 低氮胁迫对谷子苗期光合指标及生理性能的影响[J]. 山西农业科学, 2021, 49(12): 1483?1490.
Wang Y S, Zhang M, Meng X W, Han Y H. Effects of low nitrogenstress on photosynthesis indexes and physiological performance offoxtail millet at seedling stage[J]. Journal of Shanxi AgriculturalSciences, 2021, 49(12): 1483?1490.
[145]李邦, 刘春娟, 郭俊杰, 等. 低氮胁迫下外源色氨酸对高粱幼苗根系伸长的调控作用[J]. 作物学报, 2023, 49(5): 1372?1385.
Li B, Liu C J, Guo J J, et al. Effects of exogenous tryptophan onroot elongation of sorghum seedlings under low nitrogen stress[J].Acta Agronomica Sinica, 2023, 49(5): 1372?1385.
[146]Postma J A, Dathe A, Lynch J P. The optimal lateral root branchingdensity for maize depends on nitrogen and phosphorus availability[J]. Plant Physiology, 2014, 166(2): 590?602.
[147]Garnett T P, Rebetzke G J. Improving crop nitrogen use in drylandfarming[M]. Rengel Z. Improving water and nutrient-use efficiency in food production systems. Chichester, UK: John Wiley and Sons,Inc, 2013.
[148]Forde B G. Nitrate transporters in plants: Structure, function andregulation[J]. BBA-Biomembranes, 2000, 1465(1/): 219?235.
[149]Tsay Y F, Chiu C C, Tsai C B, et al. Nitrate transporters and peptidetransporters[J]. FEBS Letters, 2007, 581(12): 2290?2300.
[150]Cheng J J, Tan H L, Shan M, et al. Genome-wide identification andcharacterization of the NPF genes provide new insight into lownitrogen tolerance in Setaria[J]. Frontiers in Plant Science, 2022, 13:1043832.
[151]H?gh-Jensen H, Pedersen M B. Morphological plasticity by cropplants and their potassium use efficiency[J]. Journal of PlantNutrition, 2003, 26(5): 969?984.
[152]于海秋, 夏乐, 郭焕茹, 等. 玉米耐低钾的根系吸收机制初探[J].安徽农业科学, 2007, 35(33): 10603?10604.
Yu H Q, Xia L, Guo H R, et al. Preliminary study on rootabsorption mechanism of low-potassium tolerance in maize[J].Journal of Anhui Agricultural Sciences, 2007, 35(33): 10603?10604.
[153]Daras G, Rigas S, Tsitsekian D, et al. Potassium transporter TRH1subunits assemble regulating root-hair elongation autonomouslyfrom the cell fate determination pathway[J]. Plant Science, 2015,231: 131?147.
[154]Pilot G, Pratelli R, Gaymard F, et al. Five-group distribution of theShaker-like K+ channel family in higher plants[J]. Journal of Molecular Evolution, 2003, 56(4): 418?434.
[155]代书桃, 朱灿灿, 马小倩, 等. 谷子HAK/KUP/KT钾转运蛋白家族全基因组鉴定及其对低钾和高盐胁迫的响应[J]. 作物学报, 2023,49(8): 2105?2121.
Dai S T, Zhu C C, Ma X Q, et al. Genome-wide identification of theHAK/KUP/KT potassium transporter family in foxtail millet and itsresponse to K+ deficiency and high salt stress[J]. Acta AgronomicaSinica, 2023, 49(8): 2105?2121.
[156]欧阳浩, 蒋君梅, 杜巧丽, 等. 高粱钾离子通道Shaker蛋白家族的鉴定及生物信息学分析[J]. 山地农业生物学报, 2021, 40(5): 1?9.
Ouyang H, Jiang J M, Du Q L, et al. Identification andbioinformatics analysis of shaker protein family of potassiumchannels in Sorghum[J]. Journal of Mountain Agriculture andBiology, 2021, 40(5): 1?9.
[157]裴冬, 张喜英, 王峻. 高粱、谷子根系发育及其抗旱性研究[J]. 中国生态农业学报, 2002, 10(4): 28?30.
Pei D, Zhang X Y, Wang J. Study on root development and droughtresistance of sorghum and millet[J]. Chinese Journal of Ecol-Agriculture, 2002, 10(4): 28?30.
[158]张永清. 几种谷类作物根土系统的研究[D]. 山西晋中: 山西农业大学博士学位论文, 2005.
Zhang Y Q. Study on root soil system of several cereal crops[D].Jinzhong, Shanxi: PhD Dissertation of Shanxi AgriculturalUniversity, 2015.
基金项目:河北省农林科学院科技创新人才队伍建设项目(C23R0403);国家谷子高粱产业技术体系传统旱作技术挖掘与创新岗位(CARS-06-14.5-A23);河北省农林科学院基本科研业务费包干制项目(HBNKY-BGZ-02)。

