拟南芥细胞膜质子泵对硝酸盐吸收利用的影响
潘婷 张雅琳 周博阳 成元 喻敏 张茂星 朱毅勇

摘要: 【目的】硝态氮(NO3?-N) 是多数植物吸收利用的主要氮素形态之一,NO3?-N 的跨膜运输需要耦合质子共转运,质子运转需要细胞膜上的质子泵提供质子驱动力。本研究通过分析拟南芥细胞膜质子泵AHA1 和AHA2对硝态氮吸收的信号网络,以明确硝态氮吸收过程中的分子调控机制。【方法】以野生型Col-0、质子泵基因突变体aha1-9、aha2-5 以及恢复系AHA1/aha1-9、AHA2/aha2-5 为试验材料,在不同NO3?-N 浓度(1、10 和20mmol/L) 培养基上培养10 天,观察其表型,记录根系生长以及生物量变化,测定根系细胞膜质子泵蛋白及其磷酸化水平变化,检测根系中参与NO3?-N 响应与转运相关基因(NRT1.1、NRT2.1、NRT2.2、NRT2.4 和NLP7) 和生长素响应与转运相关基因(ARF11、IAA6、PIN7 和SAUR57) 的相对表达量。【结果】20 mmol/L NO3?-N 处理下各材料之间的生长无显著差异。在1 和10 mmol/L NO3?-N 条件下,与野生型相比,aha1-9 和aha2-5 的主根长度、侧根数量、根部和地上部生物量均显著降低。1 mmol/L NO3?-N 时,aha1-9 的上述指标与野生型的差异显著大于aha2-5。恢复系AHA1/aha1-9、AHA2/aha2-5 在各个NO3?-N 供应水平下均与野生型差异不显著。通过分离根系细胞膜发现,在1、10 mmol/L NO3?-N 条件下,相比野生型,aha1-9 和aha2-5 的细胞膜质子泵蛋白水平分别降低了68%、19% 和36%、53%,质子泵蛋白磷酸化水平分别降低了83%、43% 和16%、42%;在20 mmol/L NO3?-N 条件下,aha1-9 和aha2-5 的质子泵蛋白水平与野生型差异不显著,但磷酸化水平显著降低。通过RT-qPCR 测定发现,在1 mmol/L NO3?-N 条件下,aha1-9、aha2-5 根系中的NRT1.1、NRT2.1、NRT2.2、NLP7 表达量相比野生型显著下调,10 和20 mmol/L NO3?-N 条件下均没有显著差异。此外,在1 和10 mmol/LNO3?-N 条件下aha1-9、aha2-5 中的ARF11、IAA6、PIN7 和SAUR57 表达量显著上调,然而在20 mmol/L NO3?-N条件下其表达量没有显著差异。【结论】低氮条件下,敲除细胞膜质子泵基因不仅降低其自身蛋白的合成和磷酸化水平,同时也影响硝酸盐转运蛋白基因和生长素相关基因的表达,进而抑制植物的生长。
关键词: 拟南芥; 硝酸盐; 细胞膜质子泵; AHA1; AHA2
氮(N) 是植物生长必需的营养元素,它参与氨基酸、核酸和许多代谢物的合成,对植物生长发育和新陈代谢至关重要[1]。自然条件下,植物以吸收土壤中的无机氮为主,其中无机氮主要有两种形态:硝态氮(NO3?-N) 和铵态氮(NH4+-N)。多数植物主要以吸收NO3?-N 为主[2],根系细胞中的NO3?经过硝酸还原酶和亚硝酸还原酶迅速还原为NH4+,然后通过谷氨酰胺合成酶(glutamine synthetase,GS) 和谷氨酸合成酶(glutamate synthase,GOGAT) 途径同化成氨基酸[3]。为适应土壤中氮素浓度的变化,植物根系进化出了高亲和硝酸盐转运系统(high-affinity nitratetransport system,HATS) 与低亲和硝酸盐转运系统(low-affinity nitrate transport system,LATS),前者主要在<1 mmol/L NO3?低浓度溶液中发挥作用,后者在>1 mmol/L NO3?时起作用[4]。在拟南芥中,参与硝酸盐吸收的转运蛋白主要包括两大类:NRT1 (nitratetransporter 1) 和NRT2 (nitrate transporter 2)[5]。其基因组中有60 个基因编码NRT 蛋白,包括53 个NRT1家族基因和7 个NRT2 家族基因,其中NRT1.1、NRT2.1、NRT2.2 和NRT2.4 在NO3?-N 吸收中发挥主要作用[6]。NRT1.1 主要定位于根表皮、皮层和内皮层细胞质膜上,对NO3?-N 吸收表现出双亲和性,外界环境中硝酸盐浓度和蛋白第101 位点的苏氨酸磷酸化状态决定了NRT1.1 具有低亲和或高亲和的功能[7?8]。NRT1.1 的表达受到生长素等植物激素的调控,研究表明生长素IAA 增强了NRT1.1 表达,促进硝酸盐的吸收[9]。NRT2.1、NRT2.2、NRT2.4 均为高亲和硝酸盐转运蛋白,分布于根表皮或皮层细胞质膜,其表达受到硝酸盐的诱导[4, 10?12]。NO3?-N 除了作为矿质元素外,它还是一种重要的信号分子,可以诱导许多参与NO3?-N 吸收、代谢等途径基因的表达[13]。研究发现,转录因子NLP7 可作为硝态氮的受体,感受外界环境中硝酸盐浓度,进而激活下游NRT2.1、NRT2.2 和硝酸盐还原相关基因NIR 和NIA1 等的表达[14]。
尽管硝酸盐的吸收和运输由硝酸盐转运蛋白负责,但是作为阴离子,其跨膜运输过程是一种需要质子协同的主动运输[15?18],由于氮素是作物吸收最多的一种矿质营养,因此维持其吸收需要大量的质子驱动力。但是硝酸盐吸收与质子泵相互之间的作用关系在分子生物学水平上还未得到充分的验证。
植物细胞膜质子泵(plasma membrane H+-ATPase,PMA) 是一类利用水解ATP 产生能量,将细胞质中的H+逆浓度泵出细胞的运输蛋白。PMA 不仅参与维持细胞内pH 稳态、细胞伸长生长、矿质营养元素的吸收与转运、气孔运动等生理过程[19?24],而且在植物逆境响应中也发挥重要作用,如盐、低温、干旱、铝毒等[25?29]。PMA 是一个由多基因家族编码的蛋白质,在拟南芥中有11 个基因:AHA1~AHA11[30]。不同AHA 基因的表达具有一定的组织特异性和功能特殊性。在拟南芥中,AHA1 和AHA2 的表达量较高,且在各组织器官中广泛表达,参与气孔运动、根系生长、下胚轴伸长、逆境响应等过程[31?32];AHA4 主要在根系皮层中表达,参与调节植物的耐盐性[ 3 3 ];AHA10 定位于液泡膜,在正在发育的种子中有较高表达,参与种皮内皮中原花青素的形成[34];AHA3 调节花粉发育[33?35];AHA6、AHA8 和AHA9 与花粉管生长密切相关[20]。据报道,PMA 也参与调控养分缺乏导致的根系构型的改变。AHA2 在根系中受硝态氮诱导表达,aha2 突变体在不同硝态氮水平条件下主根和侧根的长度均显著降低[36]。也有报道表明,AHA2和AHA7 在根表皮细胞中表达占优势,AHA2 驱动细胞扩张而调节根系生长,但AHA2 和AHA7 负向调节根毛的伸长[37]。低磷条件下,拟南芥AHA2 和AHA7 在根系的表达上调,分别调节主根和根毛的生长[38]。但是有关PMA 调控养分胁迫造成的根系构型改变的具体机制并不明确。
有研究认为,植物激素可通过影响PMA 进而调节根系构型。例如,外源茉莉酸甲酯诱导莴苣幼苗根毛形成的过程与PMA 活性增强引起的根际酸化有关[39]。研究发现,生长素通过胞内TIR1/AFB 信号途径引起H+内流而使质外体碱化,而外源添加生长素可以引起AHA2 倒数第二个氨基酸残基(苏氨酸) 的磷酸化修饰[40]。PMA 的C-末端自抑制域发生磷酸化或去磷酸化可以改变其活性[41?42]。当C-末端倒数第二个残基(苏氨酸) 发生磷酸化后与14-3-3 蛋白结合,PMA 活性随即被激活[43?46]。生长素响应蛋白SAUR9和SAUR19 能够与磷酸酶PP2C.D 相互作用,通过抑制PP2C.D 活性,使质子泵C-末端倒数第二个苏氨酸残基去磷酸化,抑制PMA 活性[47?50]。但是有关硝酸盐供应是否也会影响PMA 在蛋白水平上发生磷酸化修饰,进而影响质子泵活性和根系生长,则还不清楚。
在本研究中,以拟南芥野生型Col-0 和突变体aha1-9、aha2-5 以及恢复系AHA1/aha1-9、AHA2/aha2-5 作为研究对象,通过不同浓度硝态氮处理,观察其生长表型,分析PMA 蛋白水平和磷酸化水平变化,以及对硝酸盐吸收和生长素相关的基因在转录水平的影响,探究AHA1 和AHA2 与根系吸收NO3?-N 之间可能的相互调控关系和机制。
1 材料与方法
1.1 试验材料
拟南芥野生型C o l - 0 ( W T ),突变体a h a 1 - 9(At2g18960: SAIL_1285_D12)、aha2-5 (AT4G30190:SALK_022010),AHA1/aha1-9、AHA2/aha2-5。
1.2 试验设计
取适量拟南芥种子装入1.5 mL EP 管中,加入1 mL 次氯酸钠消毒液进行表面消毒,10 min 后用无菌水清洗干净。将灭菌后的种子点在1/2 MS 培养基上,4℃ 春化2 天后放入光照培养箱培养,3 天后挑选长势一致的幼苗分别移至1、10、20 mmol/L NO3?-N培养基上继续生长10 天。光照培养箱的培养条件为:光照强度为100 μmol/(m2·s),温度为22℃,相对湿度为70%,光照时长为16 h 光照/8 h 黑暗。
对拟南芥野生型Col-0,突变体aha1-9、aha2-5、AHA/1aha1-9、AHA2/aha2-5 进行1、10、20 mmol/LNO3?-N 处理,观察生长表型,分析质子泵蛋白和磷酸化水平变化,检测相关调控基因的表达。
1.3 试验方法
1.3.1 植株生长指标的测定
WT、aha1-9 和aha2-5 以及AHA/1aha1-9 和AHA2/aha2-5 分别在1、10、20 mmol/L NO3?-N 培养基垂直培养10 天后,选取一定数量长势相近的植株,分别测量其主根长度和侧根数量,并对地上和地下部分称取鲜重。
1.3.2 实时荧光定量PCR
用MagZolTM Reagent(Trizol reagent) 试剂盒(广州美基生物科技有限公司) 提取根系总RNA,利用HiScript III 1st StrandcDNA Synthesis Kit (+gDNA wiper) (诺唯赞公司) 反转录成cDNA,使用ChamQ Universal SYBR qPCRMaster Mix (诺唯赞公司) 进行荧光定量PCR。引物信息见表1。
1.3.3 细胞膜质子泵蛋白的提取及蛋白和磷酸化水平检测
WT 和aha1-9、aha2-5 分别在1、10、20mmol/L NO3? -N 培养基上生长10 天后,参照Zhu等[51]的方法提取根系细胞膜蛋白,并用BCA 试剂盒测定蛋白含量。取相同含量的膜蛋白进行Westernblot,分别用Anti-H+-ATPase 和Anti-pThr 抗体(由名古屋大学木下俊则教授惠赠) 检测细胞膜质子泵蛋白量和磷酸化水平变化,同时以Actin 作为内参蛋白,内参蛋白抗体(Sigma-Aldrich, St. Louis, MO, USA,Cat#057M4548) 稀释3000 倍,并用ImageJ 进行灰度统计。
1.4 数据处理
本试验数据均采用Excel 2019 和SPSS 17.0 进行数据统计处理和单因素方差分析,结果采用沃勒–邓肯法比较不同处理平均值之间差异的显著性,运用GraphPad Prism 8 进行图表制作。
2 结果与分析
2.1 AHA1/2 的缺失抑制低氮下植物的生长
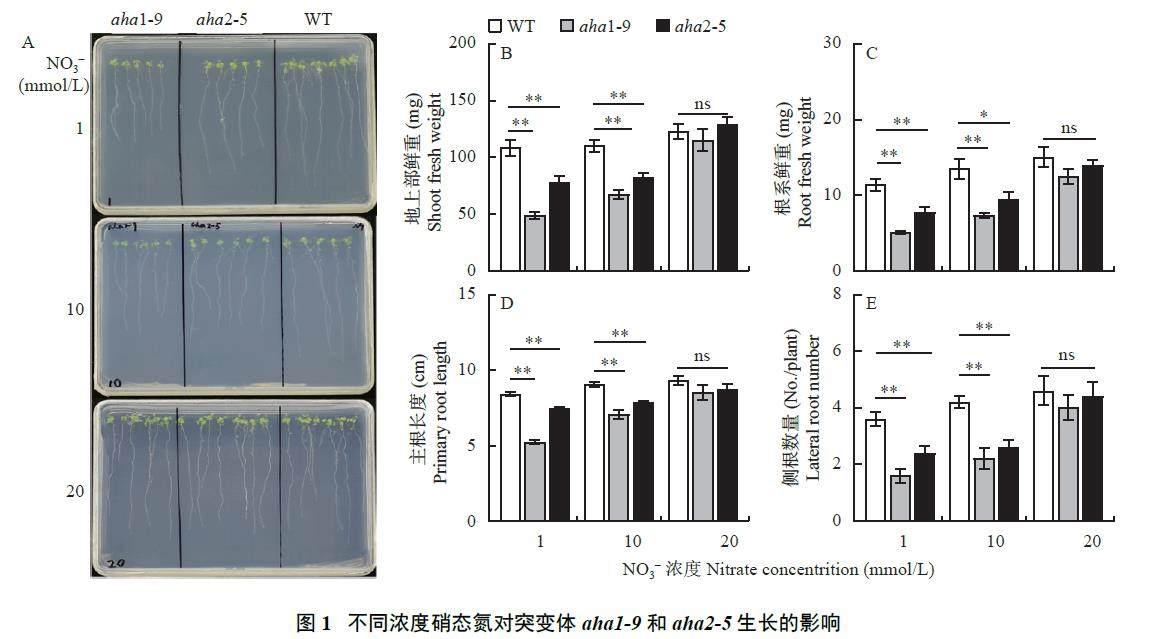
WT 和a h a 1 - 9、a h a 2 - 5 分别在含有1、1 0、20 mmol/L NO3?-N 的培养基上生长10 天,观察其表型,发现在20 mmol/L NO3?-N 培养条件下,突变体和WT 之间表型差异不显著,其地上部和地下部生物量,包括主根长和侧根数量均没有明显差异(图1A~E)。但是在10 mmol/L NO3?-N 条件下,相比于WT,两个突变体开始都表现出根系生长受抑制,地上部与根系生物量显著降低,侧根数显著减少(图1A~E,P<0.05)。随着外源硝酸盐浓度的降低,在1 mmol/L NO3?-N 条件下,aha1-9 与aha2-5的地上部和根系生长受抑制更为严重,且aha1-9 的受抑制程度尤为显著。具体来看,在1 mmol/L NO3?-N下,与WT 相比,aha1-9 和aha2-5 的地上部鲜重分别降低了55% 和27% (图1 B,P<0.01),根系鲜重分别降低了55% 和31% (图1C,P<0.01),主根长度分别缩短了38% 和11% (图1D,P<0.01),侧根数分别减少了55% 和33% (图1E,P<0.01)。上述结果说明,在NO3?低于20 mmol/L 情况下,质子泵基因突变导致地上部与地下部的生长受到显著抑制。但在高浓度NO3?供应下,这种抑制情况又会得到解除。
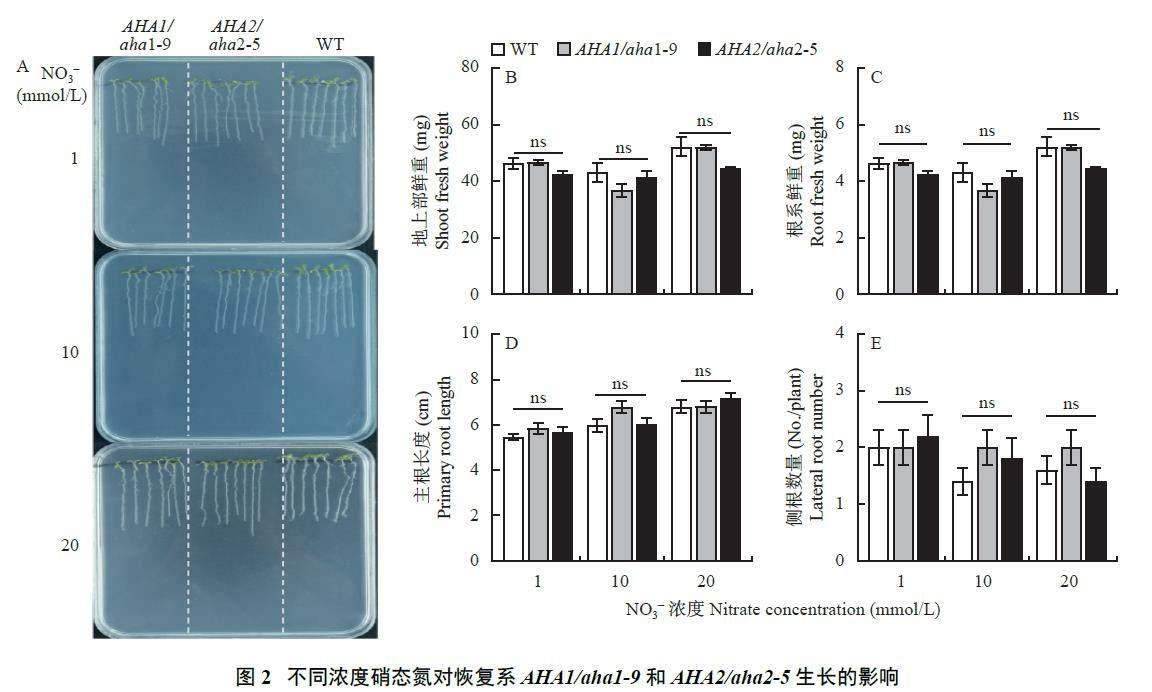
本研究进一步对恢复系AHA1/aha1-9 和AHA2/aha2-5 进行不同浓度NO3?-N 处理,发现不论在何种NO3?-N 浓度下,恢复系植株的生长均与野生型无异(图2)。以上结果说明,在1 和10 mmol/L NO3?-N 条件下,AHA1 或AHA2 的突变都会抑制植株生物量和根系生长,在1 mmol/L NO3?-N 条件下,AHA1 突变引起的生长抑制作用显著大于AHA2。
2.2 不同硝态氮浓度下AHA1/2 基因突变对细胞膜质子泵蛋白和磷酸化水平的影响
分别提取上述不同浓度NO3?-N 下WT 和aha1-9、aha2-5 的根系膜蛋白,用Anti-H+ -ATPase 和Anti-pThr 抗体通过western blot 方法分别检测其质子泵蛋白量和磷酸化的变化情况。如图3 所示,在20 mmol/L NO3?-N 下,aha1-9 和aha2-5 的Anti-H+-ATPase 条带与WT 差异不大,但Anti-pThr 条带有所减弱,说明磷酸化水平降低;在1、10 mmol/LNO3?-N 条件下,aha1-9、aha2-5 的Anti-H+-ATPase和Anti-pThr 条带均比WT 弱,表明低氮条件下AHA1 或AHA2 的缺失抑制质子泵蛋白的合成和磷酸化修饰。尤其在1 mmol/L NO3?-N 的条件下,aha1-9 的条带灰度达到最低(图3A),从灰度统计可看出,aha1-9 的相对磷酸化水平和相对蛋白水平比WT 分别降低了83% 和68% (图3B 和C,P<0.01)。这些结果表明,在1 和10 mmol/L NO3?-N 条件下,AHA1 或AHA2 的突变都会降低植株质子泵蛋白量和磷酸化水平,在1 mmol/L NO3?-N 条件下,AHA1 突变的影响显著大于AHA2。
2.3 AHA1 和AHA2 在低氮下调节NO3?-N 和生长素转运相关基因的表达
2.3.1 硝酸盐转运蛋白基因
图3 显示,aha1-9、aha2-5 的质子泵活性和磷酸化水平在低NO3?-N 条件下被抑制。因此,我们首先分析了硝酸盐转运相关基因的转录情况。如图4A~D 所示,1 mmol/LNO3?-N 条件下,与WT 相比,突变体aha1-9、aha2-5的NRT1.1、NRT2.1、NRT2.2 表达量显著下调,且NRT2.2 下调倍数最大,分别下调了2.67、1.98 倍(P<0.01)。10 和20 mmol/L NO3?-N 条件下,与WT比较,突变体aha1-9、aha2-5 的NRT1.1、NRT2.1、NRT2.2、NRT2.4 表达量与WT 差异不显著。另外,NLP7 作为植物硝酸盐信号的“开关”,能够感受外界硝酸盐浓度的变化并将信号转至细胞内,调节对NO3?-N 的吸收利用。图4E 显示,在1 mmol/L NO3?-N的条件下,与WT 比较,突变体aha1-9、aha2-5 的NLP7 的表达量显著下调,分别下调了2.52、1.74 倍(P<0.01)。综上所述,AHA1 或AHA2 的缺失显著降低了拟南芥NRT1.1、NRT2.1、NRT2.2、NLP7 对低氮的响应,从而抑制了NO3?-N 的吸收,导致植物生长受阻。
2.3.2 生长素相关基因
由于AHA1 和AHA2 的突变在低NO3?-N 下明显抑制了根的生长,所以我们进一步分析了生长素运输的相关基因ARF11、IAA6、PIN7 和生长素响应基因SAUR57 的转录情况(图5)。结果表明,与WT 相比,1 和10 mmol/L NO3?-N 的条件下,aha1-9 和aha2-5 中ARF11、IAA6、PIN7、SAUR57 相对表达量均显著上调,1 mmol/L NO3?-N条件下aha1-9 和aha2-5 分别上调了9.7、3.0、4.2、25.3 倍和17.9、6.0、7.0、31.1 倍(P<0.01);10mmol/L NO3?-N 的条件下aha1-9 和aha2-5 分别上调了4.2、2.3、3.3、15.4 倍和7.1、3.6、4.8、24.1 倍(P<0.01);在20 mmol/L NO3? -N 的条件下,aha1-9 和aha2-5 突变体与WT 差异不显著(图5A~D)。
3 讨论
旱地土壤中由于存在硝化作用,植物吸收的氮形态主要以NO3?-N 为主,然而土壤胶体带负电,NO3?-N 容易被淋溶损失,造成氮素利用率降低,因此研究植物对NO3?-N 的吸收利用具有重要意义。植物根系细胞吸收土壤中的NO3?主要依赖于NO3?/H+同向转运蛋白NRT,这一过程需要细胞膜质子泵提供质子驱动力将NO3?运输进入细胞内。也有报道表明,外源添加细胞膜质子泵活性促进剂香豆素能够显著促进玉米对NO3?-N 的吸收。此外,在水稻缺氮条件下,NO3?-N 诱导根系细胞膜质子泵基因OSA2、OSA7 等表达,然而其中具体的分子调控机制并不清楚,因此研究细胞膜质子泵活性对NO3?-N 吸收利用的调控机制具有重要意义。
我们通过对拟南芥野生型、突变体a h a 1 - 9、aha2-5 进行了不同浓度NO3?-N (1、10、20 mmol/L)的培养后发现,在1 和10 mmol/L NO3?-N 的条件下,与野生型比,aha1-9 和aha2-5 的生物量显著降低,且其主根长度和侧根数量也显著下降,在1 mmol/LNO3? -N 条件下,aha1-9 的受抑制程度要显著大于aha2-5 (图1)。恢复系AHA1/aha1-9 和AHA2/aha2-5 在各个氮水平处理下,与野生型差异不显著,能够恢复正常生长(图2)。说明在低氮条件下,AHA1 和AHA2 能够影响根系细胞膜质子泵活性,对硝态氮吸收利用具有重要作用,尤其是AHA1 影响更显著,然而在20 mmol/L NO3?-N 条件下可能由于植物处于氮素饱和状态,NO3?-N 响应基因和生长素相关基因不受诱导,从而不能够激活下游细胞膜质子泵,因此,在该浓度下,敲除细胞膜质子泵AHA1和AHA2 基因对NO3?吸收不影响,当然具体信号传递路径需要进一步验证。M?odzińska 等[36]报道表明,拟南芥根系中AHA2 在根系受硝态氮诱导表达,aha2敲除的突变体在不同硝态氮水平条件下主根和侧根的长度均显著降低。另外,拟南芥AHA2 和AHA7也能通过改变细胞膜质子泵活性,将细胞壁酸化调节根系生长,但AHA2 和AHA7 负向调节根毛的伸长[37]。拟南芥AHA2 和AHA7 也容易受低磷诱导表达,并分别调节主根和根毛的生长[ 4 0 ]。在局部NH4+供应下,AHA2 基因敲除能够降低三级侧根密度以及二级和三级侧根长度[52]。此外,Sperandio 等[53]通过氮饥饿处理,再供应NO3?-N 可以显著诱导根系细胞膜质子泵OsA2、OsA7 和OsA8 基因的表达;同时在低氮条件下,OsA2 基因表达下调会显著降低植物体内的氮含量。也有报道表明NO3?-N 能够诱导玉米(MHA3 和MHA4) 和葡萄(VvHA2 和VvHA4) 细胞膜质子泵转录水平的提高来促进NO3?-N 吸收[54]。然而,免疫印迹试验结果表明,在1 和10 mmol/LNO3?-N 的条件下,与野生型比,aha1-9和aha2-5 的细胞膜质子泵蛋白水平和磷酸化水平都显著降低(图3),说明在低氮条件下,细胞膜质子泵能够通过蛋白水平和磷酸化水平变化来调节其活性,从而保证NO3?-N 吸收利用,当AHA1 或AHA2的功能缺失导致NO3? -N 吸收受到影响,从而导致aha1-9 和aha2-5 的细胞膜质子泵蛋白水平和磷酸化水平都显著降低。此外通过分析拟南芥根系中氮信号通路中相关基因的表达,AHA1 或AHA2 的功能缺失导致低NO3?-N 下根系NRT1.1、NRT2.1、NRT2.2和NLP7 的表达量显著降低(图4A~C 和E)。NLP7 在拟南芥硝酸盐信号转导中是一个主要的硝酸盐信号感受器和上游核心转录调节因子,并参与初级硝酸盐反应[55]。在1 mmol/L NO3? -N 条件下,aha1-9 和aha2-5 中NLP7 的表达水平显著低于野生型,限制了下游高亲和转运蛋白基因NRT2.1、NRT2.2 的表达,导致拟南芥生长受到抑制。
最近的研究表明,生长素通过胞内TIR1/AFB 信号途径引起H+内流而使质外体碱化,从而抑制根系生长[41]。外源添加生长素可以通过TMK1 将AHA2蛋白C 末端的苏氨酸磷酸化,从而激活质子泵活性,使质外体碱化,这个过程与胞内生长素信号引起的质外体碱化相互拮抗[40]。也有报道表明细胞膜质子泵存在多个氨基酸位点受到磷酸化修饰的调控[40, 56]。磷酸酶PP2C.D 和生长素响应蛋白SAUR 是调控细胞膜质子泵磷酸化的一个关键成分,SAUR9和SAUR19 能够与PP2C.D 相互作用,通过抑制PP2C.D 活性,使质子泵C-末端倒数第二个残基苏氨酸去磷酸化[47?49, 51]。我们的免疫印迹试验结果及生长素相关基因表达分析结果表明,在1 和10 mmol/LNO3?-N 的条件下,与野生型比,aha1-9 和aha2-5 的细胞膜质子泵磷酸化水平显著降低,可能是由于生长素调节的相关基因IAA6 和SAUR57 等上调(图5),导致细胞膜质子泵去磷酸化,活性下降(图3)。当然,这部分工作需要进一步通过蛋白互作来验证。同时,Yang 等[57]的研究也表明,生长素可通过上调ARF11、IAA6、PIN7 和SAUR57 等生长素调节相关基因表达来抑制主根的伸长。此外,Miao 等[58]研究表明,干旱条件下,根系合成低浓度ABA 能够通过与受体PYL8 结合,抑制PP2Cs 磷酸酶活性,细胞膜质子泵去磷酸化,提高细胞膜质子泵活性,促进主根的伸长来适应水分胁迫条件[59];而高浓度ABA,可减少拟南芥胞外H+挤出,抑制根生长,Hayashi 等[21]报道,施用20 μmol/L ABA 可诱导AHA中Thr947 的去磷酸化,并以abi1 依赖的方式抑制下胚轴伸长。因此,在1 和10 mmol/L NO3? -N 条件下,植物可通过细胞膜质子泵磷酸化,提高细胞膜质子泵活性,促进根系氮素吸收和主根的伸长,而敲除细胞膜质子泵基因能够诱导生长素相关基因表达促进生长素合成,进而抑制根系的生长。
4 结论
本研究结果表明,在低氮条件下,细胞膜质子泵基因敲除不仅影响其自身蛋白的合成和磷酸化水平,而且也影响硝酸盐转运相关基因NRT1.1、NRT2.1、NRT2.2 和NLP7 的表达,导致氮素的吸收受到影响。同时,敲除质子泵基因能够诱导生长素相关基因ARF11、IAA6、PIN7 和SAUR57 的表达,促进生长素合成,从而导致植物生长受到抑制。但在高氮水平下,虽然突变体中质子泵磷酸化水平下降,但未影响硝酸盐和生长素响应与转运相关基因的表达,植物保持正常生长。
细胞膜质子泵与硝态氮吸收转运存在耦合关系,这种关系受外界硝态氮供应水平的影响,尤其是在低氮条件下,硝酸盐吸收不仅依赖于硝酸盐转运蛋白,也依赖于质子泵提供的质子驱动力。在外界硝态氮浓度非常高的情况下,硝酸盐也可以通过细胞膜内外的浓度梯度差进入细胞,但是这种情况实际土壤中几乎不存在。因此,提高作物本身的质子泵活性仍然是促进硝态氮吸收的一个决定性因素。
参 考 文 献:
[ 1 ]de Bang T C, Husted S, Laursen K H, et al. The molecularphysiologicalfunctions of mineral macronutrients and theirconsequences for deficiency symptoms in plants[J]. New Phytologist,2021, 229(5): 2446?2469.
[ 2 ]Xu G, Fan X, Miller A J. Plant nitrogen assimilation and useefficiency[J]. Annual Review of Plant Biology, 2012, 63: 153?182.
[ 3 ]徐晓鹏, 傅向东, 廖红. 植物铵态氮同化及其调控机制的研究进展[J]. 植物学报, 2016, 51(2): 152?166.
Xu X P, Fu X D, Liao H. Advances in study of ammoniumassimilation and its regulatory mechanism in plants[J]. ChineseBulletin of Botany, 2016, 51(2): 152?166.
[ 4 ]Wang Y Y, Hsu P K, Tsay Y F. Uptake, allocation and signaling ofnitrate[J]. Trends in Plant Science, 2012, 17(8): 458?467.
[ 5 ] 宋田丽, 周建建, 徐晨曦, 等. 植物硝酸盐转运蛋白功能及表达调控研究进展[J]. 上海师范大学学报(自然科学版), 2017, 46(5): 740?750.
Song T L, Zhou J J, Xu C X, et al. Progress in function and regulationof nitrate transporters in plants[J]. Journal of Shanghai NormalUniversity (Natural Sciences), 2017, 46(5): 740?750.
[ 6 ]张曦, 林金星, 单晓昳. 拟南芥无机氮素转运蛋白及其磷酸化调控机制研究进展[J]. 植物学报, 2016, 51(1): 120?129.
Zhang X, Lin J X, Shan X Y. Progress in inorganic nitrogen transportproteins and their phosphorylation regulatory mechanism inArabidopsis[J]. Chinese Bulletin of Botany, 2016, 51(1): 120?129.
[ 7 ]Liu K H, Tsay Y F. Switching between the two action modes of thedual-affinitynitrate transporter CHL1 by phosphorylation[J]. TheEMBO Journal, 2003, 22(5): 1005?1013.
[ 8 ]Martín Y, Navarro F J, Siverio J M. Functional characterization of theArabidopsis thaliana nitrate transporter CHL1 in the yeast Hansenulapolymorpha[J]. Plant Molecular Biology, 2008, 68(3): 215?224.
[ 9 ]尹伟伦, 郑冬超, 夏新莉. 生长素促进拟南芥AtNRT1.1基因表达增强硝酸盐吸收[J]. 北京林业大学学报, 2013, 35(2): 80?85.
Yin W L, Zheng D C, Xia X L. Auxin promotes nitrate uptake by upregulatingAtNRT1.1 gene transcript level in Arobidopsis thaliana[J].Journal of Beijing Forestry University, 2013, 35(2): 80?85.
[10] Li W, Wang Y, Okamoto M, et al. Dissection of the AtNRT2.1:AtNRT2.2 inducible high-affinity nitrate transporter gene cluster[J].Plant Physiology, 2007, 143(1): 425?433.
[11]Kiba T, Feria-Bourrellier A, Lafouge F, et al. The Arabidopsis nitratetransporter NRT2.4 plays a double role in roots and shoots of nitrogenstarvedplants[J]. The Plant Cell, 2012, 24(1): 245?258.
[12]Okamoto M, Vidmar J J, Glass A D. Regulation of NRT1 and NRT2gene families of Arabidopsis thaliana: Responses to nitrate provision[J]. Plant and Cell Physiology, 2003, 44(3): 304?317.
[13]OBrien J A, Vega A, Bouguyon E, et al. Nitrate transport, sensing,and responses in plants[J]. Molecular Plant, 2016, 9(6): 837?856.
[14]Liu K H, Liu M, Lin Z, et al. NIN-like protein 7 transcription factoris a plant nitrate sensor[J]. Science, 2022, 377: 1419?1425.
[15]McClure P R, Kochian L V, Spanswick R M, Shaff J E. Evidence forcotransport of nitrate and protons in maize roots: I. Effects of nitrateon the membrane potential[J]. Plant Physiology, 1990, 93(1): 281?289.
[16]Glass A D M, Shaff J E, Kochian L V. Studies of the uptake of nitratein barley: IV. Electrophysiology[J]. Plant Physiology, 1992, 99(2):456?463.
[17]Sperandio M V L, Santos L A, Tavares O C H, et al. Silencing theOryza sativa plasma membrane H+-ATPase isoform OsA2 affectsgrain yield and shoot growth and decreases nitrogen concentration[J].Journal of Plant Physiology, 2020, 251: 153220.
[18]Santi S, Locci G, Monte R, et al. Induction of nitrate uptake in maizeroots: Expression of a putative high-affinity nitrate transporter andplasma membrane H+-ATPase isoforms[J]. Journal of ExperimentalBotany, 2003, 54: 1851?1864.
[19]戴森焕, 吴海诚, 张茂星, 等. 细胞膜H+-ATPase酶在植物矿质营养中的作用[J]. 植物营养与肥料学报, 2022, 28(11): 2118?2129.
Dai S H, Wu H C, Zhang M X, et al. Roles of plasma membrane H+-ATPases in plant mineral nutrition[J]. Journal of Plant Nutrition andFertilizers, 2022, 28(11): 2118?2129.
[20]Hoffmann R D, Portes M T, Olsen L I, et al. Plasma membrane H+-ATPases sustain pollen tube growth and fertilization[J]. NatureCommunications, 2020, 11(1): 2395.
[21]Hayashi Y, Takahashi K, Inoue S, Kinoshita T. Abscisic acidsuppresses hypocotyl elongation by dephosphorylating plasmamembrane H+-ATPase in Arabidopsis thaliana[J]. Plant CellPhysiology, 2014, 55(4): 845?853.
[22]Takahashi K, Hayashi K, Kinoshita T. Auxin activates the plasmamembrane H+ -ATPase by phosphorylation during hypocotylelongation in Arabidopsis[J]. Plant Physiology, 2012, 159(2):632?641.
[23]Verweij W, Spelt C, Di Sansebastiano G, et al. An H+ P-ATPase onthe tonoplast determines vacuolar pH and flower colour[J]. NatureCell Biology, 2008, 10(12): 1456?1462.
[24]Gévaudant F, Duby G, von Stedingk E, et al. Expression of aconstitutively activated plasma membrane H+-ATPase alters plantdevelopment and increases salt tolerance[J]. Plant Physiology, 2007,144(4): 1763?1776.
[25]Cao Y B, Zhang M, Liang X Y, et al. Natural variation of an EF-handCa2+-binding-protein coding gene confers saline-alkaline tolerance inmaize[J]. Nature Communications, 2020, 11(1): 186.
[26]Merlot S, Leonhardt N, Fenzi F, et al. Constitutive activation of aplasma membrane H+-ATPase prevents abscisic acid-mediatedstomatal closure[J]. The EMBO Journal, 2007, 26(13): 3216?3226.
[27]Marra M, Camoni L, Visconti S, et al. The surprising story offusicoccin: A wilt-inducing phytotoxin, a tool in plant physiologyand a 14-3-3-targeted drug[J]. Biomolecules, 2021, 11(9): 1393.
[28]Ponce-Pineda I G, Carmona-Salazar L, Saucedo-García M, et al.MPK6 kinase regulates plasma membrane H+-ATPase activity in coldacclimation[J]. International Journal of Molecular Sciences, 2021,22(12): 6338.
[29]Zhang J, Wei J, Li D, et al. The role of the plasma membrane H+-ATPase in plant responses to aluminum toxicity[J]. Frontiers in PlantScience, 2017, 8: 1757.
[30]Palmgern, M G. Plant plasma membrane H+-ATPase: Powerhousesfor nutrient uptake[J]. Annual Review of Plant Biology, 2001, 52(1):817?845.
[31]Axelsen K B, Palmgren M G. Inventory of the superfamily of P-typeion pumps in Arabidopsis[J]. Plant Physiology, 2001, 126(2):696?706.
[32]Li Y, Zeng H, Xu F, et al. H+-ATPases in plant growth and stressresponses[J]. Annual Review of Plant Biology, 2022, 73: 495?521.
[33]Vitart V, Baxter I, Doerner P, Harper J F. Evidence for a role ingrowth and salt resistance of a plasma membrane H+-ATPase in theroot endodermis[J]. Plant Journal, 2001, 27(3): 191?201.
[34]Baxter I R, Young J C, Armstrong G, et al. A plasma membrane H+-ATPase is required for the formation of proanthocyanidins in the seedcoat endothelium of Arabidopsis thaliana[J]. Proceedings of theNational Academy of Sciences of the United States of America, 2005,102(7): 2649?2654.
[35]Robertson W R, Clark K, Young J C, Sussman M R. An Arabidopsisthaliana plasma membrane proton pump is essential for pollendevelopment[J]. Genetics, 2004, 168(3): 1677?1687.
[36]M?odzińska E, K?obus G, Christensen M D, Fuglsang A T. Theplasma membrane H+ -ATPase AHA2 contributes to the rootarchitecture in response to different nitrogen supply[J]. PhysiologiaPlantarum, 2015, 154(2): 270?282.
[37]Hoffmann R D, Olsen L I, Ezike C V, et al. Roles of plasmamembrane proton ATPases AHA2 and AHA7 in normal growth ofroots and root hairs in Arabidopsis thaliana[J]. Physiologia Plantarum,2019, 166(3): 848?861.
[38]Yuan W, Zhang D P, Song T, et al. Arabidopsis plasma membraneH+-ATPase genes AHA2 and AHA7 have distinct and overlappingroles in the modulation of root tip H+ efflux in response to lowphosphorusstress[J]. Journal of Experimental Botany, 2017, 68(7):1731-1741.
[39]Li L, Verstraeten I, Roosjen M, et al. Cell surface and intracellularauxin signalling for H+ fluxes in root growth[J]. Nature, 2021, 599:273?277.
[40]Falhof J, Pedersen J T, Fuglsang A T, et al. Plasma membrane H+-ATPase regulation in the center of plant physiology[J]. MolecularPlant, 2016, 9(3): 323?337.
[41]Palmgren M G, Larsson C, Sommarin M. Proteolytic activation ofthe plant plasma membrane H+-ATPase by removal of a terminal segment[J]. Journal of Biological Chemistry, 1990, 265(23): 13423?13426.
[42]Kinoshita T, Shimazaki K. Blue light activates the plasma membraneH+-ATPase by phosphorylation of the C-terminus in stomatal guardcells[J]. The EMBO Journal, 1999, 18(20): 5548?5558.
[43]Zhang M X, Wang Y, Chen X, et al. Plasma membrane H+-ATPaseoverexpression increases rice yield via simultaneous enhancement ofnutrient uptake and photosynthesis[J]. Nature Communications, 2021,12(1): 735.
[44]Inoue S, Kinoshita T, Matsumoto M, et al. Blue light-inducedautophosphorylation of phototropin is a primary step for signaling[J].Proceedings of the National Academy of Sciences of the UnitedStates of America, 2008, 105(14): 5626?5631.
[45]Okumura M, Inoue S, Kuwata K, Kinoshita T. Photosynthesisactivates plasma membrane H+-ATPase via sugar accumulation[J].Plant Physiology, 2016, 171(1): 580?589.
[46]Ando E, Kinoshita T. Red light-induced phosphorylation of plasmamembrane H+-ATPase in stomatal guard cells[J]. Plant Physiology,2018, 178(2): 838?849.
[47]Spartz A K, Ren H, Park M Y, et al. SAUR inhibition of PP2C-Dphosphatases activates plasma membrane H+-ATPases to promotecell expansion in Arabidopsis[J]. The Plant Cell, 2014, 26(5):2129?2142.
[48]Ren H, Gray W M. SAUR proteins as effectors of hormonal andenvironmental signals in plant growth[J]. Molecular Plant, 2015,8(8): 1153?1164.
[49]Ren H, Park M Y, Spartz A K, et al. A subset of plasma membranelocalizedPP2C. D phosphatases negatively regulate SAUR-mediatedcell expansion in Arabidopsis[J]. PLoS Genetics, 2018, 14(6):e1007455.
[50]Ding M, Zhang M X, Zeng H, et al. Molecular basis of plasmamembrane H+-ATPase function and potential application in theagricultural production[J]. Plant Physiology and Biochemistry, 2021,168: 10?16.
[51]Zhu Y Y, Di T J, Xu G H, et al. Adaptation of plasma membrane H+-ATPase of rice roots to low pH as related to ammonium nutrition[J].Plant, Cell & Environment, 2009, 32(10): 1428-1440.
[52]Biel A, Moser M, Meier I. A role for plant KASH proteins inregulating stomatal dynamics[J]. Plant Physiology, 2020, 182(2):1100?1113.
[53]Sperandio M V L, Santos L A, Bucher C A, et al. Isoforms of plasmamembrane H+-ATPase in rice root and shoot are differentiallyinduced by starvation and resupply of NO3? or NH4+[J]. PlantScience, 2011, 180(2): 251?258.
[54]Pii Y, Alessandrini M, Guardini K, et al. Induction of high-affinityNO3? uptake in grapevine roots is an active process correlated to theexpression of specific members of the NRT2 and plasma membraneH+-ATPase gene families[J]. Functional Plant Biology, 2014, 41(4):353?365.
[55]Mu X, Luo J. Evolutionary analyses of NIN-like proteins in plantsand their roles in nitrate signaling[J]. Cellular and Molecular LifeSciences, 2019, 76(19): 3753?3764.
[56]Spartz A K, Lor V S, Ren H, et al. Constitutive expression ofArabidopsis SMALL AUXIN UP RNA19 (SAUR19) in tomatoconfers auxin-independent hypocotyl elongation[J]. Plant Physiology,2017, 173(2): 1453?1462.
[57]Yang L, You J, Li J Z, et al. Melatonin promotes Arabidopsisprimary root growth in an IAA-dependent manner[J]. Journal ofExperimental Botany, 2021, 72(15): 5599?5611.
[58]Miao R, Yuan W, Wang Y, et al. Low ABA concentration promotesroot growth and hydrotropism through relief of ABA INSENSITIVE1-mediated inhibition of plasma membrane H+-ATPase 2[J]. ScienceAdvances, 2021, 7: eabd4113.
[59]Planes M D, Ni?oles R, Rubio L, et al. A mechanism of growthinhibition by abscisic acid in germinating seeds of Arabidopsisthaliana based on inhibition of plasma membrane H+-ATPase anddecreased cytosolic pH, K+, and anions[J]. Journal of ExperimentalBotany, 2015, 66(3): 813?825.
基金项目:国家自然科学基金项目 (32102482,42107047);广东省基础与应用基础研究基金项目 (2019A1515110070)。

