生物菌剂对青枯病防控效果及其影响因素的优化
胡星磊 白鸽 邱巍 袁军 秦华 赵梦丽 徐秋芳
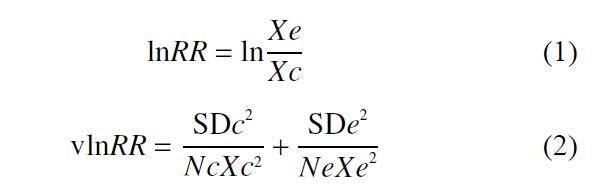
摘要: 【目的】由茄科劳尔氏菌引起的青枯病是一种普遍的细菌性土传病害,严重威胁多种经济作物的生产。青枯病主要采用生物技术防治,但由于施用方法以及生防菌株较为多元,生防效果差异较大。因此,我们研究了生物菌剂对青枯病发病率的防控效果及主要影响因素。【方法】基于Web of Science 和CNKI 数据库,以关键词“青枯病”和“生物菌剂”、“Ralstonia solanacearum”或“Pseudomonas solanacearum”和“Biological bacteriumagent”或“Biological bacterium control”进行检索。以具有1 个不施生物菌剂对照组,且具有发病率(DI)、发病率均值和样本量为条件进行筛选,共获得113 对有效数据。采用meta 分析方法评估了生物菌剂的防控效果及主要影响因素。采用Metawin 软件中的随机效应模型,以处理组和对照组之间的效应值(effect size, ES) 评价因素的效应强弱。【结果】施用生物菌剂后,青枯病发病率从77.35% 降至37.13%,防控效率为52.00%。施用模式、土壤中功能微生物与青枯菌数量比、功能微生物种类是影响青枯病防治效果的主要因素。土施、浸根、喷淋和种子处理4 种施用方法对青枯病的防控效应值分别为? 0 . 8 0~? 0 . 6 1、? 1 . 3 4~? 1 . 1 5、? 0 . 9 6~? 0 . 7 9 和?0.67~?0.49,说明4 种施用方法均有显著的防控效果,以浸根法的防控效率最好,其防控效率可达66.72%。施用生物菌剂后的土壤中功能微生物与青枯菌数量比值为1∶1、10∶1、100∶1 时,对青枯病均有显著防控效果,以比值为100∶1 时的防控效果(63.62%) 最为显著。链霉菌对青枯病的防效优于假单胞菌和芽孢杆菌,其防控效率可达74.08%。【结论】生物菌剂对青枯病的防治效果普遍较为显著,采用移栽前浸根,生物菌剂施用量达到土壤中功能微生物数量与青枯菌数量比值为100∶1,选择链霉菌属作为功能菌剂,均可获得较高且稳定的青枯病防控效果。
关键词: 青枯病; 发病率; 生物菌剂; 防控效果; meta 分析
粮食安全是一个国家赖以生存和发展的根本。长期集约化农业活动导致土壤微生态环境恶化,土传病害频发等问题更加突出,严重威胁土壤健康和农业可持续发展[1]。土传病害是指土壤中的病原真菌、细菌、线虫等特异性富集,并在条件适宜时侵染植物的根系,从而引发作物病害。通常具有病原种类多、寄主范围广、隐蔽性强、传播速度快、危害面积大、治理艰难等特点[2]。土传病害普遍发生在粮油、园艺作物和药用植物上,常见的土传病原菌有:诱发豆科作物产生冠瘿瘤的根癌农杆菌(Agrobacteriumtumefaciens),导致人参、乌头、黄芪等发生根腐病的尖孢镰刀菌(Fusarium oxysporum)[3?4]和茄腐镰刀菌(Fusarium solani)[5],诱发草莓、甜菜立枯病的立枯丝核菌(Rhizoctonia solani)[6],引起番茄、烟草、杨梅等作物青枯病的青枯菌(Ralstonia solanacearum)[7]等。这些致病菌导致植物根部乃至全株发生病害,造成严重的经济损失,而且其还通过微生物间接影响土壤化学因子,削弱土壤抵抗环境变化的能力,增加土壤健康安全风险[8]。其中,由茄科劳尔氏菌(Ralstonia solanacearum) 引起的青枯病是一类最具破坏性的植物病害[9]。青枯病是自然界普遍存在的易感性细菌性病害,其具有地域分布广泛、寄主植物多样等特点,侵染寄主多达50 个科450 种作物以上[10?11],其中包括许多重要的经济作物,如番茄[12]、烟草[13]、辣椒等茄科作物。并且随着研究范围的扩大,还不断有新的寄主植物被发现,如锦葵[ 1 4 ]、甜菜[15]、无花果[16]等。研究发现青枯病已经在中国乃至全球造成土壤生物污染、作物严重减产等问题,其中较为严重的有番茄减产16%~41%,烟草减产25%~100%[17],青枯病已受到国内外广泛关注[18?20]。
目前,青枯病的防治方法主要有化学农药防治、耕作措施防治、生物防治等[21]。喷施化学农药是目前防治青枯病最便捷快速的方法,然而,长期施用农药也会加强青枯菌的抗药性,加剧土壤微生物群落的失衡,不利于农业的可持续发展[22]。调整耕作措施能有效抑制土壤中病原菌的生长,例如番茄与十字花科或禾本科作物进行轮作对青枯病的防治效果较好,但此方法成本投入较大,经济效益低[23],因此需要寻找更为长久高效的防治手段。生物防治是利用有益微生物或其制品作为生物菌剂进行防控的手段,现已成为了一种安全、环保、经济效益高且长效的防治措施[24]。作为生物菌剂,需要其具有在青枯病防控中显著降低植物发病率的能力,诸多研究均表明生物菌剂对青枯病有较好的防控效果。其中,李志丹等[25]研究发现,接种M01 链霉菌后青枯病的发病率比对照降低了41.8%;Suresh 等[26]也发现,荧光假单胞菌VSMKU3054 显著促进了番茄幼苗的生长,并且能够显著抑制青枯菌;Elsharkawy 等[27]研究也表明,利用苏云金芽孢杆菌CR-371 处理番茄根可显著抑制青枯菌的增殖。尽管诸多研究均报道生物菌剂对青枯病具有良好的防控效果,但不少学者也发现其在田间应用效果不稳定,如Xiong 等[28]研究发现,生物菌剂的施用没有引起土壤性质的显著变化,且对烟草幼苗株高、长叶表面积、叶数等均无显著影响;Sansinenea 等[29]研究也表明,苏云金芽孢杆菌制剂的杀菌活性不稳定,并且由于紫外线辐射而易在野外条件下迅速失去活性。又因为生物防控产品基础的微生物菌剂是通过工业发酵批量生产的,它们的种群通常只能在有限的时间内自我维持,因此必须多次施用[30]。
在防控土传病害时,生物菌剂制品中活微生物的生命活动起关键作用,其防控效率及稳定性受多种因素的制约[31]。因此,需要综合试验条件(盆栽或大田)、施用模式、施用浓度、功能微生物种类等影响因素进行整体考虑。本研究旨在通过综合分析目前生物菌剂在防控青枯病中的应用情况,探究不同试验条件、施用模式、施用浓度以及生物菌剂功能微生物种类对青枯病的防控效果,系统评估和分析生物菌剂在应用效果中的影响因素,以进一步提升生物菌剂防控土传青枯病效率和稳定性,为生物菌剂的应用推广提供理论依据。
1 材料与方法
1.1 数据收集
本研究所选文献来源于中国知网(CNKI) 以及Web of Science 数据库。中文数据库以“青枯病”和“生物菌剂”为关键词,Web of Science 数据库以“ Ralstonia solanacearum”或“ Pseudomonassolanacearum”和“biological bacterium agent”或“biological bacterium control”为关键词进行检索,截至时间为2022 年9 月7 日。从CNKI 中国知网检索得到10 篇研究文献,从Web of Science 中得到495篇研究文献。再通过以下标准进行文献筛选:1) 具有1 个不施加生物菌剂的对照组;2) 具有发病率(DI,DI=青枯病发病植株数/总植株数);3) 具有发病率的均值和样本量;4) 数据重复的文献仅选取其中1 篇。按照以上的筛选标准,阅读文献题目、摘要或全文后将不符合要求的文献去除。本研究将筛选获得的48 篇文献(具体见https://www.plantnutrifert.org/cn/article/doi/10.11674/zwyf.2023460) 中的113 对数据纳入meta 分析,提取以下数据信息:不施加生物菌剂的对照组和施加生物菌剂的处理组在相关指标下的平均值、标准差和样本量,相关指标有试验类型、施用模式、施用终浓度以及生物菌剂功能微生物种类。进行数据收集时,将Xc 和Xe 分设为对照组和处理组均值,将SDc 和SDe 分设为对照组和处理组标准差,将Nc 和Ne 分设为对照组和处理组样本量,即处理的重复数;发病率为最后一次测得的发病率;试验类型分为盆栽和大田试验;生物菌剂的施用剂量,统一单位为CFU/g。文献中表格和文章的数据直接提取,图片采用Getdata graph digitizer(图表数字化工具) 软件提取数据。
1.2 Meta 分析
本研究采用Metawin 软件[32?33],选择随机效应模型,基于效应值(effect size, ES) 进行分析。处理组和对照组之间因为某因素影响而导致的差异大小用ES 进行评价,一般以0 为界限,当ES 小于0 时,表示处理低于对照。而ES 越大,即离“无效线0”越远,则该因素的效应越强。选择Hedges 等[34]的公式计算反应比的自然对数作为效应值,并计算相应的研究内方差:
式中:Xc 为对照组均值,Xe 为处理组均值,vlnRR为研究内方差,SDc 为对照组标准差,SDe 为处理组标准差,Nc 为对照组样本量,Ne 为处理组样本量,即处理的重复数。
先前的研究证明,效应值lnRR 为近似正态分布,平均值为真实反应率[34?36]。当任一效应值的95%置信区间(CI) 与lnRR=0 重叠时,认为该处理对结局指标无显著统计学意义;否则认为该处理对结局指标具有显著统计学意义。对异质性Q 值进行检验,如果其P<0.05,则引入后续一些影响因素进行分析;否则说明整体异质性小,无需进行详细分析[37]。
此外,为了评价防控效果,对防控效率CE 进行计算[38],计算公式为:
CE = (Xc-Xe)=Xc (3)
式中:Xc 为对照组发病率均值,Xe 为处理组发病率均值
1.3 数据处理与统计分析方法
采用Excel 2019 软件对数据进行初步分析。利用 SPSS 26 软件,采用单因素方差分析(One-wayANOVA, LSD 事后检验) 和t-检验(two-tailed t-test)方法对数据进行差异显著性分析,P<0.05 表示差异显著;采用R 语言“ggplot2”、“forestplot”软件包进行图片可视化[38]。
2 结果与分析
2.1 青枯病试验点分布
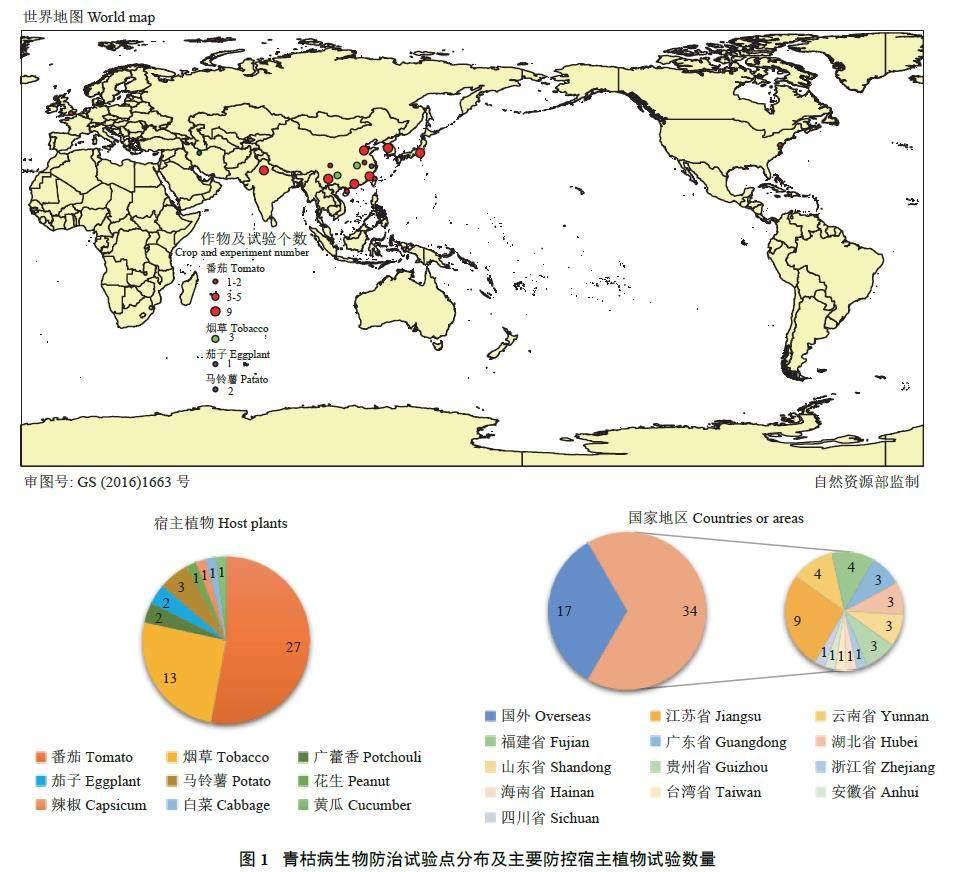
根据筛选出的48 篇文献,国内外共有34 个青枯病生物防治研究试验,分布在北纬19°~北纬51°范围内,主要包括中国、印度、韩国、日本、伊朗以及英国、美国等国家,寄主植物种类主要为番茄、烟草、茄子、马铃薯以及其他少量蔬菜作物(图1),点位的数值大小代表了在当地开展试验组的数目。本研究中涵盖的51 个生物防治试验主要在番茄、烟草、马铃薯、茄子等经济作物上进行,其中番茄和烟草作为青枯病生物防治中的模式植物被广泛研究,而对于研究地点的分布,国内的研究占据绝大部分,其中又以位于江苏省的南京农业大学开展研究最多。
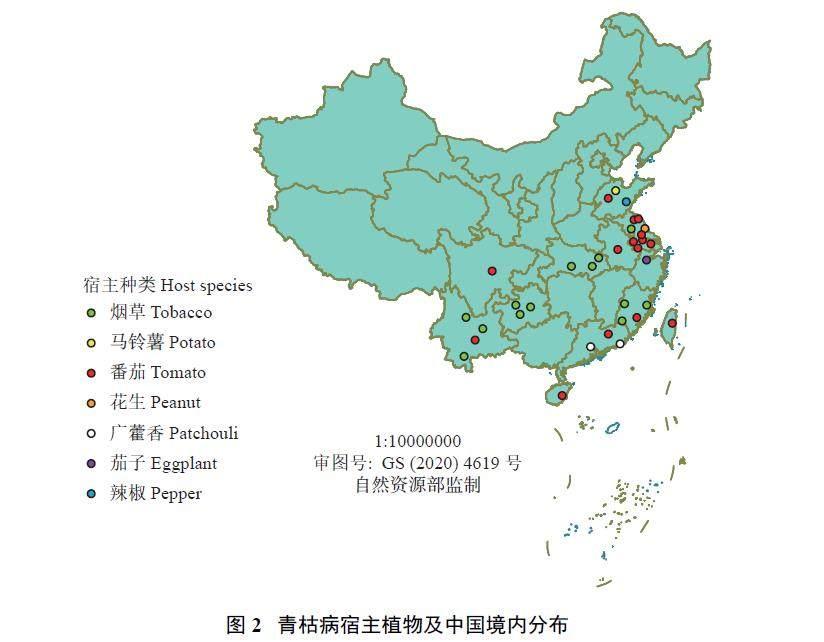
进一步对中国范围内的试验点进行统计,结果表明,南方青枯病生物防治研究试验点明显多于北方,主要分布在江苏、云南及福建省,供试作物以番茄和烟草最多,试验点数分别为15、13 个,马铃薯、茄子、广藿香作物的青枯病防治研究地点零星分布于中国东南沿海区域(图2)。
2.2 生物菌剂施用对青枯病的防控效果
为了明确生物菌剂施用对青枯病的防控效果,对筛选得到的113 对数据进行总体平均效应值、置信区间和效应值的显著性检验。生物菌剂防控青枯病效果的统计分析结果显示,整体样本量为113时,平均效应值为?0.8338,达到0.05 显著水平;整体异质性为449,达到0.05 显著水平;95% 置信区间上、下限分别为?0.7845、?0.8830,施用菌剂处理相对于未施用菌剂的青枯病防效为0.5200。生物菌剂降低青枯病发病率的平均效应值(MES) 为?0.8338,按照防控效率公式CE= (Xc?Xe)/Xc 计算,得到施用菌剂相对于不施用菌剂对青枯病的平均防控效率约为0.52,说明生物菌剂总体的防控效果较好,具有后续研究潜力。未施用生物菌剂时平均发病率为77.35%,施用生物菌剂时平均发病率为37.13%,施用菌剂后青枯病的发病率较不施用生物菌剂降低了约40%。对其总体异质性Q 进行检验,结果发现P<0.05 (图3),说明获得的113 对数据的异质性强,可以引入变量因素来解释其具体作用。
2.3 试验条件对生物菌剂防控青枯病效果的影响
对筛选得到的113 对数据,按照大田和盆栽两种试验条件分别进行防控效率和防控效果分析(图4),结果表明,在大田和盆栽两种试验条件下,生物菌剂的防控效率均达到了50% 以上,两者没有显著差异。进一步分析结果表明,大田和盆栽施用生物菌剂对青枯病防控的平均效应值分别为?0.90 和?0.82(P=0.951),青枯病的防控效应值分别为?1.02~?0.78 和?0.87~?0.76,即抑制青枯病能力的置信区间为?1.02~?0.78 和?0.87~?0.76,且两者均未与无效线0 重叠,表明在大田或盆栽试验条件下施用生物菌剂均能显著降低青枯病的发病率,且大田试验中施用生物菌剂的防控效应明显大于盆栽试验,然而由于大田试验样品量较少,该结果还需更多的大田数据支撑。
2.4 施用模式对生物菌剂防控青枯病效果的影响
为了明确施用模式对生物菌剂防控效果的影响,我们对筛选得到的113 对数据按照施用模式将其分为拌土法、浸根法、喷淋法和种子处理4 类,并进行防控效率和防控效果分析。结果表明,4 种施用模式均有很好的防控效果,其中,浸根法的防控效率最好,其防控效率可达66.72% (图5a)。进一步对其进行防控效应值分析,发现4 种施用模式对青枯病的防控效应值相差较大,拌土、浸根、喷淋、种子处理分别为?0.80~?0.61、?1.34~?1.15、?0.96~?0.79 和?0.67~?0.49,表明不同施用模式对生物菌剂防控青枯病的效果不同。且拌土、浸根、喷淋和种子处理的置信区间皆未与无效线0 相交,表明这4 种施用模式对青枯病均有显著防控效果,且浸根法效果最好(图5b)。
2.5 生物菌剂施用量对其防控青枯病效果的影响
为了明确生物菌剂施用量对其防控效果的影响,我们将添加生物菌剂后每克土壤中含有的有效菌落个数(CFU/g, 干土) 定义为生物菌剂施用浓度。然后对筛选得到的113 对数据按照不同终浓度梯度进行分类,其中,有6 组数据在文章内未明确终浓度,将其定义为缺失,其余分组分别为106、107、108、109 CFU/g。结果表明,与对照相比,4 种不同施用浓度均对青枯病防控效果良好,防控效率均在40%~60%,然而,各施用浓度间差异不显著(图6a)。进一步对其进行防控效应值分析(图6b),发现4 个不同施用浓度处理下青枯病防控的平均效应值和置信区间有明显差异,106、107、108、109 CFU/g 处理分别为?0.88~?0.36、?1.11~?0.84、?0.86~?0.75和?1.14~?0.81,表明与不施用生物菌剂相比,4 种浓度的生物菌剂对青枯病防控均有显著效果,但各施用浓度间差异不显著。
值得注意的是,评价防控效果时并不能仅仅关注土壤中生物菌剂的浓度,同时也应当考虑到土壤中原本的青枯菌浓度。综合筛选得到的48 篇文献,其中23 篇文献共62 对数据涉及了添加生物菌剂后每克土壤中功能微生物数量与青枯菌数量比值数据。将其按照1∶1、10∶1、100∶1 的比值分为3个梯度进行分析(图6c),发现当施用后每克土壤中功能微生物数量与青枯菌数量比为100∶1 时,施用生物菌剂对青枯病有显著的防控效果(P<0.05),其防控效率可达63.62%。
2.6 生物菌剂功能微生物种类对防控青枯病效果的影响
为了明确生物菌剂功能微生物种类对防控效率和防控效果的影响,我们对筛选得到的113 对数据中涉及的功能微生物按照系统发育学进行分类,共得到4 类生物菌剂,芽孢杆菌(Bacillus) 数据53对,假单胞菌(Pseudomonas) 数据23 对,链霉菌(Streptomyces) 数据10 对,其他菌种数据27 对,其中“其他菌种”主要包括大肠杆菌(ColiBacillus)1 对、丛枝菌根真菌(Arbuscular mycorrhizal fungi)1 对、白僵菌(Beauveria bassiana) 1 对、木霉(Trichoderma sp.) 2 对等。结果表明,芽孢杆菌、假单胞菌、链霉菌、其他菌种4 种功能微生物种类中,施用链霉菌时防控效率最好,其防控效率可达74.08% (图7a)。进一步对其进行防控效应值分析(图7b),发现4 种功能微生物种类降低发病率的效应值置信区间均未与无效线0 相交,说明芽孢杆菌、假单胞菌、链霉菌和其他菌种作为生防菌剂时,对土传青枯病均有很好的防控效果。而且,链霉菌对青枯病发生的平均效应值为?1.63~?1.25,绝对值明显大于芽孢杆菌的?0.85~?0.71 和假单胞菌的?1.01~?0.79,因此,链霉菌(Streptomyces) 作为生物菌剂时,对青枯病的防效优于其他两种菌剂。
3 讨论
本研究基于113 对知网和Web of Science 数据库中下载到的文献试验数据,综合解析了试验条件、施用模式、添加生物菌剂后每克土壤中功能微生物数量与青枯菌数量比值,以及生物菌剂功能微生物种类对降低土传青枯病的发病率效果差异,评估生物菌剂在防控土传青枯病中的作用,筛选到了对土传青枯病具有显著影响和非显著影响的因子。
生物菌剂的施用对土传青枯病有显著防控效果,平均防控率约为52% (图4)。且盆栽和大田试验两种条件下的试验结果均表明,生物菌剂的施用可显著降低青枯病的发病率,两者的防控效果无显著差异。之前一些研究表明,在盆栽试验中有很好防控效果的生物菌剂应用到田间之后,防控效果显著降低[39?41],因此,在潜在抗病微生物的筛选过程中,首先利用盆栽试验初步评估效果,再进一步进行大田试验,获得确切促生和防病效果这一方法是可取的[42?43]。在今后的试验中,也更应注重大田环境的实际情况,这样才能更好地反映出生物菌剂在生产中的实际效用。
生物菌剂的不同施用模式对其防控青枯病的效果具有显著影响。分析发现浸根、喷淋及拌土的施用模式较种子处理防控效果更好。其中,浸根处理对青枯病防控效果最为显著,防控效率可达66.72%,其原理是使植株根部直接接触高浓度的生防菌剂,使菌体快速定殖于植物根部,继而改变根际微生物群落结构。植物根际的营养资源、温度、空间竞争等因素会影响功能微生物的定殖,例如微观世界中,早定殖者往往能够抢先消耗资源,排挤晚到者;其次早定殖者可以利于新陈代谢改变温度影响竞争对手;最后由于早定殖可以抢先占有小生境,抢占空间,从而减少竞争对手的生长空间[44?46]。且生态学理论表明,生态群落的初始集合或扰动后的恢复可能取决于物种到达的顺序:早到的物种改变资源或环境条件的方式影响晚到的物种,影响它们在群落中定殖的能力,这些相互作用被称为优先效应[47?48]。现在越来越多的证据表明微生物组具有重要的优先效应,这些效应已被证明会影响物种定殖于植物的叶片[49]和根[50]的情况等。
Wang 等[51]研究显示,在一定范围内,生物菌剂的防控效果随着芽孢杆菌菌液浓度的上升而提高。然而本研究对生物菌剂不同施用浓度防控效果的评估结果表明,与CK 相比,不同施用浓度均显著降低了青枯病的发病率,但是不同施用浓度处理间的防控效果无显著差异(图6b)。在明确大田中青枯菌浓度的基础上,进一步对添加生物菌剂后每克土壤中功能微生物数量与青枯菌数量比值梯度进行评估,结果表明,与1∶1、10∶1 相比,当比值为100∶1 时,生物菌剂施用对防效有显著提升(图6c),这一结果表明,生物菌剂的防控效果与施用后土壤中功能微生物的数量相关,究其原因应是高相对丰度的功能微生物入侵后,其在根际定殖成功率更高、定殖数量更多[52- 53]。综合筛选出的48 篇文献,其中每克土壤中生物菌剂与青枯菌数量比有1∶1、10∶1、100∶1,但是考虑到样本量的问题(1∶1、10∶1、100∶1 的样本量分别为17、30、15 对),浓度比100∶1 不一定是最合适有效的比例,二者数量比值与防治效果间关系有待进一步探索,可以更加细化添加生物菌剂后每克土壤中功能微生物数量与青枯菌数量比关系,例如使用20∶1、50∶1,150∶1等不同的浓度梯度进行试验,以找到最为经济有效的浓度比用以防控青枯病。此外,在施用生物菌剂时应明确施用前大田中青枯菌的含量,然后在此基础上,合理计算生物菌剂的投入量,以期获得经济、高效的生防效果。
评估分析结果表明,添加链霉菌和芽孢杆菌防控效果较优,添加假单胞菌也具有一定的防治效果。其中,链霉菌成为防效最佳的菌剂,可能是由于其属于革兰氏阳性菌,环境适应性强[54];而且链霉菌是丝状菌,能够产生营养菌丝,最终形成错综复杂的菌丝,方便在不同的环境中生长和定殖;链霉菌还能形成孢子,有助于自身的存活、扩散和传播[55]。此外,研究表明链霉菌的拮抗作用是通过水解病原菌的细胞壁导致病原菌死亡[56];或者通过分泌一些抗生素来抑制病原菌蛋白质、核酸和质膜的合成,致使病原菌无法生长甚至死亡[57];亦或者是链霉菌分解土壤中的有机质,产生挥发性有机化合物VOCs(volatile organic compounds),VOCs 拥有极强的抑菌性,从而抑制了青枯菌的生长[58]。尽管链霉菌对青枯病防效提升的潜力最大,但从筛选的数据组来看,链霉菌被开发为生防菌剂的研究尚为缺乏,这可能是因为链霉菌本身生长缓慢、不好培养、生产成本较高等因素导致的[59]。然而四分之三的链霉菌都能产生拥有物种特异性的抗生素[60],它们能够通过保护植物免受各种病原体的侵害从而与植物合作共生[61],因其具备良好的抑制青枯菌根际生长的效果,因此建议在后续研究中更关注链霉菌生防菌剂的开发和实际应用。
在各个影响因素的评估中,由于生物菌剂生防过程本身复杂,导致异质性来源也复杂[62]。研究中例如试验环境、人为误差等众多不可控和无法收集的信息,会使部分因素并不能对整体异质性进行很好地解释,因此寻找具体合适的解释因素是以后研究的关键。尽管如此,meta 整体分析结果依然表明,施用生物菌剂可以显著降低青枯病的发病率。
4 结论
菌剂施用模式中以浸根法效果最好;4 种施用浓度间的防控效果无显著差异,但添加生物菌剂后每克土壤中功能微生物数量与青枯菌数量比为100∶1时,对青枯病的防控效果有显著提高;同时链霉菌作生物菌剂功能微生物时防效最佳。整体来看,未加生物菌剂的平均发病率为77.35%,添加生物菌剂的平均发病率为37.13%,生物菌剂适合被推广至实际农作物生产中防控青枯病,并可通过控制一些影响因素,最大化其防治效果。
参 考 文 献:
[ 1 ]严康, 汪海珍, 楼骏, 徐建明. 基于Web of Science对土传病害研究现状和趋势的计量分析[J]. 土壤学报, 2020, 57(3): 680?690.
Yan K, Wang H Z, Lou J, Xu J M. Bibliometric analysis of status quoand trend of the research on soil-borne diseases based on the Web ofScience database[J]. Acta Pedologica Sinica, 2020, 57(3): 680?690.
[ 2 ]韦中, 沈宗专, 杨天杰, 等. 从抑病土壤到根际免疫: 概念提出与发展思考[J]. 土壤学报, 2021, 58(4): 814?824.
Wei Z, Shen Z Z, Yang T J, et al. From suppressive soil torhizosphere immunity: Towards an ecosystem thinking for soil-bornepathogen control[J]. Acta Pedologica Sinica, 2021, 58(4): 814?824.
[ 3 ]Delgado-Baquerizo M, Guerra C A, Cano-Diaz C, et al. Theproportion of soil-borne pathogens increases with warming at theglobal scale[J]. Nature Climate Change, 2020, 10(6): 550?554.
[ 4 ]Yuan J, Wen T, Zhang H, et al. Predicting disease occurrence withhigh accuracy based on soil macroecological patterns of Fusariumwilt[J]. The ISME Journal, 2020, 14(12): 2936?2950.
[ 5 ]Xie S Y, Ma T, Zhao N, et al. Whole-genome sequencing andcomparative genome analysis of Fusarium solani-melongenaecausing fusarium root and stem rot in sweet potatoes[J]. MicrobiolSpectr, 2022, 10(4): e0068322.
[ 6 ]Elsharkawy M M, Kuno S, Hyakumachi M, et al. PCR-DGGEanalysis proves the suppression of rhizoctonia and scl-erotium rootrot due to successive inoculations[J]. Journal of Fungi, 2022, 8(2):133?145.
[ 7 ]Ahmed W, Yang J, Tan Y J, et al. Ralstonia solanacearum, a deadlypathogen: Revisiting the bacterial wilt biocontrol practices in tobaccoand other Solanaceae[J]. Rhizosphere, 2022, 21: 100479
[ 8 ]Zhang Y J, Ye C, Su Y W, et al. Soil acidification caused byexcessive application of nitrogen fertilizer aggravates soil-bornediseases: Evidence from literature review and field trials[J].Agriculture, Ecosystems & Environment, 2022, 340: 108176.
[ 9 ]Li M, Pommier T, Yin Y, et al. Indirect reduction of Ralstoniasolanacearum via pathogen helper inhibition[J]. The ISME Journal,2022, 16(3): 868?875.
[10]Hayward A. Biology and epidemiology of bacterial wilt caused byPseudomonas solanacearum[J]. Annual Review of Phytopathology,1991, 29(1): 65?87.
[11]陈玉婷, 林威鹏, 范雪滢, 蔡昆争. 硅介导番茄青枯病抗性的土壤定量蛋白质组学研究[J]. 土壤学报, 2015, 52(1): 162?173.
Chen Y T, Lin W P, Fan X Y, Cai K Z. Soil quantitative proteomicanalysis of silicon-mediated resistance of tomato (Solanumlycopersicum) to Ralstonia solanacearum[J]. Acta Pedologica Sinica,2015, 52(1): 162?173.
[12]Gava C A T, Pereira J C, Fernandes M D C, et al. Sele??o de isoladosde estreptomicetos para controle de Ralstonia solanacearum emtomateiro[J]. Pesquisa Agropecuária Brasileira, 2002, 37(10):1373?1380.
[13]Zheng Y X, Wang J M, Zhao W L, et al. Effect of bacterial wilt onfungal community composition in rhizosphere soil of tobaccos intropical Yunnan[J]. Plant Pathology Journal, 2022, 38(3): 203?211.
[14]Wu Y F, Cheng A S, Lin C H, Chen C Y. First report of bacterial wiltcaused by Ralstonia solanacearum on Roselle in Taiwan[J]. PlantDisease, 2013, 97(10): 1375?1384.
[15]Lin C H, Chuang M H, Wang J R. First report of bacterial wilt causedby Ralstonia solanacearum on Chard in Taiwan[J]. Plant Disease,2015, 99(2): 282?283.
[16]Jiang Y, Li B, Liu P, et al. First report of bacterial wilt caused byRalstonia solanacearum on fig trees in China[J]. Forest Pathology,2016, 46(3): 256?258.
[17]Nion Y A, Toyota K. Recent trends in control methods for bacterialwilt diseases caused by Ralstonia solanacearum[J]. Microbes andEnvironments, 2015, 30(1): 1?11.
[18]Peng D, Luo K, Jiang H, et al. Combined use of Bacillus subtilisstrain B-001 and bactericide for the control of tomato bacterialwilt[J]. Pest Management Science, 2017, 73(6): 1253?1257.
[19]邓家礼, 李红丽, 李小龙, 等. 生物菌剂对青枯病的防治效果研究[J]. 天津农业科学, 2015, 21(4): 117?119.
Deng J L, Li H L, Li X L, et al. Effect of microbial agent on tobaccowilt[J]. Tianjin Agricultural Sciences, 2015, 21(4): 117?119.
[20]张仁军, 魏刚, 杨兆忠, 等. 几种生物菌剂防治烟草青枯病药效试验[J]. 现代农业科技, 2019, (6): 79?81.
Zhang R J, Wei G, Yang Z Z, et al. Efficacy test on several biofungicidesagainst tobacco bacterial wilt[J]. Modern AgriculturalSciences and Technology, 2019, (6): 79?81.
[21]姚文武, 张晓丽, 秦双林, 等. 番茄青枯病发生机制及主要防治技术研究进展[J]. 长江蔬菜, 2022, (20): 30?34.
Yao W W, Zhang X L, Qin S L, et al. Research progress onpathogenic mechanism and main control techniques of tomatobacterial wilt[J]. Journal of Changjiang Vegetables, 2022, (20):30?34.
[22]刘肖肖, 董元华, 李建刚. 不同土壤改良剂对番茄青枯病的防治效果[J]. 农业环境科学学报, 2013, 32(7): 1368?1374.
Liu X X, Dong Y H, Li J G. Effects of soil amendments onsuppression of bacterial wilt of tomato[J]. Journal of Agro-Environment Science, 2013, 32(7): 1368?1374.
[23] 牛义岭, 商丽敏. 番茄青枯病的发生及防治[J]. 现代农业科技,2023, (12): 100?102.
Niu Y L, Shang L M. Occurrence and control of tomato bacterialwilt[J]. Modern Agricultural Science and Technology, 2023, (12):100?102.
[24]钟书堂, 沈宗专, 孙逸飞, 等. 生物有机肥对连作蕉园香蕉生产和土壤可培养微生物区系的影响[J]. 应用生态学报, 2015, 26(2):481?489.
Zhong S T, Shen Z Z, Sun Y F, et al. Effects of continuousapplication of bio-organic fertilizer on banana production and culturalmicroflora of bulk soil in orchard with serious disease incidence[J].Chinese Journal of Applied Ecology, 2015, 26(2): 481?489.
[25]李志丹, 黄奇, 林刿, 等. 利迪链霉菌M01对番茄生长、青枯病发病率及根际细菌群落组成的影响[J]. 微生物学通报, 2023, 50(6):2508?2518.
Li Z D, Huang Q, Lin G, et al. Effects of Streptomyces lydicus M01on growth, bacterial wilt incidence, and rhizosphere bacterialcommunity composition of tomatoes[J]. Microbiology China, 2023,50(6): 2508?2518.
[26]Suresh P, Vellasamy S, Almaary K S, et al. Fluorescent pseudomonads(FPs) as a potential biocontrol and plant growth promoting agentassociated with tomato rhizosphere[J]. Journal of King SaudUniversity Science, 2021, 33(4): 101423.
[27]Elsharkawy M M, Nakatani M, Nishimura M, et al. Control of tomatobacterial wilt and root-knot diseases by Bacillus thuringiensisCR-371 and Streptomyces avermectinius NBRC14893[J]. ActaAgriculturae Scandinavica Section B-Soil and Plant Science, 2015,65(6): 575?580.
[28]Xiong J, Peng S G, Liu Y J, et al. Soil properties, rhizospherebacterial community, and plant performance respond differently tofumigation and bioagent treatment in continuous cropping fields[J].Frontiers in Microbiology, 2022, 13: 923405.
[29]Sansinenea E, Ortiz A. Melanin: A photoprotection for Bacillusthuringiensis based biopesticides[J]. Biotechnology Letters, 2015,37(3): 483?490.
[30]Glare T R, O'Callaghan M. Microbial biopesticides for control ofinvertebrates: Progress from New Zealand[J]. Journal of InvertebratePathology, 2019, 165: 82?88.
[31]Miliute I, Buzaite O, Baniulis D, Stanys V. Bacterial endophytes inagricultural crops and their role in stress tolerance: A review[J].Zemdirbyste-Agriculture, 2015, 102(4): 465?478.
[32]Ma X M, Zhu B, Nie Y X, et al. Root and mycorrhizal strategies fornutrient acquisition in forests under nitrogen deposition: A metaanalysis[J]. Soil Biology & Biochemistry, 2021, 163: 108418.
[33]彭少麟, 郑凤英. Meta分析及MetaWin软件[J]. 土壤与环境, 1999,8(4): 295?299.
Peng S L, Zheng F Y. Introduction of MetaWin software[J]. Soil andEnvironmental Sciences, 1999, 8(4): 295?299.
[34]Hedges L V, Gurevitch J, Curtis P S. The meta-analysis of responseratios in experimental ecology[J]. Ecology, 1999, 80(4): 1150?1156.
[35]Curtis P S, Wang X. A meta-analysis of elevated CO2 effects onwoody plant mass, form, and physiology[J]. Oecologia, 1998, 113(3):299?313.
[36] Bai E, Li S L, Xu W H, et al. A meta-analysis of experimental warming effects on terrestrial nitrogen pools and dynamics[J]. NewPhytologist, 2013, 199(2): 441?451.
[37]操一凡, 沈宗专, 刘珊珊, 等. Meta分析评估中国木霉对枯萎病防控效果及其影响因素[J]. 土壤学报, 2019, 56(3): 716?727.
Cao Y F, Shen Z Z, Liu S S, et al. Evaluation of effect of trichodermacontrolling Fusarium wilt disease and its influencing factors withMeta-analysis in China[J]. Acta Pedologica Sinica, 2019, 56(3):716?727.
[38]张荣胜, 戴秀华, 陈志谊. 解淀粉芽孢杆菌Lx-11对水稻细菌性条斑病的防治效果[J]. 江苏农业科学, 2014, 42(10): 115?116.
Zhang R S, Dai X H, Chen Z Y. Control effect of Bacillusamyloliquefaciens Lx-11 on bacterial leaf streak of rice[J]. JiangsuAgricultural Sciences, 2014, 42(10): 115?116.
[39]Karthikeyan A, Kanchanadevi K, Nicodemus A. Effect of Frankiaand Micromonospora on growth and health improvement inCasuarina clones[J]. Journal of Forest Research, 2022, 27(2): 128?132.
[40]Li S L, Pi J, Zhu H J, et al. Caffeic acid in tobacco root exudatedefends tobacco plants from infection by Ralstonia solanacearum[J].Frontiers in Plant Science, 2021, 12: 690586.
[41]Marian M, Nishioka T, Koyama H, et al. Biocontrol potential ofRalstonia sp TCR112 and Mitsuaria sp TWR114 against tomatobacterial wilt[J]. Applied Soil Ecology, 2018, 128: 71?80.
[42]Wang B B, Shen Z Z, Zhang F G, et al. Bacillus amyloliquefaciensstrain W19 can promote growth and yield and suppress Fusarium wiltin banana under greenhouse and field conditions[J]. Pedosphere,2016, 26(5): 733?744.
[43]Ding C Y, Shen Q R, Zhang R F, Chen W. Evaluation of rhizospherebacteria and derived bio-organic fertilizers as potential biocontrolagents against bacterial wilt (Ralstonia solanacearum) of potato[J].Plant and Soil, 2013, 366(1): 453?466.
[44]Kennedy P G, Peay K G, Bruns T D. Root tip competition amongectomycorrhizal fungi: Are priority effects a rule or an exception?[J].Ecology, 2009, 90(8): 2098?2107.
[45]Tan J, Pu Z C, Ryberg W A, Jiang L. Species phylogeneticrelatedness, priority effects, and ecosystem functioning[J]. Ecology,2012, 93(5): 1164?1172.
[46]Tucker C M, Fukami T. Environmental variability counteractspriority effects to facilitate species coexistence: Evidence from nectarmicrobes[J]. Proceedings of the Royal Society B-Biological Sciences,2014, 281: 20132637.
[47]Debray R, Herbert R A, Jaffe A L, et al. Priority effects inmicrobiome assembly[J]. Nature Reviews Microbiology, 2022, 20(2):109?121.
[48]Geange S W, Poulos D E, Stier A C, McCormick M I. The relativeinfluence of abundance and priority effects on colonization success ina coral-reef fish[J]. Coral Reefs, 2017, 36(1): 151?155.
[49]Carlstroem C I, Field C M, Bortfeld M M, et al. Synthetic microbiotareveal priority effects and keystone strains in the Arabidopsisphyllosphere[J]. Nature Ecology & Evolution, 2019, 3(10): 1445?1454.
[50]Wei Z, Yang T J, Friman V P, et al. Trophic network architecture ofroot-associated bacterial communities determines pathogen invasion and plant health[J]. Nature Communications, 2015, 6: 8413.
[51]Wang X, Liang G. Control efficacy of an endophytic Bacillusamyloliquefaciens strain BZ6-1 against peanut bacterial wilt,Ralstonia solanacearum[J]. BioMed Research International, 2014,2014: 465435.
[52]李颖, 龙长梅, 蒋标, 韩丽珍. 两株PGPR菌株的花生定殖及对根际细菌群落结构的影响[J]. 生物技术通报, 2022, 38(9): 237?247.
Li Y, Long C M, Jiang B, Han L Z. Colonization on the peanuts oftwo plant-growth promoting rhizobacteria strains and effects on thebacterial community structure of rhizosphere[J]. BiotechnologyBulletin, 2022, 38(9): 237?247.
[53]吴金山, 王思琦, 黄家权, 等. 5株生防菌定殖能力、促生作用及其对木薯细菌性枯萎病生防潜力的研究[J]. 热带作物学报, 2022,43(9): 1880?1887.
Wu J S, Wang S Q, Huang J Q, et al. Colonization ability andgrowth-promoting effects of five biocontrol bacteria, and thebiocontrol potential against cassava bacterial blight[J]. ChineseJournal of Tropical Crops, 2022, 43(9): 1880?1887.
[54]Thakur M P, Van Der Putten W H, Cobben M M P, et al. Microbialinvasions in terrestrial ecosystems[J]. Nature Reviews Microbiology,2019, 17(10): 621?631.
[55]Chater K F, Losick R, Shapiro L. Morphological and physiologicaldifferentiation[J]. Journal of the Agricultural Chemical Society ofJapan, 1984, 65(4): 763?765.
[56]Awla H K, Kadir J, Othman R, et al. Bioactive compounds producedby Streptomyces sp. isolate UPMRS4 and antifungal activity againstPyricularia oryzae[J]. American Journal of Plant Sciences, 2016,7(7): 1077?1085.
[57]张潜, 袁歆瑜, 郭鑫, 等. 链霉菌Sa-21对烟草黑胫病的防效及抑菌作用研究[J]. 中国生物防治学报, 2022, 38(6): 1608?1618.
Zhang Q, Yuan X Y, Guo X, et al. Study on the antibacterial actionand control effect of Streptomyces Sa-21 against phytophthoranicotianae[J]. Chinese Journal of Biological Control, 2022, 38(6):1608?1618.
[58]Almeida O A C, De Araujo N O, Dias B H S, et al. The power of thesmallest: The inhibitory activity of microbial volatile organiccompounds against phytopathogens[J]. Frontiers in Microbiology,2023, 13: 951130.
[59]Vurukonda S S K P, Giovanardi D, Stefani E. Plant growthpromoting and biocontrol activity of Streptomyces spp. asendophytes[J]. International Journal of Molecular Sciences, 2018,19(4): 952.
[60]Alexander M. Introduction to soil microbiology (2nd edn)[M]. NewYork: Wiley, 1977.
[61]de Lima Procópio R E, da Silva I R, Martins M K, et al. Antibioticsproduced by Streptomyces[J]. The Brazilian Journal of InfectiousDiseases: An official publication of the Brazilian Society ofInfectious Diseases, 2012, 16(5): 466?471.
[62]Wang Z J, Luo W B, Cheng S J, et al. Ralstonia solanacearum - Asoil borne hidden enemy of plants: Research development inmanagement strategies, their action mechanism and challenges[J].Frontiers in Plant Science, 2023, 14: 1141902.
附录:Meta 分析数据来源文献
[1]Abd Alamer I S, Tomah A A, Li B, Zhang J Z. Isolation,identification and characterization of rhizobacteria strains forbiological control of bacterial wilt (Ralstonia solanacearum) ofeggplant in China[J]. Agriculture, 2020, 10(2): 37.
[ 2 ]Ahmed W, Zhou G S, Yang J, et al. Bacillus amyloliquefaciens WS-10 as a potential plant growth-promoter and biocontrol agent forbacterial wilt disease of flue-cured tobacco[J]. Egyptian Journal ofBiological Pest Control, 2022, 32(1): 25.
[ 3 ]Ahn I P, Lee S W, Kim M G, et al. Priming by rhizobacteriumprotects tomato plants from biotrophic and necrotrophic pathogeninfections through multiple defense mechanisms[J]. Molecules andCells, 2011, 32(1): 7?14.
[ 4 ]Bahmani K, Hasanzadeh N, Harighi B, Marefat A. Isolation andidentification of endophytic bacteria from potato tissues and theireffects as biological control agents against bacterial wilt[J].Physiological and Molecular Plant Pathology, 2021, 116: 101692.
[ 5 ]Chu D P, Ilyas N, Peng L J, et al. Genomic insights on fightingbacterial wilt by a novel Bacillus amyloliquefaciens strain Cas02[J].Microbial Biotechnology, 2022, 15(4): 1152?1167.
[ 6 ]Clough S E, Jousset A, Elphinstone J G, Friman V P. Combining invitro and in vivo screening to identify efficient Pseudomonasbiocontrol strains against the phytopathogenic bacterium Ralstoniasolanacearum[J]. Microbiology Open, 2022, 11(2): e1283.
[ 7 ]Ding C Y, Shen Q R, Zhang R F, Chen W. Evaluation of rhizospherebacteria and derived bio-organic fertilizers as potential biocontrolagents against bacterial wilt (Ralstonia solanacearum) of potato[J].Plant and Soil, 2013, 366(1/2): 453?466.
[ 8 ]Hariprasad P, Chandrashekar S, Singh S B, Niranjana S R.Mechanisms of plant growth promotion and disease suppressionby Pseudomonas aeruginosa strain 2apa[J]. Journal of BasicMicrobiology, 2014, 54(8): 792?801.
[ 9 ]Hu Y, Li Y Y, Yang X Q, et al. Effects of integrated biocontrol onbacterial wilt and rhizosphere bacterial community of tobacco[J].Scientific Reports, 2021, 11(1): 2653.
[10]Hu Y, Zhao W, Li X H, et al. Integrated biocontrol of tobaccobacterial wilt by antagonistic bacteria and marigold[J]. ScientificReports, 2021, 11(1): 16310.
[11]Huang C N, Lin C P, Hsieh F C, et al. Characterization andevaluation of Bacillus amyloliquefaciens strain WF02 regarding itsbiocontrol activities and genetic responses against bacterial wiltin two different resistant tomato cultivars[J]. World Journal ofMicrobiology and Biotechnology, 2016, 32(11): 183.
[12]Huang J F, Wei Z, Tan S Y, et al. Suppression of bacterial wiltof tomato by bioorganic fertilizer made from the antibacterialcompound producing strain Bacillus amyloliquefaciens HR62[J].Journal of Agricultural and Food Chemistry, 2014, 62(44):10708?10716.
[13]Huang J F, Wei Z, Tan S Y, et al. The rhizosphere soil of diseasedtomato plants as a source for novel microorganisms to controlbacterial wilt[J]. Applied Soil Ecology, 2013, 72: 79?84.
[14]Im S M, Yu N H, Joen H W, et al. Biological control of tomatobacterial wilt by oxydifficidin and difficidin-producing Bacillus methylotrophicus DR-08[J]. Pesticide Biochemistry and Physiology,2020, 163: 130?137.
[15]Jinal N H, Amaresan N. Evaluation of biocontrol Bacillus species onplant growth promotion and systemic-induced resistant potentialagainst bacterial and fungal wilt-causing pathogens[J]. Archives ofMicrobiology, 2020, 202(7): 1785?1794.
[16]Kaari M, Joseph J, Manikkam R, et al. Biological control ofStreptomyces sp. UT4A49 to suppress tomato bacterial wilt diseaseand its metabolite profiling[J]. Journal of King Saud University-Science, 2022, 34(1): 101688.
[17]Kaari M, Joseph J, Manikkam R, et al. Biocontrol Streptomycesinduces resistance to bacterial wilt by increasing defense-relatedenzyme activity in Solanum melongena L[J]. Current Microbiology,2022, 79(5): 146.
[18]Kheirandish Z, Harighi B. Evaluation of bacterial antagonists ofRalstonia solanacearum, causal agent of bacterial wilt of potato[J].Biological Control, 2015, 86: 14?19.
[19]Konappa N M, Maria M, Uzma F, et al. Lactic acid bacteria mediatedinduction of defense enzymes to enhance the resistance in tomatoagainst Ralstonia solanacearum causing bacterial wilt[J]. ScientiaHorticulturae, 2016, 207: 183?192.
[20]Li J Y, Zhao Q Q, Wuriyanghan H, Yang C. Biocontrol bacteriastrains Y4 and Y8 alleviate tobacco bacterial wilt disease by alteringtheir rhizosphere soil bacteria community[J]. Rhizosphere, 2021, 19:100390.
[21]Liu Y X, Shi J X, Feng Y G, et al. Tobacco bacterial wilt can bebiologically controlled by the application of antagonistic strains incombination with organic fertilizer[J]. Biology and Fertility of Soils,2013, 49(4): 447?464.
[22]Ma L, Zhang H Y, Zhou X K, et al. Biological control tobaccobacterial wilt and black shank and root colonization by bio-organicfertilizer containing bacterium Pseudomonas aeruginosa NXHG29[J]. Applied Soil Ecology, 2018, 129: 136?144.
[23]Marian M, Morita A, Koyama H, et al. Enhanced biocontrol oftomato bacterial wilt using the combined application of Mitsuaria sp.TWR114 and nonpathogenic Ralstonia sp. TCR112[J]. Journal ofGeneral Plant Pathology, 2019, 85(2): 142?154.
[24]Shen T, Lei Y H, Pu X D, et al. Identification and application ofStreptomyces microflavus G33 in compost to suppress tomatobacterial wilt disease[J]. Applied Soil Ecology, 2021, 157: 103724.
[25]Shi W G, Li J Q, Yao H X, et al. Ribosomal ITS sequence-directedselection for endophytic Myrothecium strains antagonistic toRalstonia solanacearum to control patchouli bacterial wilt[J].Biocontrol, 2022, 67(2): 237?248.
[26]Sotoyama K, Akutsu K, Nakajima M. Suppression of bacterial wilt oftomato by soil amendment with mushroom compost containingBacillus amyloliquefaciens IUMC7[J]. Journal of General PlantPathology, 2017, 83(1): 51?55.
[27]Subedi N, Taylor C G, Paul P A, Miller S A. Combining partial hostresistance with bacterial biocontrol agents improves outcomes fortomatoes infected with Ralstonia pseudosolanacearum[J]. CropProtection, 2020, 135: 104776.
[28] Tan S Y, Dong Y, Liao H P, et al. Antagonistic bacterium Bacillus amyloliquefaciens induces resistance and controls the bacterial wilt oftomato[J]. Pest Management Science, 2013, 69(11): 1245?1252.
[29]Tan S Y, Jiang Y, Song S, et al. Two Bacillus amyloliquefaciensstrains isolated using the competitive tomato root enrichment methodand their effects on suppressing Ralstonia solanacearum andpromoting tomato plant growth[J]. Crop Protection, 2013, 43:134?140.
[30]Usmonov A, Yoo S-J, Kim S T, et al. The Bacillus zanthoxyli HS1strain renders vegetable plants resistant and tolerant against pathogeninfection and high salinity stress[J]. The Plant Pathology Journal,2021, 37(1): 72?78.
[31]Wang X B, Liang G B. Control efficacy of an endophytic Bacillusamyloliquefaciens strain BZ6-1 against peanut bacterial wilt,Ralstonia solanacearum[J]. BioMed Research International, 2014,2014: 465435.
[32]Wang X B, Tang D Y, Wang W. Improvement of a dry formulationof Pseudomonas protegens SN15-2 against Ralstonia solanacearumby combination of hyperosmotic cultivation with fluidized-beddrying[J]. Biocontrol, 2020, 65(6): 751?761.
[33]Zhong W, Huang J F, Tan S Y, et al. The congeneric strain Ralstoniapickettii QL-A6 of Ralstonia solanacearum as an effective biocontrolagent for bacterial wilt of tomato[J]. Biological Control, 2013, 65(2):278?285.
[34]Wei Z, Huang J F, Yang C L, et al. Screening of suitable carriers forBacillus amyloliquefaciens strain QL-18 to enhance the biocontrol oftomato bacterial wilt[J]. Crop Protection, 2015, 75: 96?103.
[35]Wu B, Wang X, Yang L, et al. Effects of Bacillus amyloliquefaciensZM9 on bacterial wilt and rhizosphere microbial communities oftobacco[J]. Applied Soil Ecology, 2016, 103: 1?12.
[36]Wu K, Fang Z Y, Guo R, et al. Pectin enhances bio-control efficacyby inducing colonization and secretion of secondary metabolites byBacillus amyloliquefaciens SQY 162 in the rhizosphere of tobacco[J]. PLoS ONE, 2015, 10(5): e0127418.
[37]Wu X Z, Li H L, Wang Y, Zhang X B. Effects of bio-organicfertiliser fortified by Bacillus cereus QJ-1 on tobacco bacterial wiltcontrol and soil quality improvement[J]. Biocontrol Science andTechnology, 2020, 30(4): 351?369.
[38]Xiong H Q, Li Y T, Cai Y F, et al. Isolation of Bacillusamyloliquefaciens JK6 and identification of its lipopeptides surfactinfor suppressing tomato bacterial wilt[J]. Royal Soc ChemistryAdvances, 2015, 5: 82042?82049.
[39] Yamamoto S, Shiraishi S, Kawagoe Y, et al. Impact of Bacillus amyloliquefaciens S13‐3 on control of bacterial wilt and powderymildew in tomato[J]. Pest Management Science, 2015, 71(5):722?727.
[40]Yuan S F, Li M Y, Fang Z Y, et al. Biological control of tobaccobacterial wilt using Trichoderma harzianum amended bioorganicfertilizer and the arbuscular mycorrhizal fungi Glomus mosseae[J].Biological Control, 2016, 92: 164?171.
[41]Yuan S F, Wang L L, Wu K, et al. Evaluation of Bacillus-fortifiedorganic fertilizer for controlling tobacco bacterial wilt in greenhouseand field experiments[J]. Applied Soil Ecology, 2014, 75: 86?94.
[42]Zhang J, Guo T T, Wang P C, et al. Characterization of diazotrophicgrowth-promoting rhizobacteria isolated from ginger root soil asantagonists against Ralstonia solanacearum[J]. Biotechnology &Biotechnological Equipment, 2018, 32(6): 1447?1454.
[43]Zhang Y Y, Li G W, Li Q, et al. Identification and characterization ofvirulence-attenuated mutants in Ralstonia solanacearum as potentialbiocontrol agents against bacterial wilt of Pogostemon cablin[J].Microbial Pathogenesis, 2020, 147: 104418.
[44]Zheng X F, Wang J P, Chen Z, et al. A Streptomyces sp. strain:isolation, identification, and potential as a biocontrol agent againstsoilborne diseases of tomato plants[J]. Biological Control, 2019, 136:104004.
[45]Zhou T T, Li C Y, Chen D, et al. phlF?mutant of Pseudomonasfluorescens J2 improved 2, 4-DAPG biosynthesis and biocontrolefficacy against tomato bacterial wilt[J]. Biological Control, 2014,78: 1-8.
[46]Zhou Y, Yang L Y, Wang J, et al. Synergistic effect betweenTrichoderma virens and Bacillus velezensis on the control of tomatobacterial wilt disease[J]. Horticulturae, 2021, 7(11): 439?453.
[47]刘高峰, 张明宇, 黄光辉, 等. 石灰氮与生物菌剂配施对烟草根际微生物群落及防控青枯病的影响[J]. 河南农业大学学报, 2020, 54(5):748?754.
Liu G F, Zhang M Y, Huang G H, et al. Effects of application of limenitrogen and biological bacteria on soil microbial flora of tobaccorhizosphere and prevention and control of bacterial wilt[J]. Journal ofHenan Agricultural University, 2020, 54(5): 748?754.
[48]沈建平, 李小龙, 李红丽, 等. 不同菌剂防治烟草青枯病的效果[J].湖北农业科学, 2017, 56(4): 666?669.
Shen J P, Li X L, Li L H, et al. The effect of different microbial agenton tobacco wilt[J]. Hubei Agricultural Sciences, 2017, 56(4):666?669.
基金项目:浙江省自然科学基金青年基金项目(LQ22C150005);国家自然科学基金青年基金项目(32102472);学校科研发展基金项目(2021FR042)。

