内蒙古玉米大斑病菌孢子数量动态变化规律
李岩佳 马丽杰 郭帅领 胡小平 吕金 黄卫利 梁红伟 韩艳茹 罗国君 姜立慧 李猛 云旭
摘 要 揭示内蒙古地区玉米大斑病菌孢子的数量动态变化规律,并为玉米大斑病的预警和防控提供更科学的依据,利用孢子捕捉仪及 Real-time PCR方法,连续3 a(2021-2023年)对内蒙古6个玉米主产区的空气中的分生孢子数量进行监测。结果表明,内蒙古地区玉米大斑病菌孢子数量的高峰期出现在6月中上旬和8月中下旬。相关性分析显示,6个地区监测的孢子数量与空气温度均呈正相关(P<0.05)。孢子数量与内蒙古西部3个地区(巴彦淖尔、鄂尔多斯和呼和浩特)的相对湿度呈正相关(P<0.05),与内蒙古东部3个地区(赤峰、通辽和兴安盟)的相对湿度相关性不显著。这说明在内蒙古西部地区空气温度和相对湿度是影响孢子浓度的关键因子,在内蒙古东部地区空气温度是影响孢子浓度的关键因子。
关键词 玉米大斑病;分生孢子;Real-time PCR;动态监测;气象因子
由大斑凸脐蠕孢菌[Exserohilum turcicum (Pass.) Leonard et Suggs]引起的玉米大斑病(Northern corn leaf blight,NCLB)是一种全球性的玉米叶部真菌病害。该病害于1876年在意大利首次被发现,20世纪初期已遍布亚洲、非洲和美洲等玉米产区[1-2]。1899年,该病害在中国辽宁、吉林和黑龙江3省被发现,随后在其他各省玉米种植区相继出现,且在中国东北、华北北部、西北东部、西南冷凉山区以及其他高海拔地区发生严重[3]。内蒙古是中国主要的春播玉米产区,近年来玉米的播种面积呈逐年上升趋势,到2020年,玉米播种面积已达3.82×106 hm2,占全国玉米种植面积的1/10[4]。玉米大斑病是内蒙古玉米上发生最为普遍、危害最重的叶部真菌病害。玉米在开花期和灌浆期受侵染对产量损失影响最大[5]。一般情况下,感病品种可减产约20%,严重时减产达50%以上[6]。Symbol`@@
玉米大斑病菌通过菌丝体和分生孢子在玉米植株病残体上越冬,至第2年春季再萌发侵染植株。气候条件适宜时,10~14 d就会在叶片病斑上产生分生孢子,分生孢子借空气、雨水等可进行再侵染。病菌从种子萌发到收获均可侵染植株[7]。病菌孢子数量是影响病害发生的关键因素之一,监测孢子数量动态变化规律可为病害预测提供重要的基础数据[8]。于舒怡[9]利用固定式孢子捕捉器(载玻片粘附凡士林)捕捉空气中玉米大斑病菌分生孢子,明确了辽宁省不同生态区田间玉米大斑病菌孢子密度动态变化规律。此外,在感病品种和菌源量一定的情况下,环境因子也是影响病害发生的关键因素。玉米大斑病的适宜发病温度为20~25 ℃,超过28 ℃对病害有抑制作用。6-8月份的降水量也是影响病害发展的关键因素[10-11],其主要会对分生孢子的数量造成影响,因此,关注病菌分生孢子数量对于病害的预测意义重大。
明确玉米大斑病菌分生孢子数量动态变化规律,对该病害的科学精准绿色防控具有指导作用,对保障玉米生产和粮食安全具有重要意义。目前,关于内蒙古地区玉米大斑病菌孢子数量周年变化规律以及孢子浓度与气象因子关系的研究还未见报道。本研究将以玉米大斑病菌作为研究对象,连续3 a对内蒙古6个玉米主产区空气中的孢子进行捕捉,同时对空气温度、相对湿度和降水量等气象因子进行详细记录,采用 Real-time PCR法对捕捉到的孢子进行定量分析,以期明确玉米大斑病菌分生孢子在内蒙古地区的周年数量动态变化规律和空气中的孢子数量与气象因子的关系,为玉米大斑病的精准预测和病情防控提供理论基础。
1 材料与方法
1.1 试验地点及样本采集
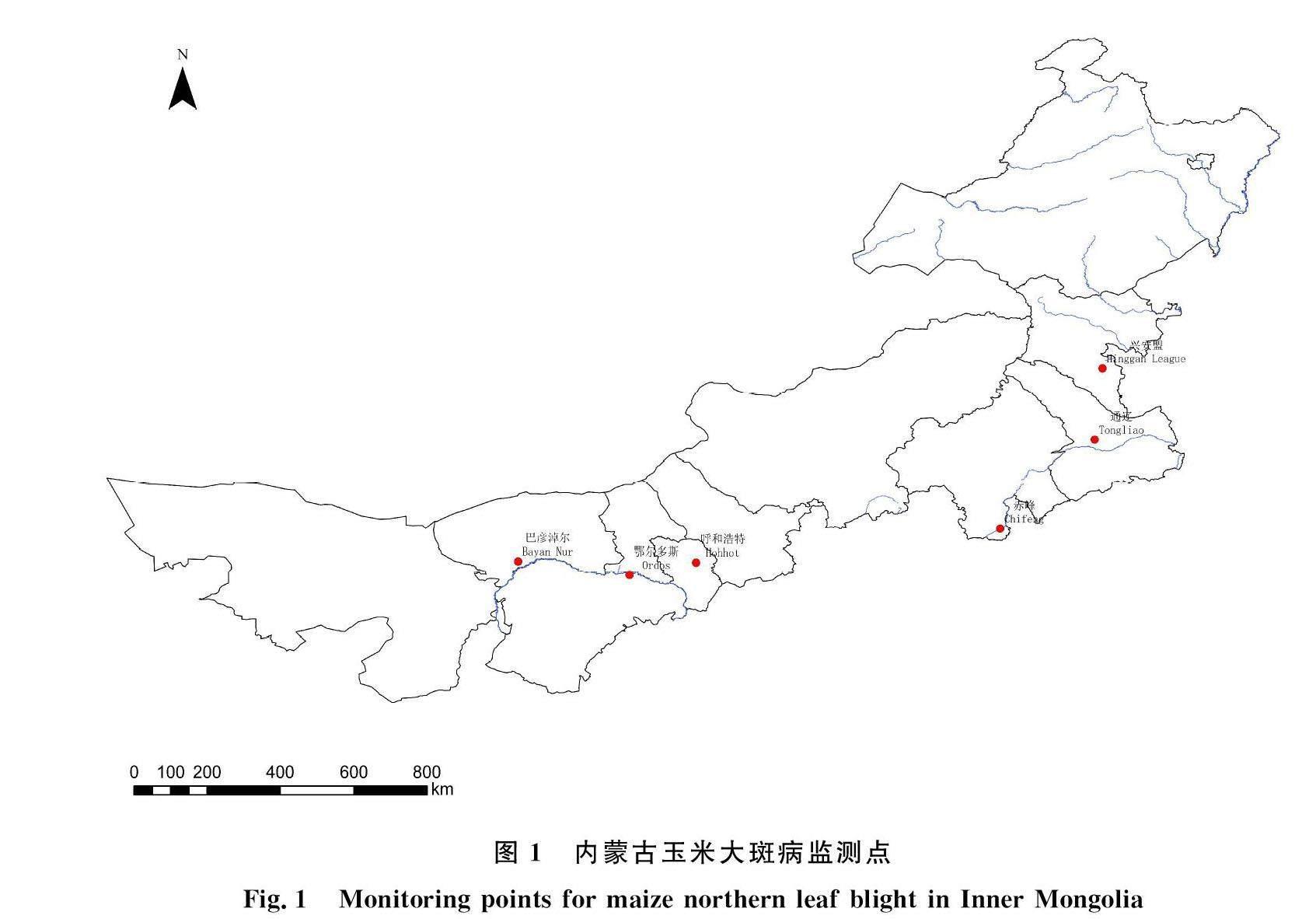
选择内蒙古春玉米区有代表性的6个盟市作为调查点,自西向东分别为巴彦淖尔市临河区、鄂尔多斯市达拉特旗、呼和浩特市玉泉区、赤峰市宁城县、通辽市开鲁县和兴安盟突泉县(图1)。各盟市选择的调查点常年种植玉米,种植面积均在33 hm2以上,玉米品种为当地自选品种。于2021年4月初在每个调查点田块旁边固定安装小西农孢子捕捉仪(西安黄氏生物工程有限公司产品),3 a间孢子捕捉仪的位置不移动。在孢子捕捉仪两侧插入涂抹凡士林的5 cm长的捕捉针,通过高速旋转将玉米大斑病菌分生孢子收集在捕捉针上,最后将两根捕捉针取下放入同一个2.0 mL离心管中,带回实验室放于-80 ℃冰箱中保存,备用。该仪器可在无人操作的环境中连续旋转采样,每 7~10 d取一次样品。
1.2 DNA提取
选用Fast DNA Spin Kit for soil 试剂盒(美国MP Biomedicals 有限责任公司产品)对捕捉针上捕捉的分生孢子样品进行DNA提取。抽提过程中为避免孢子的损失,直接将Sodium Phosphate Buffer 和MT buffer加入收集管中,在MM400研磨仪(德国Retsh公司产品)上以25 Hz 频率研磨40 s,共研磨3次,后续步骤按照说明书进行。
1.3 Real-time PCR供试引物及体系优化
采用石妞妞等[12]设计的玉米大斑病菌特异性引物(表1)进行Real-time PCR,反应的体系为:SYBR Green 12.5 μL,上下游引物各1 μL,DNA模板4 μL,补ddH2O 6.5 μL。程序为 95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火30 s,共40个循环。在Light Cycler 480实时荧光定量PCR仪(瑞士罗氏诊断有限公司)上进行。
1.4 Real-time PCR重复性评价及标准曲线的 建立
对采集到的玉米大斑病叶进行组织分离和纯化,挑取纯化好的菌株,将其置于PDA平皿上 26 ℃培养7 d,用无菌水洗下孢子,用两层滤纸过滤,除去悬液中的菌丝,将滤液在4 000 r·min-1下离心10 min,去除上清液,加入无菌水。在血球计数板下将其稀释成1×105 、1×104、1×103、 1×102、1×101、1×100 mL-1 6个梯度的孢子悬浮液模拟样本,研磨粉碎后,参照Fast DNA Spin Kit for soil 试剂盒说明书提取DNA。以无菌水作为阴性对照,按照上述反应体系和程序进行Real-time PCR。每个稀释度重复3次,计算变异系数,评价其重复性。根据1×105、1×104、1×103、1×102、1×101、1×100 mL-1 6个梯度的孢子浓度对数(x)和对应的Ct值(cycle threshold)(y)绘制标准曲线。
1.5 气象数据的获取及相关分析
在孢子捕捉仪附近安装多维环境气象监测仪(西安黄氏生物工程有限公司产品),采集空气温度、相对湿度及降水量等关键气象数据,并上传到云端数据库中保存,备用。采用SPSS软件的Spearman相关性分析方法对空气中的孢子数量与气象因子之间的关系进行分析。
2 结果与分析
2.1 Real-time PCR体系评价
将浓度为1×105 、1×104、1×103、1×102、 1×101、1×100 mL-1 的孢子模拟样品在同一条件下进行Real-time PCR,每个浓度重复3次,Ct值的平均值分别为13.70、17.49、22.24、25.54、 29.01、32.87;变异系数依次为0.04%、0.01%、 0.03%、0.02%、0.03%、0.02%,均小于1%(表2),说明该检测方法具有良好的重复性。
2.2 标准曲线
运用Real-time PCR方法对1×105 、 1×104、1×103、1×102、1×101、1×100 mL-1 6个浓度的孢子模拟样品进行定量,以不同梯度的分生孢子浓度的对数为横坐标,对应的Ct值为纵坐标绘制标准曲线(图2)。标准曲线方程为y= -3.819 4x+33.023,决定系数(R2)为0.997 4。Ct值的平均值为13.70~32.87,最低可检测到的孢子浓度为1 mL-1。
2.3 各地区孢子数量动态分析
分析2021-2023年各地区孢子浓度情况,2021年巴彦淖尔市的玉米大斑病菌孢子浓度在6月12日达到峰值,此时的孢子浓度为135.25 mL-1,相对湿度为60.87%,空气温度为 26.2 ℃;2022年巴彦淖尔市的玉米大斑病菌孢子浓度在8月11日达到峰值,此时的孢子浓度为19.45 mL-1,相对湿度为60.41%,空气温度为25.98 ℃;2023年巴彦淖尔市的玉米大斑病菌孢子浓度在8月14日达到峰值,此时的孢子浓度为 7 172.44 mL-1,相对湿度为73.08%,空气温度为29.17 ℃(图3)。
分析2021-2023年鄂尔多斯市的孢子浓度发现,2021年鄂尔多斯市的玉米大斑病菌孢子浓度在6月10日达到峰值,此时的孢子浓度为 121.34 mL-1,相对湿度为46.92%,空气温度为 17.50 ℃;2022年鄂尔多斯市的玉米大斑病菌孢子浓度在9月23日达到峰值,此时的孢子浓度为1 019.15 mL-1,相对湿度为65.94%,空气温度为22.89 ℃;2023年鄂尔多斯市的玉米大斑病菌孢子浓度在9月7日达到峰值,此时的孢子浓度为684.60 mL-1,相对湿度为79.16%,空气温度为25.86 ℃(图4)。
分析2021-2023年呼和浩特市的孢子浓度发现,2021年呼和浩特市的玉米大斑病菌孢子浓度在8月6日达到峰值,此时的孢子浓度为4.94 mL-1,相对湿度为55%,空气温度为24.96 ℃;2022年呼和浩特市的玉米大斑病菌孢子浓度在7月28日达到峰值,此时的孢子浓度为115.40 mL-1,相对湿度为62.66%,空气温度为 23.29 ℃;2023年呼和浩特市的玉米大斑病菌孢子浓度在8月24日达到峰值,此时的孢子浓度为 2 398.97 mL-1,相对湿度为64.79%,空气温度为18.92 ℃(图5)。
分析2021-2023年赤峰市的气象因子对孢子浓度的影响发现,2021年赤峰市的玉米大斑病菌孢子浓度在6月2日达到峰值,此时的孢子浓度为283.91 mL-1,相对湿度为49.38%,空气温度为24.03 ℃;2022年赤峰市的玉米大斑病菌孢子浓度在8月1日达到峰值,此时的孢子浓度为1 006.94 mL-1,相对湿度为77.49%,空气温度为27.63 ℃;2023年赤峰市的玉米大斑病菌孢子浓度在6月2日达到峰值,此时的孢子浓度为 1 742.85 mL-1,相对湿度为71.68%,空气温度为20.75 ℃(图6)。
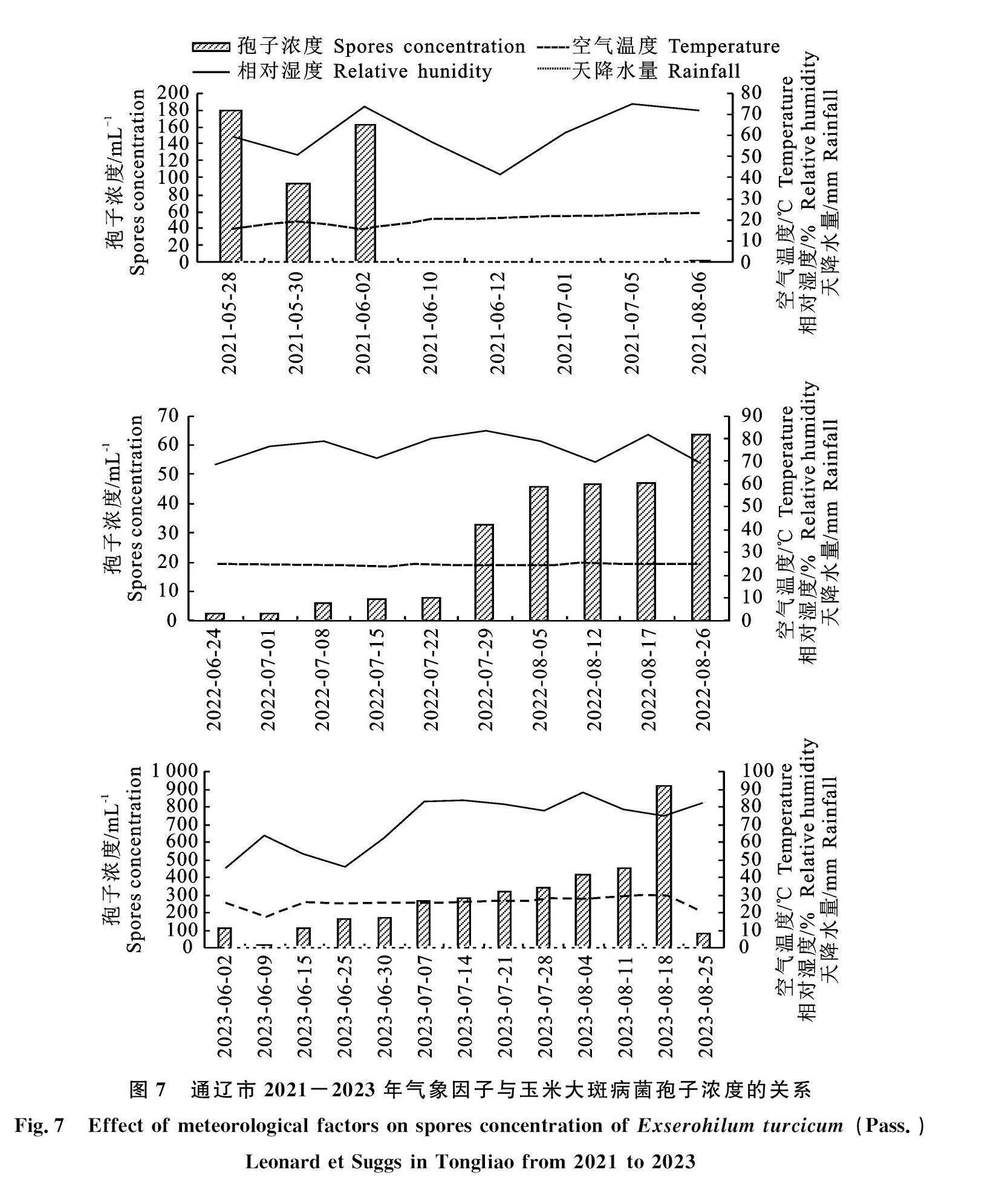
分析2021-2023年通辽市的孢子浓度发现,2021年通辽市的玉米大斑病菌孢子浓度在5月28日达到峰值,此时的孢子浓度为178.83 mL-1,相对湿度为59.51%,空气温度为 15.68 ℃;2022年通辽市的玉米大斑病菌孢子浓度在8月26日达到峰值,此时的孢子浓度为 63.28 mL-1,相对湿度为69.23%,空气温度为 25.03 ℃;2023年通辽市的玉米大斑病菌孢子浓度在8月18日达到峰值,此时的孢子浓度为918.03 mL-1,相对湿度为74.70%,空气温度为30.28 ℃(图7)。
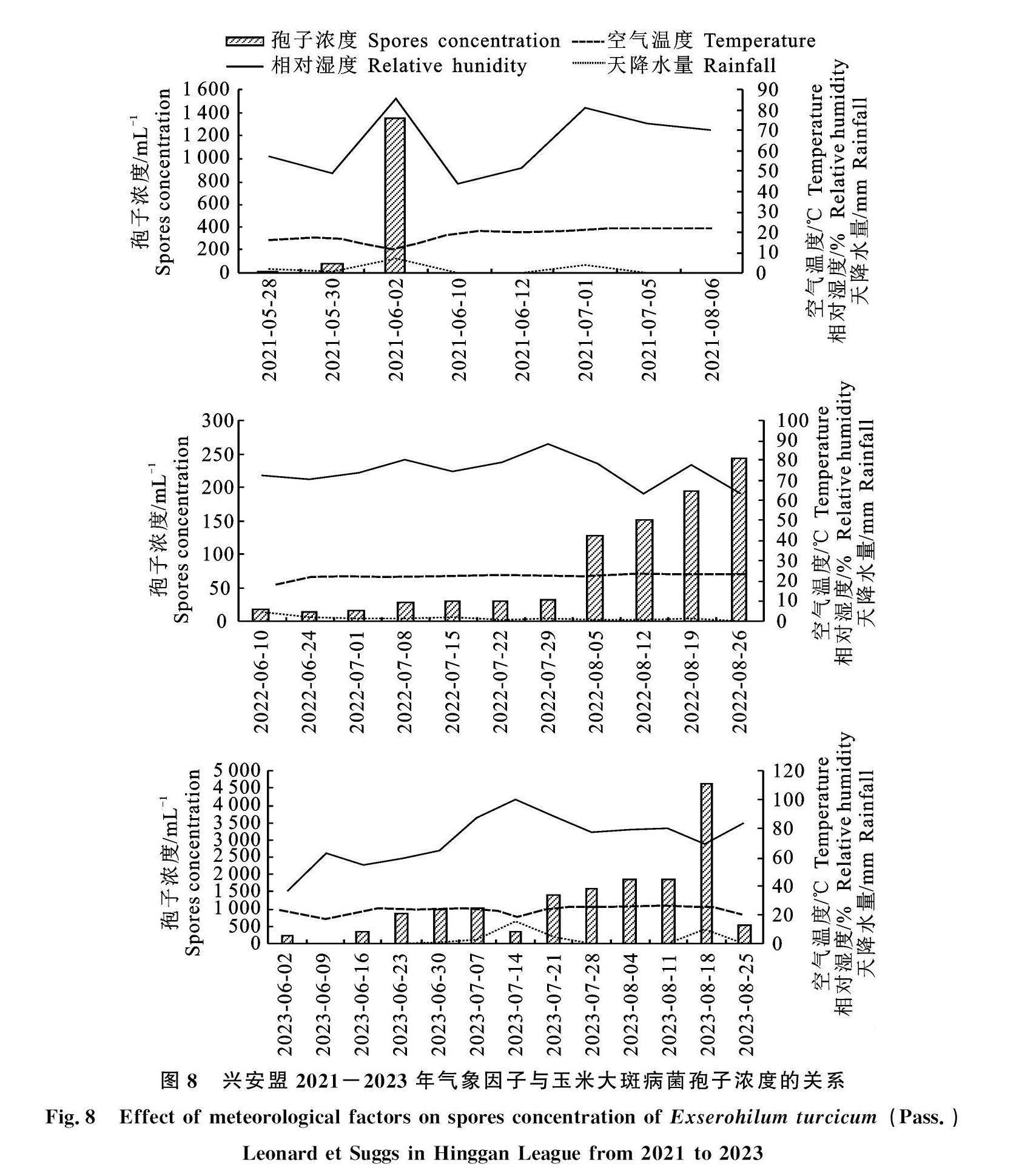
分析2021-2023年兴安盟的孢子浓度发现,2021年兴安盟的玉米大斑病菌孢子浓度在6月2日达到峰值,此时的孢子浓度为1 350.27 mL-1,相对湿度为85.70%,空气温度为11.21 ℃;2022年兴安盟的玉米大斑病菌孢子浓度在8月26日达到峰值,此时的孢子浓度为244.19 mL-1,相对湿度为63.48%,空气温度为23.37 ℃;2023年兴安盟的玉米大斑病菌孢子浓度在8月18日达到峰值,此时的孢子浓度为4 609.61 mL-1,相对湿度为69.83%,空气温度为26.31 ℃(图8)。
分析2021-2023年各地孢子浓度的总和发现,3 a间各地区的孢子浓度总和呈逐年递增趋势,且2023年各地区的孢子浓度总和普遍高于前两年。其中,巴彦淖尔市、呼和浩特市、通辽市和兴安盟的孢子浓度在2021年和2022年相差不大,但在2023年有显著的增长趋势;鄂尔多斯市2023年和2022年的孢子浓度总和基本相同,但较2021年有明显的增长;赤峰市3 a间孢子浓度总和呈持续增长趋势(图9)。
2.4 气象因子对玉米大斑病菌孢子浓度的影响
对2021-2023年内蒙古地区空气中的孢子浓度与气象因子进行相关性分析,结果表明,内蒙古6个盟市的孢子浓度与空气温度均呈显著正相关(P<0.05),其中鄂尔多斯市、赤峰市、通辽市和兴安盟地区的孢子浓度与空气温度呈极显著正相关(P<0.01)。内蒙古西部3个地区(巴彦淖尔市、鄂尔多斯市、呼和浩特市)的孢子浓度与相对湿度呈显著正相关(P<0.05),东部3 个地区(赤峰市、通辽市、兴安盟)的孢子浓度与相对湿度相关性不显著。巴彦淖尔市、鄂尔多斯市和赤峰市的孢子浓度随着降水量的增加而减少,呼和浩特市和兴安盟的孢子浓度随着降水量的增加而增加,但孢子浓度与降水量的相关性均不显著。由于通辽地区获取气象因子期间无降雨,因此孢子浓度与降水量之间无法分析相关性(表3)。
3 讨 论
目前,使用化学药剂仍然是防治玉米大斑病最有效的方式。明确内蒙古地区的玉米大斑病菌孢子数量动态变化规律,对预测田间病害发生情况,合理精准施药至关重要。建立科学的玉米大斑病菌孢子数量检测体系是监测病原菌动态变化的前提。目前,已有利用孢子捕捉仪与实时荧光定量PCR(Quantitative Real-time PCR)方法监测病原菌数量动态变化规律的报道,如苜蓿锈病[13]、大豆锈病[14]、甜菜霜霉病[15]、小麦条锈病[16]、小麦赤霉病[17]等。本研究参考实验室小麦条锈菌夏孢子检测体系,构建了玉米大斑病菌孢子检测体系,最低能够检测到1 mL-1的孢子浓度,可用于内蒙古地区空气中玉米大斑病菌孢子样品的检测。
本研究3 a间利用孢子捕捉仪捕捉采集孢子的时间不一致(图3~图8),主要是因为在2021年初次设计捕捉起始时间时,首先参考了于舒怡[9]的研究结果,于舒仪利用孢子捕捉器对辽宁省玉米大斑病发病前空中孢子携带量进行持续捕捉,结果表明,5月初(玉米刚播种)田间即可偶尔捕捉到玉米大斑病分生孢子,6月中旬达高峰,6月下旬首次发现病斑。结合内蒙古地区春玉米实际播种时期(4月下旬到5月上旬),确定了2021年初次捕捉采集孢子的时间为5月28日(鄂尔多斯市播种时间较其他地区早,因此提早了2 d;巴彦淖尔市由于天气原因推迟了4 d),为了捕捉到初次释放的分生孢子和找寻孢子释放高峰期,前3次捕捉和6月中旬捕捉均间隔2 d捕捉1次。后期结合2021年田间病害调查结果发现,内蒙古6个监测点初次发病主要集中在7月中下旬到8月上旬(个别提前到7月初,如赤峰地区),8月中下旬到9月上旬进入发病盛期。因此,2022年和2023年设计孢子捕捉起止时间时,向后推迟到从6月上旬开始,到9月中旬结束。个别监测点出现采集时间不一致是由于孢子捕捉针需要人工采集并进行更换,受外界因素的影响(疫情防控和当地恶劣天气)不能及时取样,导致采集时间存在一定的偏差。
本研究通过对内蒙古6个盟市玉米大斑病菌孢子连续3 a的监测发现,孢子浓度的高峰期主要集中在玉米吐丝期(6月中上旬)和抽穗灌浆期(8月中下旬)。玉米大斑病是多循环病害,第二次高峰期的出现应是再侵染引起的。巴彦淖尔市、鄂尔多斯市、通辽市和兴安盟均出现孢子浓度峰值后移的现象(2021年孢子浓度峰值主要在6月中旬出现,2022年和2023年孢子浓度峰值在8月中下旬出现)。在其他因素如气候、品种等适宜的条件下,孢子浓度峰值后移可能影响玉米的抽穗灌浆,最终将对玉米的产量和品质造成影响。
大量研究表明,空气中的孢子浓度与气象因子密切相关。宋晶晶等[18]发现,空气中小麦白粉菌的孢子密度与温度和相对湿度呈负相关,与降水量呈正相关。于舒怡等[19]证明了高湿和降水会降低空气中葡萄霜霉病菌孢子密度。户雪敏等[20]发现小麦条锈菌夏孢子数量与空气温度与日照时数呈显著正相关。谷医林[21]证明空气中孢子密度与相对湿度呈负相关,且在湿度处于60%左右的水平时,小麦条锈菌夏孢子孢子浓度出现最大值。本研究发现,内蒙古自西向东6个盟市的孢子浓度与空气温度呈正相关(P< 0.05),温度在23~27 ℃的时候,随着气温的升高孢子浓度增加,当温度超过30 ℃时,孢子浓度减少。这与冯胜泽等[22]在室内研究的玉米大斑病菌分生孢子的产孢机制结果相一致。本研究结果还表明,内蒙古西部3个地区(巴彦淖尔市、鄂尔多斯市、呼和浩特市)的孢子浓度与相对湿度呈显著正相关(P<0.05),东部3个地区(赤峰市、通辽市、兴安盟)的孢子浓度与相对湿度相关性不显著,说明在内蒙古西部地区空气温度和相对湿度是影响孢子浓度的关键因子,东部地区空气温度是影响孢子浓度的关键因子。另外研究发现,巴彦淖尔市、鄂尔多斯市和赤峰市的孢子浓度随着降水量的增加而减少,可能是因为降水过大降低了空气中的孢子浓度;但呼和浩特市和兴安盟的孢子浓度随着降水量的增加而增加,这可能由于适宜的降水加快了孢子萌发速度。
本研究还发现,内蒙古西部3个地区巴彦淖尔市、鄂尔多斯市和呼和浩特市2023年孢子浓度分别高达7 172.44 mL-1、684.60 mL-1和 2 398.97 mL-1,但田间调查发病很轻,病情指数分别为0.22、0.44和0.52。分析可能是由于相对高温低湿环境不利于分生孢子的萌发,也可能与当地玉米品种的抗病性有关,如鄂尔多斯市监测点种植的玉米品种为‘满世通161号,抗大斑病(3R)。内蒙古东部3个地区赤峰市、通辽市和兴安盟2023年孢子浓度分别为742.85 mL-1、 918.03 mL-1和4 609.61 mL-1,田间调查病情指数分别为17.05、21.04和58.72。病情指数表现出随着孢子浓度增加而升高的趋势。说明孢子浓度是引起内蒙古东部区玉米大斑病发生的关键因素。
内蒙古地区东西长约2 400 km,南北最大跨度1 700多km,横跨东北、华北、西北地区,囊括了中国北方春玉米区的各种生态类型区,自西向东6个地区盟市之间气象差异较大。在后续构建玉米大斑病发病程度预测模型中,可将东部3个地区划为一类,西部3个地区划为一类,分别构建模型。此外,玉米大斑病的发生还与玉米品种、侵染时期等因素密切相关,本研究仅研究分析了关键气象因子对玉米大斑病菌孢子浓度的影响,在未来的研究中,可充分考虑玉米品种、侵染时段等因素对大斑病发生的影响。同时,将结合3 a田间病害调查结果,研究孢子浓度与病害发生程度的关系。本研究对于监测点附近的玉米品种没有做干预,均以当地主栽品种为准并记录了品种类型,主要为下一步建立更接近田间实际发生情况的内蒙古地区玉米大斑病发病程度的监测预警系统做准备。并且通过本研究已经确定了影响玉米大斑病发生的几个关键因子如孢子浓度、温度、相对湿度、品种等。
综上所述,空气中有效孢子浓度并不是由单一因素决定,而是多种因子综合作用的结果。本研究基于孢子捕捉仪和Real-time PCR定量方法,明确了内蒙古地区玉米大斑病菌孢子的周年变化规律,同时分析了空气温度、相对湿度和降水量对孢子动态的影响,为后期构建基于孢子数量和气象因子的预测模型奠定基础,同时也为玉米大斑病的早期防治提供理论依据和参考价值。
参考文献 Reference:
[1] 王慧慧,张文忠,芦 明,等.玉米大斑病的研究进展[J]. 天津农业科学,2016,22(12):133-136.
WANG H H,ZHANG W ZH,LU M,et al.Research progress of northern corn leaf blight [J].Tianjin Agricultural Sciences,2016,22(12):133-136.
[2]朱飞宇.玉米大斑病菌StRALF基因的克隆与表达分析[D].沈阳:沈阳农业大学,2020.
ZHU F Y.Cloning and expression analysis of StRALF gene in Setosphaeria turcica[D].Shenyang:Shenyang Agricultural University,2020.
[3]毕欢欢,张晓雅,王小敏,等.玉米大斑病菌 StCHS6的基因结构及表达规律分析[J].华北农学报,2019,34(6):198-202.
BI H H,ZHANG X Y,WANG X M,et al.The structure and expression pattern analysis of StCHS6 gene in Setosphaeria turcica[J].Acta Agriculturae BorealiSinica,2019,34(6):198-202.
[4]连丽娟.内蒙古玉米产业发展特点及建议[J].北方经济,2021(5):32-34.
LIAN L J.Characteristics and suggestions of corn industry development in Inner Mongolia[J].Northern Economy,2021(5):32-34.
[5]SETYAWAN B,SULIANSYAH I,ANWAR A,et al.Short communication:resistance of eleven new hybrid maize genotypes to Turcicum leaf blight (Exserohilum turcicum)[J].Biodiversitas,2016,17(2):604-608.
[6]杨淳博.山西玉米大斑病菌生物学特性及品种抗病性研究[D].山西晋中:山西农业大学,2020.
YANG CH B.Study on the biological characteristics and variety resistance of Exserohilum turcicum in Shanxi province[D].Jinzhong Shanxi:Shanxi Agricultural University,2020.
[7]陈小丹.玉米大斑病的发生及防治[J].现代农村科技,2022(8):42-43.
CHEN X D.The occurrence and prevention of Northern corn leaf blight[J].Modern Rural Technology,2022(8):42-43.
[8]户雪敏,陈富华,陆可心,等.湖北襄阳小麦条锈菌夏孢子数量的周年动态[J].麦类作物学报,2023,43(1):124-129.
HU X M,CHEN F H,LU K X,et al.Annual dynamic of urediniospore of Puccinia striiformis f.sp.tritici in Xiangyang,Hubei Province[J].Journal of Triticeae Crops,2023,43(1):124-129.
[9]于舒怡.辽宁玉米叶部病害田间流行动态及预测模型研究[D].沈阳:沈阳农业大学,2011.
YU SH Y.Studies on the field epidemiology of maize leaf spots and development of forecast and precaution model in Liaoning province[D].Shenyang:Shenyang Agricultural University,2011.
[10] 鲜 丽.内蒙古通辽市优质玉米高产种植及主要病虫害防治技术[J].农业工程技术,2022,42(2):64-65.
XIAN L.High-yield planting of high-quality maize and main pest control technology in Tongliao City,Inner Mongolia[J].Agricultural Engineering Technology,2022,42(2):64-65.
[11]赵海军,张静峰,张连奎,等.内蒙古突泉县玉米大斑病发生与温、湿度灰色关联分析[J].现代农业研究,2021,27(3):50-53.
ZHAO H J,ZHANG J F,ZHANG L K,et al.Correlation analysis on the occurrence and temperature and humidity of maize spot disease in Tuquan County,Inner Mongolia[J].Modern Agricultural Research,2021,27(3):50-53.
[12]石妞妞,杜宜新,阮宏椿,等.一种玉米大斑病菌分子检测引物及快速检测方法:CN201610231220.4[P].2019-03-19.
SHI N N,DU Y X,RUAN H CH,et al.A molecular detection primer and rapid detection method for Northern corn leaf blight:CN201610231220.4[P].2019-03-19.
[13]马丽杰,武占敏,张俊杰,等.内蒙古苜蓿锈菌越冬的分子定量检测[J].西北农业学报,2022,31(4):517-524.
MA L J,WU ZH M,ZHANG J J,et al.Molecular quantitative detection for overwintering of Uromyces striatus in Inner Mongolia[J].Acta Agriculturae Boreali-occidentalis Sinica,2022,31(4):517-524.
[14]BAENES C W,SZABO L J,BOWERSOX V C.Identifying and quantifying Phakopsora pachyrhizi spores in rain[J].Phylopathology,2009,99(4):328.
[15]KLOSTERMAN S J,AMY A,NEIL M R,et al.Coupling spore traos and quantitative PCR assays for detection of the downy mildew pathogens of spinach(Peronospora effusa) and beet(P.schachtii)[J].Phytopathology,2014,104(12):1349.
[16]郭丽丽,户雪敏,张升恒,等.陇南小麦条锈菌夏孢子的周年动态变化规律[J].麦类作物学报,2019,39(10):1257-1262.
GUO L L,HU X M,ZHANG SH H,et al.Annual dynamic of urediniospore of Puccinia striiformis f.sp. tritici in Longnan [J].Journal of Triticeae Crops,2019,39(10):1257-1262.
[17]CHOUDHURY R A,KOIKE S R,FOX A D,et al.Season-long dynamics of spinach downy mildew determined by spore trapping and disease incidence[J].Phylopathology,2016,106(11):1311.
[18]宋晶晶,曹远银,李天亚,等.小麦白粉病菌空中孢子量与气象因子的关系及病害预测模型的建立[J].湖北农业科学,2011,50(13):2652-2654.
SONG J J,CAO Y Y,LI T Y,et al.Relationship between the amount of aerial conidia of Blumeria graminis f.sp.tritici and meteorological factors and the establishment of forecasting model[J].Hubei Agricultural Sciences,2011,50(13):2652-2654.
[19]于舒怡,刘远长,王 辉,等.避雨栽培对葡萄霜霉病菌孢子囊飞散时空动态的影响[J].中国农业科学,2016,49(10):1892-1902.
YU SH Y,LIU Y CH,WANG H,et al.Effect of rain-shelter cultivation on temporal and spatial dynamic of airborne sporangia of Plasmopara viticola [J].Scientia Agricultura Sinica,2016,49(10):1892-1902.
[20]户雪敏,陈富华,陆可心,等.湖北襄阳小麦条锈菌夏孢子数量的周年动态[J].麦类作物学报,2023,43(1):124-129.
HU X M,CHEN F H,LU K X,et al.Annual dynamic of urediniospore of Puccinia striiformis f.sp.tritici in Xiangyang,Hubei province[J].Journal of Triticeae Crops,2023,43(1):124-129.
[21]谷医林.甘肃省甘谷地区小麦条锈菌和白粉菌周年动态及传播路径的分析[D].北京:中国农业大学,2018:19.
GU Y L.Annual dynamic and dispersal of Puccinia striiformis f.sp.tritici and Blumeria graminis f.sp.tritici in Gangu,Gansu province [D].Beijing:China Agricultural University,2018:19.
[22]冯胜泽,赵 洁,刘星晨,等.玉米大斑病菌分生孢子产生条件的分析及产孢机制初探[C]//中国植物病理学会.中国植物病理学会2016年学术年会论文集.北京:中国农业科学技术出版社,2016:1.
FENG SH Z,ZHAO J,LIU X CH,et al.Analysis of conidia production conditions and preliminary study on spore production mechanism of Northern corn leaf blight [C]∥Chinese Society of Plant Pathology.Proceedings of the 2016 Annual Meeting of the Chinese Society of Plant Pathology.Beijing:China Agricultural Science and Technology Press,2016:1.
Annual Dynamic Variation of Conidium Number of Exserohilum turcicum (Pass.) Leonard et Suggs in Inner Mongolia
LI Yanjia1,MA Lijie2,GUO Shuailing1,HU Xiaoping1,L Jin2,
HUANG Weili3,LIANG Hongwei4,HAN Yanru5,LUO Guojun6,
JIANG Lihui7,LI Meng8 and YUN Xu9
(1.Collage of Plant Protection.Northwest A&F University,Key Laboratory of Integrated Management of Crop Pests on
the Loess Plateau,Ministry of Agriculture and Rural Affairs,Yangling Shannxi 712100,China; 2.Ordos Vocational
College of Eco-environment,Ordos Inner Mongolia 017010,China; 3.Xian Huangs Biological Engineering Co.,
Ltd,Xian 710065 China; 4.Inner Mongolia Academy of Agricultural and Animal Husbandry Sciences,
Hohhot 010031,China; 5.Linhe District Agricultural Technology Extension Center of Inner Mongolia,Bayannur
Innner Mongolia 015000,China; 6.Ningcheng County Agricultural and Animal Husbandry Technology Extension
Center,Chifeng Inner Mongolia 024205,China; 7.Kailu County Agricultural and Animal Husbandry Technology
Extension Center,Tongliao Inner Mongolia 028400,China; 8.Tuquan County Agricultural and Animal Husbandry
Technology Extension Center,Hinggan League Inner Mongolia 137500,China; 9.Ordos Academy of
Agricultural and Animal Husbandry Sciences,Ordos Inner Mongolia 014300,China)
Abstract To investigate the dynamic change rule of pathogen spores of Exserohilum turcicum (Pass.) Leonard et Suggs in Inner Mongolia and provide a more scientific basis for early warning and control of maize northern leaf blight,the numbers of conidia in the air of six maize-producing areas in Inner Mongolia were monitored for three consecutive years (2021-2023) by spore trapper and Real-time PCR.The results showed that the peak of the numbers of conidia in Inner Mongolia appeared in Mid-to-early June and Mid-to-late August.Correlation analysis showed that the numbers of conidia monitored in the six regions were positively correlated with air temperature (P<0.05).The numbers of conidia were positively correlated with the relative humidity in three regions of western Inner Mongolia (Bayan Nur,Ordos and Hohhot) (P<0.05),but were not significantly correlated with the relative humidity in three regions of eastern Inner Mongolia (Chifeng,Tongliao and Hinggan League).In conclusion,the key factors affecting spore concentration are air temperature and relative humidity in the west of Inner Mongolia,and the key factor affecting spore concentration is air temperature in the east of Inner Mongolia.
Key words Maize northern leaf blight; Conidium; Real-time PCR; Dynamic Monitor; Meteorological factors
Received 2023-12-17 Returned 2024-01-29
Foundation item Science and Technology Project of Inner Mongolia (No.2021GG0197);Project of Key Laboratory of Integrated Management of Crop Pests on the Loess Plateau,Ministry of Agriculture and Rural Affairs (No.KFJJ20210101); Ordos Industry Innovation Talent Project (No.2022).
First author LI Yanjia,female,master student.Research area:epidemiology of plant diseases.E-mail:Laleenareina@nwafu.edu.cn
Corresponding author HU Xiaoping,male,professor.Research area:epidemiology of plant diseases. E-mail:xphu@nwsuaf.edu.cn
MA Lijie,female,associate professor.Researcharea:epidemiology of plant diseases.E-mail:malijie1016@163.com(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

