香樟黑斑病病原菌鉴定及其拮抗菌B505的生防效果
郑爱芳 张名雪 周姝珂 高晔 苏子艳 张建冬 张郝宇 宋晓贺

摘 要 为明确引起香樟黑斑病的病原菌,发掘防治该病害的生防细菌资源,根据科赫法则,采用组织分离法对引起香樟黑斑病的病原菌进行分离纯化。依据形态特征及ITS、 Alta1、gdp基因对病原菌进行分类鉴定;测定不同培养基、温度、pH等因素对病原菌生长的影响;采用平板对峙法筛选香樟黑斑病拮抗细菌,并对其进行抑菌活性试验。结果表明,引起香樟黑斑病的病原菌为互隔交链孢菌Alternaria alternata,其最佳生长温度为25 ℃,最适pH为6.5,最适培养基为PDA培养基。筛选获得1株对香樟黑斑病有较强抑制作用的菌株B505,鉴定为贝莱斯芽胞杆菌Bacillus velezensis,该菌株可强烈抑制香樟黑斑病病原菌的菌丝生长和孢子萌发,对香樟离体叶片黑斑病的抑制率为55.6%,以上结果为生物防治香樟叶部病害提供了新的思路。
关键词 香樟黑斑病;真菌病害;分离鉴定;贝莱斯芽胞杆菌;拮抗菌
香樟(Cinnamomum camphora)是一种常绿乔木,树冠较大,夏天浓荫遍地,植株能够耐受短期水淹,对有害气体有一定的抗性,且有驱虫效果,是中国长江流域及以南地区如杭州、义乌、马鞍山、宜宾、南充、长沙市等多个城市的重要园林绿化植物[1]。香樟的叶子和果实能提取多种具有生理活性的物质,具有抗肿瘤、抗炎症等作用[2-3],此外,香樟具有抗有毒气体和耐烟尘能力,能够净化空气[4-5]。然而香樟叶部易遭受病原微生物的侵袭,导致炭疽病、白粉病、溃疡病等真菌病害的发生和流行,造成叶片发生病变,严重时导致叶片脱落、植株矮小,严重降低道路绿地景观的观赏价值[6-7]。同时,香樟叶片真菌病害流行产生的一些病原菌产物会造成部分敏感人群的过敏反应,引发呼吸道疾病[8-9]。
化学农药防治植物真菌病害仍然是常用的手段,但容易造成病原菌抗药性的产生和环境的污染,危害人类的身体健康[10],开发低毒、对环境友好的微生物源杀菌剂替代化学药物成为当前的研究热点[11],目前已商业化使用的生物防治剂有芽胞杆菌[12]、假单胞菌[13]、木霉[14]等,微生物防治具有良好的应用前景[15]。生防菌能否在植物表面或内部定殖成为影响生防效果的关键因素[16-17],在健康植物的组织和表面存在大量微生物,有益微生物可以直接与病原菌发生作用,通过在叶片上定殖,改变微生物群落结构来控制植物病害[18-20],从根际、叶际分离的有益土著微生物具有定殖能力强,对植物细胞无害,抗菌效果较好等特点,在植物真菌病害防治方面有良好的效果[21-23]。
本研究采用组织分离法,分离纯化香樟黑斑病病原菌,通过科赫法则、形态学和分子生物学鉴定,明确病原菌的致病性和分类地位,从香樟叶部和根际土壤分离拮抗细菌,并初步研究其对香樟黑斑病的生防特性,以期为生物防治香樟叶部病害提供新的思路。
1 材料与方法
1.1 样本的采集
从安庆市区公园的香樟树上采集典型的发病叶片,装入灭菌纸袋中,带回实验室,4 ℃冰箱保存,备用。
1.2 香樟黑斑病病原菌的分离纯化
将病叶病健交界处病斑随机剪成0.5 mm的组织块,用无菌水冲洗干净,用75%乙醇漂洗1 min,无菌水冲洗3次;0.1%升汞消毒30 s,无菌水冲洗3次,放入PDA(含氯霉素)培养基中 25 ℃恒温培养。发现组织周围有菌长出,及时转接到PDA培养基上进一步分离纯化。
1.3 香樟黑斑病病原菌致病性测定
菌丝接种法:用打孔器取新鲜菌饼(d = 5 mm),将菌丝面朝下置于无菌的健康叶片上,以接种空白PDA菌饼为对照,25 ℃恒温培养。孢子接种法:从PDA平板上刮取新鲜的子实体,放入装有30 mL无菌生理盐水的三角瓶中,150 r/min摇床震荡15 min,然后用无菌脱脂棉过滤收集孢子,用血球计数板计算孢子浓度,调整孢子悬液浓度为1×106 CFU/mL,取20 μL孢子悬液滴在无菌的叶片上,以滴加相同体积无菌水的叶片为对照,叶片根部用含水无菌脱脂棉保持湿润,25 ℃恒温培养[24]。
1.4 香樟黑斑病病原菌鉴定
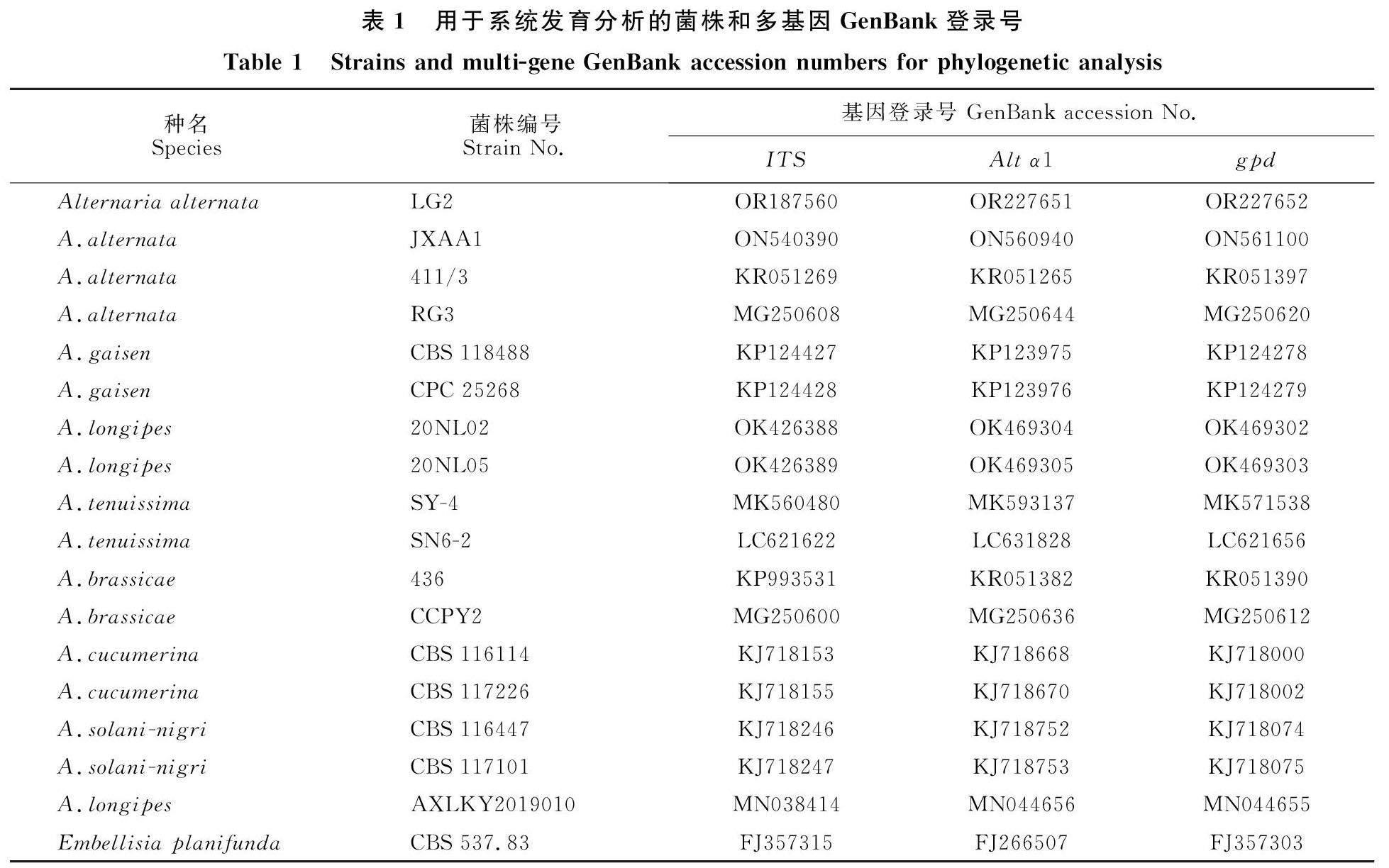
根据菌落的形态、颜色、性状及生长情况等特征,参考《中国真菌志链格孢属》[25]的描述初步对菌株进行形态分类学鉴定。收集菌株菌丝体,参照UNIQ-10柱式真菌基因组抽提试剂盒(上海生物工程有限公司)操作说明,提取菌株基因组DNA。以纯化的香樟黑斑病病原菌LG2的DNA为模板,分别对核糖体RNA内转录间隔区基因ITS(ITS1:TCCGTAGGTGAACAYCCTGCGG,ITS4:TCCTCCGCTTATTGATATGC); 链格孢过敏原基因Alt α1(Altα1-F:ATGCAGTTCACCACCATCGC,Altα1-R:ACGAGGGTGAYGTAGGCGTC);3-磷酸甘油醛脱氢酶基因gpd (gpd-F:GCCGTCAACGACCCCTTCATTGA,gpd-R:GGGTGGAGTCGTACTTGAGCATGT)进行PCR扩增。PCR反应体系为:Phusion Master Mix(2×)15 μL、正反向引物 (5 μmol/L)各2 μL、gDNA(10 ng/μL) 2 μL (10~20 ng),补水至总体积30 μL。PCR反应程序:94 ℃ 预变性1 min;94 ℃变性 30 s,50 ℃退火 45 s,72 ℃延伸 30 s,30个循环;72 ℃ 10 min,4 ℃保存,PCR产物用15 g/L琼脂糖凝胶电泳检测样品质量[26],PCR产物测序由通用生物(安徽)股份有限公司完成。将测得的序列提交至NCBI,获得登录号,并下载近缘菌株的上述3个基因序列,比对的菌株及相关基因登录号等信息如表1所示。在Phylosuite软件中,通过MAFFT进行序列比对、Gblock修剪、Concatenation串联,用 ModelFinder对优化的数据选择最优模型,采用MrBayes法构建系统发育树。
1.5 香樟黑斑病病原菌的生物学特性研究
1.5.1 培养基 玉米粉琼脂脱水培养基(CMA):青岛海博生物技术有限公司;虎红琼脂(RBA)脱水培养基:青岛海博生物技术有限公司。土豆培养基(PDA,含氯霉素,用于分离病原真菌),青岛海博生物技术有限公司。PDA培养基(活化培养真菌):马铃薯200 g、蔗糖20 g、琼脂20 g、水1 000 mL。NA培养基(培养细菌):牛肉膏3 g、蛋白陈10 g、NaCl 10 g、琼脂15~20 g、水1 000 mL、pH 7.0。改良NA培养基(可培养细菌和真菌):牛肉膏3 g、酵母膏1 g、蛋白陈5 g、葡萄糖10 g、琼脂15~20 g、水1 000 mL、pH 7.0[27-28]。
1.5.2 不同培养基对病原菌菌丝体生长的影响 将5 mm的病原菌菌饼菌丝面朝下分别接种于PDA、CMA、RBA、NA、改良NA培养基中央,每组3个重复,25 ℃培养5 d,十字交叉法测量菌落直径。
1.5.3 不同pH对病原菌菌丝体生长的影响 将改良NA培养基pH调整为4.0、4.5、5.0、 5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0共11个梯度,将新鲜的菌饼菌丝面朝下接种于培养基中央,每组3个重复,25 ℃培养5 d,十字交叉法测量菌落直径。
1.5.4 不同温度对病原菌菌丝体生长的影响 将新鲜的菌饼菌丝面朝下接种于改良NA平板中央,分别在10、15、20、25、30、35、40 ℃条件下培养5 d,每组3个重复,十字交叉法测量菌落直径。
1.6 香樟黑斑病菌拮抗菌株的筛选及鉴定
土壤拮抗菌分离法:取香樟树冠下距地面深5~20 cm处土壤,称取10 g,加入到装无菌玻璃珠和90 mL无菌水的三角瓶中,摇床150 r/min震荡20 min后,静置沉淀之后取上清液涂布到NA平板上。叶片内生及叶际拮抗微生物分离法:选取香樟健康叶片,不经消毒,剪成0.5 mm的组织块,1个叶片选3个组织块,接种到NA培养基上,将两种方法制备的平板置于37 ℃恒温培养,观察并分离纯化细菌菌落,可初步利用土壤和叶片中丰富的微生物作为指示菌,观察分离菌的拮抗作用。参考细菌基因组DNA提取试剂盒(广州捷倍斯生物科技有限公司)操作说明,提取菌液基因组DNA。细菌采用16s rRNA通用引物:上游引物(27F): 5′-AGAGTTTGATCCTGGCTCAG - 3′和下游引物(1492R): 5′ - TACGGYTACCTTGTTACGACTT - 3′进行PCR扩增,产物由上海凌恩生物科技有限公司完成测序。通过BLAST分析,将所得菌株序列与Genbank核酸数据库中已知种的16s rRNA序列比对,确定菌株类别[29]。
1.7 抗菌细菌抑制香樟黑斑病菌菌丝生长的显微形态观察
用打孔器取新鲜的香樟黑斑病菌菌饼(d= 5 mm),接种在改良的NA培养基平板中央,同时在中央菌饼十字线上距离其约为2 cm的地方(共4 处)接种抗菌菌株,以不接抗菌菌株的平板为对照,每组5个重复,25 ℃恒温培养,待对照组病原菌长满平板后,十字交叉法测量菌落直径,并计算抑菌率[30]。抑菌率=(对照病原菌直径―处理病原菌直径)/(对照病原菌直径―5)×100%。用解剖刀取平板上抑菌带边缘的受抑制的香樟黑斑病菌菌丝体,置于载玻片上,用盖玻片轻轻按压,置于显微镜下观察菌丝的形态。
1.8 拮抗细菌对香樟黑斑病菌孢子萌发的抑制效果
用无菌生理盐水将香樟黑斑病菌的孢子悬浮液浓度调整为1.0×103、1.0×104、1.0×105 CFU/mL,拮抗菌株在NA中培养36 h后,调整浓度为1.0×107 CFU/mL。取3支15 mL试管,分别加入2 mL不同浓度的病菌孢子悬浮液,然后依次加入2 mL拮抗菌液和2 mL NB培养基,以加入相同体积的无菌水为对照,设3个重复, 28 ℃恒温培养24 h,光学显微镜观察孢子的形态,并计算孢子萌发抑制率。
孢子萌发抑制率 = (对照组孢子萌发率―处理组孢子萌发率)/对照组孢子萌发率×100%
1.9 拮抗细菌抑制香樟黑斑病菌菌的离体叶片试验
将香樟叶片进行表面消毒,在无菌叶片上滴加10 μL浓度为1.0×104 CFU /mL香樟黑斑病病原菌孢子悬浮液,待叶片晾干后,喷洒20 μL浓度为1.0×107 CFU/mL的拮抗菌发酵液,以滴加无菌水为对照,叶柄处用含有无菌水的无菌脱脂棉包裹,置于25℃光照培养箱中培养,每组10个叶片,3次重复。分别培养3 d、7 d、11 d观察叶片发病情况。
香樟叶片发病严重度=发病面积/叶片总面积×100%
防治效果=(对照组发病严重度-处理组发病严重度)/对照组发病严重度×100%
2 结果与分析
2.1 香樟黑斑病病原菌的分离鉴定
2.1.1 香樟黑斑病田间症状 香樟黑斑病危害香樟叶片,老叶和幼嫩的新叶均可发病,主要危害新叶,病斑黑褐色,连成一片,边缘卷曲(图1-A和图1-B),严重时叶片枯萎下垂,新梢枯死。
2.1.2 香樟黑斑病病原菌形态特征 从患病叶片中分离得到2种真菌和1种细菌。其中一种真菌属于青霉属,一种真菌是灰绿色的霉菌,命名为LG2;经致病性检测,灰绿色的霉菌LG2具有致病性,其他分离株无致病性。菌落在PDA培养基上,25 ℃培养6 d,长满整个平板。正面灰绿色(图1-E),背面黑色(图1-F),气生菌丝密集。菌丝黑色,有隔膜,分生孢子黑褐色,棒槌状,有2~7个横隔膜,0~4个纵隔膜(图1-G),大小为 (4~6) μm×(13~20)μm。分生孢子链状排列(图1-H)。根据病原菌的培养特征和形态学特点,将该病原菌初步鉴定为链格孢属真菌A. sp.。
2.1.3 香樟黑斑病病原菌致病性测定 香樟黑斑病菌孢子悬浮液接种5 d,幼嫩叶片上出现点状病斑,浅褐色。接种后11 d,病斑颜色加深,呈黑褐色,病斑连成一片(图1-C)。病原菌菌饼接种 5 d,病斑呈黑褐色,病斑表面长满灰色菌丝(图1-D)。两种接种方法接种,发病症状均与香樟树上叶片发病症状相同。分别从发病的叶片上重新分离病原菌,其菌落特征与香樟树上发病叶片上分离纯化的菌落一致。
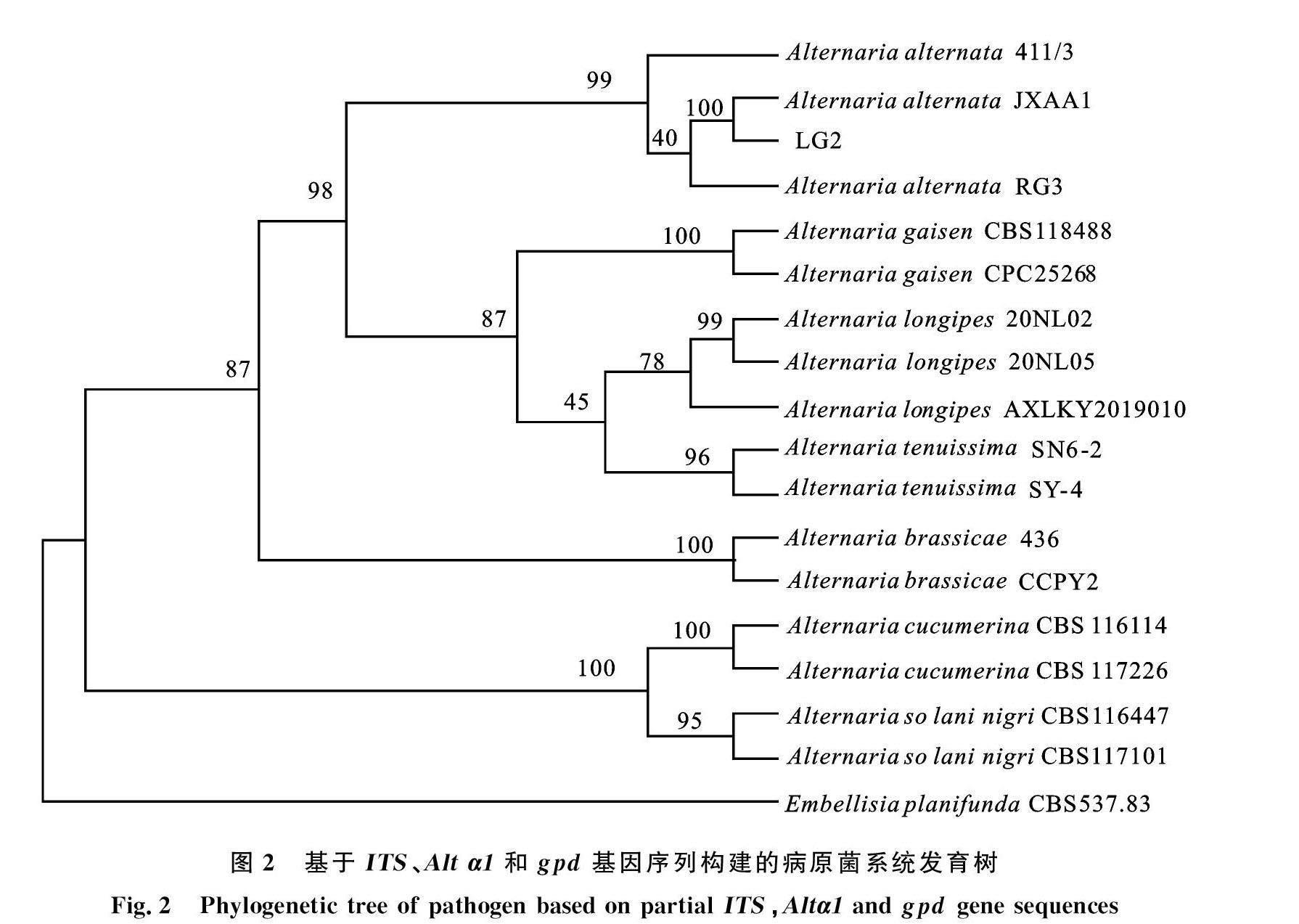
2.1.4 香樟黑斑病病原菌分子鉴定 通过 ITS、 Alta1和gdp 基因序列扩增与测序,获得大小分别为539、485和177 bp的基因片段,提交至NCBI,登录号分别为:OR187560 、OR227651和OR227652。通过与近源菌株比对,以E.planifunda为外群构建发育树,结果显示香樟黑斑病病菌菌株LG2与A.alternata JXAA1聚在同一分支上。结合形态学特征和分子生物学特性,将该菌株鉴定为互生链格孢A .alternata,如图2。
2.2 香樟黑斑病病原菌生物学特性研究
2.2.1 不同培养基对病原菌菌丝生长的影响 由表1可知,病菌LG2在PDA、NA、改良NA、玉米粉琼脂培养基和虎红琼脂培养基5种培养基上均能正常生长,其中在PDA培养基和改良的NA培养基生长得最好,菌落直径分别为8.63 cm和8.52 cm,差异不显著(P>0.05),菌丝体生长比较浓密旺盛;在玉米粉琼脂培养基、虎红琼脂培养基上生长略差,菌丝较为稀疏;在NA培养基上生长得菌落较小,菌丝稀疏,生长较差(表2)。
2.2.2 不同pH及温度对病原菌菌丝体生长的影响 由图3-A可知,病原菌菌丝在pH为 4.0~9.0均能生长,其中pH为6.0~8.0时生长较好,最适pH为6.5(图3-A)。病原菌菌丝在温度为10 ℃~40 ℃均能生长,25 ℃生长最好,为最适温度,超过35 ℃菌丝生长缓慢(图3-B)。研究还发现,病菌在4 ℃时也能缓慢生长,具有耐低温能力。
2.3 香樟黑斑病拮抗细菌生防特性研究
2.3.1 香樟叶片拮抗细菌的分离鉴定 叶片组织在NA培养基上培养48 h,发现6个组织块周围均有相似的细菌检出,对分布在其周围的其他杂菌有明显的抑制作用;土壤中分离得到的1株细菌对平板上周围的霉菌也有抑制作用。平板对峙试验表明土壤和叶片上分离得到的细菌对香樟叶片病原菌都有抑制效果,其中通过叶片组织分离得到的菌株B505对病原菌的抑菌圈最大,且对植物叶片没有致病作用,因此将菌株B505作为拮抗菌进行后续研究。菌株B505在改良NA培养基上呈乳白色,表面有褶皱凸起,直径3~6 mm,菌落边缘不规则(图4-A)。革兰氏阳性细菌(图4-B),杆状,大小为(0.5~0.6) μm ×(2.5~3.0) μm,有芽胞。经PCR扩增、测序和BLAST比对,菌株B505 16S rDNA序列长度为1 450 bp,与菌株Bacillus velezensis CBMB205(NR116240)同源性为99.65%。结合菌落形态和分子生物学鉴定,将菌株B505命名为贝莱斯芽胞杆菌 B.velezensis,Genbank登录号为ON834320。
2.3.2 拮抗细菌B505抑制香樟黑斑病菌菌丝生长的显微形态观察 菌株B505对香樟黑斑病菌的对峙效果如图4-D所示,图4-C为对照组病原菌菌落,对峙培养6 d,病菌的生长受到明显抑制,抑菌带宽度为8.0 mm,抑菌率为71%。显微镜观察菌丝的形态特征,正常菌丝呈竹节状、细胞不膨大(图4-E),受抑制的香樟黑斑病菌有隔菌丝呈藕节状,细胞畸形、膨大(图4-F)。
2.3.3 拮抗细菌B505对香樟黑斑病菌孢子萌发的抑制作用 由表3可知,菌株B505(浓度为1.0×107 CFU/mL)与香樟黑斑病菌孢子在液体培养基中共培养,香樟黑斑病菌孢子悬浮液的浓度为1.0×103~1.0×105 CFU/mL,其抑制率为60%~98%,且随着病菌孢子悬浮液浓度的增加,抑菌率降低。当B505和香樟黑斑病菌孢子比例为10 000∶1时,共培养时香樟黑斑病菌孢子萌发抑制作用最强,其抑制率高达98%。在链格孢悬浮液的浓度为1.0×103时与B505共培养,显微镜观察发现,多数分生孢子不萌发,部分仅形成短小的芽管,有的畸形甚至被裂解(图5-A,箭头所示)。对照组孢子正常萌发,一个孢子可以萌发形成多个菌丝,菌丝较长,无膨大现象(图5-B、5-C)。
2.3.4 离体叶片法测定B505对香樟黑斑病的防治效果 如图6所示,培养3 d,喷洒B505发酵液的试验组叶片形成小型的离散病斑(图6-A),接种香樟黑斑病菌孢子悬浮液(1.0×103 CFU/mL)的对照组,叶片形成黑色病斑(图6-D);培养7 d,试验组离散型病斑略有扩展(图6-B),而对照组病斑进一步扩大,颜色加深,病斑表面产生病症(绒毛状菌丝,镜检发现有链格孢菌孢子形成)(图6-E);培养11 d,处理组叶片病斑大小稳定,基本没有变化,病斑数量没有增加和扩展,叶片病变面积为10%(图6-C),对照组叶片离散的病斑大量增加,中心病斑进一步增大,叶片病变面积为22%(图6-F),拮抗菌B505对香樟叶片黑斑病的防治效果显著,抑菌率为55.6%。
3 讨 论
香樟在生长过程中易受真菌侵染引起叶部病害。目前,已经报道的香樟叶部真菌病害种类较多,主要有:由胶孢炭疽菌Colletotrichum gloeosporioides引起的炭疽病[31],由囊孢壳菌大茎点霉菌Macrophoma sp.引起的溃疡病[32],由白粉菌Erysiphaceae引起的白粉病[33],由煤炱目的煤炱菌Capnodium sp.引起的煤污病[34]等。本研究从香樟幼嫩叶片中分离获得1株链格孢属黑斑病菌,经鉴定命名为互隔交链孢菌Alternaria alternata。目前未有该病原菌引起香樟黑斑病的报道。病原菌菌丝和孢子悬浮液对香樟叶片的接种试验表明,幼嫩的叶片极易感染,但老叶因有较厚蜡质层保护感染能力较差。因此,应当在春季香樟嫩叶大量生长的时期进行香樟黑斑病的防治工作。
香樟叶部真菌病害的防治主要是通过喷施化学农药,化学防治会增加环境污染的风险,影响人类的健康[35]。生物防治可减少环境污染,促进植物生长,在植物病虫害防治中越来越受到人们的重视。生防细菌芽胞杆菌抗逆性极强,不污染环境,对植物病原真菌具有良好的抑制效果。贝莱斯芽胞杆菌是芽胞杆菌属的一个新种[36],研究表明贝莱斯芽胞杆菌对炭疽菌Colletotrichum spp.、葡萄座腔菌Botryosphaeria dothidea、链格孢菌Alternaria spp.、新拟盘多毛孢Neopestalotiopsis spp.和拟茎点霉菌Phomopsis sp.均具有拮抗效果[36],对苹果炭疽病[37]、稻瘟病[38]、草莓灰霉病[39]等也具有良好的生防效果。本研究中分离获得的贝莱斯芽胞杆菌B505对香樟黑斑病菌抑制效果显著。除此之外,对3种病原霉菌赤叶枯刺盘孢菌Colletotrichum gloeosporoides、小孢拟盘多毛孢Pestalotiopsis microspora、青霉菌Penicillium,1种致病细菌大肠杆菌Escherichia coli和1种生防菌球孢白僵菌Beauveria bassiana、2种大型真菌白耙齿菌Irpex lacleus、裂褶菌Schizophyllum commune 等均具有明显的抑制作用(未发表)。梁巧兰等[40]研究表明裂褶菌能引起花椒树腐朽病。白耙齿菌是白腐菌,容易造成木材的腐朽,分离的拮抗菌B505对白耙齿菌Irpex lacleus和裂褶菌Schizophyllum commune Franch有明显的抑制作用,因此未来可将该拮抗菌用于相关领域的病害防治。贝莱斯芽胞杆菌B505对球孢白僵菌有抑制作用,如果将该生防菌用于防治作物病害时,应避免与生防菌白僵菌、绿僵菌同时使用。
贝莱斯芽胞杆菌在生长和繁殖的过程中会产生一些具有抑菌活性的代谢产物[41]。Huang等[42]发现贝莱斯芽胞杆菌HYEB5-6代谢产物可能通过蛋白酶和葡聚糖酶来抑制病原真菌分生孢子萌发、芽管生长。本研究B505与香樟黑斑病菌对峙试验产生较宽的抑菌带,说明B505在生长的过程中可能在培养基表面或者内部分泌具有抑菌活性的代谢产物,从而抑制了香樟黑斑病菌菌丝的生长。B505发酵液可抑制香樟黑斑病菌孢子萌发和芽管的生长,降低香樟黑斑病的发病严重程度,进一步说明B505在生长繁殖过程中可能产生了抑菌次生代谢产物。下一步的研究工作将会采用基因组和代谢组学技术,筛选抑菌代谢产物,为进一步利用贝莱斯芽胞杆菌奠定基础。与此同时,本研究只在室内实验室条件下测定贝莱斯芽胞杆菌对香樟黑斑病具有拮抗效果,对香樟黑斑病田间防治效果尚未进一步研究,后续将会进一步测定B505对其田间的防病效应。
参考文献 Reference:
[1] ZHOU Y,YAN W.Conservation and applications of camphor tree(Cinnamomum camphora) in China:ethnobotany and genetic resources[J].Genetic Resources and Crop Evolution,2016,63:1049-1061.
[2] HYE JL,EUN A H,WEON J Y,et al.In vitro anti-inflammatory and anti-oxidative effect of Cinnammomum camphora extracts[J].Journal of Ethnopharmacology,2006,103:208-216.
[3] 褚衍亮,王 娜.樟树果红色素的稳定性及抗氧化活性研究[J].北方园艺,2010(12):44-47.
CHU Y L,WANG N.Study on stability and antioxidative activity of red pigment in fruit of Camphor tree[J].Northern Horticulture,2010(12):44-47.
[4] 郝临雨.紫苏籽及香樟精油的提取及活性研究[D].上海: 上海应用技术大学,2021.
HAO L Y.Study on extraction and activity of perilla seed and Cinnamomum camphora essential oils.[M.D.Dissertation].Shanghai:Shanghai Institute of Technology,2021.
[5] CHEN J,TANG C,ZHANG R,et al.Metabolomics analysis to evaluate the antibacterial activity of the essential oil from the leaves of Cinnamomum camphora(Linn.) Presl[J].Journal of Ethnopharmacology,2020,253:112652.
[6] 徐明珠,罗 欢,周志雄,等.香樟叶斑病病原菌的分离与鉴定[J].中国森林病虫,2017,36(4):21-25,28.
XU M ZH,LUO H,ZHOU ZH X,et al .Isolation and identification of the pathogen from the leaf spot disease on Cinnamomum camphora[J].Forest Pest and Disease,2017, 36(4):21-25,28.
[7] 孙玉萍.浅谈香樟常见病虫害及其防治技术要点[J].南方农业,2021,15(27):23-24.
SUN Y P.Common pests and diseases of Camphor and its control technical points[J].South China Agriculture,2021,15(27):23-24.
[8] 曹 晨,姚晶晶,李 婕,等.链格孢菌在支气管哮喘儿童中致敏特点分析[J].国际呼吸杂志,2022,42(16):1237-1241.
CAO CH,YAO J J,LI J,et al.Analysis of sensitization characteristics of A.alternata in children with bronchial asthma[J].International Journal of Respiration,2022, 42(16):1237-1241.
[9] LSERS,GREGORY L G,ZHANG Y,et al.Pulmonary ORMDL3 is critical for induction of Alternaria- induced allergic airways disease[J].The Journal of Allergy and Clinical Immunology,2017,139(5):1496.
[10] HATAMLEH A A,DANISH M,AL-DOSARY M A, et al.Physiological and oxidative stress responses of Solanum lycopersicum(L.)(tomato)when exposed to different chemical pesticides[J].RSC Advances,2022, 12(12):7237-7252.
[11] TALIBI I,ASKARNE L,BOUBAKER H,et al.Antifungal activity of Moroccan medicinal plants against citrus sour rot agent Geotrichum candidum[J].Letters in Applied Microbiology,2012,55(2):155-161.
[12] MILJAKOVID,MARINKOVI J,BALEEVI-TUBI S.The significance of Bacillus spp.in disease suppression and growth promotion of field and vegetable crops[J].Microorganisms,2020,8(7):1037.
[13] IMRANM,ABO-ELYOUSR K,MOUSA M,et al.A study on the synergetic effect of Bacillus amyloliquefaciens and dipotassium phosphate on A.solani causing early blight disease of tomato[J].European Journal of Plant Pathology,2022,162(1):63-77.
[14] MLLERT,BEHRENDT U.Exploiting the biocontrol potential of plant-associated pseudomonads- A step towards pesticide-free agriculture?[J].Biological Control,2021,155(1/2):104538.
[15] CHA J Y,HAN S,HONG H J,et al.Microbial and biochemical basis of a Fusarium wilt-suppressive soil[J].ISME Journal,2016,10(1):119-129.
[16] 李 颖,龙长梅,蒋 标,等.两株PGPR菌株的花生定殖及对根际细菌群落结构的影响[J].生物技术通报,2022,38(9):237-247.
LI Y,LONG CH M,JIANG B,et al.Colonization on the peanuts of two plant-growth promoting rhizobacteria strains and effects on the bacterial community structure of rhizosphere[J].Biotechnology Bulletin,2022,38(9):237-247.
[17] LINDOW S E,BRANDL M T.Microbiology of the Phyllosphere[J].Applied and Environmental Microbiology,2003,69(4):1875-1883.
[18] GU L K,BAI Z H,JIN B,et al.Assessing the impact of fungicide enostroburin application on bacterial community in wheat phyllosphere[J].Journal of Environmental Sciences,2010,22(1):134-141.
[19] ATTIA M S,EL-SAYYAD G S,ELKODOUS M A,et al.The effective antagonistic potential of plant growth-promoting rhizobacteria against Alternaria solani-causing early blight disease in tomato plant[J].Scientia Horticulturae,2020,266:1-14.
[20] JAYAKUMARA,KRISHNA A,MOHAN M,et al.Plant growth enhancement,disease resistance,and elemental modulatory effects of plant probiotic endophytic Bacillus sp.Fcl1[J].Probiotics Antimicrob Proteins,2019, 11(2):526-534.
[21] RABBEEMF,ALI MS,CHOI J,et al.Bacillus velezensis:A valuable member of bioactive molecules within plant microbiomes[J].Molecules,2019,24(6):1046.
[22] 胡党振,徐嫒媛,于梦怡,等.芽胞杆菌处理对柑桔苗木黄龙病抑制效果[J].中国农业大学学报,2021,26(8):72-83.
HU D ZH,XU Y Y,YU M Y,et al.Inhibitory effect of Bacillus treatment on citrus Huanglongbing disease in nursery growth plants[J].Journal of China Agriculture University,2021,26(8):72-83.
[23] 穆文强,康慎敏,李平兰.根际促生菌对植物的生长促进作用及机制研究进展[J].生命科学,2022,34(2) :118-127.
MU W Q,KANG SH M,LI P L.Advances in rhizosphere growth-promoting bacteriafunction on plant growth facilitation and their mechanisms[J].Chinese Bulletin of Life Science ,2022,34(2):118-127.
[24] 于静亚,董立坤,王志华,等.石楠叶霉病病原鉴定及对药物敏感性测定[J].植物病理学报,2017,47(4):440-447.
YU J Y,DONG L K,WANG ZH H,et al.Identification of pathogen for leaf spot disease of Photinia serrulata Lindl.and determination of its sensitivity to fungicides[J].Acta Phytopathologica Sinica,2017,47(4):440-447.
[25] 张天宇.中国真菌志(第16卷):链格孢属[M].北京:科学出版社,2003.
ZHANG T Y.Chinese fungi(Vol.16):Alternaria.[M].Beijing:Science Press,2003.
[26] 张宗斌,岳正波,吴景行,等.1株海洋产电菌 Shewanella XMS-1 的特性分析[J].环境工程.2021,39(1):33-39.
ZHANG Z B,YUE ZH B,WU J X,et al.Characterization of one strain of marine electrogenic Shewanella XMS-1[J].Environmental Engineering,2021,39(1):33-39.
[27] 严占勇,肖崇刚,易 龙,等. 防治辣椒疫病的芽胞菌株的筛选及其抑菌效果的测定[J].中国蔬菜,2005(6):18-20.
YAN ZH Y,XIAO CH G,YI L,et al.Screening test and inhibiting effect of spore bacterio to Phytophthora capsici[J].China Vegetables,2005(6):18-20.
[28] 刘思怡,杨春琳,曾 倩,等.雷竹丛枝病病原生物学特性及药剂防效试验[J].菌物学报,2022,41(11):1867-1888.
LIU S Y,YANG CH L,ZENG Q,et al.Biological characteristics and fungicidal control efficacy of the pathogens causing witches broom of Phyllostachys violascens[J].Mycosystema,2022,41(11):1867-188.
[29] 王彩霞,李兴红,魏艳敏,等.引起葡萄叶斑病的链格孢种类的初步鉴定[J].植物保护学报,2019,46(1):175-183.
WANG C X,LI X H,WEI Y M,et al.Identification of Alternaria species causing leaf spots in grapes[J].Journal of Plant Protection,2019,46(1):175-183.
[30] 郝卫宁,李 辉,胡美英,等.柑桔绿霉病拮抗细菌的筛选、鉴定及其抑制效果[J].中国生物防治学报,2011,27(2):284-288.
HAO W N,LI H,HU M Y,et al.Selection of antagonistic bacteria against citrus green mold and its inhibition activity on shatang mandarin fruit[J].Chinese Journal of Biological Control,2011,27(2):284-288.
[31] 王丽贞.芳香樟炭疽病的研究[D].福州:福建农林大学,2007.
WANG L ZH.Study on the anthracnose of Cinnamomum camphora var.linaloolifera Fujian[D].Fuzhou:Fujian Agriculture and Forestry University.2007.
[32] 宋结根.潜水河湿地公园香樟溃疡病调查及防治对策[J].吉林农业,2019(24):94-95.
SONG J G.Investigation and control countermeasures of camphor canker disease in Shuihe Wetland Park[J].Agricultureof Jilin,2019(24):94-95.
[33] KIRSCHNER R,LIU W A.Two new hosts of anamorphic Erysiphe quercicola:Cinnamomum camphora and Murraya paniculata Science Direct[J].Mycoscience,2014, 55(3):190-195.
[34] 徐勤明,何志堃.无锡市香樟煤污病和日本壶链蚧的危害情况分析[J].江苏林业科技,2017,44(5):32-34.
XU Q M,HE ZH K.Analysis on the harm of Camphor coal stain in Wuxi city and Asterococcus muratae Kuwana [J].Journal of Jiangsu Forestry Science & Technology,2017,44(5):32-34.
[35] 郭立勇.园林植物保护存在的问题及对策[J].现代园艺,2018(4):68.
GUO L Y.Problems and countermeasures of garden plant protection[J].Contemporary Horticulture,2018(4):68.
[36] 王 迪,高 岩,吴小双,等.两株贝莱斯芽胞杆菌鉴定及其对薄壳山核桃黑斑病病原菌的拮抗效果[J].中国生物防治学报,2022,38(6):1572-1581.
WANG D,GAO Y,WU X SH,et al.Identification of two strains of Bacillus velezensis isolated from Carya illinoensis leaf and their antagonistic effects on pecan black spot pathogen[J].Chinese Journal of Biological Control,2022,38(6):1572-1581.
[37] KIM Y S,LEE Y,CHEON W,et al.Characterization of Bacillus velezensis AK-0 as a biocontrol agent against apple bitter rot caused by Colletotrichum gloeosporioides[J].Scientific Reports,2021,11(1):626.
[38] 沙月霞,王 琦,李 燕.稻瘟病生防芽胞杆菌的筛选及防治效果[J].中国生物防治学报,2016,32(4):474-484.
SHA Y X,WANG Q,LI Y.Screening and prevention of Bacillus biocontrol against rice blast[J].Chinese Journal of Biological Contro,2016,32(4):474-484.
[39] 关一鸣,潘晓曦,王 莹,等.哈茨木霉菌、枯草芽孢杆菌对人参灰霉病和根腐病病原菌的拮抗作用[J].江苏农业科学,2014,42(5):123-124.
GUAN Y M,PAN X X,WANG Y,et al.Antagonistic effects of Trichoderma harziaum and Bacillus subtitis on pathogens of Botrytis cinerea and root rot of ginseng[J].Jiangsu Agricultural Sciences,2014,42(5):123-124.
[40] 梁巧兰,魏列新,徐秉良,等.花椒树腐朽病病原菌鉴定及其生防菌剂筛选[J].西北农业学报,2022,31(9):1211-1221.
LIANG Q L,WEI L X,XU B L,et al.Identification on pathogens of Zanthoxylum bungeanum decay disease and screening of its biocontrol fungicides[J].Acta Agriculturae Boreali-occidentalis Sinica,2022,31(9):1211-1221.
[41] TORAL L,RODRíGUEZ M,BéJAR V,et al.Crop protection against Botrytis cinerea by rhizhosphere biological control agent Bacillus velezensis XT1[J].Microorganisms,2020,8(7):992.
[42] HUANG L,LI Q C,HOU Y,et al.Bacillus velezensis strain HYEB5-6 as a potential biocontrol agent against anthracnose on Euonymus japonicus[J].Biocontrol Science and Technology,2017,27(5):636-653.
Isolation and Identification of Pathogen Causing Camphor
Black Spot Disease and Biocontrol Characteristics of Antagonistic Bacillus velezensis B505
ZHENG Aifang1,2,3,ZHANG Mingxue1,ZHOU Shuke1,GAO Ye1,SU Ziyan1 ,ZHANG Jiandong1,ZHANG Haoyu1 and SONG Xiaohe1,3
(1.College of Life Science,Anqing Normal University,Anqing Anhui 246133,China;2.Key Laboratory of
Biodiversity and Ecology Conservation in Southwest Anhui,Anqing Anhui 246133,China;
3.Research Center of Aquatic Organism Conservation and Water Ecosystem Restoration
in Anhui Province,Anqing Normal University,Anqing Anhui 246133,China)
Abstract This study aimed to identify the pathogen causing the black spot disease on Cinnamomum camphora and to investigate the potential biocontrol bacteria resources for the preventation and control of this disease.The pathogen was isolated and purified using the tissue isolation method.The pathogen was identified through the integration of colony,micromorphology,and ribosomal rDNA-ITS testing.This study also explored effects of physical and chemical factors,such as the medium,temperature,and pH on its growth.Bacteria with antagonistic properties against camphor black spots were screened using the plate confrontation method,and their antibacterial activity was tested.The results showed that the pathogen causing camphor black spots was Alternaria alternata.The optimum growth temperature,pH,and medium were 25 ℃,6.5,and potato dextrose agar,respectively.The Bacillus velezensis strain B505 was screened for its strong inhibitory effects on camphor black spots, achieved by suppressing both pathogen mycelial growth and spore germination.In vitro testing revealed a leaf black spot inhibition rate of 55.6% on Cinnamomum camphora,the above results provide a novel approach to the biological control of camphor leaf diseases.
Key words Camphor black spot disease; Fungal diseases; Isolation and identification; Bacillus velezensis; Antagonistic bacteria
Received 2023-03-16 Returned 2023-07-13
Foundation item Natural Science Research Project of Anhui University(No.KJ2019A0551); the Natural Science Foundation of Anhui Province(No.2008085MC105);Undergraduate Innovation and Entrepreneurship Training Program of Anhui Province(No.S202310372085);Open Fund of Key Laboratory of Biodiversity Ecology Conservation in Southwest Anhui(No.Wxn202308).
First author ZHENG Aifang,female,master,associate professor.Research area:environmental biology.E-mail:aifangzheng@126.com
Corresponding author SONG Xiaohe,female,Ph.D,associate professor,master supervisor.Research area:microbial resource development and utilization.E-mail:sxhapril@163.com
(责任编辑:史亚歌 Responsible editor:SHI Yage)

