三叶柄翅缨小蜂属(Lymaenon Walker)一雌雄同体新种记述(膜翅目:小蜂总科)
李金哲 胡红英 康宁 曹竹君 张述理

摘 要 昆虫在生长发育过程中常出现雌雄同体现象,但目前缨小蜂科暂无此类记载,本研究报道了采集自新疆高海拔地区——阿尔金山国家级自然保护区——的三叶柄翅缨小蜂属(Lymaenon Walker)一新种,根据采集地点命名为阿尔金山三叶柄翅缨小蜂(Lymaenon altun Li&Hu,sp.nov.),并对该种进行记述,附形态特征图。鉴别特征为:体黄褐色,齿端部淡红色;中单眼大;唇基中央具凸起;第四索节明显短;中胸盾片和小盾片具鳞片状刻纹;前翅长宽比小于3;后翅翅脉端部具2列纤毛。同时提供新种的ITS2和28S rDNA序列,为三叶柄翅缨小蜂属的分类鉴定提供分子数据。基于28S rDNA片段对新种及采自新疆高海拔地区三叶柄翅缨小蜂属的4种11条序列进行系统进化树分析,分子水平上新种与海滨三叶柄翅缨小蜂(Lymaenon litoralis)亲缘关系较近,基于气候环境因素初步探讨该个体雌雄同体现象的可能成因。
关键词 缨小蜂科;三叶柄翅缨小蜂属;形态分类;DNA条形码;雌雄同体
三叶柄翅缨小蜂属(Lymaenon Walker)隶属于膜翅目(Hymenoptera)小蜂总科(Chalcidoidea)缨小蜂科(Mymaridae),为世界广布属。其分类地位混乱,1834-1949年认为三叶柄翅缨小蜂属(Lymaenon)是柄翅缨小蜂属(Gonatocerus)的同物异名。在对柄翅缨小蜂属(Gonatocerus)进行分类研究时,根据前胸背板分三叶和后胸背板带状两个特征定立三叶柄翅缨小蜂种团(Litoralis-group)。2015年Huber将三叶柄翅缨小蜂种团重新归为属级水平,目前已记录172种,其中22种在中国分布[1]。该属的主要形态特征为:体中型,雌性触角索节7~8节,雄性鞭节11节,颜面具2条下触角沟,单眼具3根单眼毛,前胸背板分3叶,中胸气门大于前胸气门,后胸小盾片带状,并胸腹节中部具齿突,跗节5节,目前认为其主要寄生于大叶蝉科和角蝉科[2]。
昆虫的雌雄同体现象是指:生物体在基因型或表型上同时具备雄性和雌性特征的现象,目前对雌雄同体个体的判定主要以形态鉴定为依据。膜翅目中雌雄同体现象通常分为两侧对称、前后对称和嵌合型3种类型。目前此类形态异常个体出现的机制尚不完全清楚,通常归因于发育异常[3]。小蜂总科中雌雄同体现象最早的报道是由分类学家Taylor于1935年发现,他在实验室饲养的跳小蜂科花翅跳小蜂属(Microtery ishii Tachikawa)物种中,通过形态学鉴定发现了一只同时具有雌性触角和雄性外生殖器的标本,他认为该个体的出现与以亲代孤雌生殖为主、两性生殖为辅的生殖方式有关[4]。1963年Tachikawa汇总了Microtery ishii Tachikawa、Rhopus acaetes(Walker)、Anicetus ceroplastis Ishii、Tropidophryne melvillei Compere 4个跳小蜂科物种内的雌雄同体现象[5]。目前小蜂总科中榕小蜂科(Agaonidae)、小蜂科(Chalcididae)、金小蜂科(Pteromalidae)、赤眼蜂科(Trichogrammatidae)皆有雌雄同体个体报道[6-10]。但目前尚未有过缨小蜂科雌雄同体现象的报道,缨小蜂科形态异常个体(雌雄同体、雌雄嵌合体)的研究有待进一步深入。
新疆大学昆虫实验室在对新疆高海拔地区阿尔金山自然保护区寄生蜂资源调查过程中发现了首例缨小蜂科三叶柄翅缨小蜂属的雌雄同体个体。阿尔金山自然保护区位于“甘、青、新”三省交界处,且地处青藏高原西北边界 [11],其特殊的高原生态系统和高寒气候条件可能孕育了具有独特形态特征的个体。本文对新种:阿尔金山三叶柄翅缨小蜂(Lymaenon altun Li&Hu,sp.nov.)的雌雄同体个体进行了详细的形态描述,提供了相应的鉴别特征图;缨小蜂科因个体微小其主要鉴定方式目前以形态学结合分子手段为主,目前NCBI数据库中暂无三叶柄翅缨小蜂属ITS2、28S rDNA序列,因此本研究通过无损伤DNA提取法,PCR扩增得到新种的ITS2、28S rDNA序列,同时扩增了采集于新疆高寒环境地区的三叶柄翅缨小蜂属4个物种的28S rDNA序列,对得到的三叶柄翅缨小蜂属5种11条28S rDNA序列进行建树分析,序列上传至NCBI数据库,为三叶柄翅缨小蜂属的分类鉴定提供分子数据。基于气候环境因素等,初步探讨新种雌雄同体现象的成因,为缨小蜂科形态异常个体的生物学研究和机理探索奠定基础。
1 材料与方法
1.1 标本采集、制作和保存
在2020-2021年7月期间,通过网扫、黄盘和马氏网诱集对新疆高寒环境地区阿尔金山自然保护区和帕米尔高原地区缨小蜂科标本进行采集,共获得隶属于三叶柄翅缨小蜂属的标本5种46头,前期将标本置于装有无水乙醇的2 mL冻存管中,-20 ℃保存。将标本置于石英砂玻璃皿(直径8 cm)中,于NIKON SMZ25体式显微镜下拍照测量,图片处理工具为Adobe Photoshop CS5。
对新种及种群数量较多的物种选取形态较好的个体进行DNA提取后制作为玻片标本,主要采用中性树脂封片法,改进部分为:无损伤提取DNA后不必解离,用蒸馏水冲洗2次后,无水乙醇脱水5 min,随后吸除酒精,放置1 min待酒精完全干燥,直接取虫体置于载玻片上,加入1滴丁香油和中性树胶混合物后解剖和整姿,47 ℃静待5 min盖片,烘箱55 ℃烘干7 d。按照地点、种名和性别特征进行标记装盒保存。
玻片标本目前保存于新疆大学生命科学与技术学院昆虫标本馆(ICXU)。新种形态学描述术语中缩略词包括:F1~F8为雌性触角第一至第八索节,fl1~fl11为雄性触角第一至十一鞭节。
1.2 DNA提取和基因片段PCR扩增及测序
1.2.1 基因组 DNA的提取 采用无损伤DNA提取方法,在体视显微镜下提前将缨小蜂标本放置于1.5 mL离心管中,加入无水乙醇,-20 ℃冷冻过夜。PBS缓冲液快速清洗2次后,蒸馏水清洗1次,在滤纸上晾干后转移至新的1.5 mL离心管中。主要根据TIANamp Genomic DNA kit试剂盒方法提取基因组DNA,操作过程改进部分为:将蛋白酶K和Buffer AEL加入装有虫体的1.5 mL离心管后应延长56 ℃水浴时间至5 h,冷抽提,即冷冻过夜后70 ℃10 min水浴,后期将溶液转移至纯化柱时也应在56 ℃进行从而保证DNA更好的与吸附膜结合。将得到的DNA模板溶液于-20 ℃保存,备用。
1.2.2 PCR扩增及测序 PCR扩增引物由生工生物工程(上海)有限公司合成,ITS2引物为ITS2F:ATTCCCGGACCACGCCTGGCTGA,ITS2R:TCCTCCGCTTATTGATATGC;28S rDNA引物为D23551 F:CGTGTTGCTTGATAGTGCAGC,D2-4057 R:TCAAGACGGGTCCTGAAAGT。扩增体系总体积为25 μL,包括:2×PCR Master Mix 12.5 μL、上下游引物各0.5 μL(10 μmol·L-1)、DNA模板5 μL、ddH2O 6.5 μL。
ITS2基因的反应程序:95 ℃预变性5 min;94 ℃变性50 s;52~55 ℃梯度退火50 s、72 ℃延伸50 s循环35次;循环结束后72 ℃延伸10 min;降温至4 ℃结束。28S rDNA基因的反应程序同 ITS2。两组扩增产物以3 mL点样,1% 琼脂糖凝胶(Spanish)120 V电压下进行30 min电泳,DNA maker为2 000 u。凝胶成像仪下观察电泳结果, ITS2和28S rDNA出现明亮的目的条带,委托生工生物公司进行双向测序。
2 结果与分析
2.1 新种——阿尔金山三叶柄翅缨小蜂(Lymaenon altun Li&Hu,sp.nov.)
鉴别特征:体黄褐色;三角片上半部分浅黄色,下半部分为棕色;齿端部淡红色;中单眼大,唇基中央具凸起,触角F4节明显短于F1和F2节,棒节具8个条形感受器;中胸盾片和小盾片具鳞片状刻纹,并胸腹节左右侧叶各具3根刚毛,中叶纤毛散乱排布;中躯与后躯近等长;前翅翅面密布纤毛,无裸区,翅长宽比小于3;翅脉短;斜毛列延伸至翅面3/4,与翅后缘平行;后翅基部具2列刚毛,翅面后1/2纤毛较密。
物种描述:正模:体长为1.27 mm。体大部分黄褐色,但头部以头顶横脊为分界,上方为浅褐色,下方淡黄色,齿端部淡红色,触角基节、柄节、梗节淡黄色,柄节、梗节背面观边缘为棕色,索节棕色,左右触角鞭节和索节各节上具4条条形感受器;前胸背板及侧板浅黄色;中胸褐色至深褐色,三角片上半部分浅黄色下半部分为棕色;前翅透明;足包括基节在内大部分呈淡黄色,后足胫节及腿节后2/3部分棕色,端跗节及爪棕色;后躯柄后腹前三节淡黄色,其余为浅棕色至棕色(图1-A)。
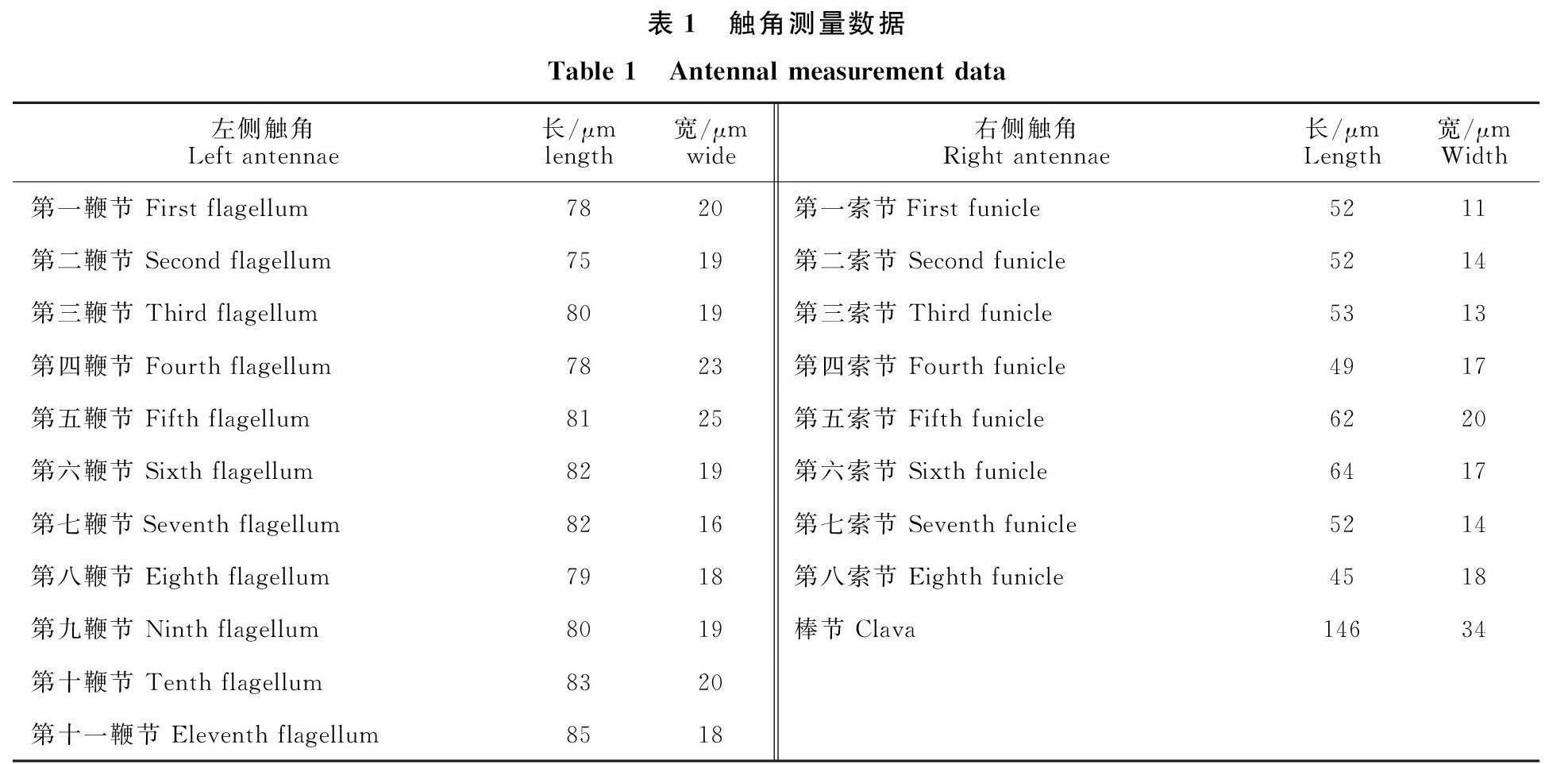
头部光滑不具刻纹(图1-B),正面观近正方形,侧面观近三角形,头宽为高的0.96倍(213∶221),为额宽的1.03倍(213∶206);单眼具3根单眼毛,中单眼大;触角窝宽度为其距横小梁的0.57(19∶33);复眼椭圆形,高为颚眼距的1.72倍(131∶76);唇基中央具凸起,上颚短左右各具3齿,左右齿不交叉,端部尖锐;触角具支角突,基节柄节不愈合;触角异型(图1-C、图1-D);左侧触角13节,呈雄性形态,鞭节11节,基节长为柄节的0.5倍(40∶80),柄节长为宽的2.66倍(80∶30),梗节椭圆形较右侧梗节短,长为宽的1.35倍 (38∶28),各鞭节长度相近,fl2最短,fl11相对较长;右侧触角11节,呈雌性形态,其中索节8节、棒节1节,基节与柄节分离,长为柄节的0.60倍(56∶94),柄节纺锤形明显宽于左侧,为左侧的1.43倍(43:30),长为宽的2.18倍(94∶43),梗节长为宽的2.65倍(53∶20),索节F8稍短于其他索节,F5、F6最长,其余各索节近等长,F5最宽,棒节长为宽的4.29倍(146∶34),稍长于F7与F8的总长(表1),具8个条形感受器。
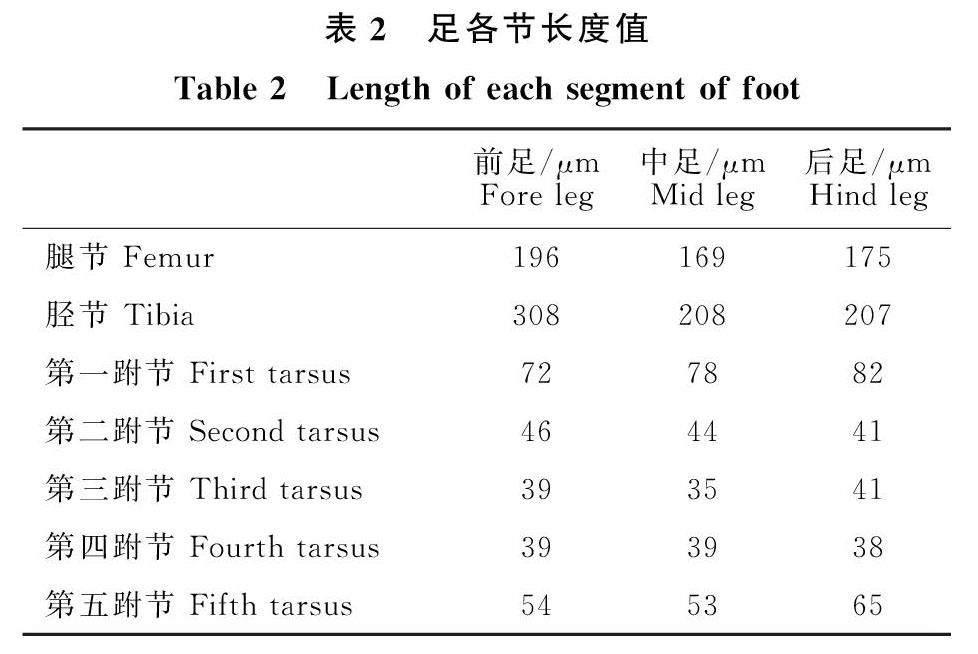
中躯:中躯与后躯近等长,前胸背板分为三叶,左右侧叶各具2根刚毛;中胸盾纵沟明显,附近具1对刚毛,中胸盾片中叶和小盾片具鳞片状刻纹(图1-E);中胸盾片中叶长于小盾片,为并胸腹节长的2.07倍(143∶69);小盾片分前后两叶,前小盾片远宽于后小盾片;后胸背板带状,后胸小盾片为长方形,长为宽的5.73(109∶19)倍;并胸腹节具倒v形亚中脊,分三叶,中叶具散乱排布的粗壮刚毛,左右侧叶各具3个刚毛。前翅宽,长为宽的2.91倍(1999∶685),翅面密布纤毛无裸区,从缘脉端部开始具一斜毛列延伸至翅面的2/3(图1-F);翅脉长为翅长的0.29倍(599∶1999),痣脉具3个钟形感受器(图1-J);最长缘毛为翅宽的0.29倍。后翅长为宽的17.9倍,翅前缘具2列纤毛,后缘具1列纤毛,翅后1/2具2列纤毛;最长缘毛为翅宽的11.19倍。后翅翅脉上具2列浓密的纤毛(图1-G),翅脉端部着生三根弯曲的纤毛(图1-H)。前足基节具细纵纹(图1-K),中足胫节具一距,分2叉,前中后足各节长度比例如下(表2)。
后躯:腹柄节短,长为宽的0.67倍,连接至柄后腹腹面,与第三腹节相连,阳茎从腹部第4节伸出,长为中足胫节的0.56倍,阳茎内突长为阳茎的0.52倍,阳茎基侧突与钩爪相接处左右各具1列刚毛(图1-I)。
检视标本:正模:雌雄同体,新疆阿尔金山国家级自然保护区老头山西北方1 km(黄盘诱集于高山荒漠,主要植被:高山野决明、苔草),N:36°56′25.86″,E:90°16′48.24″,海拔:4 052.62 m,2021.VII.21,胡红英团队采集。
生物学:未知。
分布:中国新疆(若羌县)。
词源:新种种名取自采集地阿尔金山。
讨论:新种整体体长及体色特征与奥里斯三叶柄翅缨小蜂(L.aureus)相似,但新种棒节具8个条形感受器,而奥里斯三叶柄翅缨小蜂(L.aureus)具6个条形感受器;此外,奥里斯三叶柄翅缨小蜂(L.aureus)前翅末端明显斜圆,翅面明显窄于新种;与哈尔里三叶柄翅缨小蜂(L.karlik)相比虽然棒节都具8个条形感受器,且前翅宽密布纤毛,翅脉短,但新种F7节不具条形感受器。新种头部近正方形,头宽和头高近等长,但哈尔里三叶柄翅缨小蜂(L.karlik)头部正面观近三角形;新种中胸盾片中叶与小盾片上具明显的鳞片状刻纹。
2.2 ITS2和28S rDNA片段的PCR扩增结果
测序得到的所有序列均上传至NCBI数据库,其中阿尔金山三叶柄翅缨小蜂(L.altun Li&Hu,sp.nov.)的 ITS2基因片段为687 bp(登陆号:OP758552)及28S rDNA基因片段为559 bp(登陆号:OP748247), ITS2各碱基含量分别A:25.2%,T:21.1%,G:22.9%,C:30.6%;28S rDNA各碱基含量分别A:25.5%,T:22.6%,G:22.6%,C:29.4%。此外获得海滨三叶柄翅缨小蜂(L.litoralis)的28S rDNA基因片段3条(登录号:OQ130050、OQ130052、OQ130059);哥萨克三叶柄翅缨小蜂(L.kazak)的28S rDNA基因 片段3条(登录号:OQ130055、OQ130057、OQ130058);哈尔里三叶柄翅缨小蜂(L.karlik)的28S rDNA基因片段1条(登录号:OQ130051);奥里斯三叶柄翅缨小蜂(L.aureus)的28S rDNA基因片段3条(登录号:OQ130053、OQ130054、OQ130056)。
2.3 基于28S rDNA基因的系统发育分析
基于MEGA 7.0软件计算遗传距离,以登录号代表各序列建立表格,得到哥萨克三叶柄翅缨小蜂(L.kazak)的种内遗传距离为0.00;奥里斯三叶柄翅缨小蜂(L.aureus)和海滨三叶柄翅缨小蜂(L.litoralis)的种内遗传距离均为0.01,种间最小遗传距离为0.02。新种从形态学上与其余4种有明显区分,从遗传距离上判断,其与其他各种的遗传距离均远大于0.02,与海滨三叶柄翅缨小蜂(L.litoralis)亲缘关系最近,种间遗传距离为0.05 (表3)。
利用最大似然法(ML)和邻接法(NJ)对新种与获得的三叶柄缨小蜂属4种的10条28S rDNA序列,分别构建系统发育树,选定新带柄翅缨小蜂(Gonatocerus novifasciatus Girault)1911的28S rDNA基因序列(AY953534.1)为外群,结果显示两种方法建树拓扑结构一致(图2,图3)。哈尔里三叶柄翅缨小蜂(L.karlik)与海滨三叶柄翅缨小蜂(L.litoralis)为近缘物种,阿尔金山三叶柄翅缨小蜂(L.altun Li&Hu,sp.nov.)与海滨三叶柄翅缨小蜂(L.litoralis)及哈尔里三叶柄翅缨小蜂(L.karlik)聚为一大分支,同属于三叶柄翅缨小蜂属(Lymaenon)。
3 讨 论
本文记述的三叶柄翅缨小蜂属新种:阿尔金山三叶柄翅缨小蜂(L.altun Li&Hu,sp.nov.)的雌雄同体个体,为缨小蜂科首次记录。在新疆高寒地区(阿尔金山自然保护区、帕米尔高原地区)的采样过程中,共获得隶属于三叶柄翅缨小蜂属的5种46头标本,其余4种分别为哈尔里三叶柄翅缨小蜂(L.karlik)、哥萨克三叶柄翅缨小蜂(L.kazak)、海滨三叶柄翅缨小蜂[L.litoralis (Haliday,1833)]、奥里斯三叶柄翅缨小蜂[L.aureus (Girault,1911)],但目前仅获得一只雌雄同体个体,这说明即使在极端环境下雌雄同体现象也是很罕见的。
目前,对膜翅目昆虫雌雄同体现象的形成原理共有3种猜想,一是与内共生体沃尔巴克氏体(Wolbachia)相关 [12]。一般可通过分子手段,特异性扩增沃尔巴氏体wsp基因片段,通过设置阳性对照检验昆虫是否感染沃尔巴克氏体[13-14]。本研究参考赵紫苗等[15]的方法对阿尔金山的雌雄个体基因组DNA进行了wsp基因片段扩增,电泳结果显示未得到相应的wsp明亮条带,但因目前获得标本量有限,试验结果具有一定人为因素干扰,阿尔金山雌雄同体个体的成因是否与沃尔巴氏体有关仍需进一步探讨。二是减数分裂时期发育异常导致,可能情况包括:卵子仅单核受精;多精子效应,即胚胎发育受多个精细胞影响,在受精过程中,一个精子使卵子受精,而另一个精子的细胞核在胚胎中产生单倍体细胞从而影响胚胎性别发育;二倍体胚胎中产生单倍体细胞;单倍体胚胎产生二倍体细胞;性染色体意外缺失或性染色体部分基因片段缺失[16]。三为环境因素,如Pereira在对榕小蜂雌雄同体现象成因的探讨中提出低温可能导致了昆虫的发育异常[17],Albert认为产卵温度影响金小蜂科雌雄同体个体产生的概率[18],阿尔金山自然保护区气候严寒干燥,且采集地为高海拔低氧地区,这种独特的气候环境可能是导致发育异常个体出现的原因之一,但目前仍需要更多的研究来阐明导致缨小蜂雌雄同体个体出现的因素。
致谢:本研究的顺利开展得益于巴音郭楞蒙古自治州阿尔金山国家级自然保护区管理局的鼎力支持,特此感谢!
参考文献 Reference:
[1] AISHAN Z,TRIAPITSYN S V,HU H Y.A review of the Chinese species of Lymaenon(Hymenoptera:Mymaridae),with description of six new species [J].Zootaxa,2020,4834(4).https://doi.org/10.11646/zootaxa.4834.4.5
[2]HUBER J T.World reclassification of the Gonatocerus group of genera(Hymenoptera:Mymaridae)[J].Zootaxa,2015,3967(1):1-184.
[3]WCISLO W T,GONZALEZ V H,ARNESON L.A review of deviant phenotypes in bees in relation to brood parasitism,and a gynandromorph of Megalopta genalis(Hymenoptera:Halictidae) [J].Journal of Natural History,2004,38(11):1443-1457.
[4]TAYLOR T H C.The campaign against Aspidiotus destructor,Sign.,in Fiji [J].Bulletin of Entomological Research,1935,26(1):1-102.
[5]TACHIKAWA T.Revisional studies on the Encyrtidae of Japan(Hymenoptera:Chalcidoidea) [J].Memoirs of the Ehime University. Section VI,1963,9:1-264.
[6]HALSTEAD J A.A gynandromorph of Hockeria rubra (ASHMEAD)(Hymenoptera:Chalcididae) [J].Proceedings of the Entomological Society of Washington,1988,90(2):258-259.
[7]PEREIRA R A S,PRADO A P,KJELLBERG F.Gynandromorphism in pollinating fig wasps(Hymenoptera:Agaonidae) [J].Entomol News,2003,114(3):152-155.
[8]BEUKEBOOM L W,KAMPING A.No patrigenes required for femaleness in the haplodiploid wasp Nasonia vitripennis [J].Genetics,2006,172(2):981-989.
[9]TULGETSKE G M,STOUTHAMER R.Characterization of intersex production in Trichogramma kaykai infected with parthenogenesis-inducing Wolbachia [J].Naturwissenschaften,2012,99(2):143-152.
[10] LEUNG K.Polyploidy and host specificity genetics in Nasonia parasitoid wasps[D/OL].The Kingdom of the Netherlands, Groningen:University of Groningen,2020[2023-01-02].https://doi.org/10.33612/diss.134432017
[11]高 浩,潘学标,符 瑜.气候变化对内蒙古中部草原气候生产潜力的影响[J].中国农业气象,2009,30(3):277-282,288.
GAO H,PAN X B,FU Y.Influence of climate change on potential climate productivity in grassland of central Inner Mongolia[J].Chinese Journal of Agrometeorology,2009,30(3):277-282,288.
[12]SERBUS L R,CASPER-LINDLEY C,LANDMANN F, et al.The genetics and cell biology of Wolbachia-host interactions [J].Annual Review of Genetics,2008,42:683-707.
[13]BRAIG H R,ZHOW W,DOBSON S L,et al.Cloning and characterization of a gene encoding the major surface protein of the bacterial endosymbiont Wolbachia pipientis [J].Journal of Bacteriology,1998,180(9):2373-2378.
[14]SIMES P M,MIALDEA G,REISS D,et al.Wolbachia detection:an assessment of standard PCR protocols [J].Molecular Ecology Resources,2011,11(3):567-572.
[15]赵紫苗,方 洁,沈 利,等.影响系统发育分析的昆虫共生菌Wolbachia筛查及分型方法[DB/OL].Bio-101 e1010611.[2023-01-02]. https://bio-protocol.org/pdf/bio-protocol1010611.pdf
ZHAO Z M,FANG J,SHEN L,et al.Screening and typing of symbiotic Wolbachia that affects insect phylogenetic analysis[DB/OL].Bio-101 e1010611.[2023-01-02].https://bio-protocol.org/pdf/bio-protocol1010611.pdf
[16]PEREIRA R,NARITA S,KAGEYAMA D,et al.Gynandromorphs and intersexes:potential to understand the mechanism of sex determination in arthropods [J].Terrestrial Arthropod Reviews,2010,3(1):63-96.
[17]PEREIRA R A S,PRADO A P,KJELLBERG F.Gynandromorphism in pollinating fig wasps(Hymenoptera:Agaonidae) [J].Entomol News,2003,114(3):152-155.
[18] KAMPING A,KATJU V,BEUKEBOOM L W,et al.Inheritance of gynandromorphism in the parasitic wasp Nasonia vitripennis [J].Genetics,2007,175(3):1321-1333.
Description of a New Hermaphrodite Species of Lymaenon Walker (Hymenoptera:Chalcidoidea)
LI Jinzhe,HU Hongying,KANG Ning,CAO Zhujun and ZHANG Shuli
(College of Life Science and Technology,Xinjiang University,Xinjiang Key Laboratory of
Biological Resources and Genetic Engineering,Urumqi 830046,China)
Abstract Insects often exhibit hermaphroditic phenomenon during their growth and development.however,no such occurrence has been documented in Mymaridae.This paper presents a new species of genus Lymaenon Walker, named as Lymaenon altun Li&Hu,sp.nov,collected from the alpine region of Altun Mountain National Nature Reserve.The morphological characteristics of the hermaphrodite were described in detail.The photographs of the type specimen were also provided.Distinguished features included a body coloration of yellowish-brown with light red toothed ends,large medium ocelli,a produced margin in the middle part of the clypeus,and an obviously short fourth funicle segment of the antennae.The mesoscutum and scutellum exhibit scaly sculpture.The forewing is less than 3 times as long as it is broad.The end of the hind wing vein has 2 rows of cilia.At the same time, ITS2 and 28S rDNA sequences of the new species were acquired and deposited in NCBI database,These molecular data contribute to the classification and identification of the genus.The results of phylogenetic tree analysis,conducted on the basis of the 28S rDNA gene fragment from the new species and 11 sequences of 4 Lymaenon species collected from Xinjiang alpine area,show that the new species is closely related to Lymaenon litoralis.The possible causes of the gynandromorph were discussed with reference to climate and environmental factors.
Key words Mymaridae; Lymaenon; Morphological classification; DNA barcoding; Gynandromorph
Received 2023-01-02 Returned 2023-02-15
Foundation item The National Natural Science Foundation of China (No.31860612,32070472).
First author LI Jinzhe,female,master student.Research area:entomology.E-mail:1683117848@qq.com
Corresponding author HU Hongying,female,professor,doctoral supervisor.Research area:biological control,entomological taxonomy.E-mail:huhongying@xju.edu.cn
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

