海藻酸寡糖诱导黄瓜抗灰霉病效果及其机理研究
董梓慧 马青
摘 要 为了研究海藻酸寡糖对黄瓜灰霉病的防治效果及诱导抗病机理,以黄瓜感病品种3叶期植株为试材,通过盆栽试验、酶活测定法和实时荧光定量,测定接菌后0~48 h内,黄瓜叶片的防御相关酶活性[超氧化物歧化酶(SOD)活性、氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)活性、氧化物酶(POD)活性]和信号转导途径关键基因表达量(茉莉酸途径关键基因 JAR1和 EIN2;水杨酸途径关键基因 NPR1和 PR1)。结果表明:①海藻酸寡糖的最佳诱导浓度为50 mg/L,诱导时间为3 d,防效可达66.75%;②防御相关酶的活性均显著提高;③水杨酸途径关键基因 NPR1和 PR1相对表达量均上调。可见海藻酸寡糖通过激发水杨酸信号转导,提高植株体内防御相关酶活,增加植株抗病性。
关键词 海藻酸寡糖;诱导抗病性;信号转导途径;防御相关酶活
灰霉病是设施黄瓜的重要病害,也是世界性重要病害。黄瓜灰霉病具有流行性强,再侵染频率高等特点。全国各地受到不同程度的危害,一般年份可减产10%~20%,严重时损失可达50%[1],可危害黄瓜的茎、叶、花和果实,严重影响黄瓜的产量和品质,造成巨大的经济损失。黄瓜灰霉病是典型低温高湿性病害,病害发生的最适条件为外界环境温度为20 ℃,湿度大于90%[2]。
目前,黄瓜灰霉病的防治主要依靠化学药剂,虽然能快速有效地达到防治病害目的,但是随着化学农药长期大量使用,易使病原菌产生耐药性,造成病害再猖獗,污染农产品及环境残毒超标等一系列问题。而生物制剂具有保护生态平衡、不易产生抗性、安全天然和易分解等优点,是理想的化学药剂替代品[3-4]。
因此,筛选出具有良好诱导防效的生物制剂是目前替代化学农药,防治病害大发生,保证可持续发展的有效措施。海藻酸寡糖具有较好的水溶性、吸收性和激发子活性和较强的应用潜力,能够克服化学防治带来的副作用,如刘同梅[5]在研究中发现用50 mg/L海藻酸寡糖处理烟草感病品种,处理组防御相关酶活显著提升,水杨酸途径关键基因过表达,水杨酸含量增加,烟草的诱导抗病性显著提升[5];在干旱胁迫下,用海藻酸寡糖处理青菜,发现其体内的脯氨酸和丙二醛含量显著增加,抗氧化酶活性显著增强[6];但其在诱导黄瓜抗灰霉病方面罕见报道。
1 材料与方法
1.1 试验材料
病原菌:黄瓜灰霉病菌(Botrytis cinerea)由西北农林科技大学植物病害综合治理实验室 提供。
培养基:马铃薯葡萄糖琼脂培养基(PDA)、羧甲基纤维素培养基(CMC)供试品种:选用‘中农6号,种子在无菌水中 3~4 d,选取发芽一致的种子播种于大小一致的花盆中,待长出3片真叶时进行试验。
供试药剂:海藻酸寡糖由大连化工研究所提供,用无菌水配制成母液,稀释成不同浓度目标 试剂。
1.2 试验方法
1.2.1 海藻酸寡糖盆栽试验 确定最适诱导浓度试验:选取生长良好、长势一致3叶期的黄瓜植株,称取供试诱导剂用无菌水配成25 mg/L母液,再将母液按比例配制成目标浓度,将药液喷施于植株第2片真叶叶部表面,直至叶片完全湿润,自然晾干。以清水为空白对照。待处理1 d后,接种位置如图1所示,在黄瓜植株第1片真叶、第2片真叶和第3片真叶上,分别接种2~3个灰霉菌菌饼,23 ℃、95%湿度条件下培养3 d后测量病斑直径,计算病斑面积和诱导防效。每个处理10个植株,3次生物学重复[7-8]。
确定最佳诱导时间:选取生长良好、长势一致的3叶期的黄瓜植株,用最适诱导浓度的供试诱导剂喷施于植株第2片真叶叶部表面,直至叶片完全湿润,自然晾干。以无菌水为空白对照。待处理不同时间后,在黄瓜植株第1片真叶、第2片真叶和第3片真叶上,分别接种2~3个灰霉菌菌饼,23 ℃、90%湿度条件下培养,3 d后测量第1片真叶、第2片真叶和第3片真叶的病斑直径,计算病斑面积和防治效果。每个处理10个植株, 3次生物学重复。
1.2.2 测定防御酶活性 植株的处理:选取长势一致的3叶期黄瓜植株,将海藻酸寡糖(50 mg/L)喷施于黄瓜第2片真叶,直至叶片完全湿润,自然晾干。以无菌水为空白对照。待处理3 d后,在黄瓜植株第1片真叶、第2片真叶和第3片真叶上,分别接种2~3个灰霉菌菌饼,23 ℃、95%湿度条件下培养,采集接菌后0 h、6 h、12 h、24 h和48 h的植株叶片,叶片采集后立即用锡箔纸包被,置于液氮中迅速冷冻,保存于-80 ℃冰箱。采用邻苯三酚法测定超氧化物歧化酶(SOD)活性、紫外线吸收法测定氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)活性、比色法测定氧化物酶(POD)活性。
1.2.3 抗病相关基因的实时定量分析 试验参照“1.2.2”中采样方法,采用Trizol法提取黄瓜叶片总RNA,使用TaKaRa的Prime Script TMII 1st Strand cDNA Synthesis Kit,对RNA进行反转录,将待测cDNA置于-20 ℃保存。从葫芦科作物基因组数据库里获得病程相关蛋白(Pathogenesis related protein,PR蛋白)基因和信号转导途径相关基因的完整mRNA序列,利用软件Primer premier 5.0设计用于qRT-PCR的引物。引物长度为15~30 bp,获得产物长度为80~200 bp,由上海生工合成。以待测cDNA为模板,采用20 μL体系,三步法,以黄瓜actin为内参基因进行实时荧光定量PCR。加样过程需在冰上进行。每个样品设置3个生物学重复。
1.3 数据分析
用Excel 2019处理数据,利用2-ΔΔt的计算方法,IBM SPSS Statistics软件进行差异性分析,Graph Pad Prism 8作图。
2 结果与分析
2.1 海藻酸寡糖的最适诱导浓度
经不同浓度海藻酸寡糖处理植株第2片真叶24 h后,接种病原菌。结果如表1所示,处理组的病斑面积与对照组具有显著差异。说明海藻酸寡糖能够诱导黄瓜激活抗病系统。但海藻酸寡糖是否能够激活黄瓜系统诱导抗病性,还需进一步证明。如表2所示,在同一植株上,未经海藻酸寡糖处理的第1片真叶和第2片真叶,接种病原菌后,处理组的病斑面积与对照组亦具有显著差异,说明海藻酸寡糖能够激活黄瓜系统诱导抗病性。且表1和表2结果表明,浓度为50 mg/L时的防治效果好,说明海藻酸寡糖的最适诱导浓度为50 mg/L。
2.2 海藻酸寡糖最佳诱导时间
诱导剂作用方式与化学农药不同,具有迟滞性,即植物经诱导剂刺激后产生免疫应答需要一定的时间,不同植物面对不同诱导物所产生免疫应答所需时间不同。因此,在确定诱导剂最适诱导浓度的基础上,设置时间梯度,确定最佳诱导时间。经50 mg/L海藻酸寡糖处理1~5 d后,接种病原菌,结果如表3和表4所示:植株的第2片真叶经海藻酸寡糖处理3 d后,其诱导防效最高,可达66.75%。同时与其同一植株上未经处理的第1、第3片真叶的诱导防效也在同一诱导时间内最高,分别达21.67%和44.48%。说明在该诱导时间下,海藻酸寡糖的系统抗病作用最好。
2.3 海藻酸寡糖诱导抗病性机理的研究
对PAL活性的影响:在接菌后,经诱导剂处理的第2片真叶的PAL活性如图2-A所示,其叶内的PAL活性在接菌6 h时达到峰值,为240.51 U/(g·h),与对照组有显著差异。与其同一植株上未经诱导剂处理的第1、3片真叶中PAL活性如图2-B和2-C所示,PAL活性均在接菌6 h达到峰值,分别为172.35 U/(g·h)、225.68 U/(g·h),说明植株体内的PAL经海藻酸寡糖诱导后活性增强。
对CAT活性的影响:同一植株上处理叶与未处理叶中的CAT活性如图3-A所示,在接菌后6 h,处理组第2片真叶的CAT活性达到峰值,为12.50 U/(g·h),与对照组之间有显著差异。同时,未处理叶中CAT活性如图3-B和3-C所示,第1、第3片真叶的CAT活性分别在接菌后12 h、6 h时,达到峰值,分别为7.64 U/(g·h)和10.29 U/(g·h),与对照组之间有显著差异。说明植株体内的CAT经海藻酸寡糖诱导后活性增强。
对SOD活性的影响:接种后植株内SOD活性随时间变化如图4-A、4-B、4-C所示,其中处理叶第2片真叶SOD活性在接菌后12 h达到峰值,为100.34 U/(g·h)。而未处理叶第1、第3片真叶SOD活性分别在12 h、24 h达到峰值,分别为89.95 U/(g·h)和92.24 U/(g·h)。说明植株体内的SOD经海藻酸寡糖诱导后活性增强。
对POD活性的影响:根据标准曲线y= 0.031 4x-0.029 1,R2=0.999 3,测得POD酶活性如图5所示,植株处理叶第2片真叶与未处理叶第1、第3片真叶,同时在接种24 h后POD活性达到峰值,分别为17.94 U/(g·min)、14.04 U/(g·min)和17 U/(g·min)。其中未处理叶第1片真叶POD活性与对照组没有显著差异,这与植物级性运输有关,说明海藻酸寡糖是能够通过局部诱导,激发黄瓜整体的POD活性,但位于处理叶下部叶片的系统诱导抗病性低于上部叶片。
2.4 对相关防卫基因表达量的影响
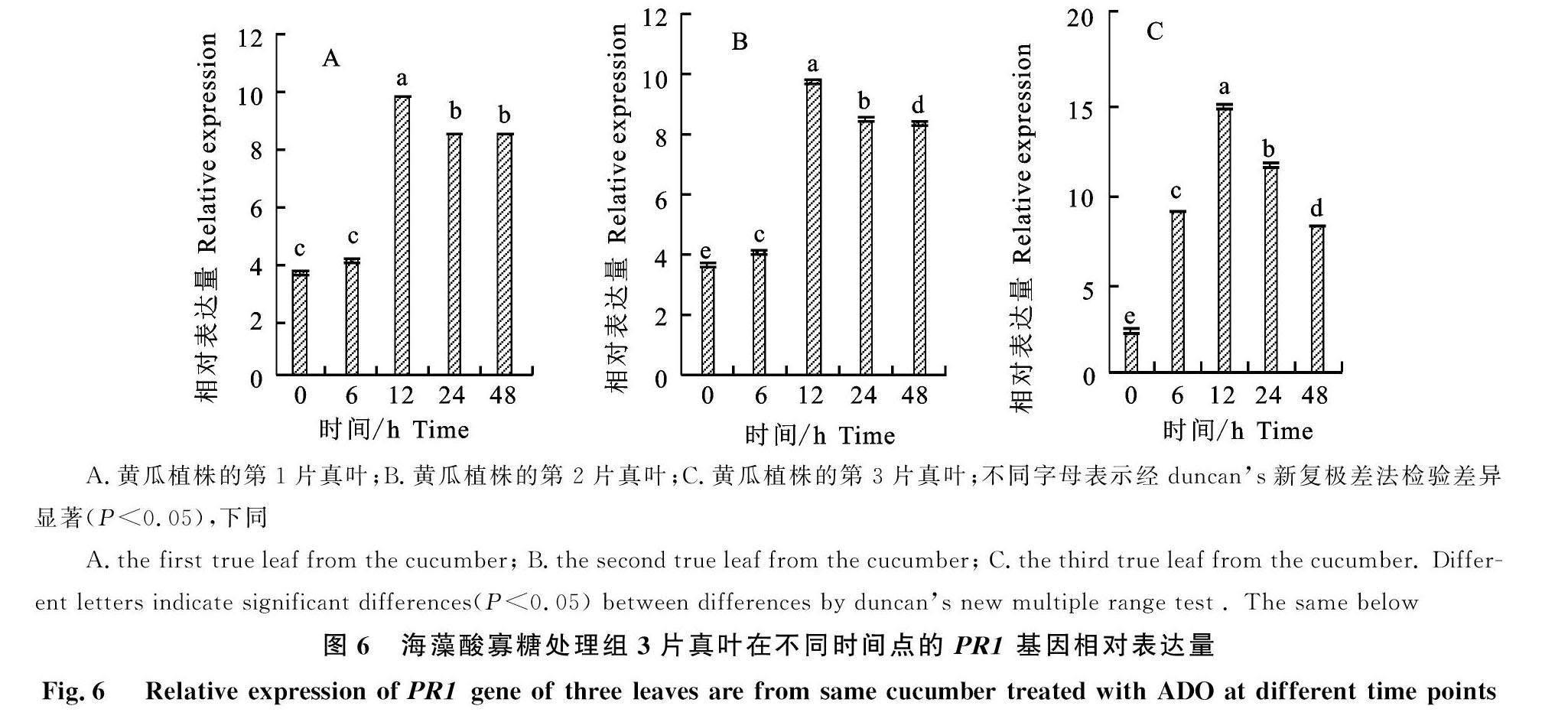
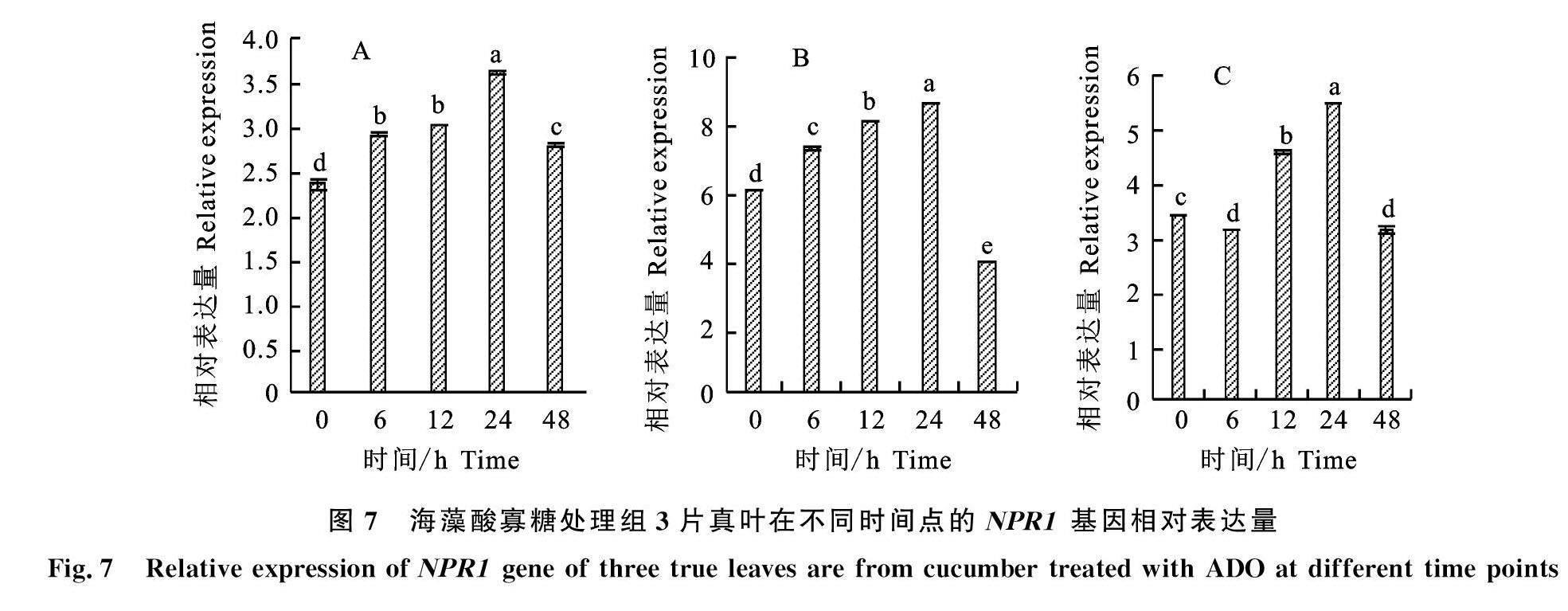
测定海藻酸寡糖处理组处理叶(第2片真叶)和未处理叶(第1片和第3片真叶)的PR1、NPR1在接菌后不同时间点的相对表达量,结果如图6、图7所示,处理组3片真叶的PR1、NPR1相对表达量均上调,分别在接菌后12 h、24 h达到峰值,说明植株体内的水杨酸途径被 激活。
JAR1和 EIN2在不同时间点的相对表达量结果如图8、图9所示,处理组3片真叶的 JAR1和 EIN2相对表达量均下调,说明茉莉酸途径未被激活。
3 讨 论
牛红艳等[9]研究发现,海藻酸钠的降解产物海藻酸寡糖具有较高的水溶性高,强吸收性和较高的激发子活性;江琳琳等[10]研究表明,海藻酸寡糖可以能够激发大豆子叶产生植保素,对水稻植物细胞同样具有激发子活性;张运红等[11]已证明,喷施海藻寡糖可以缓解干旱胁迫对小麦发育的抑制作用,苗长、根长、生物量等增加,并且丙二醛、脯氨酸含量下降,叶绿素、部分抗氧化酶活力升高。但其在防治黄瓜灰霉病方面存在罕见 报道。
本次试验旨在为海藻酸寡糖在黄瓜灰霉病防治方面提供理论支持,通过盆栽试验、抑菌试验、防御相关酶活测定和相关防卫基因表达量测定,探究海藻酸寡糖的诱导抗病效果和系统诱导抗病机理。
有研究表明:诱导剂作用方式与化学农药不同,具有迟滞性,即植物经诱导剂刺激后产生免疫应答需要一定的时间,不同植物面对不同诱导物所产生免疫应答所需时间不同,如水杨酸和茉莉酸甲酯处理甜瓜2~5 d后,其对枯萎病的防治效果最好[12]。本试验结果表明,海藻酸寡糖也具有迟滞性,在处理黄瓜3 d后药效最好。
防御酶与植物抗性有着很大关系,它们参与活性氧清除、酚类、木质素和植保素等抗病相关物质的合成,能抵御活性氧及氧自由基对细胞膜系统的伤害,使植物抵抗病害的能力增强。当防御酶活性显著提高,说明黄瓜抗病性增强[13-16]。测定酶活性试验表明,植株部分叶片经诱导剂处理后,整株叶片的苯丙氨酸解氨酶(PAL)、过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性均显著提升,说明海藻酸寡糖可以通过局部诱导激发黄瓜整体的防御酶活性,增强抗病性。
植物在识别植物诱导剂后,会启动不同的信号转导途径。在整个植物抗病信号转导过程中,主要由两条不同的信号转导途径发挥作用,一条是水杨酸途径;另一条是茉莉酸/乙烯途径[17]。根据研究,这两条信号转导途径既存在拮抗关系,激活其中一个信号通路的同时,必然会影响另外一个途径介导的对病原菌的抗性[18],如刘同梅[5]在研究中发现,经海藻酸寡糖处理的烟草,在接种TMV后,其体内的水杨酸途径关键基因和水杨酸含量显著上升,但茉莉酸含量无明显变化;也存在同时发挥作用的情况[19],如Feys等[20]研究报道,拟南芥根际细菌可以同时激发植物的水杨酸途径和茉莉酸/乙烯途径,从而提高番茄对丁香假单胞菌的抗性。本试验利用qRT-PCR技术,测定信号转导途径关键基因表达量。结果表明,海藻酸寡糖处理组叶内的茉莉酸途径关键基因 JAR1和 EIN2表达量均下调;水杨酸途径关键基因 NPR1和 PR1表达量均上调,说明海藻酸寡糖通过激活水杨酸途径,提高黄瓜抗性。
为更加接近实际农药喷洒活动,整体试验更具有说服力和可操作性,在本试验中采用3片真叶期的黄瓜做为供试植株,仅用诱导剂处理中部叶片,测定整株叶片的防治效果、抗病相关酶活和基因表达量,探究海藻酸寡糖的生产实践价值。试验结果表明,海藻酸寡糖比市面上应用较为广泛的壳寡糖的诱导抗病效果更好,并且其抗病机理是通过激活水杨酸信号转导途径,进而激发植株体内相关防御酶活性,来抑制病原菌在植株细胞中的增殖。
参考文献 Reference:
[1] 杜晓峰,王 璐,张杰婷,等.黄瓜灰霉病生防菌株的筛选与鉴定[J].吉林农业大学学报,2019(2):7.
DU X F,WANG L,ZHANG J T,et al.Screening and identification of biocontrol strains against cucumber gray mold [J].Journal of Jilin Agricultural University,2019(2):7.
[2]瓮巧云,黄聪聪,王娜梁,等.拟南芥抗灰霉病基因 T1N6-22互作蛋白的筛选与分析[J].华北农学报,2017,32(2):45-49.
WENG Q Y,HUANG C C,WANG N L,et al.Arabidopsis gray mold resistance gene T1N6-22 screening and analysis of interacting proteins [J].Acta Agriculturae Boreali-Sinica,2017,32(2):45-49.
[3]苏 琴.化学防治与生物防治的优缺点浅析[J].内蒙古农业科技,2011(6):84-85.
SU Q.Analysis of advantages and disadvantages of chemical control and biological control [J].Inner Mongolia Agricultural Science and Technology,2011(6):84-85.
[4]曾勇峰.新型抗菌物质CF66I发酵工艺的优化及动力学的研究[D].辽宁大连:大连理工大学,2006.
ZENG Y F.Optimization of fermentation process and kinetics of a new antibacterial substance CF66I [D].Dalian Liaoning:Dalian University of Technology,2006.
[5]刘同梅.海藻酸钠寡糖诱导植物抗病作用和机制的初步研究[D].辽宁大连:大连海洋大学,2018.
LIU T M.Preliminary study on the effect and mechanism of sodium alginate oligosaccharide inducing plant disease resistance [D].Dalian Liaoning:Dalian Ocean University,2018.
[6]杨 锦,尹媛红,沈 宏.海藻功能物质对菜心抗旱胁迫的影响[J].磷肥与复肥,2019(3):40-48.
YANG J,YIN Y H,SHENG H.Effect of seaweed functional substances on drought resistance of Chinese cabbage [J].Phosphate Fertilizer and Compound Fertilizer,2019(3):40-48.
[7]上官妮妮.ε-聚赖氨酸等物质对番茄灰霉病的防治效果研究[D].陕西杨凌:西北农林科技大学,2015.
SHANGGUAN N N.ε-Study on the control effect of polylysine and other substances on tomato gray mold [D].Yangling Shaanxi:Northwest A&F University,2015.
[8]李月飞.番茄灰霉病拮抗细菌18BS-12的鉴定及生防潜力研究[D].陕西杨凌:西北农林科技大学,2014.
LI Y F.Identification and biocontrol potential of antagonistic bacteria 18BS-12 against tomato gray mold [D].Yangling Shaanxi:Northwest A&F University,2014.
[9]牛红艳,严国富,汤 洁.海藻酸寡糖的纯化及分子量测定[J].中国食品添加剂,2019,30(4):6.
NIU H Y,YAN G F,TANG J.Purification and molecular weight determination of alginate oligosaccharides [J].China Food Additives,2019,30(4):6.
[10] 江琳琳,陈温福,陈晓艺,等.海藻酸寡糖生物活性研究[J].大连工业大学学报,2009(3):157-160.
JIANG L L,CHEN W F,CHEN X Y,et al.Study on the biological activity of alginate oligosaccharides [J].Journal of Dalian University of Technology,2009(3):157-160.
[11]张运红,孙克刚,杜 君,等.海藻寡糖增效尿素对水稻产量和品质的影响[J].河南农业科学,2016,45(1):4.
ZHANG Y H,SUN K G,DU J,et al.Effect of algae oligosaccharide synergetic urea on rice yield and quality [J].Henan Agricultural Science,2016,45(1):4.
[12]李 金,臧 威,孙剑秋,等.植物诱导抗病性研究进展[J].安徽农业科学,2008(18):255-256.
LI J,ZANG W,SUN J Q,et al.Research progress in plant induced disease resistance [J].Anhui Agricultural Science,2008(18):255-256.
[13]郭海艳,刘 璐,孙宇蛟,等.3种外源诱导剂预处理对甜瓜抗病特征及其Fom-2和CHT基因表达的影响[J]. 西北植物学报,2018,38(5):15.
GUO H Y,LIU L,SUN Y J,et al.Effects of three exogenous inducers pretreatment on melon disease resistance characteristics and Fom-2 and CHT gene expression [J].Acta Botanica Boreali-Occidentalia Sinica,2018,38(5):15.
[14]徐俊光.壳寡糖对植物病原真菌的抑菌活性及其机理的初步研究[D].辽宁大连:中国科学院研究生院(大连化学物理研究所),2007.
XU J G.Preliminary study on the antibacterial activity and mechanism of chitosan oligosaccharide against plant pathogenic fungi [D].Dalian Liaoning:Graduate School of Chinese Academy of Sciences (Dalian Institute of Chemical Physics),2007.
[15]刘碧源,高仕瑛,李邦良,等.壳寡糖抗菌活性的实验研究[J].中国生化药物杂志,2003(2):73-75.
LIU B Y,GAO SH Y,LI B L,et al.Experimental study on antibacterial activity of chitosan oligosaccharide [J].Chinese Journal of Biochemical Medicine,2003(2):73-75.
[16]杨宜红.大丽轮枝菌激发棉花防御反应的研究[D].南京:南京农业大学,2016.
YANG Y H.Study on the defense response of cotton stimulated by Verticillium dahliae[D].Nanjing:Nanjing Agricultural University,2016.
[17]KUMAR D,FAI L Y,HOTZ T,et al.Role of tobacco methyl esterase in plant disease resistance signaling and its subcellular localization[J].In Vitro Cell Devan,2011,47:S50-S51.
[18]THOMMA B P,PENNINCKX I A,CAMMUEB P,et al.The complexity of disease signaling in Arabidopsis[J].Current Opinion in Immunology,2001,13(1):63-68.
[19]KUNKEL B N,BROOKS D M.Cross talk between signaling pathways in pathogen defense[J].Current Opinion in Plant Biology,2002(4):325-331.
[20]FEYS B J,PARKER J E.Interplay of signaling pathways in plant disease resistance[J].Trends Genet,2000(16):166-172.
Effciency of Alginate Oligosaccharides on Induced Resistance against
Botrytis cinerea in Cucumber and Their Mechanisms
DONG Zihui1,2 and MA Qing1
(1.College of Plant Protection,Northwest A&F University ,Yangling Shaanxi 712100,China;
2.Agricultural Technology Extension Center,Pingluo Ningxia 753400,China)
Abstract In order to investigate effect of alginate oligosaccharides on induced resistance against Botrytis cinerea in cucumber and understand their mechanisms,the trefoil stage of a susceptible variety of cucumber was used as the experimental materials. During 0-48 h after inoculation in pot experiment,enzyme activity determination method and real-time fluorescence quantification were used to determine the activities of defense related enzymes [(superoxide dismutase (SOD),hydrogen oxide (CAT),phenylalanine ammonia lyase (PAL)],and peroxidase (POD) activity in cucumber leaves. The expression of key genes in the signal transduction pathway,including JAR1 and EIN2 ( key gene of plant in Jasmonic Acid Pathway),as well as NPR1 and PR1(key gene of plant in Salicylic Acid Pathway),were analyzed. The results showed that the optimal induction concentration of ADO was 50 mg/L,with the induction period of 3 days,and the control efficiency of 66.75%; the activities of defense related enzymes significantly increased; the relative expression of NPR1 and PR1,key genes of salicylic acid pathway,were up-regulated. Thre results suggest that alginate oligosaccharides have the potential to enhance the activity of defense related enzymes in plants,thereby increasing plant disease resistance through the stimulation of salicylic acid signal transduction.
Key words ADO; Induced disease resistance; Signal transduction pathway; Defense related enzyme activity
Received 2022-11-06 Returned 2023-03-23
Foundation item Key R&D Program of Shaanxi Province(No.2019ZDLNY03-07).
First author DONG Zihui,female,master student. Research area:plant pathology,comprehensive control of plant diseases.E-mail:zhibaodongzihui@163.com
Corresponding author MA Qing,female,doctoral supervisor,professor.Research area:plant pathology,comprehensive control of plant diseases. E-mail: maqing@nwafu.edu.cn
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

