辣椒白粉病抗性主基因+多基因混合遗传分析
张涛 马正宝 张茹 汪来田 王永富 黄立娟 郭娜纳 李伟 魏兵强

摘 要 辣椒白粉病是一种常见的真菌病害,该病严重影响辣椒生产。以辣椒白粉病高抗材料(NSR和NVD)为母本,高感材料(20c89、20c93)为父本,分别构建两组P1、P2、F1、F2四世代遗传群体(2021组和2022组),通过调查统计辣椒不同世代群体内单株的白粉病病情指数,利用植物数量性状主基因+多基因混合遗传分析法对辣椒白粉病抗性进行遗传分析。结果表明:两组群体辣椒白粉病抗性遗传均受两对加性-显性上位性主基因+加性-显性多基因控制,并且基因遗传效应和遗传力等参数在两组群体中表现出较高的一致性。2021组第1对主基因加性效应和显性效应值分别为12.706 5和-34.710 7,第2对主基因加性效应和显性效应值分别为-9.170 6和-16.943 2,主基因遗传率为86.11%;2022组第1对主基因加性效应和显性效应值分别为20.043 1和-18.068 2,第2对主基因加性效应和显性效应值分别为-1.066 8和-6.090 4,主基因遗传率为97.16%。
关键词 辣椒;白粉病;抗性;主基因+多基因;遗传分析
辣椒(Capsicum spp.)是茄科、辣椒属1 a生或多年生草本植物,在世界上广泛种植,是世界范围内最为重要的蔬菜和辛辣香料作物之一。辣椒以其特殊的口感和高营养价值而闻名于世,含有丰富的维生素C和多种抗氧化物质[1],深受大众喜爱。
鞑靼内丝白粉菌(Leveillula taurica (Lev.)Arn.)是一类非常重要的生物营养性病原菌,寄主范围广泛。此真菌引发的白粉病在世界各地均有发生,会对多种园艺作物造成危害[2-3],如辣椒[4]、茄子[5]、番茄[6]、马铃薯[7]、菠菜[8]等。在农业生产中,白粉菌主要侵染植物叶片组织,严重时可危害茎秆、叶柄(鞘)和花蕾等部位。植物在受到白粉菌侵染后,光合作用效率明显降低,其呼吸作用和蒸腾作用有所增强,生长所需营养物质积累减少而消耗增加,进而影响作物产量和品质[9]。辣椒白粉病与其他作物不同的是,在发病初期叶片背面首先出现白粉菌丝, 只有对白粉病非常敏感的品种,病原菌才会在叶面出现[10]。该病自1971年在美国出现后[11],为害日益严重,目前该病几乎在所有辣椒种植地区都有发生。
培育抗病品种通常被认为是控制这种病害最经济、有效和环境友好的方法。了解白粉病抗性遗传规律并且挖掘抗病新基因有利于抗病品种的选育,加速育种进程。目前,已在多种作物上有关于白粉病抗性遗传规律的相关报道。Jo等[12]研究认为辣椒白粉病抗性是由单显性基因控制。Morishita等[13]研究表明,黄瓜白粉病抗性是由一对隐性和一对不完全显性基因控制,认为白粉病的抗性会随温度的变化而变化。Cohen等[14]研究认为,美洲南瓜白粉病抗性是由一个不完全显性的单基因所控制,并将其命名为Pm-0。王准等[15]对甜瓜白粉病抗性进行遗传分析,认为甜瓜白粉病的抗性受一对不完全显性基因和一对隐性基因共同控制。同时,国内外对白粉病抗性基因的挖掘已经开展很多研究。在番茄上,Van等[16]通过研究发现野生番茄G1.1560白粉病抗性是由一个不完全显性基因Ol-1控制,被定位在6号染色体Aps-1基因座附近,随后番茄白粉病抗性基因Ol-2、Ol-3也被陆续报道[17-18]。在大麦上,自从MLO基因被报道是一个隐性突变体,且对白粉病具有广谱抗性后,该mlo突变体已被广泛用作欧洲野生大麦育种资源[19]。在辣椒上,Zheng等[20]通过同源克隆得到了CaMlo2基因,进一步通过病毒诱导的基因沉默技术(VIGS)证实CaMlo2基因对辣椒白粉病易感性起到一定作用。到目前为止,MLO的同源基因已在烟草[21]、黄瓜[22]、南瓜[23]和甜瓜[24]等多个作物上被鉴定并成功克隆。然而关于辣椒白粉病抗性遗传规律、遗传模式和抗病基因挖掘等方面,国内外虽已开展较多,但相关报道较少,相对于其他作物来说研究仍较为滞后。
由盖钧镒[25]提出的植物数量性状主基因+多基因混合遗传模型分析法不仅可以检测数量性状主基因的个数和多基因的存在,而且可对基因遗传效应及方差等遗传参数进行估计,已成为植物数量性状遗传解析的重要方法之一。该方法已在多种作物的数量性状遗传上得到应用,如水稻[26]、烟草[27]、棉花[28]、辣椒[29]、甘蓝[30]等。本研究分别构建两组辣椒白粉病抗性P1、P2、F1、F2四世代混合遗传群体,利用主基因+多基因混合分析法研究辣椒白粉病抗性的遗传规律,以期为今后辣椒抗白粉病育种材料的创制和新品种选育提供理论依据,并为辣椒白粉病抗性基因的定位提供参考。
1 材料与方法
1.1 供试材料
NuMex Suave Red(C.chinense Jacq.)和NuMex Veteran's Day(Capsicum annuum L.)为辣椒白粉病高抗纯系材料,引自美国新墨西哥州立大学辣椒研究所,为书写与分析方便,分别简写为NSR和NVD。20c89(Capsicum annuum L.)和20c93(Capsicum annuum L.)为白粉病高感材料,为甘肃农业大学园艺学院蔬菜分子育种实验室选育的辣椒优良自交系。
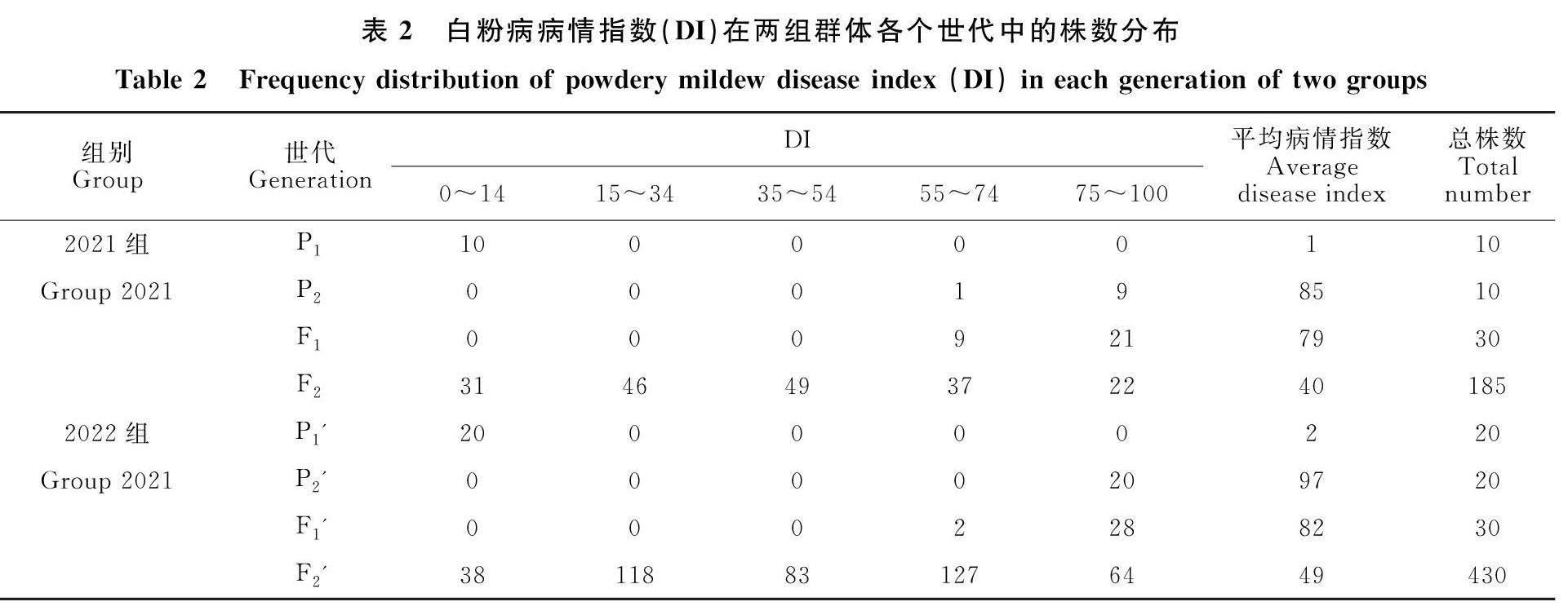
2020年春季配制两个杂交组合,即NSR×20c89和NVD×20c93,分别得到杂交种子F1和F1'。2020年秋季分别种植F1和F1',收获自交种子F2和F2'。2021年在酒泉市农业科学研究院酒泉试验基地露地种植第一组(简写为2021组)四世代群体P1(NSR)、P2(20c89)、F1、F2,两个亲本各10株,F1共30株,F2 共185株。2022年在甘肃农业大学园艺学院兰州试验基地塑料大棚种植第二组(简写为2022组)四世代群体P1'(NVD)、P2'(20c93)、F1'、F2',两个亲本各20株,F1'共30株,F2'共430株,所有供试材料均采用常规化管理。
1.2 病情指数调查方法
两年试验分别于每年8月下旬试验地白粉病大量自然发病并且一致性较好后,进行单株白粉病病情指数调查。
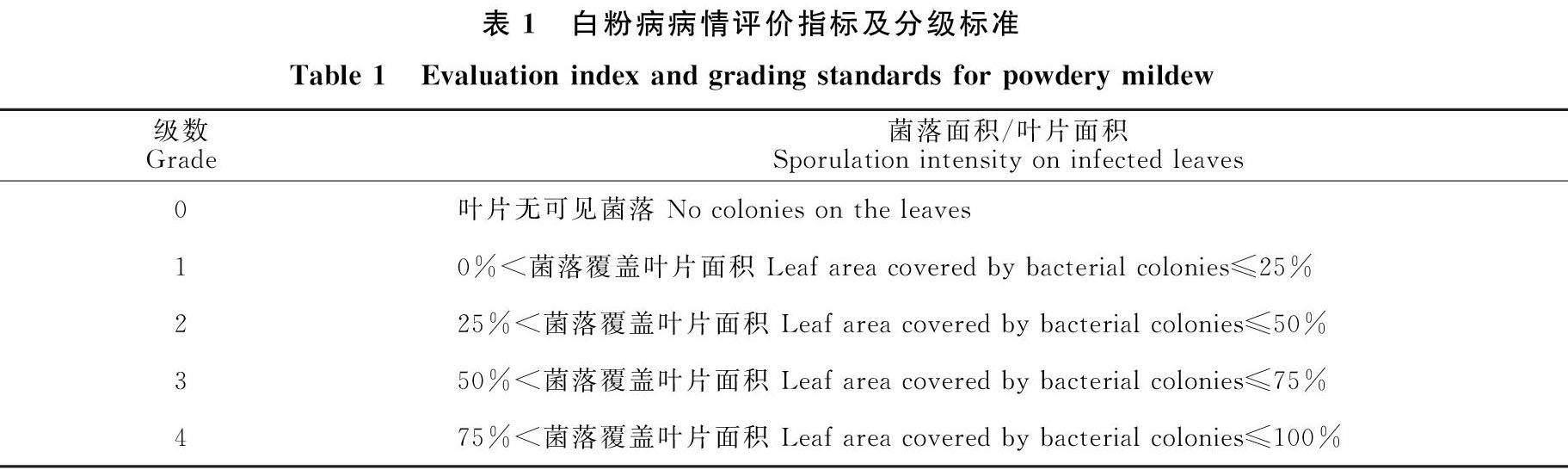
白粉病病情评价指标及分级标准参照白锐琴[31]方法进行并略有改动。在发病高峰期分别对2021组群体和2022组群体中的每个单株从下而上(中下部)调查5片真叶发病情况。感病叶片上菌落密度级别(Sp)分为0~4共5个等级(表1,图1)。
病情指数计算方法:病情指数(DI)=∑(各级病叶数×相对级数值)/(调查总叶数×最高级数)×100,高抗(HR):0≤DI<15,抗病(R):15≤DI<35,中抗(MR):35≤DI<55,感病(S):55≤DI<75,高感(HS):75≤DI≤100。
1.3 数据分析
应用盖钧镒[25]提出的植物数量性状主基 因+多基因混合遗传模型分析法分别对2021组P1、P2、F1、F2和2022组P1'、P2'、F1'、F2'两组四世代群体进行世代联合分析。获得5类共计24个遗传模型,并计算混合模型的极大似然函数值(MLV,maximum likelihood method)和有关成分分布参数,进一步将MLV转换为AIC(Akaikes information criterion)值,依据Akaike提出的最大熵规则[32],从24个遗传模型中每组各选取AIC值相对较小的3个模型作为备选模型。进一步对每组的3个备选模型进行均匀性检验、Smirnov检验和Kolmogorov检验,从而选出最佳遗传模型,采用最小二乘法估计出最佳遗传模型的一阶遗传参数,由群体方差和成分分布方差估计出最佳遗传模型的二阶遗传参数[33-34]。
数据分析软件SEA-G4由华中农业大学章元明教授惠赠。
2 结果与分析
2.1 不同世代中白粉病病情指数的次数分布
由白粉病病情指数在两组群体各个世代中的株数分布(表2)可知,母本P1(NSR)和P1'(NVD)表现为高抗,平均病情指数分别为1和2,父本P2(20c89)和P2'(20c93)表现为高感,平均病情指数分别为85和97。亲本之间的抗性差异明显,已达到极显著水平。F1和F1'均为感病株且平均病情指数分别为79和82,远高于中亲值43和48,偏向高值亲本,故初步推测辣椒白粉病抗病主基因相对感病基因为隐性遗传。2021组F2分离群体病情级别的株数分布表现为偏离正态分布的单峰(图2),2022组F2'分离群体病情级别的株数分布呈现双峰趋势,且双峰高度差异较小(图3)。表明辣椒白粉病抗性符合数量性状遗传特点,可用主基因+多基因混合遗传分析法进行分析。
2.2 白粉病主基因+多基因遗传模型分析
利用植物数量性状主基因+多基因混合遗传分析法,分别对2021组和2022组四世代群体进行世代联合分析,获得1对主基因、2对主基因、多基因、1对主基因+多基因和2对主基因+多基因共5类24种遗传模型在两组群体中的极大对数似然函数值和AIC值(表3),2021组AIC值相对较小的3个模型分别为MX2-ADI-AD (2 085.88)、MX1-AD-ADI(2 087.35)和MX2-ADI-ADI(2 091.48),2022组AIC值相对较小的3个模型分别为MX2-ADI-AD(4 257.41)、 MX2-ADI-ADI (4 260.60)和MX2-AD-AD (4 350.88)。
进一步对两组的候选遗传模型分别进行适合性检测(均匀性检验、Smirnov检验和Kolmogorov检验,5个统计量分别为U12、U2 2、U3 2、nW2和Dn),并选择适合性检验统计量达到显著水平个数最少的模型作为最佳遗传模型(表4)。2021组3个候选遗传模型均有3项适合性检验统计量与该模型的差异达到显著性水平,采用AIC值最小原则,选择MX2-ADI-AD作为最佳遗传模型。2022 组MX2-ADI-AD有3项适合性检验统计量与该模型的差异达到显著性水平,而MX2-ADI-ADI和MX2-AD-AD分别有4项和11项,故两组群体MX2-ADI-AD均为最佳遗传模型,MX2-ADI-AD为两对加性-显性上位性主基因+加 性-显性多基因模型。
2.3 遗传参数分析
2.3.1 一阶参数 分别对两组群体的MX2-ADI-AD模型遗传参数进行估计(表5),整体来看,最佳遗传模型的遗传参数在两组群体中表现出较高的一致性。
由一阶遗传参数可知,2021组第1对主基因的加性效应(da)和显性效应(ha)值分别为 12.706 5和-34.710 7,第2对主基因的加性效应(db)和显性效应(hb)值分别为-9.170 6和 -16.943 2,2对主基因的显性度(| ha / da |、 | hb /db |)分别为2.731 7和1.847 6,均大于1,表现为超显性作用。在主基因互作效应中,加性×加性(22.85)和显性×显性互作(38.588 4)起主导作用。
2022组第1对主基因的加性效应和显性效应值分别为20.043 1和-18.068 2,第2对主基因的加性效应和显性效应值分别为-1.066 8和-6.090 4,2对主基因的显性度分别为0.901 5和5.709 0,说明第1对主基因呈部分显性作用,第2对主基因呈超显性作用。在主基因互作效应中,与2021组不同的是加性×显性(22.85)大于加性×加性(8.936),因此,加性×显性和显性×显性互作(38.588 4)起主导作用。
2.3.2 二阶参数 二阶遗传参数结果表明,2021组和2022组群体表型总方差(δ2p)分别为89.894和19.863 6,主基因遗传方差(δ2mg)分别为 557.069 9和680.477 3。两组群体的主基因遗传率分别为86.11%和97.16%,均表现出很高的遗传力。而多基因的遗传方差(δ2pg)和遗传力(h2pg(%))两组均为0。
3 讨 论
白粉病是辣椒种植中最常见、危害最大的病害之一。据报道,因落叶造成的损失高达75%,产量损失高达40%[35],此病害严重制约辣椒产业发展。目前,辣椒白粉病抗性遗传研究国内外虽开展较多,但相关报道较少,而且不同学者的研究结果存在差异。Shifriss等[10]通过辣椒抗白粉病材料HV-12进行遗传研究,认为至少有三对基因控制辣椒抗白粉病。Blat等[36]利用HV-12、#124和Chilli 3个纯合抗病亲本和3个纯合感病亲本进行杂交组合试验,研究表明抗白粉病材料HV-12至少有三个基因控制,#124至少有两个,Chilli则至少有四个基因,并且发现感病基因具有一定程度的显性作用;Jo等[12]通过抗病亲本VK515 R和PMSingang,感病亲本VK515 S和Bukang分别构建F2∶3和F2群体,发现F2∶3群体纯合抗病株、杂合株、纯合感病株符合1∶2∶1的比例,F2群体中抗病株和感病株符合3∶1,结果表明在这两个群体中白粉病抗性是由单显性基因控制,这与Blat等[36]的结论正好相反;白锐琴[31]采用辣椒抗病材料H3的重组自交系F8群体研究辣椒抗白粉病遗传方式,结果表明白粉病抗性至少由两对基因控制,并且还受一些微效基因控制。本研究结果表明,辣椒白粉病抗性由两对加性-显性上位性主基因+加性-显性多基因控制,这与白锐琴[31]的研究结果高度相似,与Manivannan等[37]采用抗病亲本AR1与感病亲本TF68构建的F5群体在2号和5号染色体上分别鉴定出Pm-2.1和Pm-5.1等2个QTL相对应,并且认为辣椒白粉病抗病主基因相对感病基因为隐性遗传,这与Jo等[12]的结论相反,而更接近Blat等[36]的结论。分析造成不同学者研究结果存在差异的原因,主要有三点。首先是辣椒白粉病抗源材料不同,遗传机理可能不同;其次为抗性鉴定标准和遗传分析方法存在差异;再次白粉病发病程度受到一定的栽培地和栽培环境 影响。
本研究表明,2021组两对主基因的加性效应值分别为12.706 5和-9.170 6,显性效应值分别为-34.710 7和-16.943 2;2022组两对主基因的加性效应值分别为20.043 1和-1.066 8,显性效应值分别为-18.068 2和-6.090 4。说明2021组和2022组中两对主基因的遗传效应方向一致,加性效应分别来自抗病亲本和感病亲本,而两对主基因的显性效应均来自抗性亲本。所不同的是,两对主基因的显性度在不同群体中有所差异。2021组中两对主基因的显性度均大于1,表现为超显性效应;而2022组中,第一对主基因表现为部分显性接近完全显性效应,第二对主基因表现为超显性效应,这可能是由于抗性亲本差异所致。在主基因间互作效应中,2021组加性×加性、加性×显性、显性×加性和显性×显性互作效应值分别为22.85、15.077 4、19.122 3和 38.588 4,2022组分别为8.936 0、25.307 7、 13.044 5和34.48 9。说明主基因间互作在两组群体中均具有正向遗传效应,并且显性×显性互作占据主要地位。结合两对主基因的加性、显性单位点联合效应来看,辣椒白粉病抗性遗传中主基因的3种效应大小关系应为互作效应>显性效应>加性效应。2021组和2022组主基因遗传率分别高达86.11%和97.16%,受环境影响较小,一致性较好。表明在辣椒遗传育种过程中,对早期世代抗病材料选择时要注重主基因的选择。
值得一提的是,本试验采用的两个抗病亲本NSR和NVD分别属于‘C.chinense Jacq.和‘Capsicum annuum L.两个栽培种。本研究通过对NSR×20c89和NVD×20c93两组亲本构建的四世代群体进行混合遗传分析,结果表明无论是中国辣椒还是一年生辣椒,其白粉病抗性均受两对加性显性上位性主基因+加性显性多基因控制,说明辣椒白粉病抗性在种间具有相似或相同的遗传机理。
此外,本试验是两组不同遗传群体在不同年份、不同地点和不同栽培环境下进行的,但得到的遗传模型完全相同,说明白粉病抗性遗传比较稳定。而数量性状基因遗传效应的差异,除了受基因型因素外,可能还受一定的环境作用[38]。酒泉市位于甘肃省西北部,属大陆性干旱气候区,露地干旱且降水少[39]。而兰州市处于甘肃省中部,属温带大陆性气候,塑料大棚试验田靠近黄河湿地。塑料大棚的棚温和湿度均要高于露地,更适宜白粉病发病。在本研究中,根据单株的白粉病发病程度来看,塑料大棚的2022组F2'植株较露地的2021组F2来说更容易感病,与预想一致。因此,可能造成了本文中所述两组群体在3个备选模型上出现1个不一致的现象,说明在不同栽培环境下对辣椒白粉病抗性确有一定影响,但其主要还是受主基因控制。
4 结 论
本研究认为辣椒白粉病抗病基因具有隐性作用,明确了辣椒白粉病抗性由两对加性-显性上位性主基因+加性-显性多基因控制,主基因间存在互作效应并且不利于白粉病抗性,主基因遗传率在两组群体中分别高达86.11%和97.16%,受环境影响较小,一致性较好,可以在杂交后代的早期世代对抗病材料进行选择。
参考文献 Reference:
[1] MATEOS R M,JIMNEZ A,ROMN P,et al.Antioxidant systems from pepper (Capsicum annuum L.):involvement in the response to temperature changes in ripe fruits[J].International Journal of Molecular Sciences,2013,14(5):9556-9580.
[2]ELLINGHAM O,DAVID J,CULHAM A.Enhancing identification accuracy for powdery mildews using previously underexploited DNA loci[J].Mycologia,2019,111(5):798-812.
[3]SIAHAAN S A,HIDAYAT I,KRAMADIBRATA K, et al.Bauhinia purpurea, Durio zibethinus, and Nephelium lappaceum:additional hosts of the asexual morph of Erysiphe quercicola[J].Mycoscience,2016,57(6):375-383.
[4]MCCOY J E,BOSLAND P W.Identification of resistance to powdery mildew in chile pepper[J].HortScience,2019,54(1):4-7.
[5]BUBICI G,CIRULLI M.Screening and selection of eggplant and wild related species for resistance to Leveillula taurica[J].Euphytica,2008,164(2):339-345.
[6]LIN C P,DAI Y L,HUANG J H,et al.First report of tomato powdery mildew caused by Leveillula taurica in taiwan[J].Plant Disease,2021,106(2):757.
[7]GLAWE D A,DU TOIT L J,PELTER G Q.First report of powdery mildew on potato caused by Leveillula taurica in North America[J].Plant Health Progress,2004,5(1):15.
[8]SOYLU S,UYSAL A,KURT S,et al.Morphological and molecular characterization of spinach powdery mildew disease caused by Leveillula taurica in Turkey[J].Journal of Plant Pathology,2021,103(3):955-959.
[9]杨 学.亚麻白粉病田间药剂试验研究[J].黑龙江农业科学,2007(2):48-49.
YANG X.Study on chemical medicament to prevent powdery mildew[J].Heilongjiang Agricultural Sciences,2007(2):48-49.
[10] SHIFRISS C,PILOWSKY M,ZACKS J M.Resistance to Leveillula Taurica mildew (Oidiopsis taurica) in Capsicum annuum[J].Phytoparasitica,1992,20(4):279-283.
[11]MCGRATH M T,SHISHKOFF N,BORNT C,et al.First occurrence of powdery mildew caused by Leveillula taurica on pepper in new york[J].Plant Disease,2001,85(10):1122-1122.
[12]JO J,VENKATESH J,HAN K,et al.Molecular mapping of PMR1, a novel locus conferring resistance to powdery mildew in pepper (Capsicum annuum) [J].Frontiers in Plant Science,2017,8:2090.
[13]MORISHITA M,SUGIYAMA K,SAITO T,et al.Powdery mildew resistance in cucumber[J].Japan Agricultural Research Quarterly,2003,37(1):7-14.
[14]COHEN R,HANAN A,PARIS H S.Single-gene resistance to powdery mildew in zucchini squash (Cucurbita pepo) [J].Euphytica,2003,130(3):433-441.
[15]王 准,宫国义,柳唐镜,等.甜瓜白粉病新抗源的抗性遗传规律[J].中国瓜菜,2022,35(4):8-13.
WANG ZH,GONG G Y,LIU T J,et al.Inheritance of a new resistance source for powdery mildew in melon(Cucumis melo) [J].China Cucurbits and Vegetables,2022,35(4):8-13.
[16]VAN DER BEEK J G,PET G,LINDHOUT P.Resistance to powdery mildew (Oidium lycopersicum) in Lycopersicon hirsutum is controlled by an incompletely-dominant gene Ol-1 on chromosome 6[J].Theoretical and Applied Genetics,1994,89(4):467-473.
[17]HUANG C,HOEFS-VAN DE PUTTE P M,HAANSTRA-VAN DER MEER J G,et al.Characterization and mapping of resistance to Oidium lycopersicum in two Lycopersicon hirsutum accessions:evidence for close linkage of two Ol-genes on chromosome 6 of tomato[J].Heredity,2000,85(6):511-520.
[18]BAI Y,VAN DER HULST R,BONNEMA G,et al.Tomato defense to Oldium neolycopersici:dominant Ol genes confer isolate-dependent resistance via a different mechanism than recessive Ol-2[J].Molecular Plant-Microbe Interactions,2005,18(4):354-362.
[19]LYNGKJAER M,NEWTON A,ATZEMA J,et al.The Barley mlo-gene:an important powdery mildew resistance source[J].Agronomie,2000,20(7):745-756.
[20]ZHENG Z,NONOMURA T,APPIANO M,et al.Loss of function in Mlo orthologs reduces susceptibility of pepper and tomato to powdery mildew disease caused by Leveillula taurica[J].Plos One,2013,8(7):e70723.
[21]FUJIMURA T,SATO S,TAJIMA T,et al.Powdery mildew resistance in the Japanese domestic tobacco cultivar Kokubu is associated with aberrant splicing of MLO orthologues[J].Plant Pathology,2016,65(8):1358-1365.
[22]ZHOU S J,JING Z,SHI J L.Genome-wide identification, characterization, and expression analysis of the MLO gene family in Cucumis sativus[J].Genetics and Molecular Research,2013,12(4):6565-6578.
[23]WIN K T,ZHANG C,LEE S.Genome-wide identification and description of MLO family genes in pumpkin (Cucurbita maxima Duch.) [J].Horticulture, Environment, and Biotechnology,2018,59(3):397-410.
[24]CHENG H,KONG W,HOU D,et al.Isolation, characterization, and expression analysis of CmMLO2 in muskmelon[J].Molecular Biology Reports,2013,40(3):2609-2615.
[25]盖钧镒.植物数量性状遗传体系的分离分析方法研究[J].遗传,2005(1):130-136.
GAI J Y.Segregation analysis of genetic system of quantitativetraits in plants[J].Hereditas,2005(1):130-136.
[26]江建华,张武汉,党小景,等.水稻核不育系柱头性状的主基因+多基因遗传分析.作物学报,2021,47(7):1215-1227.
JIANG J H,ZHANG W H,DANG X J,et al.Genetic analysis of stigma traits with genic male sterile line by mixture model of major gene plus polygene in rice(Oryza sativa L.)[J].Acta Agronomica Sinica,2021,47(7):1215-1227.
[27]姚志敏,张兴伟,向德虎,等.烤烟不同生育时期产量性状的遗传效应分析[J].植物遗传资源学报,2016,17(1):105-113.
YAO ZH M,ZHANG X W,XIANG D H,et al.Genetic effects analysis of flue-cured tobacco yield traits at different growth stages[J].Journal of Plant Genetic Resources,2016,17(1):105-113.
[28]刘雅辉,王秀萍,李 强,等.棉花苗期耐盐性主基因和多基因混合遗传分析[J].西北农业学报,2015,24(8):57-61.
LIU Y H,WANG X P,LI Q,et al.Mixed inheritance analysis of salt tolerance in cotton seedling stage[J].Acta Agriculturae Boreali-occidentalis Sinica,2015,24(8):57-61.
[29]WEI B Q,WANG L L,BOSLAND P W,et al.A joint segregation analysis of the inheritance of fertility restoration for cytoplasmic male sterility in pepper[J].Journal of the American Society for Horticultural Science,2020,145(1):3-11.
[30]刘 霞,张冰冰,马 兵,等.甘蓝型油菜株高及其相关性状的主基因+多基因遗传分析[J].西北农业学报,2018,27(4):528-536.
LIU X,ZHANG B B,MA B,et al.Mixed major gene plus poly-gene genetic analysis of plant height and its related traits in Brassica napus L[J].Acta Agriculturae Boreali-occidentalis Sinica,2018,27(4):528-536.
[31]白锐琴.辣椒白粉病抗性QTL定位[D].北京:中国农业科学院,2019.
BAI R Q.Identification of QTL for resistance to powdery mildew in pepper[D].Beijing:Chinese Academy of Agricultural Sciences,2019.
[32]AKAIKE H.On entropy maximization principle[J].Application of Statistics,1977,543:27-41.
[33]ZHANG Y M,GAI J Y,YANG Y H.The EIM algorithm in the joint segregation analysis of quantitative traits[J].Genetical Research,2003,81(2):157-163.
[34]CAI C C,TU J X,FU T D,et al.The genetic basis of flowering time and photoperiod sensitivity in rapeseed Brassica napus L[J].Russian Journal of Genetics,2008,44(3):326-333.
[35]BLAT S F,COSTA C P,VENCOVSKY R,et al.Reaction of sweet and hot pepper accesses to powdery mildew (Oidiopsis taurica) [J].Horticultura Brasileira,2005,23:72-75.
[36]BLAT S F,COSTA C P,VENCOVSKY R,et al.Inheritance of reaction to Leveillula taurica (Lev.) Arn.in Capsicum annuum L[J].Scientia Agricola,2005,62:40-44.
[37]MANIVANNAN A,CHOI S,JUN T H,et al.Genotyping by sequencing-based discovery of snp markers and construction of linkage map from F5 population of pepper with contrasting powdery mildew resistance trait[J].Hindawi Limited,2021,2021:1-8.
[38]JANSEN R C.A general mixture model for mapping quantitative trait loci by using molecular markers[J].Theoretical and Applied Genetics,1992,85(2):252-260.
[39]杨卫民.酒泉市气候变化特征及对农业生产的影响[J].现代农业科技,2018(13):205-210.
YANG W M.Characteristics of climate change and its influence on agricultural production in Jiuquan City[J].Modern Agricultural Science and Technology,2018(13):205-210.
Genetic Analysisof Resistance to Powdery Mildew by Mixed Model of Major Genes Plus Polygenes in Chili Pepper
ZHANG Tao1,MA Zhengbao1,ZHANG Ru2,WANG Laitian3,WANG Yongfu1,
HUANG Lijuan1,GUO Nana1,LI Wei1 and WEI Bingqiang1
(1.College of Horticulture,Gansu Agricultural University,Lanzhou 730070,China;2.Vegetable
Research Institute,Gansu Academy of Agricultural Sciences,Lanzhou 730070,China;
3.Jiuquan Academy of Agricultural Sciences,Jiuquan Gansu 735099,China)
Abstract Powdery mildew is a common fungal disease seriously affecting the production of chili pepper.In this study, two progenies of P1, P2, from F1, F2 of four generation genetic populations were constructed with materials highly resistant (NSR, NVD) to chili pepper powdery mildew as female parent and high susceptibility materials (20c89, 20c93) as male parent.These progenies, named as Progenies 2021 and Progenies 2022, were investigated.The powdery mildew disease indexes of every individuals in different generation population were investigated, the genetic analysis of chili pepper powdery mildew was carried out using the mixed model of major gene plus polygenes.The results showed that the inheritance of the resistance to powdery mildew in the two progenies were controlled by two major additive-dominant epistatic genes and additive-dominant polygene.Genetic parameters such as genetic effect and variance showed high consistency in the two progenies.The values of additive effect and dominant effect of the first major genes in progenies 2021 were 12.706 5 and -34.710 7, respectively, the values of additive effect and dominant effect of the second major genes were -9.170 6 and -16.943 2, respectively, and the heritability of the major gene was 86.11%.The values of additive effect and dominant effect of the first major genes in progenies 2022 were 20.043 1 and -18.068 2, respectively, and the values of additive effect and dominant effect of the second major genes were -1.066 8 and -6.090 4, respectively, and the heritability of the major gene was 97.16%.
Key words Chili pepper;Powdery mildew;Resistance;Major gene plus polygene;Genetic analysis
Received 2023-02-11 Returned 2023-04-01
Foundation item Key Research and Development Program of Gansu Province (No.21YF5NA091);Lanzhou Talent Innovation and Entrepreneurship Project(No.2021-RC-65); Support Fund for Young Mentors of Gansu Agricultural University (No.GAU-QDFC-2020-07);Key Research and Development Program of Gansu Academy of Agricultural Sciences(No.2020GAAS17).
First author ZHANG Tao,male,master student.Research area:genetics and olecular reeding of vegetables.E-mail:zt941980553@163.com
Corresponding author WEI Bingqiang,male,professor,doctoral supervisor.Research area:genetics and olecular reeding of vegetables.E-mail:bqwei@gsau.edu.cn
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)

