褪黑素对镉胁迫下烟草幼苗生长和生理特性的影响
丹冬淳 陈征 胡钟胜 钱建财 张莉 赵红朝 黄五星
doi:10.15889/j.issn.1002-1302.2024.10.010
摘要:土壤镉污染严重威胁植物生长和人体健康,烟草是全球广泛种植的经济作物,也是镉的积累者。为探究褪黑素对镉胁迫下烟草幼苗生长和生理特性的影响,以烤烟品种K326为试验材料,采用水培试验,通过叶面喷施 200 μmol/L 褪黑素处理,探究10 μmol/L镉胁迫下褪黑素对烟草幼苗生长指标和生理特性的影响。结果表明,10 μmol/L 镉胁迫下烟草幼苗的生长发育受到抑制,褪黑素能有效缓解镉胁迫。与对照相比,镉处理组的烟苗根长、最大叶面积以及根、茎、叶的生物量均显著下降(P<0.05);褪黑素的施用改善了镉的抑制,与镉处理相比,镉+褪黑素处理的根长、最大叶面积以及根、叶的生物量分别显著增加了91.0%、12.3%、33.3%、13.8%。烟草幼苗的光合特性受到镉的胁迫,褪黑素的施用降低了镉对净光合速率、气孔导度和蒸腾速率的胁迫,同时也改善了镉对烟草幼苗叶绿素、类胡萝卜素的合成及叶绿素荧光的抑制,增加了烟苗体内抗氧化酶活性、渗透调节物质含量,降低了丙二醛含量,并且提高了生长素、赤霉素、1-氨基环丙烷羧酸含量,降低脱落酸含量。综上所述,外源喷施褪黑素可以有效缓解Cd胁迫,促进根系生长,增强光合作用,调节生理代谢过程,提高烟草对镉的耐受能力,为缓解镉对烟草幼苗的胁迫提供栽培技术及理论基础。
关键词:烟草;褪黑素;Cd胁迫;抗氧化;光合作用;荧光参数;激素
中图分类号:X173;S572.01 文献标志码:A
文章编号:1002-1302(2024)10-0075-08
收稿日期:2023-08-05
基金项目:河南省重点研发与推广专项(编号:202102310026);江苏中烟工业有限责任公司科技项目(编号:2021410001300050)。
作者简介:丹冬淳(1999—),男,河南济源人,硕士研究生,主要从事烟草品质生态研究。E-mail:812849459@qq.com。
通信作者:黄五星,博士,副教授,主要从事烟草品质生态与质量评价研究。E-mail:wxhuang@henau.edu.cn。
烟草是我国重要的经济作物之一,易富集镉(Cd)等重金属,进而对其产质量造成不良影响[1]。Cd富集导致不良影响的主要原因之一是其进入烟株体内后诱导细胞叶绿体和线粒体代谢产生过量活性氧(ROS),攻击DNA、RNA、蛋白质和细胞膜脂系统,最终造成细胞膜损伤和电解质渗漏[2]。Cd富集引发的胁迫信号会激活植物抗氧化防御体系,各种抗氧化酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)]活性水平在胁迫状态下会显著增加,清除过量超氧阴离子和H2O2,维持细胞氧化还原的平衡状态[3]。同时,Cd胁迫还会导致烟株内源激素平衡受到破坏[4]。
褪黑素(N-乙酰基-5-甲氧基色胺)是一种生物活性小分子。科学家在1958年从奶牛的松果体中首次分离得到褪黑素[5]。20世纪90年代人们陆续从藻类、细菌中发现褪黑素的存在,打破了褪黑素的物种研究局限性[6-7]。1995年Dubbels等通过放射免疫分析法在植物提取物中首次发现了植物内源褪黑素含量的品种差异[8],开启了植物褪黑素的研究进程。
褪黑素在最初的功能研究中是作为一种高效的抗氧化剂,减轻细胞受到的过量自由基氧化损伤。随着不断研究,人们发现褪黑素在哺乳动物、鱼类、鸟类、爬行动物和两栖动物中具备多种生物学功能[5,9],例如,能够调节昼夜节律、睡眠、情绪、食物摄入、体温、视网膜生理、性行为、季节性繁殖和免疫系统[10]。多项研究证实,褪黑素可以作为一种生长调节剂参与植物种子萌发、生长、开花、生根、光合作用、成熟/衰老和细胞保护反应等多项生物学进程的调控[11]。此外,适宜浓度的褪黑素可以清除过量自由基,有效改善植物氧化损伤[12-13],保护植物免受如病原菌侵染、盐碱胁迫、极端温度、辐射和重金属污染等多种生物和非生物胁迫[14-20],同时它可以通过增加细胞内的酶和非酶类抗氧化剂水平来清除ROS,从而维持细胞体内的氧化还原平衡[14]。另外有研究表明,外源褪黑素可以保护叶绿体结构和光合器官,增强PS Ⅱ光化学活性,提高叶片光合效率,从而缓解Cd胁迫对烤烟幼苗生长的抑制,提高烟苗对Cd胁迫的适应能力[21]。
目前,已有许多关于烟草Cd胁迫的研究,但有关褪黑素在烟草幼苗缓解Cd胁迫方面的研究及其对内源激素的影响罕见报道。因此本试验采用水培的方法,研究喷施褪黑素对Cd胁迫下烟草幼苗幼苗生长和生理特性的影响,旨在为生产上褪黑素的应用及重金属防控提供理论依据和参考。
1 材料与方法
1.1 试验设计
试验于2023年3月30日在河南农业大学烟草品质生态与质量评价实验室进行。以烤烟品种K326为试验材料(中国农业科学院烟草研究所提供),将种子在次氯酸钠溶液(10%)中浸泡30 min,之后用去离子水冲洗5次以确保表面无菌。种子在暗室中发芽,至出现2张真叶后转移到盛有蛭石和泥炭(体积比1 ∶1)灭菌基质的塑料盆中,在温室中继续培养,生长室昼夜温度为25 ℃/18 ℃,相对湿度70%,光—暗周期为14 h—10 h。
当烟苗生长到4张真叶时,将长势一致的烟苗移入水培盒中,用霍格兰营养液对烟苗每周换水3次。缓苗1周后同时加入Cd处理和褪黑素(MT)处理,镉处理浓度为10 μmol/L,以氯化镉作为镉源(CdCl2·2.5H2O,纯度≥99.0%,购自北京百灵威科技有限公司)。处理分别设置为对照(CK,不添加Cd和MT)、Cd处理(连续Cd胁迫7 d)、MT+Cd处理(连续Cd胁迫7 d同时每天均匀喷施200 μmol/L褪黑素10 mL于叶片正反面),褪黑素试剂购自北京索莱宝公司,分析纯标准。为防止强光降解褪黑素,喷施时间为19:00,每天喷施1次,持续7 d后,自下而上剪取烟株第4张叶进行各项指标测定。地下部样品取样前置于EDTA-Na2(20 mmol/L)溶液中浸泡15 min,然后用去离子水润洗后吸干表面水分,将样品分别收集于事先标记好的锡纸中,迅速置于液氮,冷冻5 min后放入-80 ℃超低温冰箱保存,用于镉含量的测定。
1.2 测定项目与方法
1.2.1 生物量测定
用刻度尺测量各处理烟苗的根长、最大叶长和最大叶宽,最大叶面积=最大叶长×最大叶宽×0.634 5[22]。使用电子天平测定烟苗样品的鲜质量。将烟草样品放入烘箱,先在 105 ℃ 杀青30 min,而后在70 ℃环境的烘箱中将样品烘干至恒重[23]。使用电子天平分别测定根部、茎部和叶部的干质量。
1.2.2 光合特性指标和叶绿素含量测定
使用便携式光合测定仪(Li-6400,美国LI-COR公司)于09:00—11:00测定各处理叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr);叶绿素含量的测定参照Wang等的方法[24]。
1.2.3 Cd含量测定
将烘干后的样品粉碎过60目筛,称取样品0.4 g(精确至0.000 1 g)置于微波消解管(CEM-Mars,USA)中,并加入6 mL硝酸和2 mL H2O2进行消解,随后使用ICP-OES(Vista-MPX,USA)测定消解后样品溶液中的镉含量。
1.2.4 抗氧化酶活性、丙二醛(MDA)和渗透调节物质含量测定
超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性和脯氨酸(Pro)含量采用北京北京索莱宝科技有限公司生产的检测试剂盒测定。MDA含量和可溶性糖含量采用苏州科铭生物技术有限公司生产的检测试剂盒测定。
1.2.5 叶绿素荧光参数测定
采用Li-6800便携式光合测定仪测定烟草叶绿素荧光参数,测定前烟草在黑暗条件下适应24 h,测定光系统Ⅱ的光化学效率(Fv/Fm),在实际培养光强下适应1 h,待荧光信号稳定后测定烟草叶片能量捕获效率(Fv′/Fm′)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)、电子传递速率(ETR)和光系统Ⅱ效率(ΦPSⅡ)。
1.2.6 植物激素含量测定
利用LC-ESI-MS/MS系统(HPLC,Shimadzu UFLC SHIMADZU CBM30A system;MS,Applied Biosystems 6500 Triple Quadrupole),检测烟草叶片中植物激素绝对含量。在各处理组中随机取9株烟苗,3株烟苗混合为1个重复进行取样,共3个重复进行测序。借助粉碎机将烟草叶片组织粉碎至粉末状态,称取50 mg加入适量内标,用甲醇/水/甲酸溶液(15 ∶4 ∶1,1 mL)提取样本,然后用80%甲醇(100 μL)复溶提取液并进行LC-MS/MS分析。依次配制0.01、0.05、0.1、0.5、1、5、10、50、100、200、500 ng/mL浓度的标准品溶液,获取各浓度标准品的对应定量信号的质谱峰强度。
1.3 数据分析
利用SPSS 19.0和Origin 9.0进行统计分析和图表制作,多重比较选用Duncans法,在0.05显著水平上比较差异。
2 结果与分析
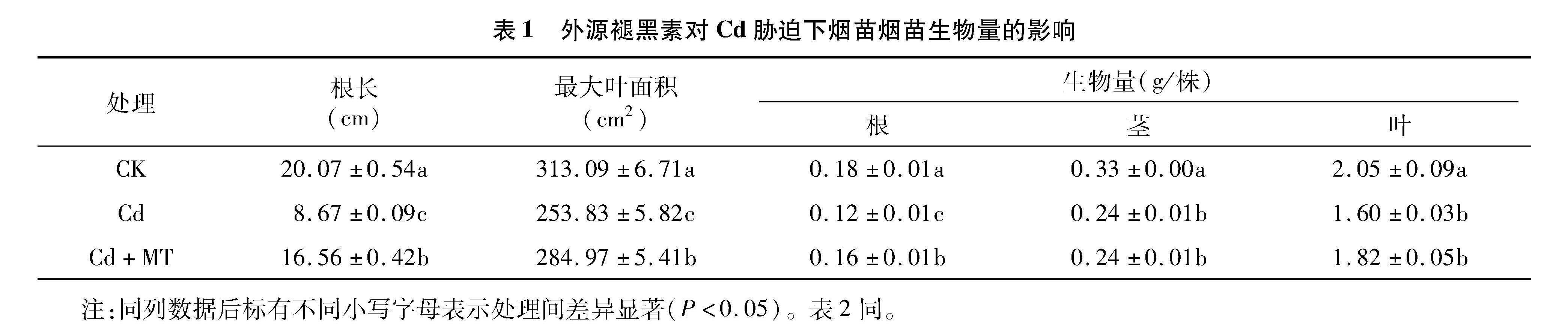
2.1 外源褪黑素对Cd胁迫下烟草幼苗生物量的影响
植物干物质积累量(生物量)是反映其生长状况最直观的指标。由表1可知,与CK相比,Cd胁迫处理烟苗根长、最大叶面积、根生物量、茎生物量和叶生物量均显著降低(P<0.05)。与Cd处理相比,Cd+MT 处理烟苗的根长显著增加了91.0%,最大叶面积显著增加了12.3%,根生物量显著增加了33.3%,叶生物量增加了13.8%,而茎生物量保持不变。表明Cd胁迫下,200 μmol/L外源褪黑素能促进Cd胁迫下烟苗生长。
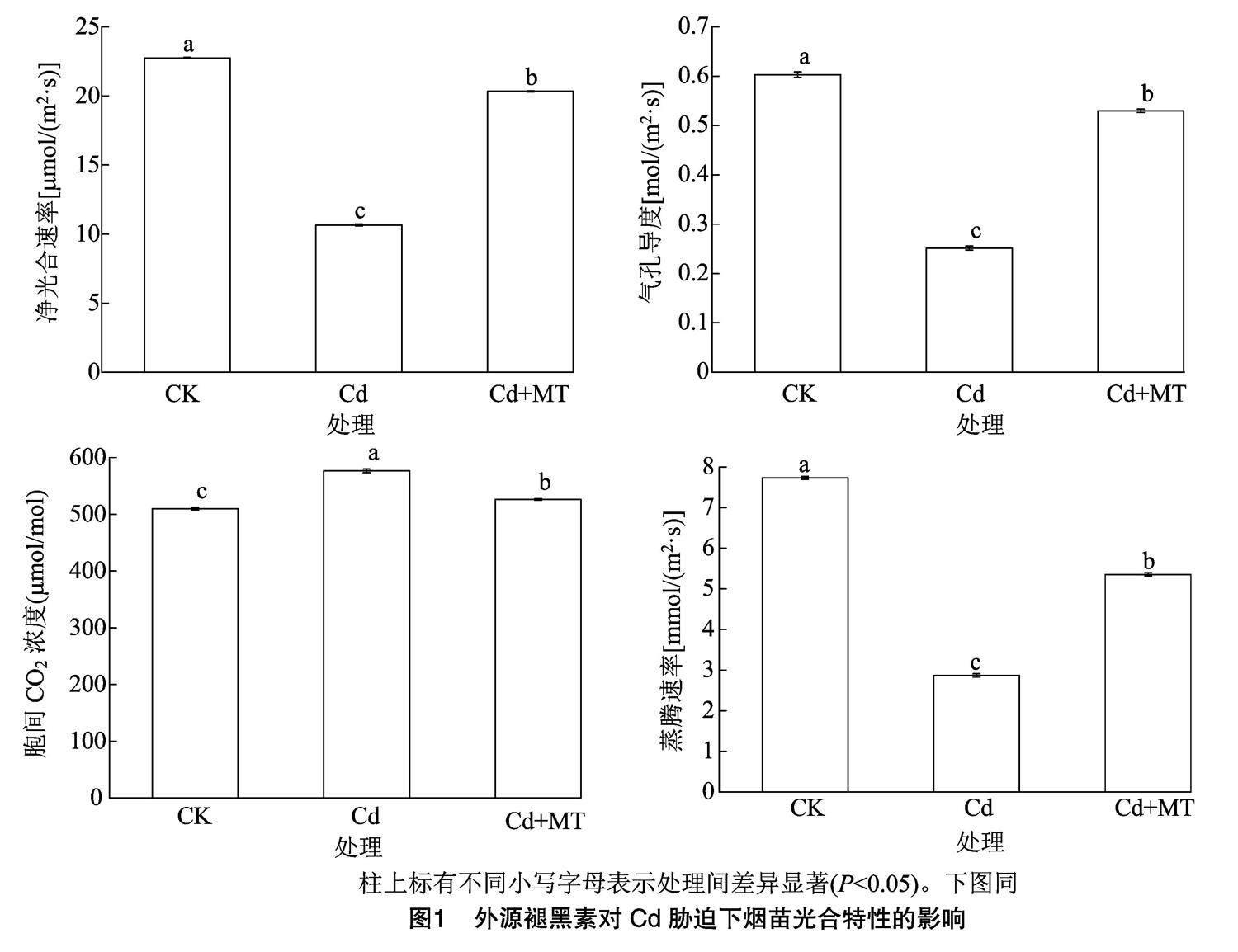
2.2 外源褪黑素对Cd胁迫下烟草幼苗光合参数的影响
对各处理幼苗的光合特性进行测定,具体如图1所示。与CK相比,Cd胁迫处理烟苗叶片的净光合速率、气孔导度和蒸腾速率均显著降低,胞间CO2浓度显著升高。与Cd处理相比,Cd+MT处理的烟苗叶片的净光合速率、气孔导度和蒸腾速率均显著增加,胞间CO2浓度显著降低。表明Cd胁迫下,200 μmol/L外源褪黑素对Cd胁迫下烟苗光合作用具有显著的保护作用。
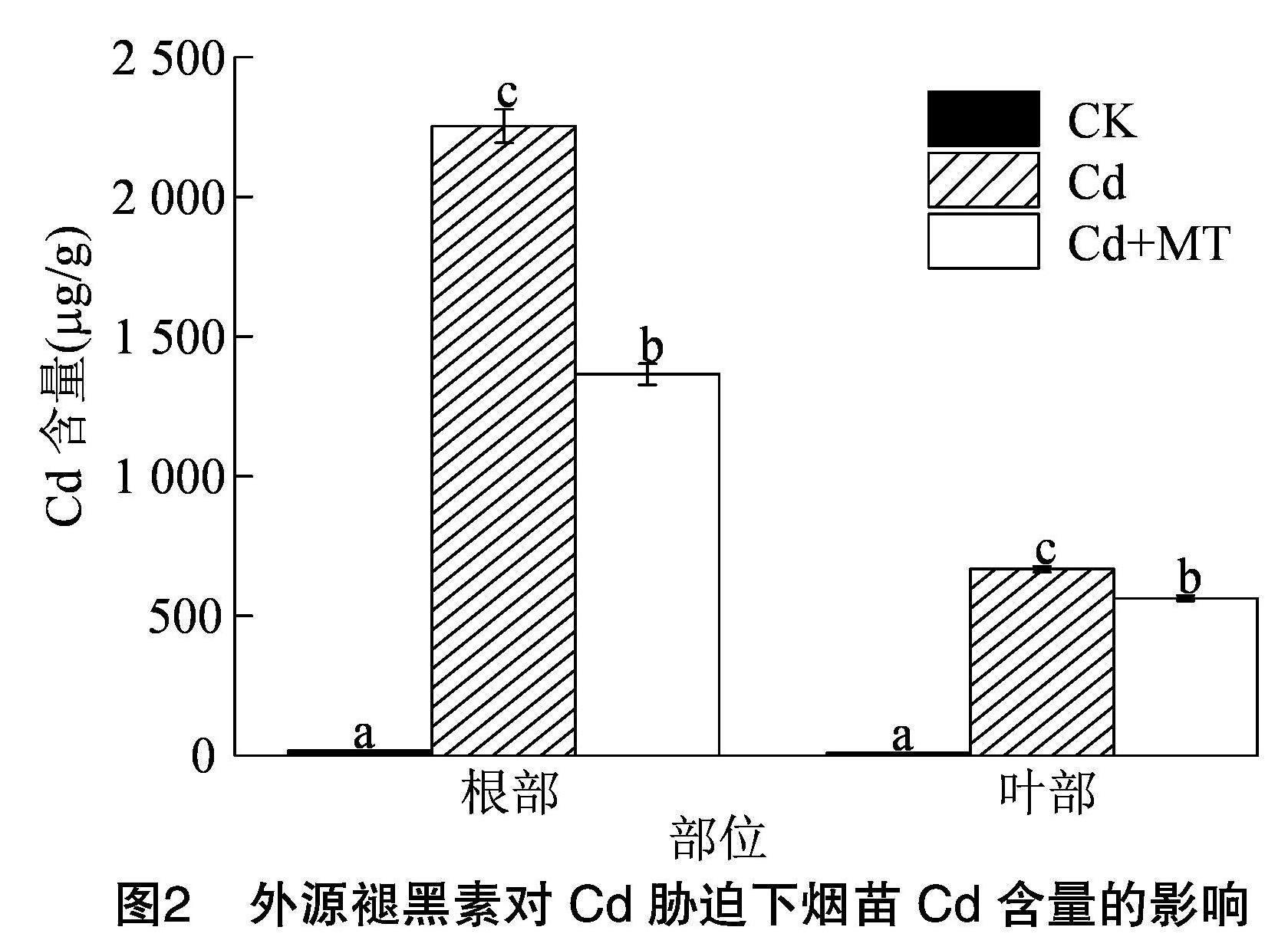
2.3 外源褪黑素对Cd胁迫下烟草Cd含量的影响
对不同处理下烟草幼苗体内Cd含量进行测定,具体如图2所示。与CK相比,Cd胁迫显著提高了烟草幼苗体内Cd含量,分别是CK的123.4倍(根部)、70.2倍(叶部)。而与Cd处理相比,Cd+MT处理的烟苗根部和叶片的Cd含量显著降低,降幅分别为39.4%和15.7%。说明Cd胁迫下,200 μmol/L 外源褪黑素处理能够显著抑制烟草幼苗对镉的吸收。
2.4 外源褪黑素对Cd胁迫下烟草幼苗抗氧化酶活性的影响
抗氧化酶活性是反映植物抗氧化能力的重要指标。由图3可知,与CK相比,Cd胁迫显著增强了烟草幼苗叶片及根中SOD、POD和CAT的活性,叶部增幅分别为296.4%、148.6%、181.3%,根部增幅分别为393.5%、120.9%、159.4%。与Cd处理相比,Cd+MT处理进一步提高了SOD、POD和CAT酶活性,叶部增幅分别为124.1%、101.1%、38.7%,根部增幅分别为112.6%、127.5%、35.5%,均达显著水平。结果表明,200 μmol/L外源褪黑素处理能够显著提高Cd胁迫下烟草体内抗氧化酶活性。
2.5 外源褪黑素对Cd胁迫下烟草幼苗MDA活性的影响
MDA是衡量氧化胁迫程度的常用指标之一,其含量的高低一定程度上可以反映植物在逆境胁迫下膜脂过氧化的程度。由图4可知,烟苗根的MDA含量明显低于叶片。与CK相比,Cd胁迫处理烟苗叶片及根中MDA含量显著提高,增幅分别为81.7%和66.7%。而与Cd处理相比,Cd+MT处理的烟苗叶片及根中MDA含量显著降低,降幅分别为33.1%和21.9%。说明Cd胁迫下200 μmol/L外源褪黑素处理可以通过降低过氧化物含量来减轻氧化损伤,缓解烟草Cd胁迫。
2.6 外源褪黑素对Cd胁迫下烟草幼苗渗透调节物质含量的影响
脯氨酸和可溶性蛋白是植物的主要渗透调节物质。由图5可知,与CK相比,Cd胁迫处理的烟苗叶片及根中脯氨酸和可溶性蛋白含量均显著增加,脯氨酸含量的增幅分别为93.6%(叶部)、91.4%(根部),可溶性蛋白含量的增幅分别为67.0%(叶部)、85.2%(根部)。与Cd处理相比,施
用200 μmol/L MT处理的幼苗叶片及根中脯氨酸含量分别显著提高19.5%、20.8%,可溶性蛋白含量分别显著提高29.1%、3.8%。说明200 μmol/L外源褪黑素处理可以通过增加烟草幼苗体内渗透调节物质含量,缓解烟草Cd胁迫。
2.7 外源褪黑素对Cd胁迫下烟草幼苗光合色素含量的影响
对不同处理下烟草幼苗叶片的叶绿素含量进行测定,具体如图6所示。与CK相比,Cd胁迫处理烟草幼苗叶片叶绿素含量显著降低33.7%(叶绿
素a含量下降24.2%,叶绿素b含量下降43.0%),类胡萝卜素含量显著降低89.7%。与Cd处理相比,Cd+MT处理的幼苗叶片叶绿素含量显著提高了39.0%(叶绿素a含量提高31.1%,叶绿素b含量提高49.3%),类胡萝卜素含量显著提高557.1%。说明200 μmol/L外源褪黑素处理能够显著提高烟草幼苗叶片光合色素含量,缓解烟草Cd胁迫。
2.8 外源褪黑素对Cd胁迫下烟草幼苗叶绿素荧光参数的影响
PSⅡ荧光参数的变化能够准确反映叶片的光合生理状态。由表2可知,与CK相比,Cd胁迫处理烟苗叶片的Fv/Fm、Fv′/Fm′、qP、ETR和ΦPSⅡ分别降低7.8%、34.1%、22.1%、30.7%和24.6%,NPQ升高34.0%,差异均达显著水平。与Cd处理相比,Cd+MT处理的烟苗叶片的Fv/Fm、Fv′/Fm′、qP、ETR和ΦPSⅡ分别显著升高6.7%、39.9%、17.0%、37.5%和14.3%,NPQ显著降低12.1%。说明 200 μmol/L 外源褪黑素可以减弱Cd对烟苗叶片荧光的不利影响。
2.9 外源褪黑素对Cd胁迫下烟草幼苗激素含量的影响
植物激素对植物的生长发育产生显著的调节作用。由图7可知,与CK相比,Cd胁迫处理烟苗叶片的生长素(IAA)、赤霉素(GA)和1-氨基环丙烷羧酸(ACC)含量均显著降低,脱落酸(ABA)含量显著升高。IAA、GA和ACC含量的降幅分别为27.6%、16.4%和22.8%,ABA含量的增幅为40.4%。与Cd处理相比,Cd+MT处理的烟苗叶片的IAA、GA和ACC含量分别提高了17.1%、12.3%和15.9%,ABA含量降低了16.6%,均达显著水平。说明200 μmol/L外源褪黑素处理对烟苗叶片的激素合成代谢有显著影响。
3 讨论与结论
重金属胁迫下植物生长的适应机制是作物逆境生物学研究的核心问题之一,提高作物应对重金属胁迫的能力已成为我国耕地土壤镉污染状况随工业化的快速发展日益严重背景下维持农业生产力的紧迫目标之一[25]。生物量是反映植物响应重金属胁迫最直接的表现[26]。植物体内的重金属含量是评价植物修复效果好坏的最直接指标[27]。本研究中,Cd胁迫导致烟草幼苗根长、最大叶面积以及根、茎、叶的生物量显著降低,外源褪黑素处理有效缓解了Cd胁迫对烟草幼苗生长的抑制作用。研究表明,褪黑素参与植物体内多种代谢途径,并具有良好的缓解植物镉胁迫的能力[28-29]。吕怡颖等研究发现,施用外源褪黑素可以降低烟草幼苗对Cd的富集,减少对Cd的吸收和积累,降低烟苗体内各部位的Cd含量[27]。本研究中,与Cd处理相比,Cd+MT 处理的烟苗根部镉含量显著降低39.4%,叶部镉含量显著降低15.7%,与张盛楠等的研究结果[30]一致。
重金属胁迫引起植株体内的ROS大量积累,氧化DNA、蛋白质、细胞膜脂等生物大分子,导致细胞代谢失衡紊乱,氧化还原失衡[26],其中丙二醛是细胞膜脂过氧化的最终产物,可以用来反映细胞膜的受损程度[31]。本研究中,Cd胁迫后烟草幼苗体内MDA含量显著升高,而与Cd处理相比,Cd+MT处理的烟苗体内MDA含量显著降低,说明褪黑素能够减少脂质过氧化产物的积累。褪黑素最初的功能是作为一种自由基清除剂清除体内过多的活性氧和活性氮,从而保护植物细胞免受氧化损伤[12]。以往研究表明,外源施用褪黑素能够明显减少小麦、芥菜、玉米、水稻和百日草植株体内的ROS水平和细胞膜脂过氧化程度,同时增强抗氧化防御系统[32-36]。本研究也发现,Cd胁迫下烟苗体内SOD、POD、CAT活性增强,且外源褪黑素处理进一步显著增强了这3个抗氧化酶的活性。另外,重金属胁迫下植物体内脯氨酸和可溶性蛋白含量增加,从而保护细胞膜结果和调节细胞质的渗透平衡[37],这与本研究结果一致,而外源褪黑素的施用则进一步促进了脯氨酸及可溶性蛋白含量的提高。
镉胁迫会导致植物叶绿体受损,抑制叶绿素的合成,影响植物的光合作用[38]。本研究中Cd胁迫显著降低烟苗的光合色素含量(叶绿素a含量下降24.2%,叶绿素b含量下降43.0%,类胡萝卜素含量下降89.7%)、净光合速率、气孔导度和蒸腾速率,而胞间CO2浓度显著升高,在甜高粱和蒌蒿中也有同样的结果[39-40]。外源褪黑素处理显著提高了烟苗的光合色素含量、净光合速率、气孔导度和蒸腾速率,显著减少了胞间CO2浓度。结果表明,褪黑素可能通过诱导叶绿体基因的表达和增强相关酶的活性来增加叶绿素的合成。这种增加的叶绿素含量有助于提高光能吸收和光合作用效率,从而增强植物对Cd胁迫的适应能力。
叶绿素荧光和光合作用的关系十分密切,叶绿素荧光参数可以反映出逆境因子对植物光合作用机制以及光合生理状况的损伤程度[4]。Yang等研究发现,叶面喷施褪黑素能够显著增加茶树叶片的Fv/Fm、ΦPSⅡ、ETR、qP,显著降低NPQ,从而有效提高叶片的光能利用率[41]。本研究结果显示,Cd胁迫下施用外源褪黑素显示出更高的Fv/Fm和ΦPSⅡ,这暗示褪黑素能够维持光系统Ⅱ的功能稳定性,减少Cd胁迫引起的光合作用损失。同时与Cd组相比,Cd+MT组的烟苗也表现出更高的ΦPSⅡ,这可能意味着褪黑素有助于保护和维持光系统Ⅱ的光能利用效率,在Cd胁迫下优化光合作用过程。此外,Cd+MT组的烟苗相较于Cd组显示出较低的NPQ,即叶片的非光化学耗散能力降低。这可能意味着褪黑素能够减少叶片中的光能耗散,从而防止过量的能量积累,减轻光损伤的发生。
植物激素是指在植物体内合成的、通常从合成部位运往作用部位、对植物的生长发育产生显著调节作用的微量有机物质,广泛参与了逆境等多种生理活动的调节,其对植物生理活动的调节会涉及自身浓度的变化[42-44]。本研究中,Cd胁迫显著降低了烟苗叶片的IAA、GA和ACC含量,显著提高了ABA含量,而褪黑素处理显著提高IAA、GA和ACC的含量,并显著降低ABA含量。这与李冬等的研究结果[4]一致。
综上所述,本研究结果表明,叶面喷施 200 μmol/L 褪黑素对Cd胁迫下的烟草幼苗生长和生理特性具有正向调节作用。褪黑素能通过提高SOD、POD、CAT这些抗氧化酶的活性并降低过氧化产物MDA的含量来增强烟苗的抗氧化能力,减轻烟苗在Cd胁迫下的氧化损伤,降低Cd胁迫下烟苗叶绿素降解,提高其光合性能并降低烟苗体内Cd含量,进而提高烟苗对Cd胁迫的耐受性,缓解烟草Cd胁迫。同时,褪黑素可能通过抑制ABA和提高IAA、GA和ACC水平来缓解Cd胁迫对植物的损伤,但仍需进一步的研究来明确其作用机制。
参考文献:
[1]邓小鹏,何 莲,夏 妍,等. 不同固化剂对土壤Cd的固化及烟草地上部Cd含量的影响[J]. 江苏农业科学,2017,45(3):246-249.
[2]Claeys H,Inzé D. The agony of choice:how plants balance growth and survival under water-limiting conditions[J]. Plant Physiology,2013,162(4):1768-1779.
[3]Chen Z,Xu J Y,Wang F Z,et al. Morpho-physiological and proteomic responses to water stress in two contrasting tobacco varieties[J]. Scientific Reports,2019,9:18523.
[4]李 冬,申洪涛,王艳芳,等. 外源褪黑素对干旱胁迫下烟草幼苗光合碳同化和内源激素的影响[J]. 草业学报,2021,30(1):130-139.
[5]Lerner A B,Case J D,Takahashi Y,et al. Isolation of melatonin,the pineal gland factor that lightens melanocytes1[J]. Journal of the American Chemical Society,1958,80(10):2587.
[6]Pggeler B,Balzer I,Hardeland R,et al. Pineal hormone melatonin oscillates also in the dinoflagellate Gonyaulax polyedra[J]. Naturwissenschaften,1991,78(6):268-269.
[7]Tilden A R,Becker M A,Amma L L,et al. Melatonin production in an aerobic photosynthetic bacterium:an evolutionarily early association with darkness[J]. Journal of Pineal Research,1997,22(2):102-106.
[8]Dubbels R,Reiter R J,Klenke E,et al. Melatonin in edible plants identified by radioimmunoassay and by high performance liquid chromatography-mass spectrometry[J]. Journal of Pineal Research,1995,18(1):28-31.
[9]Maronde E,Stehle J H. The mammalian pineal gland:known facts,unknown facets[J]. Trends in Endocrinology & Metabolism,2007,18(4):142-149.
[10]Pandi-Perumal S R,Trakht I,Srinivasan V,et al. Physiological effects of melatonin:role of melatonin receptors and signal transduction pathways[J]. Progress in Neurobiology,2008,85(3):335-353.
[11]Carrillo-Vico A,Lardone P J,Alvarez-Sánchez N,et al. Melatonin:buffering the immune system[J]. International Journal of Molecular Sciences,2013,14(4):8638-8683.
[12]Arnao M B,Hernández-Ruiz J.Melatonin:a new plant hormone and/or a plant master regulator?[J]. Trends in Plant Science,2019,24(1):38-48.
[13]Arnao M B,Hernández-Ruiz J.Melatonin:plant growth regulator and/or biostimulator during stress?[J]. Trends in Plant Science,2014,19(12):789-797.
[14]向 君,樊利华,张楠楠,等. 施磷对干旱胁迫下箭竹根际土壤养分及微生物群落的影响[J]. 生态学报,2021,41(23):9422-9431.
[15]Janas K M,Posmyk M M.Melatonin,an underestimated natural substance with great potential for agricultural application[J]. Acta Physiologiae Plantarum,2013,35(12):3285-3292.
[16]Li X,Ahammed G J,Zhang X N,et al. Melatonin-mediated regulation of anthocyanin biosynthesis and antioxidant defense confer tolerance to arsenic stress in Camellia sinensis L.[J]. Journal of Hazardous Materials,2021,403:123922.
[17]Gong X Q,Shi S T,Dou F F,et al. Exogenous melatonin alleviates alkaline stress in Malus hupehensis Rehd. by regulating the biosynthesis of polyamines[J]. Molecules,2017,22(9):1542.
[18]Meng J F,Xu T F,Wang Z Z,et al. The ameliorative effects of exogenous melatonin on grape cuttings under water-deficient stress:antioxidant metabolites,leaf anatomy,and chloroplast morphology[J]. Journal of Pineal Research,2014,57(2):200-212.
[19]Siddiqui M H,Alamri S,Al-Khaishany M Y,et al. Exogenous melatonin counteracts NaCl-induced damage by regulating the antioxidant system,proline and carbohydrates metabolism in tomato seedlings[J]. International Journal of Molecular Sciences,2019,20(2):353.
[20]Yamamoto H A,Mohanan P V.Effects of melatonin on paraquat or ultraviolet light exposure-induced DNA damage[J]. Journal of Pineal Research,2001,31(4):308-313.
[21]Siddiqui M H,Alamri S,Khan M N,et al. Melatonin and calcium function synergistically to promote the resilience through ROS metabolism under arsenic-induced stress[J]. Journal of Hazardous Materials,2020,398:122882.
[22]李 格,代 快,李江舟,等. 烟秆生物炭与化肥配施对烟草生长及产量的影响[J]. 中国土壤与肥料,2022(3):91-100.
[23]Yu Y,Wan Y N,Wang Q,et al. Effect of humic acid-based amendments with foliar application of Zn and Se on Cd accumulation in tobacco[J]. Ecotoxicology and Environmental Safety,2017,138:286-291.
[24]Wang P,Sun X,Li C,et al. Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple[J]. Journal of Pineal Research,2013,54(3):292-302.
[25]国土资源部. 环境保护部和国土资源部发布全国土壤污染状况调查公报[J]. 资源与人居环境,2014(4):26-27.
[26]张 晓,张环纬,陈 彪,等. 外源硅及水杨酸对镉胁迫下烟草幼苗生长和生理特性的影响[J]. 中国农业科技导报,2019,21(3):133-140.
[27]吕怡颖,王继明,郑元仙,等. 外源褪黑素对镉胁迫下烟草幼苗生长和耐镉性的影响[J/OL]. 分子植物育种,2022. (2022-04-12)[2023-08-01]. https://www.cnki.com.cn/Article/CJFDTotal-FZZW2022 0330008.htm.
[28]王庆安,陈碧华,赵戴军. 外源海藻酸钠对镉胁迫下黄瓜幼苗镉吸收及生长的调控效应[J]. 江苏农业科学,2022,50(10):145-150.
[29]姚 欢,王 铤,刘 磊,等. 褪黑素对大头菜幼苗生长及镉积累的影响[J]. 土壤,2019,51(5):1001-1005.
[30]张盛楠,黄益宗,李 颜,等. Cd胁迫下不同外源植物激素对水稻幼苗抗氧化系统及Cd吸收积累的影响[J]. 环境科学,2021,42(4):2040-2046.
[31]Tang T,Kang W,Shen M,et al. Accumulation mechanism and risk assessment of Artemisia selengensis seedling in vitro with the hydroponic culture under cadmium pressure[J]. International Journal of Environmental Research and Public Health,2022,19(3):1183.
[32]张 珂,李 依,厉萌萌,等. 外源褪黑素对镉胁迫下小麦幼苗生长生理特征及镉含量的影响[J]. 轻工学报,2022,37(4):111-117.
[33]万 常. 外源褪黑素对芥菜镉毒害的缓解效应研究[D]. 长沙:中南林业科技大学,2022.
[34]闫 艳. 褪黑素及其与硅复合应用对玉米生长和耐镉性的影响[D]. 新乡:河南科技学院,2022:41-43.
[35]李 佳. 外源褪黑素对铜胁迫下水稻幼苗的生理指标影响及转录组分析[D]. 杭州:杭州师范大学,2022:58-59.
[36]朱红霞,李赛楠,苏文青,等. 外源褪黑素对铬胁迫下百日草种子萌发及幼苗生理特性的影响[J]. 山东农业科学,2022,54(9):64-69.
[37]张 云. 吲哚乙酸及褪黑素对菊芋铝毒响应的调控作用[D]. 金华:浙江师范大学,2021:66-67.
[38]Abbasi G H,Akhtar J,Anwar-ul-Haq M,et al. Morpho-physiological and micrographic characterization of maize hybrids under NaCl and Cd stress[J]. Plant Growth Regulation,2015,75(1):115-122.
[39]郝正刚,王志恒,魏玉清,等. 外源钙镉处理对甜高粱幼苗叶片光合作用的影响[J]. 江苏农业科学,2019,47(19):75-80.
[40]周小梅,董 萌,余红兵,等. 促生菌对Cd胁迫下蒌蒿光合特性的影响[J]. 草地学报,2022,30(2):348-355.
[41]Yang N,Han M H,Teng R M,et al. Exogenous melatonin enhances photosynthetic capacity and related gene expression in a dose-dependent manner in the tea plant[Camellia sinensis (L.) Kuntze][J]. International Journal of Molecular Sciences,2022,23(12):6694.
[42]张雪峰. 低温胁迫对玉米种子萌发过程中内源激素含量变化的影响[J]. 沈阳农业大学学报,2011,42(2):147-151.
[43]李 蒙,范高领,张 燕,等. 外源2,4-表油菜素内酯(EBR)对弱光胁迫下黄心菜生长和碳水化合物代谢的影响[J]. 南方农业学报,2019,50(5):1028-1034.
[44]范军强,路晓明,王会文,等. 低温胁迫下甘蓝型冬油菜抗寒性与叶片激素含量的关联性[J]. 江苏农业学报,2023,39(1):15-21.

