滇龙胆C2H2基因家族鉴定及响应茉莉酸甲酯诱导表达分析
谷云霞 王梦琦 张婷 单李铭 刘小莉

摘要:滇龙胆(Gentiana rigescens)是龙胆药材的基源植物之一,C2H2锌指蛋白是锌指蛋白家族中的一个大家族,其成员在1年生滇龙胆转录中最为丰富,本研究拟在对滇龙胆转录组中C2H2基因家族进行鉴定并分析响应茉莉酸甲酯(MeJA)诱导表达模式,为滇龙胆C2H2转录因子功能研究提供参考。基于滇龙胆转录组数据,利用NCBI、MAFFT、MEME、STRING等在线网站及TBtools 软件对其基因信息、进化关系、表达模式等进行分析。结果表明,从滇龙胆转录组中共鉴定出31 个含有C2H2保守结构域的序列(GrC2H2 1~GrC2H2 31),编码的氨基酸数量在53(GrC2H2 14)~604个(GrC2H2 31)之间,等电点介于4.23~9.92之间,且31 个家族成员都定位在细胞核中,其家族分为10 个亚家族,GrC2H2 5、GrC2H2 6、GrC2H2 8、GrC2H2 11、GrC2H2 17、GrC2H2 18、GrC2H2 19、GrC2H2 22、GrC2H2 23 和GrC2H2 31 共10个转录因子为滇龙胆C2H2转录因子的正调控因子。2种浓度MeJA诱导后C2H2表达模式显示,MeJA浓度越高,GrC2H2基因表达量越高。本研究首次鉴定了滇龙胆C2H2基因家族并分析了其响应MeJA表达模式,可为后续深入研究C2H2基因家族功能及滇龙胆优质品种的选育提供理论参考。
关键词:滇龙胆;生物信息学;C2H2 转录因子;基因表达;茉莉酸甲酯诱导
中图分类号:S567.23+9.01文献标志码:A
文章编号:1002-1302(2024)09-0051-07
滇龙胆(Gentiana rigescens Franch. ex Hemsl.)为龙胆科龙胆属多年生草本植物,是历版《中华人民共和国药典》规定的药材龙胆的基原植物之一,以干燥的根和根茎入药,具有清热燥湿、泻肝胆实火的功效[1],是龙胆泻肝颗粒、泻肝安神胶囊等多种中成药的原料[2]。裂环烯醚萜类物质如龙胆苦苷、獐牙菜苦苷、獐牙菜苷等为滇龙胆的主要活性成分[3]。上述成分的含量直接影响药材的品质及药用价值,因此通过调控裂环烯醚萜生物合成途径提高滇龙胆药材品质具有现实意义。
转录因子是生物体中调控基因转录的一类蛋白质,能直接结合或者间接作用于特定核苷酸序列,激活或抑制目标基因表达,其中C2H2锌指蛋白属于TFⅢ转录因子,是锌指蛋白家族中的一个大家族[4]。在功能上,既能结合 DNA 和 RNA,又能与蛋白质相互作用,具有转录调控、RNA 代谢等多种生物学功能[5] 。有关C2H2 型锌指蛋白在植物代谢调控方面的研究很少,研究发现拟南芥中AtZAT6基因正向调节花青素和总黄酮生物合成积累,C2H2转录因子可能影响佛手柠檬烯等单萜物质的释放量[6-7] 。滇龙胆转录组中共鉴定出2 637个unigene参与编码66个TF家族,其C2H2转录因子家族成员最为丰富(199个,占7.5%),其是否与裂环烯醚萜类成分的积累相关?这值得深入探讨。茉莉酸甲酯(MeJA) 作为一种植物激素,在植物次生代谢过程中起诱导信号传导作用,MeJA处理能显著诱导辣椒 C2H2 锌指蛋白基因CaZFs,且可能在防御信号转导中发挥作用[8]。这表明MeJA作为逆境信号物质可以诱导植物抗逆响应,能够刺激植物次生代谢产物的生物合成,但能否诱导GrC2H2基因表达、其表达趋势如何尚未见报道。本研究对1年生栽培滇龙胆进行转录组测序,挖掘出滇龙胆 C2H2 家族基因,与拟南芥(Arabidopsis thaliana) C2H2 家族基因对比鉴定滇龙胆C2H2 家族成员,并对其进行生物信息学分析,探讨MeJA诱导滇龙胆C2H2转录因子对裂环烯醚萜生物合成的调控作用,以期为后续解析滇龙胆C2H2 基因家族功能、基因调控网络构建和调控滇龙胆品质提供基础资料。
1 材料与方法
1.1 植物材料
试验材料于2022年8月在云南省大理白族自治州永平县滇龙胆种植基地(99°58′47″E,25°58′47″N,
海拔2 200 m)采集,经鉴定为龙胆科滇龙胆草(Gentiana rigescens Franch. ex Hemsl. ),利用Illumina Novaseq 6000 sequencing 转录组测序平台对100 mg/L(XZ)、300 mg/L(LZ)MeJA处理的1年生滇龙胆以及空白组(3个生物学重复)完成转录组测序。
1.2 滇龙胆C2H2基因家族成员鉴定及理化性质分析
根据滇龙胆转录组测序数据,筛选出滇龙胆C2H2的家族成员基因,将其基因上传到NCBI上的开放阅读框(ORF)中 (http://www.ncbi.nlm.nih.gov/gorf/gorf.html),获得全部蛋白质序列,并去除结构域过短的蛋白质序列。再将得到的滇龙胆C2H2基因家族蛋白序列上传到NCBI中进行Blast(http://blast.ncbi.nlm.nih.gov/)检索,去除非植物的C2H2基因家族的蛋白质序列,从而得到滇龙胆C2H2家族的候选基因。然后用ExPASy-ProtParam(https://web.expasy.org/protparam/)在线工具预测滇龙胆C2H2锌指蛋白的分子质量、氨基酸大小、等电点、不稳定系数、蛋白质疏水性等理化性质[9]。利用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)在线预测滇龙胆 C2H2蛋白的亚细胞定位情况。
1.3 滇龙胆C2H2系统发育树的构建
利用MAFFT 比对 和NJ/UPGMA 系统发育(https://mafft.cbrc.jp/alignment/server/index.html)在线网站对滇龙胆C2H2家族的氨基酸序列进行多比对分析并以拟南芥C2H2基因家族作为参考序列,然后用比对结果构建系统发育树,参数选择默认值,再将系统发育树用iTOL(https://itol.embl.de/)网站进行美化,从而确定滇龙胆C2H2转录因子的分类。
1.4 滇龙胆C2H2 基因保守结构域和基序分析
运用 MEME(http://meme-suite. org/tools/meme)网站对滇龙胆C2H2家族蛋白做基序分析,识别的基序数设置为10,其余参数设置为默认值。通过NCBI(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/cdd/wrpsb.cgi)网站的CD-search分析滇龙胆C2H2基因家族成员的保守结构域。然后利用TBtools软件将滇龙胆C2H2基因家族成员的进化树、基序以及保守结构域合并处理并进行可视化分析[10]。
1.5 滇龙胆C2H2基因家族蛋白互作网络分析
以拟南芥(Arabidopsis thaliana)作为模式植物,置信度阈值为0.15,利用 STRING蛋白互作数据库(http://string-db. org/)分析滇龙胆C2H2 蛋白互作模式,分析其基因共表达情况。
1.6 滇龙胆C2H2蛋白表达模式分析
以空白(ZK)、100 mg/L(XZ) 、300 mg/L(LZ)MeJA处理的转录组测序数据为基础,依据FPKM值,用TBtools软件绘制滇龙胆C2H2基因表达热图并进行可视化分析。
2 结果与分析
2.1 滇龙胆C2H2基因家族理化性质分析
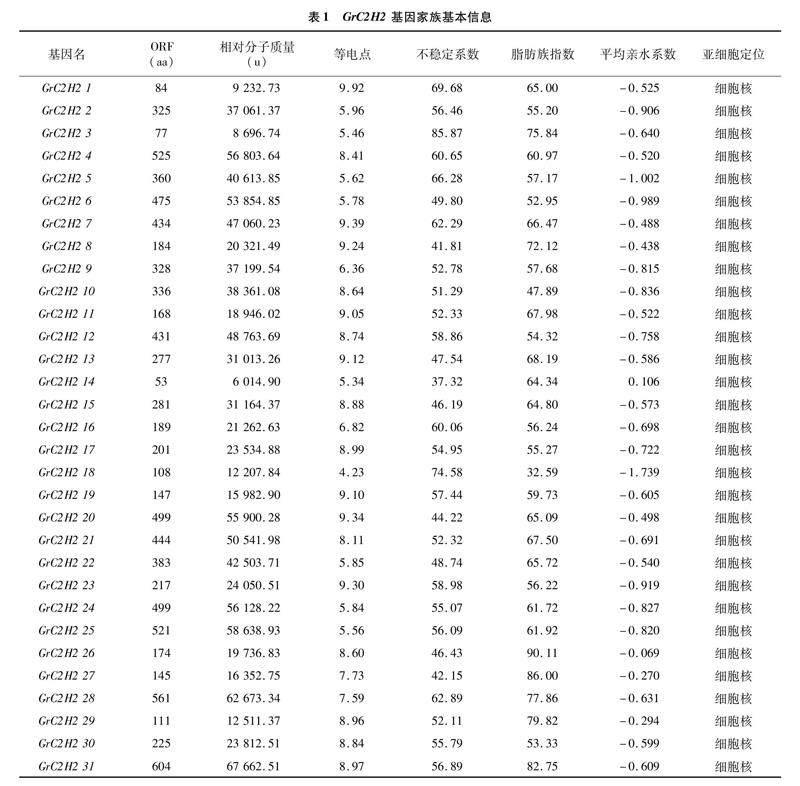
通过NCBI的OFR与Blast数据库的比对与分析,从滇龙胆基因组中共鉴定出31个含有C2H2保守结构域的序列,并将所得序列依次命名为 GrC2H2 1~ GrC2H2 31(表1)。蛋白理化性质分析结果显示,31 个GrC2H2基因的编码氨基酸数量在53(GrC2H2 14)~ 604个(GrC2H2 31)之间,差异相对较大;相对分子质量介于6 014.90(GrC2H2 14)~
67 662.51(GrC2H2 31)u之间;最大理论等电点为 9.92,最小为4.23,平均值为7.73,其中只有GrC2H2 14不稳定系数小于40,为稳定蛋白。除了GrC2H2 14,其他GrC2H2成员的平均亲水系数都为负值,因此滇龙胆C2H2家族蛋白多数为不稳定的亲水蛋白。此外,亚细胞定位预测结果显示,31 个家族成员都定位到细胞核中,推测滇龙胆C2H2转录因子可能都在细胞核中发挥作用。
2.2 滇龙胆C2H2基因的系统发育分析
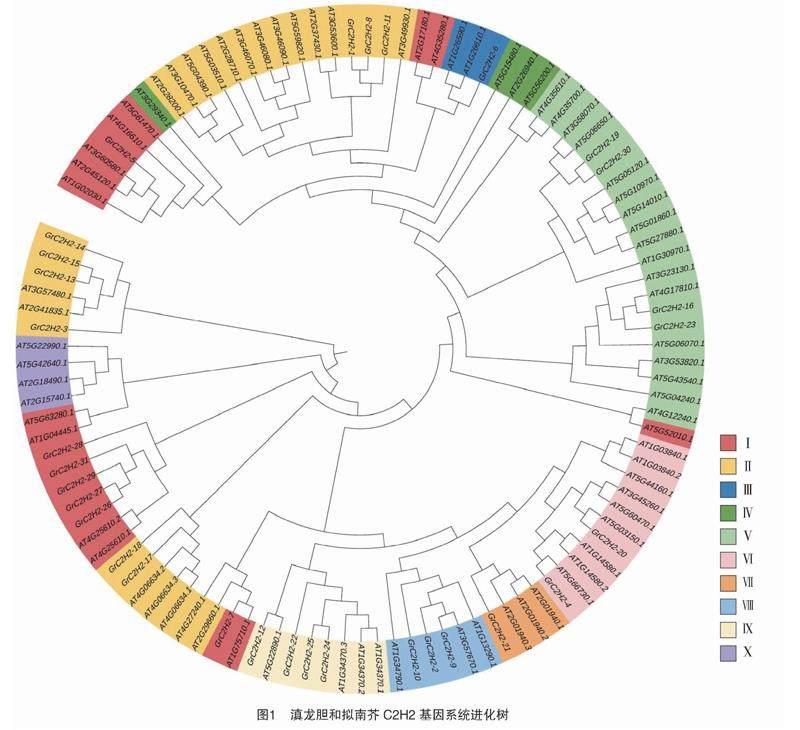
为准确了解滇龙胆C2H2各基因间的亲缘关系和生物学联系,利用MAFFT 比对和NJ/UPGMA 系统发育网站将滇龙胆C2H2和拟南芥C2H2的家族成员构建系统进化树(图1),并结合PlantTFDB拟南芥数据库和 Englbrecht 等的分类方法[11]进行分类,结果显示,滇龙胆C2H2家族分为10 个亚家族,除了Ⅳ、Ⅹ亚家族中无滇龙胆C2H2家族成员外,Ⅰ、Ⅱ、Ⅲ、Ⅴ、Ⅵ、Ⅶ、Ⅷ、Ⅸ中分别含有7、9、1、4、2、1、3、4 个滇龙胆C2H2家族成员。通过滇龙胆C2H2型转录因子与拟南芥C2H2型转录因子在系统进化上的同源关系,推测两者可能在某些生物学功能上起着相同或相似的作用[10]。
2.3 滇龙胆C2H2基因家族进化树、保守基序与结构域分析
通过TBtools软件将GrC2H2基因家族成员的进化树、基序以及保守结构域合并处理并进行[JP3]可视化分析,结果(图2)显示,有28 个基因中存在motif 1,其次分别有9、7个基因成员中分别存在motif 8和motif 4,而GrC2H2 1、GrC2H2 8、GrC2H2 11、GrC2H2 19、GrC2H2 30、GrC2H2 16、GrC2H2 23、GrC2H2 5、GrC2H2 6和GrC2H2 17只含有motif 1。GrC2H2 25、GrC2H2 24、GrC2H2 22和GrC2H2 12含有相似的保守基序,且以上4个成员在系统进化关系上同属Ⅸ亚家族,这可能与其行使某些特定的功能有关。然后,根据CDD在线数据库检测保守功能结构域,发现有9 个GrC2H2基因含有zf-C2H2_6保守功能结构域,有3 个GrC2H2基因含有zf-C2H2保守功能结构域,有1个GrC2H2基因含有 zf-C2H2_8 保守功能结构域。
2.4 滇龙胆C2H2基因家族蛋白互作网络分析
通过STRING数据库,把拟南芥作为模式植物对GrC2H2基因家族成员进行蛋白互作及共表达预测分析,结果(图3-A)显示,11个GrC2H2成员之间有互作关系,其中AT3G46080.1(对应的滇龙胆同源蛋白为GrC2H2 11)属于网络中的主要中心节点,其余10 个拟南芥C2H2蛋白互相之间有着强或弱的相互作用关系。其中,AT5G03150.1(GrC2H2 20)和AT1G03840.1(GrC2H2 4),以及AT3G46090.1([JP4]GrC2H2 11)、AT2G37430.1(GrC2H2 8)和AT3G46080.1(
GrC2H2 11)具有较强的相互作用关系。GrC2H2共表达结果(图3-B)显示,只有少数基因间存在共表达,其中,ZAT 7(GrC2H2 11)的基因共表达水平明显高于其他成员。
2.5 滇龙胆C2H2基因家族成员表达模式分析
为了解GrC2H2在MeJA诱导下的表达模式情况,从滇龙胆转录组中挑选出 31 个GrC2H2基因家族成员的 FPKM 值,构建GrC2H2基因表达模式的热图,结果(图4)显示,不同GrC2H2基因在2个浓度MeJA处理后的表达量存在差异,表现为LZ组(300 mg/L)>
XZ组(100 mg/L)>ZK组(空白),可见MeJA的浓度影响GrC2H2基因的表达量,MeJA的浓度越高,GrC2H2基因的表达量越高。此外,数据结果显示,GrC2H2 5、GrC2H2 6、GrC2H2 8、GrC2H2 11、GrC2H2 17、GrC2H2 18、GrC2H2 19、GrC2H2 22、GrC2H2 23和GrC2H2 31 共10个转录因子为GrC2H2基因的正调控因子。
3 讨论
C2H2型转录因子是锌指蛋白中的一大类且广泛存在于真核生物中。据研究报道,目前已经在拟南芥和陆地棉等中分别鉴定到176、386 个C2H2型锌指蛋白[11-12]。而本研究中通过对滇龙胆草转录组数据进行生物信息学分析,共鉴定出31 个GrC2H2基因家族成员,且31个GrC2H2蛋白之间理化性质差异大。GrC2H2的亚细胞定位结果显示GrC2H2定位都在细胞核中,该定位结果与烟草、大麻、木薯的预测结果[5,10,13]一致,说明GrC2H2可能全部在细胞核中发挥作用。
为解析滇龙胆C2H2基因家族的亲缘关系及生物学联系,把拟南芥C2H2基因家族作为模式植物与滇龙胆C2H2基因家族进行系统发育分析,结果显示滇龙胆C2H2家族分为10 个亚家族,与拟南芥C2H2基因家族[11]和药用植物大麻C2H2基因家族[10]的分类基本相一致,与木薯C2H2基因家族(6 个亚家族)[13]和烟草 C2H2 基因家族(5 个亚家族)[5]的分类进行比较发现,滇龙胆的分类更多,表明滇龙胆C2H2基因在锌指蛋白C2H2 基因中分布很广。
根据其保守结构域的不同,锌指蛋白主要分为C2H2型、C4型和C6型[14],本研究中有9 个GrC2H2基因为C6型,有3 个GrC2H2基因为C2H2型。C2H2型锌指蛋白在调控植物的非生物胁迫抗性(包括干旱、盐、低温与铝等的胁迫)、生物胁迫抗性和生长发育中发挥关键调控作用[15]。本研究数据结果显示,不同亚家族之间差异明显,亚家族Ⅷ和Ⅸ中含有的motif 4 在其他亚家族都不存在,并且这个结构域与 C2H2 保守结构域紧密相连。研究表明,许多植物激素参与调控C2H2型锌指蛋白基因的表达,龙欧等研究发现,金荞麦C2H2-2基因是一个受MeJA诱导的C2H2型锌指蛋白转录因子,并通过激活芦丁生物合成关键酶基因FLS、PAL与 F3′5′H 的表达来促进芦丁的合成积累[16]。推断GrC2H2基因可能与激素胁迫有关,参与调控植物次生代谢物的合成积累。
GrC2H2基因编码蛋白互作网络分析结果表明,GrC2H2家族成员在植物生长发育及生物和非生物胁迫等应答过程中联系不是特别紧密,只有少部分基因体现出同源性,说明GrC2H2基因各成员之间相互作用关系较弱。其中,GrC2H2共表达结果显示,ZAT 7(GrC2H2 11)的基因共表达水平较高。研究表明,拟南芥ZAT 7(AT3G46090)基因对盐胁迫的耐受性更强,且在盐胁迫下主要在根中的表达有所提高[17],由此推测滇龙胆C2H2家族中的GrC2H2 11可能与拟南芥ZAT 7具有相似功能。
MeJA作为基因调控的诱导子,可上调或下调许多植物次生代谢物质基因的表达,是调控植物次生代谢物合成的重要激素[18]。Zheng等研究发现,AabHLH 1、AaYABBY 5和AaWRKY 17是青蒿素生物合成的受MeJA诱导的正调控因子[19]。本研究中,滇龙胆C2H2基因家族中经MeJA诱导处理后找到10个正调控因子,且GrC2H2基因在不同浓度MeJA处理后的表达量存在差异,MeJA的浓度越高GrC2H2基因的表达量越高,表明GrC2H2是一个受植物激素MeJA诱导的C2H2型锌指蛋白转录因子。本研究为深入挖掘和研究C2H2基因家族功能及滇龙胆优质品种的选育奠定了重要基础。
参考文献:
[1]国家药典委员会. 中华人民共和国药典:一部[M]. 北京:中国医药科技出版社,2020:99.
[2]沈 磊,谢文菠,王修波,等. 滇龙胆不同部位提取物保肝抗炎作用的研究[J]. 中成药,2017,39(4):701-705.
[3]韩 多,赵志莲,刘卫红,等. 3种龙胆属药用植物叶中主要有效成分的积累[J]. 中国医药工业杂志,2016,47(7):865-869.
[4]杨明磊,晁江涛,王大伟,等. 烟草C2H2锌指蛋白转录因子家族成员的鉴定与表达分析[J]. 遗传,2016,38(4):337-349.
[5]Ciftci-Yilmaz S,Mittler R. The zinc finger network of plants[J]. Cellular and Molecular Life Sciences,2008,65(7/8):1150-1160.
[6]Shi H T,Liu G Y,Wei Y X,et al. The zinc-finger transcription factor ZAT6 is essential for hydrogen peroxide induction of anthocyanin synthesis in Arabidopsis[J]. Plant Molecular Biology,2018,97(1/2):165-176.
[7]韩 婷,杜 方. 植物萜烯类合成的转录调控研究进展[J]. 山西农业科学,2020,48(10):1686-1692.
[8]Sharma R,Mahanty B,Mishra R,et al. Genome wide identification and expression analysis of pepper C2H2 zinc finger transcription factors in response to anthracnose pathogen Colletotrichum truncatum[J]. 3 Biotech,2021,11(3):118.
[9]苏文娟,陈 霞,曹瑞兰,等. 山苍子WRKY基因家族鉴定及表达分析[J]. 农业生物技术学报,2022,30(7):1290-1302.
[10]刘美琦,孙 伟,孟祥霄,等. 药用植物大麻C2H2基因家族鉴定与表达分析[J]. 药学学报,2021,56(5):1486-1496.
[11]Englbrecht C C,Schoof H,Bhm S. Conservation,diversification and expansion of C2H2 zinc finger proteins in the Arabidopsis thaliana genome[J]. BMC Genomics,2004,5(1):39.
[12]Salih H,Odongo M R,Gong W F,et al. Genome-wide analysis of cotton C2H2-zinc finger transcription factor family and their expression analysis during fiber development[J]. BMC Plant Biology,2019,19(1):400.
[13]井建玲,张 鹏,王振宇,等. 木薯C2H2型锌指蛋白转录因子家族全基因组鉴定及表达分析[J]. 植物生理学报,2020,56(12):2664-2676.
[14]Berg J M,Shi Y. The galvanization of biology:a growing appreciation for the roles of zinc[J]. Science,1996,271(5252):1081-1085.
[15]王海波,程来亮,何 平,等. 苹果抗寒矮化砧应答冷胁迫的转录因子基因鉴定[J]. 植物生理学报,2017,53(8):1468-1478.
[16]龙 欧,卢 翔,石亚亮,等. 金荞麦C2H2-ZFP家族基因分析及FdC2H2-2在芦丁合成积累中的功能表征[J]. 植物遗传资源学报,2023,24(4):1161-1173.
[17]Ciftci-Yilmaz S,Morsy M R,Song L H,et al. The EAR-motif of the Cys2/His2-type zinc finger protein ZAT7 plays a key role in the defense response of Arabidopsis to salinity stress[J]. Journal of Biological Chemistry,2007,282(12):9260-9268.
[18]Mangas S,Bonfill M,Osuna L,et al. The effect of methyl jasmonate on triterpene and sterol metabolisms of Centella asiatica,Ruscus aculeatus and Galphimia glauca cultured plants[J]. Phytochemistry,2006,67(18):2041-2049.
[19]Zheng H,Fu X Q,Shao J,et al. Transcriptional regulatory network of high-value active ingredients in medicinal plants[J]. Trends in Plant Science,2023,28(4):429-446.
收稿日期:2023-05-31
基金项目:国家自然科学基金(编号:81660634);云南省科技厅-云南中医药大学联合专项(编号:202101AG070013);云南省高校药用食用花卉科技创新团队项目(编号:2020YGC01);科技创新基地建设项目(编号:202207AB110015)。
作者简介:谷云霞(1998—),女,云南玉溪人,硕士研究生,主要从事中药资源开发与利用研究。E-mail:2075927117@qq.com。
通信作者:刘小莉,博士,副教授,主要从事中药资源研究。E-mail:kmxunzi@aliyun.com。

