库尔勒香梨大果芽变的鉴定与评价
卢登洋 童盼盼 闫敏 鲍荆凯 刘鸣哲 夏怡蕾 吴翠云


摘要:为鉴定和评价库尔勒香梨大果芽变的性状,为生产栽培和遗传育种提供理论依据,在2020—2021年对库尔勒香梨(对照)及其大果芽变的植物学形态、生物学特性、品质特性进行比较分析。结果表明,大果芽变果实呈倒卵形,库尔勒香梨呈纺锤形;大果芽变的叶片保卫细胞宽度和果肉细胞长度均显著增大;在果实动态发育过程中,大果芽变的单果重及果实含水率均显著高于库尔勒香梨,在果实成熟期,与库尔勒香梨相比,大果芽变果实的可溶性糖含量及糖酸比分别显著提高78.39%和84.54%,石细胞含量显著降低33.33%。经表型性状和品质特性分析,判定大果芽变为库尔勒香梨的优良芽变,可作为品种改良及新品种选育的亲本材料。
关键词:库尔勒香梨;大果芽变;生物学特性;果实品质
doi:10.13304/j.nykjdb.2022.0869
中图分类号:S661.2 文献标志码:A 文章编号:10080864(2024)05005213
梨是全球主要的水果之一,是我国的第三大水果[1],也是新疆主要的果产品之一。其中,新疆梨以巴州地区的库尔勒香梨最为著名,截至2020年,库尔勒香梨种植面积约3.1万hm2,总产量达40.27万t[2]。但在生产中梨品种结构单一、果实品质参差不齐[3]、无法满足市场多元化的需求是新疆梨产业发展的短板[4]。多元化、不同成熟期的梨品种选育与应用是促进新疆梨产业持续健康发展的关键。目前,我国梨产量和栽培面积均居世界首位,芽变选种和杂交育种发挥了重要作用[5]。近50年来,我国使用芽变选种培育出94个不同特色的梨芽变单株,其主要变异性状包括树体性状、花性状、果实性状等[6]。黄花梨、鸭梨、库尔勒香梨、新高梨和砀山酥梨等容易发生芽变[7]。其中,已报道的库尔勒香梨芽变品种有‘沙01‘新梨2号‘早美香‘94-9等,不仅丰富了梨品种资源,而且‘新梨2号‘早美香已广泛应用于生产[8-11]。本研究对课题组前期发现的库尔勒香梨大果型芽变的物候期、形态特征、果实发育动态变化、抗寒性进行调查,开展细胞学、倍数性鉴定,并与其亲本进行对比分析,以期为库尔勒香梨芽变的品种审定、登记和示范种植奠定基础。
1 材料与方法
1.1 试验材料
本研究以库尔勒香梨(以下简称香梨)及其大果芽变为试验材料,样品来自新疆阿拉尔市第一师十团十五连(40°33′21″N、81°10′38″E)梨园(4年生嫁接苗)。试验梨园土肥水管理一致,园相整齐。2016年在梨园内的1株香梨树侧枝上发现其叶片和果实明显增大,经过2 年的观察,性状稳定。2018年采集香梨突变体枝条嫁接坐果后观察,发现其仍表现出稳定的大果性状,推测这可能是香梨大果型芽变。本研究选择树体健壮、无病虫害且长势一致的香梨及其芽变各6株树进行挂牌标记,作为样本树。
1.2 试验方法
1.2.1 物候期调查
于2021年根据《植物新品种特异性、一致性和稳定性测试指南 梨》[12]标准进行物候期调查。
1.2.2 形态学特征调查
参照《植物新品种特异性、一致性和稳定性测试指南 梨》[12],于2021 年观测香梨及其大果芽变的株型,并分别调查各30 片成熟叶片、盛花期花朵和成熟果实的形态特征。
1.2.3 叶片性状及组织结构调查
于2021年9月21日分别从香梨和大果芽变一次枝第3~5节位随机采摘10片成熟叶片,用于观察叶片组织结构和气孔大小。采用常规石蜡切片法观测叶片组织结构。气孔大小的测定采用指甲油印迹法,在叶片上、下表面涂上6 cm2的透明指甲油,待指甲油完全干燥后用透明胶布撕下制片。香梨及其大果芽变各制片3张,每张观察15个视野,并用测微尺进行数据测定。
1.2.4 果实生长发育动态指标的测定
于2020—2021 年连续2 年采摘香梨及其芽变果实,每年6月13日开始采样,每隔15 d从样本树4个不同方向分别取大小相似、高度一致的10个果实(共40个),直至成熟(9月21日),采收后立即置于冰盒带回实验室。
10个果实用于进行细胞学测量,参考杨立等[13]的石蜡制片法并加以优化。3张切片,每张观察10个视野。细胞长度通过BX53荧光显微镜[奥林巴斯(深圳)工业有限公司]观察,用测微尺沿果心方向测定连续7个细胞的长度,根据下列公式计算细胞数量。
细胞数量=托杯的宽度/细胞长度(1)
30个果实用于发育动态的测定。果实指标测定单果重、纵横径;用Hunter Lab色差仪(日本Minolta公司)测定果实色差,果实4个面各测1个值;TD-35型折光仪(浙江托普仪器有限公司)测可溶性固形物含量;果实含水率和石细胞含量的测定参照徐胜利等[14]的方法;参照位杰等[15]的方法测定维生素C(Vc)、蛋白质、可溶性糖和可滴定酸含量,并参照下列公式计算糖酸比。用硝酸铝比色法和Folin-酚法测定总黄酮和总酚含量[16]。
以上各重复3次,取平均值。
糖酸比=可溶性糖含量/可滴定酸含量(2)
1.2.5 倍性鉴定方法
于2021年4月8日采摘新稍第3~5节位30片新鲜幼叶用于倍性鉴定。采用FACSCalibur流式细胞仪(美国BD公司)测定,以香梨幼嫩叶片DNA含量为对照进行倍性鉴定,3次重复。
1.3 数据处理
果实品质的试验数据为2020—2021年连续2 年数据的平均值,采用Excel 进行统计,采用SPSS 24进行显著性分析,采用GraphPad Prism 8进行绘图。
2 结果与分析
2.1 香梨及其芽变的物候期比较分析
香梨及其芽变的物候期调查结果见表1,2年发育期中的各物候期不存在明显差异,香梨及其芽变均在3 月底开始萌芽,4 月10—11 日初花,4月中旬展叶,4月18—20日为末花期,9月20—21日果实成熟。
2.2 香梨及其芽变的树性特征比较
由表2可知,香梨及其芽变的树性特征存在一定差别,芽变的1年生枝条皮孔数量多,而香梨的1年生枝条皮孔数量少;香梨的主干树皮呈现片状剥落且芽托大小表现为中等,而芽变的主干树皮特征表现光滑且芽托较小;其他形态特征指标相同。
2.3 香梨及其芽变的叶片性状比较
2.3.1 香梨及其芽变的叶片质量性状比较
由表3可知,香梨及其芽变叶片质量性状存在不同。香梨的叶片形状和叶基形状皆为圆形,而芽变的叶片形状为卵圆形,叶基形状为宽楔形。香梨的叶缘表现为锐锯齿、叶姿呈水平状,而芽变的叶缘为复锯齿,叶姿呈斜向上的状态。
2.3.2 香梨及其芽变的叶片数量性状比较
由表4 可知,香梨及其芽变的叶片长和叶面积存在显著差异(P<0.05)。芽变的平均叶片长达63.67 mm,比香梨显著提升12.25%。芽变的叶面积为1 858.71 mm2,比香梨叶面积大20.03%。
2.3.3 香梨及其芽变的叶片解剖结构比较
由表5可知,香梨及其芽变叶片的解剖结构不存在显著性差异。香梨及其芽变的叶片厚度在280.00 μm左右。香梨的栅海比达1.31,比芽变的栅海比高0.1,但差异不显著。
2.3.4 香梨及其芽变的叶片气孔性状比较
对香梨叶片的气孔状态进行统计分析,结果表明(表6),香梨及其芽变叶片的气孔性状存在一定差异,芽变的保卫细胞宽度显著大于香梨,达121.73 μm,是香梨的1.16倍,说明芽变的保卫细胞有变宽的趋势。香梨及其芽变的气孔数目在6~14个,气孔密度都在110.00 mm-2左右。
2.4 香梨及其芽变的花性状比较
由表7可知,香梨及其芽变的花瓣形状、柱头位置、花瓣基部茸毛、花序花朵数、花瓣横径、单药花粉量、花粉生活力均存在一定差异。香梨的花瓣形状是圆形,而芽变的是卵圆形;香梨的柱头位置高于花药且有花瓣基部茸毛,而芽变的柱头位置与花药等高、没有花瓣基部茸毛。香梨的花序花朵数平均达8.23朵,显著高于芽变的花序花朵数。香梨的花瓣横径为8.23 mm,较芽变的花瓣横径显著高出26.25%。香梨的单药花粉量达7 228.58 粒,较芽变的单药花粉量显著高出51.09%。芽变的花粉生活力达86.68%,显著高于香梨。
2.5 香梨及其芽变的果实描述型性状比较
由表8可知,香梨及其芽变的果实描述型性状存在一定差别。其中,香梨的果实形状呈纺锤形,无或极少蜡质,果锈位置在萼端,而芽变的果实形状呈倒卵形,蜡质少,果锈位置在梗端。香梨的梗洼深度为中、萼洼深度为浅、萼洼状态呈肋状,而芽变的梗洼深度为浅、萼洼深度为深、萼洼状态呈平滑。香梨的种子颜色为褐色,种子形状呈椭圆形,而芽变的种子颜色是深褐色,种子形状呈卵圆形。
2.6 香梨及其芽变的果实发育动态比较
2.6.1 香梨与芽变材料果实发育动态变化
由图1 可知,香梨与其大果芽变的单果重、果实纵径、果实横径生长变化曲线基本一致,且均存在显著差异(P<0.05);而二者的果形指数在果实发育过程中不断变化,但在果实成熟期芽变的果形指数低于香梨。从6月上旬到7月上旬,香梨及其大果芽变的果实发育缓慢。8月份是梨果实发育迅速膨大期,大果芽变单果重增长幅度显著大于香梨,且在果实发育中期一直处于较高的水平,直到成熟期达到最大,此时大果芽变的平均单果重为240.35 g,是香梨的1.56倍,差异显著,说明芽变为大果型芽变(图2)。
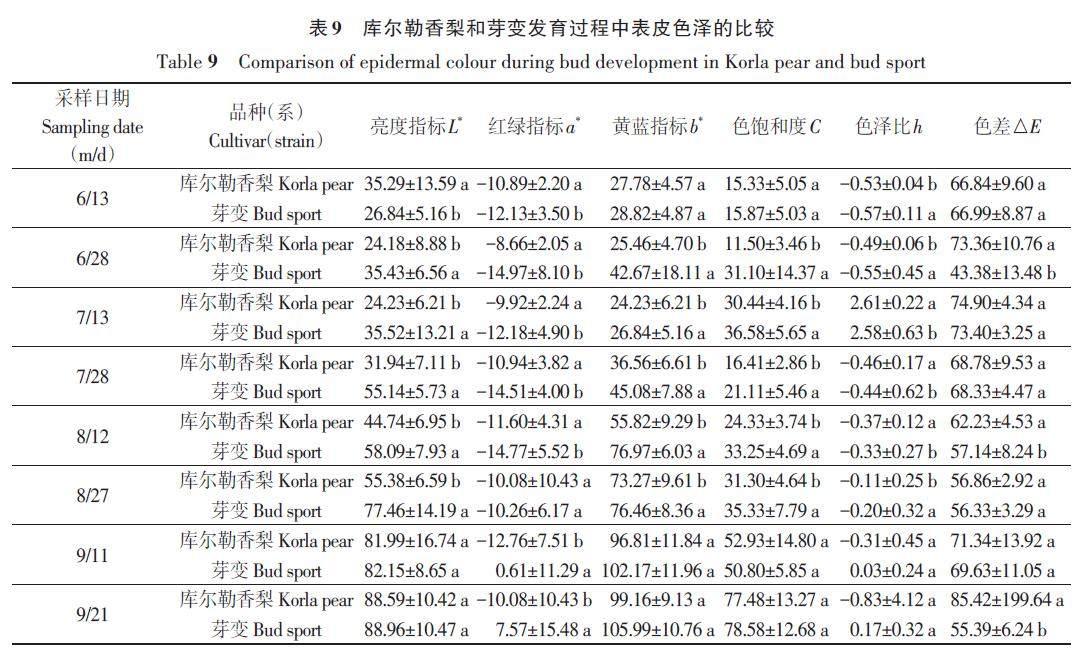
2.6.2 香梨和大果芽变发育过程中果皮色泽的比较
如表9所示,在果实发育过程中,香梨及其芽变的亮度指标(L*)呈现出持续上升的变化趋势、黄蓝指标(b*)呈现出先下降后上升的变化趋势,红绿指标(a*)、色饱和度(C)、色泽比(h)和色差(△E)均呈现出锯齿状的变化趋势。香梨及其芽变的b*值在6月中旬到7月中旬逐渐下降,呈浅绿色,在7月下旬到果实成熟逐渐上升,呈黄色。在果实成熟期,香梨及其芽变的a*和△E 存在显著差异,C 值维持在70 %左右,表明此时果皮颜色较深。
2.6.3 香梨及其芽变果实的内在品质比较
从图3可知,香梨及其芽变可溶性糖含量、糖酸比均随着果实发育呈上升的趋势,可溶性固形物含量呈现“高-低-高”的变化趋势,可滴定酸含量呈现下降的变化趋势。在果实成熟期,芽变可溶性糖含量为16.90%,比香梨高2.94%,且芽变的糖酸比是香梨的1.18倍,二者差异显著(P<0.05)。二者的可溶性固形物含量均在8月下旬达到最高,分别为12.90% 和12.78%,然后在果实成熟期迅速下降。
从图4中可以看出,在果实发育过程中,香梨及芽变的Vc 和蛋白质含量的动态曲线均呈现“高-低-高”的变化趋势;石细胞含量、总黄酮和总酚含量整体呈现下降趋势;含水率呈现“低-高-低”的变化趋势。在果实成熟期,香梨与芽变的Vc含量分别为10.98和11.97 mg·100 g-1,蛋白质含量分别为0.30% 和0.36%;芽变的石细胞含量比香梨显著降低15.12%,芽变的含水率达到87.95%,是香梨的1.02倍;二者的总黄酮和总酚含量与幼果期相比分别下降71.87%、52.30% 和63.64%、72.25%。
2.6.4 香梨及其芽变果实发育期果肉细胞长度和细胞数量的比较
通过对香梨及其芽变果肉的细胞长度和细胞数量进行调查发现,细胞长度的不同是引起芽变和香梨果实大小差异的因素之一,6月28日时芽变果实的细胞长度明显大于香梨,是香梨的1.54倍(图5)。如表10所示,随着果实发育,香梨及其芽变的果肉细胞长度除在8 月27日无显著性差异外,其他时期都存在显著性差异,表现为芽变果肉细胞长度显著大于香梨的细胞长度;二者的果肉细胞数量在果实发育前期无显著性差异,而在果实发育中、后期两者果肉的细胞数量存在显著差异。在果实成熟期,芽变的果肉细胞长度达919.22 μm,比香梨增大了1.03倍,香梨果肉的细胞数量是芽变果实的1.08倍。
2.7 香梨及其芽变的染色体倍性分析
使用流式细胞仪对香梨及其芽变的幼嫩叶片进行检测,用已知倍性的香梨进行校准,确定其各发育期峰值的位置,以此为对照分析芽变倍性。如图6所示,香梨及其芽变均为二倍体,说明香梨的芽变性状并非染色体加倍造成。
3 讨论
根据已有研究将大果型芽变分为2类,第1类为染色体加倍形成的大果型芽变。研究发现,梨多倍体与二倍体间的性状不同,与二倍体品种相比,多倍体品种一般表现为枝粗、叶大、果大和花大等巨大性特征,同时酶的活性强、新陈代谢旺盛、抗逆性和适应性加强[17],已鉴定的梨多倍体芽变品种包括‘沙01‘晋县大鸭梨‘海天鸭梨‘大巴梨‘花盖王等。第2类大果型芽变为果实质量控制基因变异而形成的,这类芽变的变异性状多局限于果实,而其他组织与原品种间常无明显变化,引起此类型芽变可能是由于细胞数量的增加、激素及控制果实大小的相关基因等因素引起的。张树军[18]对南果梨及其芽变‘大南果梨进行研究发现,芽变‘大南果梨并非多倍体造成的,而是细胞长度和数目的不同所致,明确了生长促进类激素与生长抑制类激素之间的比值是影响南果梨果个大小的主要原因。本研究发现,库尔勒香梨及其芽变的倍性相同(二倍体),其果实增大的机制并非染色体加倍,而是果实发育过程中处于分裂期的细胞活跃增殖导致细胞分裂期的延长,与舒莎珊等[19]的研究结果一致,但芽变的大果型遗传机理还需进一步研究。
果实大小是梨外观品质的重要指标,果实的细胞长度和数量控制梨果大小,而细胞数量的多少对梨果大小影响较大[20]。梨果实的大小差异很大,一些栽培的梨单果重达数千克,而一些野梨果实的单果重只有几克。目前,对于梨果实的差异取决于细胞长度或细胞数量,还没有明确的结论。Goffinet等[21]认为,细胞长度和细胞间隙不是影响果大小的主要因素。Malladi等[22]则认为,芽变果实大小主要与其细胞长度有关。Harada等[23]研究发现,苹果果实细胞的增殖能力和细胞扩张的程度可以共同影响苹果果实最终的大小。梨果实的生长过程可分为细胞分裂期、迅速生长期和果实成熟期。细胞分裂期主要是细胞数量的増加,一般从开花后开始一直持续到花后的4~7周;细胞分裂期结束后,种子开始迅速发育,即梨果实发育开始进入迅速生长期[20]。本试验通过石蜡制片法观察香梨和芽变果实,二者不论在细胞长度还是细胞数量方面均存在显著差异,也就是说,二者果实大小变异是其细胞数量和细胞大小的不同所致,且芽变果实细胞在果实成熟期出现活跃增殖现象,使得果实增大,因此,果实成熟期是芽变果实膨大的关键时期,细胞长度的差异是造成二者果实大小差异的主要原因之一。
果实单果重的生长曲线有2种类型,单“S”型和双“S”型。本研究中,香梨和芽变果实的整体发育动态曲线呈现双“S”型,这与陈月等[24]的研究结果一致,均呈现这种常见的双“S”型曲线,符合梨果实生长规律的生长模式。芽变的平均单果重、果实纵径和横径显著高于香梨,与渠利莎[25]的研究结果相似。黄娟等[26]发现, 果实的色调值、红绿指标和色泽比等可用于定性判别和定量分析,没有筛选误差和颜色重叠,颜色分类界限清晰。本研究认为,在果实成熟期,香梨和芽变果实的红绿指标和色差存在显著差异,C 值维持在70%左右,表明此时果皮颜色较深。
果实硬度和可溶性固形物是重要指标之一,而可溶性糖和可滴定酸含量是决定梨果实风味的重要因素。根据彭文莉[27]确定高品质香梨和香脆梨的标准,优质香梨的可溶性固形物≥11.5%、可溶性固形物>11% 则是梨果实中的高糖品种(系)[28]。有研究表明,果实可滴定酸含量低于1%,表明梨果实中的酸含量非常低,而高品质梨果实中酸含量相对较高[29]。本研究中,芽变果实的可溶性糖含量显著高于香梨,平均达到16.90%。在果实发育过程中,香梨和芽变二者果实的可溶性固形物含量在8月下旬达到最高,然后在果实成熟期迅速下降,这与李刚波等[30]在‘翠冠梨和‘苏翠1号中的研究结果不同,说明不同梨品种果实含糖量的变化存在差异。在果实成熟期,香梨和芽变的可溶性固形物含量分别为12.69% 和12.10%,可滴定酸均<1%,按照优质香梨的评判标准,芽变果实较香梨果实内在品质优良,含糖量高,风味佳。梨果实还含有一些特殊的功能营养成分,如黄酮和多酚类化合物,这些物质具有清除自由基、抗氧化和抗衰老的特性[31]。在幼果期,芽变果实的总黄酮和总酚含量均显著高于香梨果实的总黄酮和总酚含量,说明芽变果实具有较强的抗氧化能力,这与翟锐等[32]的报道一致,具体的抗氧化作用机理还需进一步研究。
参考文献
[1] 马友福,陈敏,杨成泉,等.九个西洋梨品种果实品质评价分析[J].果树资源学报,2021,2(5):30-33.
MA Y F, CHEN M, YANG C Q, et al .. Evaluation and analysison fruit quality of nine European pear cultivars [J]. J. FruitResour., 2021,2(5):30-33.
[2] 王秀梅,张峰,江振斌,等. 库尔勒市香梨的市场营销现状及建议[J]. 落叶果树,2021,53(5):46-49.
WANG X M, ZHANG F, JIANG Z B, et al .. The marketingstatus and suggestions of Korla fragrant pear [J]. DeciduousFruits, 2021,53(5):46-49.
[3] 张峰,蒋志琴,陈小光,等. 库尔勒香梨产业发展因素分析及对策建议[J]. 中国农学通报,2021,37(34):159-164.
ZHANG F, JIANG Z Q, CHEN X G, et al .. The developmentfactors of Pyrus sinkiangensis ‘Korla Xiangli industry [J].Chin. Agric. Sci. Bull., 2021,37(34):159-164.
[4] 赵德英,徐锴,闫帅,等. 梨供给侧结构性改革如何助力乡村振兴[J]. 中国果树,2019(3):5-10.
ZHAO D Y, XU K, YAN S, et al .. How to assist ruralvitalization with supply-side structural reform in pear industry [J].China Fruits, 2019(3):5-10.
[5] 陈启亮,张靖国,杨晓平,等. 我国梨新品种权保护现状与分析[J]. 中国果树,2021(9):93-96.
CHEN Q L, ZHANG J G, YANG X P, et al .. Current situationand analysis on protection of new pear variety rights in China [J].China Fruits, 2021(9):93-96.
[6] 武春昊,卢明艳,闫兴凯,等. 我国近五十年梨芽变育种研究进展与展望[J]. 北方园艺,2018(19):156-161.
WU C H, LU M Y, YAN X K, et al .. Research progress andprospect of pear bud sport breeding in recent fifty years ofChina [J]. Northern Hortic., 2018(19):156-161.
[7] 卢愿,张明,卜令龙,等. 我国梨育种工作研究进展[J].农业科技通讯,2017(7):226-227, 280.
[8] 杨振. 库尔勒香梨辐射育种及芽变沙01 的品种特性研究[D]. 乌鲁木齐:新疆农业大学,2012.
YANG Z. Researches on radiation breeding of Korla fragrantpear and variety characterization of its bud sport sha 01 [D].Urumqi: Xinjiang Agricultural University, 2012.
[9] 吴志华,张洪平,韩寄桥,等.香梨芽变新品种新梨2号[J].新疆农业科学,1994(4):175.
[10] 陈月. 库尔勒香梨及其芽变类型的生长结果习性观测及SRAP分子检测[D].乌鲁木齐:新疆农业大学,2014.
CHEN Y. The observation of growth behavior and SRAPmolecular detection of Korla fragrant pear and its bud mutationtypes [D]. Urumqi:Xinjiang Agricultural University, 2014.
[11] 风格. 库尔勒香梨优良芽变品系94-9 的选育[EB/OL].(2001-01-01) [2022-09-16]. https://kns. cnki. net/kcms2/article/abstract?v=0kbmF0AymBD-PubJ0yCLxIKXc9O-VU4T_xGupGjqWki_RUGG3FafAr3IGJRTgCo_OGwKANDGe8o4NyTMwI3db1c9jvsmqbZ0H1YDIgDu8XFLFJW3oT4EQDmYNpb_pfFjK--pkmdcVUd2FE6xLCdQlQ==&uniplatform=NZKPT&language=CHS.
[12] 方成泉, 林盛华, 王风华, 等. 植物新品种特异性、一致性和稳定性测试指南 梨: NY/T 2231—2012[S].北京:中国标准出版社,2012.
[13] 杨立,秦仲麒,伍涛,等. 不同发育时期的梨果肉组织石蜡切片制备[J]. 农业科技通讯,2017(12):213-215.
YANG L, QIN Z Q, WU T, et al .. Preparation of paraffinsections of pear flesh tissues at different developmental stages [J].Bull. Agric. Sci. Technol., 2017(12):213-215.
[14] 徐胜利,陈小青,徐崇志,等. 新疆梨系统品种花粉直感对香梨果萼发育及品质的影响[J].山西果树,2014(5):3-6.
XU S L, CHEN X Q, XU C Z, et al .. Effect of direct pollensensing on calyx development and quality of balsam pear inXinjiang pear system varieties [J]. Shanxi Fruit Tree,2014(5):3-6.
[15] 位杰,蒋媛,林彩霞.库尔勒香梨及其芽变和杂交品种(系)果实品质评价因子的选择[J].食品科学,2018,39(11):69-74.
WEI J, JIANG Y, LIN C X. Selection of quality evaluationfactors for Korla fragrant pear, bud mutants and hybridvarieties (strains) [J]. Food Sci., 2018,39(11):69-74.
[16] 李雁琴,宋丽军,张丽,等. 不同品种红枣冻干片的理化品质及抗氧化性比较[J].食品研究与开发,2020,41(11):28-33, 65.
LI Y Q, SONG L J, ZHANG L, et al .. Comparison of physicchemistryqualities and antioxidant activity of frozen slices ofdifferent jujube varieties [J]. Food Res. Dev., 2020,41(11):28-33,65.
[17] 黄礼森,李树玲,丛佩华. 梨多倍体与二倍体性状比较[J]. 中国果树,1990(3): 30-31.
[18] 张树军.‘ 南果梨大果型芽变的细胞、生理及分子基础研究[D].南京: 南京农业大学,2011.
ZHANG S J. Studies on the cellular, physiological andmolecular basis of large-fruit bud mutant of ‘Nanguoli [D].Nanjing: Nanjing Agricultural University, 2011.
[19] 舒莎珊,李鑫,骆军,等‘. 翠冠梨大果型芽变的细胞学及相关基因表达研究[J].果树学报,2017,34(6):660-669.
SHU S S, LI X, LUO J, et al .. Studies on cytology and relatedgene expression pattern of a large-fruited bud mutant from‘Cuiguan pear (Pyrus pyrifolia) [J]. J. Fruit Trees, 2017,34(6):660-669.
[20] 于婷婷.‘ 苹果梨及其大果型芽变细胞学和果实糖、酸差异比较研究[D]. 延吉: 延边大学,2020.
YU T T. Comparative study on the physiological changes andthe differences of fruit sugar and acid content between‘Pingguoli pear and its large fruit bud [D]. Yanji: YanbianUniversity, 2020.
[21] GOFFINET M C, ROBINSON T L, LAKSO A N. A comparisonof ‘Empire apple fruit size and anatomy in unthinned andhand-thinned trees [J]. J. Hortic. Sci., 2015,70(3): 375-387.
[22] MALLADI A, HIRST P M. Increase in fruit size of aspontaneous mutant of‘ Gala apple (Malus domestica Borkh.)is facilitated by altered cell production and enhanced cell size [J].J. Exp. Bot., 2010,61(11): 3003-3013.
[23] HARADA T, KURAHASHI W, YANAI M, et al .. Involvementof cell proliferation and cell enlargement in increasing the fruitsize of Malus species [J]. Sci. Hortic., 2005,105(4): 447-456.
[24] 陈月,刘永杰,覃伟铭,等.库尔勒香梨及其不同芽变类型果实发育动态和品质比较[J]. 新疆农业科学,2014,51(5):817-823.
CHEN Y, LIU Y J, QIN W M, et al .. Comparison of fruitdevelopment and quality of Korla fragrant pear and its differentbud mutations [J]. Xinjiang Agric. Sci.,2014,51(5):817-823.
[25] 渠利莎. 库尔勒香梨和砀山酥梨芽变鉴定[D].杨凌:西北农林科技大学,2019.
QU L S. Identification of bud sports in Korla pear andDangshansu pear [D]. Yangling: Northwest A&F University, 2019.
[26] 黄娟,李新建.基于色差仪法的库尔勒香梨果实颜色分级标准[J].北方园艺,2018(17):38-44.
HUANG J, LI X J. The Korla fragrant pear colour gradingbased on colorimeter [J]. Northern Hortic., 2018(17):38-44.
[27] 彭文莉. 湖北省砂梨栽培品种评价研究[D]. 北京:中国农业科学院,2012.
PENG W L. Evaluation studies on cultivars of sand pear (Pyruspyrifolia Nakai)in Hubei province [D]. Beijing: ChineseAcademy of Agricultural Sciences, 2012.
[28] 广新梅,徐崇志,王绪春,等.采摘期内库尔勒香梨品质指标变化规律及相关关系[J]. 江苏农业科学, 2018, 46(19):118-121.
[29] 姚改芳,杨志军,张绍铃,等.梨不同栽培种果实有机酸组分及含量特征分析[J].园艺学报,2014,41(4):755-764.
YAO G F, YANG Z J, ZHANG S L, et al .. Characteristics ofcomponents and contents of organic acid in pear fruits fromdifferent cultivated species [J]. Acta Hortic. Sin., 2014,41(4):755-764.
[30] 李刚波,樊继德,杨峰,等.2种早熟砂梨果实发育过程中糖含量的动态变化研究[J].江西农业学报,2019,31(6):22-25.
LI G B, FAN J D,YANG F, et al .. Dynamic changes in sugarcontent of two early-maturing sand pears during fruitdevelopment [J]. Acta Agric. Jiangxi, 2019,31(6):22-25.
[31] 李政红,张玉星,葛会波. 梨果实提取物的体外抗氧化活性[J].食品科技,2018,43(7):193-197.
LI Z H, ZHANG Y X, GE H B. Antioxidant activities of pearfruits [J]. Food Sci. Technol., 2018,43(7):193-197.
[32] 翟锐,房晨,范二婷,等‘. 早酥梨及其红皮芽变‘红早酥梨类黄酮组分变化与合成模式研究[J].果树学报,2016,33(增刊):75-82.
ZHAI R, FANG C, FAN E T, et al .. The dynamic concentrationchanges and biosynthesis pattern of flavonoid compounds in‘Zaosu pear and its red bud mutant‘ Red zaosu [J]. J. FruitSci., 2016,33(S):75-82.
(责任编辑:胡立霞)
基金项目:南疆重点产业支撑计划项目(2017DB006);新疆自治区研究生创新性计划项目(XJ2021G297)。

