无脑膜附着的脑实质内或皮层下脑膜瘤的临床特点及手术(附4例临床报告及文献复习)
朱蔚林 刘朝晖 谢永帆 赵建农
【摘要】 目的 探讨无脑膜附着的脑实质内或皮层下脑膜瘤的临床、影像学和组织病理学特征及手术疗效。方法 回顾性分析2019年12月—2022年12月在海南省人民医院手术治疗的4例无脑膜附着脑膜瘤患者的临床特点,影像学和组织病理学特征,对手术处理原则、手术疗效及长期随访结果,结合文献进行总结。结果 所有患者好发部位是额顶叶,3例囊实性。癫痫发作为术前、术后常见症状。三维核磁共振成像(MRI)示,肿瘤均位于脑内,术前MRI及术中、术后病理均证实无硬脑膜附着。4例患者全切,2例WHO Ⅰ级,2例WHO Ⅱ级,1例不典型性脑膜瘤术后复发,1例术后无放疗,3例术后行放疗。平均随访1.5年,存活3例。结论 无脑膜附着的脑实质内或皮层下脑膜瘤术前容易被误诊,部分皮层下或脑实质内脑膜瘤的瘤周水肿严重发生在病变附着于周围脑组织的区域,并非包围整个肿瘤表面,MRI波谱等特征可能有助于鉴别。WHO Ⅱ级非典型脑膜瘤其增殖率高,侵犯脑实质,复发概率高。首选手术治疗,肿瘤完全切除是预防肿瘤复发的最重要因素。对于非典型或恶性脑膜瘤,建议在初次手术后立即进行放疗。
【关键词】 脑实质;脑皮质;硬脑膜附着;脑膜瘤;显微手术
【中图分类号】 R739.41 【文献标志码】 B 【文章编号】 1672-7770(2024)03-0313-05
脑膜瘤是成人最常见的原发性中枢神经系统肿瘤,从无症状的偶发肿瘤到致命性肿瘤,临床表现差异较大。大多数脑膜瘤是良性的,典型脑膜瘤基底位于硬脑膜,全切除可达到非常低的复发率。然而皮质下脑膜瘤缺乏硬脑膜附着,并被脑组织包围,是偶发性的,文献中仅偶尔报道[14]。由于缺乏独特的影像学特征,术前诊断具有挑战性,组织学、临床特征、手术疗效是否同刻板一致的以硬脑膜为基底的典型脑膜瘤一样有待探讨,海南省人民医院神经外科2019年12月—2022年12月手术治疗近400例脑膜瘤,其中有4例为无脑膜附着的脑实质内或皮层下脑膜瘤,现报告如下。
1 资料与方法
1.1 一般资料 共纳入4例无脑膜附着的脑实质内或皮层下脑膜瘤患者,其中男3例,女1例;年龄46~51岁,平均年龄47岁;2例术前手脚乏力、麻木,言语不清,2例同时伴发癫痫发作。所有患者均签署知情同意书。
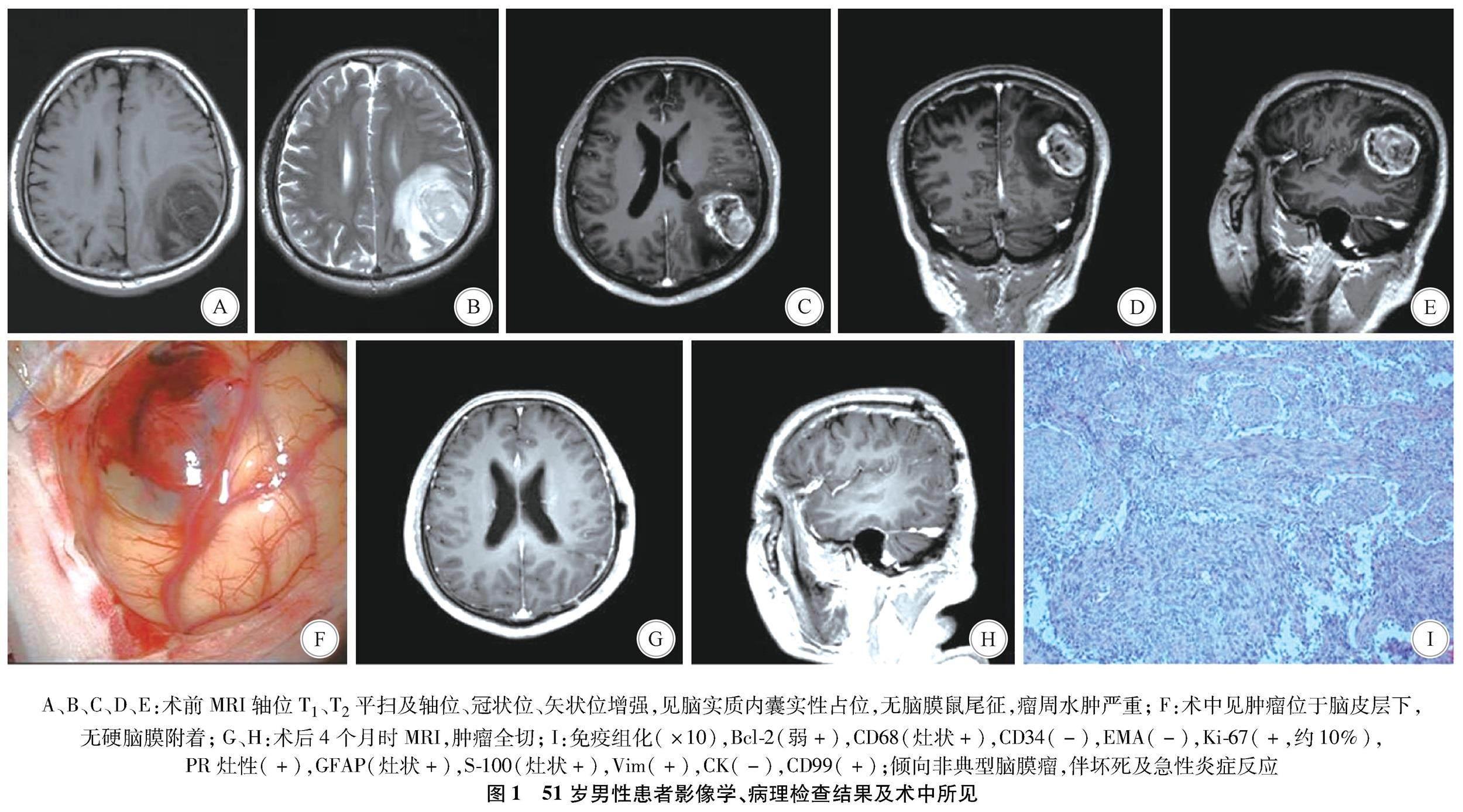
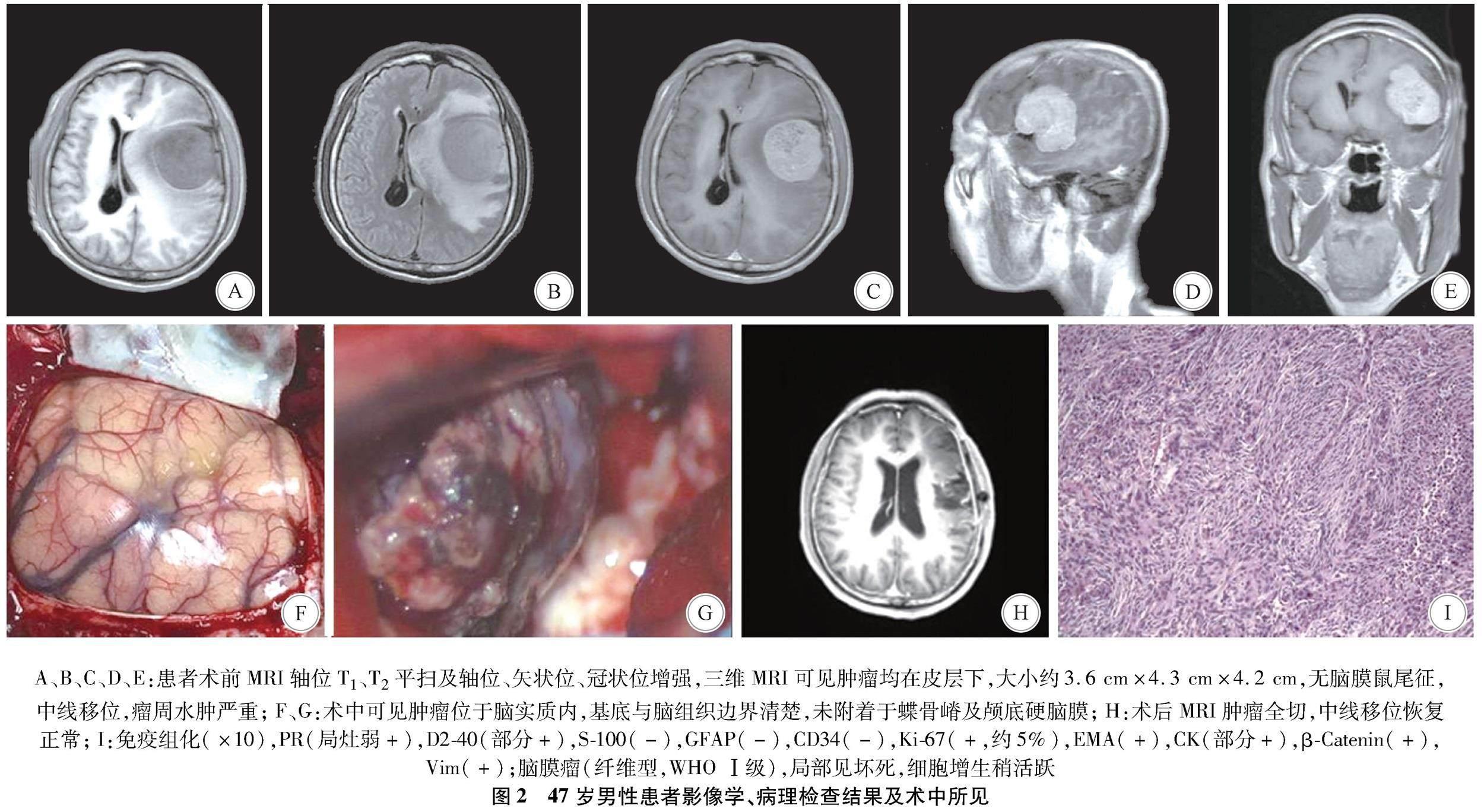
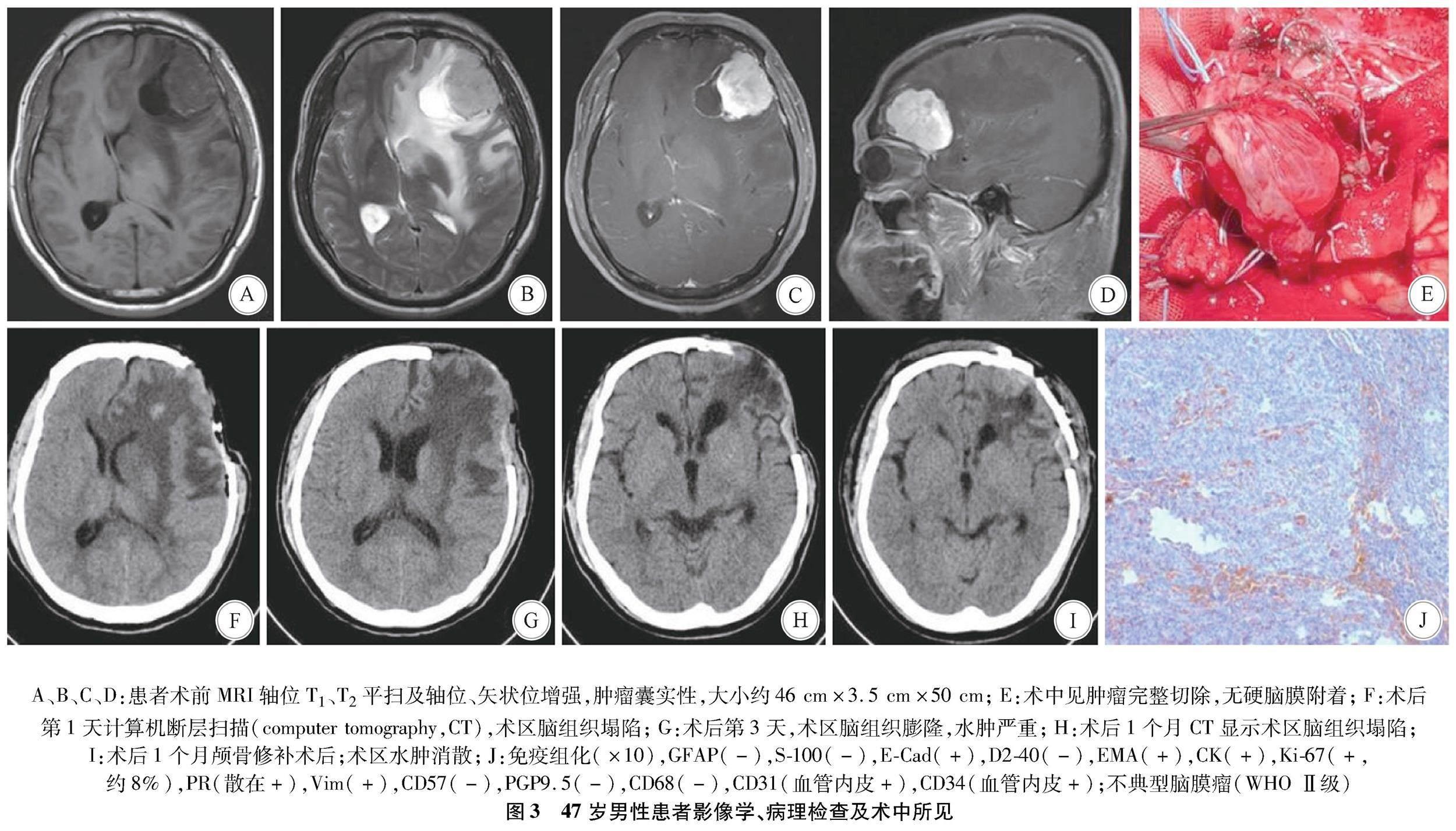
1.2 影像学、病理检查结果及术中所见 见图14。
1.3 方法 4例患者术前均行三维MRI,均显示肿瘤位于脑实质内或者皮质下。根据肿瘤部位采取不同的手术入路,手术全切肿瘤,邻近脑膜未予切除。切除肿瘤均行分子病理检测。
2 结 果
4例患者肿瘤全切,肿瘤位于皮层以下,凸面及颅底无脑膜附着,脑肿瘤深部与脑组织边界相对清晰,但存在共生血管,粘连紧密。3例囊实性肿瘤,囊液呈黄色,瘤壁光滑完整。
病例1术后能够行走自如,肢体无麻木,但术后3个月讲话欠流利,术后4个月讲话流利。
病例2术后第4天出现水肿加重,1周时出现癫痫大发作,随后1周出现嗜睡,小便失禁,烦躁,胡言乱语,右侧手脚偏瘫。CT复查显示水肿较前加重,中线移位明显,环池尚清晰,建议去骨瓣减压,但家属要求保守治疗,予以脱水1周后清醒,但讲话欠流利。右侧肢体肌力恢复至扶行,右手不能灵活地握筷子进食。3个月后门诊随访,患者行走自如,讲话较前流利,随访2年恢复正常。
病例3术后第1天复查CT显示骨窗塌陷,脑组织水肿较术前减轻,但术后第3天开始(图3G),水肿加重,骨窗处脑组织膨隆,张力增加;患者出现恶心、呕吐等颅高压征,给予脱水后水肿消失;脑组织塌陷,4周后行颅骨修补(图3I)。
病例4病理结果示,免疫组化EMA(+),Vim(+),H3K27ME3(+),CD34(血管内皮+),PR(+),GFAP(-),Ki-67(+,部分约8%),SSTRa(+),S100B(-),SCGN(-),MCM2(15%+),MGMT(+)。脑膜瘤(上皮型)WHO Ⅰ级,生长活跃。
所有患者随访6个月~2年,病例1术后放疗,但术后1年复发,于外院手术,术后死亡。病例3、4常规放疗,随访6个月未复发。病例2术后未行放疗,随访2年未复发。
4 讨 论
脑膜瘤起源于脑膜的蛛网膜帽细胞,与硬脑膜有共同的位置,并伴有硬脑膜附着。脑实质内脑膜瘤或没有硬脑膜附着的脑膜瘤是罕见的。无硬脑膜附着的脑膜瘤可分为五种类型:脑室内脑膜瘤、松果体区脑膜瘤、侧裂深部脑膜瘤、实质内或皮质下脑膜瘤,以及其他;它们可能起源于异位脑膜上皮细胞,而不是直接毗邻硬脑膜;其在男性患者中更为常见。无硬脑膜附着的脑膜瘤最常发生在脑室,也可能发生在侧裂深部,松果体区,甚至在脑实质[3]。
本研究共研究了400例脑膜瘤患者,仅4例少见病例。4例患者起源于脑实质内或者皮层下没有硬脑膜附着的脑膜瘤,推测可能起源于脑血管之间腔隙的蛛网膜帽细胞或脑沟内的软脑膜,有学者认为蛛网膜帽细胞在迁移过程中停留在这些地方[3];本组病例1、3、4的病理结果显示肿瘤结节表面似带软脑膜(图1F,图3E、图4F),印证了这一起源结论。但是硬脑膜粘连的缺失,使其术前诊断存在挑战,尤其4例患者中术前MRI或者CT显示大片水肿区(图1B,图2B、图3B、图4A),肿瘤囊实性改变,容易误诊为转移瘤或者胶质瘤。
本组4例患者诊断为皮层下或者脑实质内脑膜瘤需符合以下三个条件:(1)术前三维MRI均显示肿瘤位于脑皮层下或者脑实质内,均无硬脑膜附着;(2)术中也证实无硬脑膜为基底;(3)病理检查诊断为脑膜瘤。4例患者无典型的CT和MRI特征,囊肿壁的增强强烈提示肿瘤细胞的存在,但囊肿壁的没有增强并不排除囊肿壁中肿瘤细胞的存在。CT或MRI增强程度取决于肿瘤细胞的存在和数量[5]。
皮层下及脑实质内脑膜瘤CT及常规MRI无特征性表现,给诊断带来困难,但MRI波谱特征可能有助于鉴别,皮质下或脑实质内脑膜瘤磁共振波谱显示Cho峰和Ala峰升高,而NAA峰无明显降低[1]。这与胶质NAA峰明显减少和Cho峰明显增加的胶质瘤不同,可用于临床实践中区分胶质瘤和非胶质瘤,同时可排除转移性肿瘤[1]。但本组病例4中,T2波谱,Ch/NAA max=4,因此需要结合PET-CT更为可靠。脑实质脑膜瘤的常规影像学表现与脑外脑膜瘤相似;然而,这些患者 MRS除了定位之外还有显著差异。MRS包含一个与脑外脑膜瘤相似的高Ala峰;然而,NAA峰存在,这与脑外脑膜瘤缺乏NAA峰不同。需要进一步研究NAA峰的存在,可以增加大量的术前诊断数据,从而提高对原发性间质脑膜瘤的怀疑。
有研究报道了30例实质内脑膜瘤,脑实质内脑膜瘤最常见的症状是癫痫发作,其次是头痛和偏瘫[4]。本组4例患者符合文献报道,因为脑膜瘤位于皮层或者脑室内,容易发生癫痫。在影像学检查上,4例患者术前第一诊断均未被诊断为脑膜瘤。额叶是最常见的位置,其次是顶叶和颞叶,与典型脑膜瘤相似。典型脑膜瘤的多发年龄通常在50~60岁,在女性中更常见(60%~80%的病例)[6]。这种显著差异主要与激素因素有关,特别是孕酮[6]的存在。而本组中有3例患者为男性,与文献报道的实质内脑膜瘤有一种不同的流行病学模式,它们更常发生在男性和更年轻的人群中一致[6]。
4例患者首次手术后免疫组化显示PR灶性(+),GFAP(-),(EMA)(+),Vim(+)。孕激素受体PR灶性(+),同典型脑膜瘤相似;胶质纤维酸性蛋白GFAP(-)提示非胶质细胞瘤;上皮细胞膜抗原(EMA)(+),波形蛋白Vim(+)提示间叶组织,提示肿瘤恶性变。
病例2、病例4肿瘤结节表面带软脑膜(图2I、图4F)。从病理来看皮层下或者实质内脑膜瘤的存在可以用实质中软脑膜元素的存在来解释。但它们的病理生理学机制尚不完全清楚,推测它们可起源于脉络丛间质或软脑质的异位脑膜上皮细胞,由于细胞迁移的改变,可导致脑室脑膜瘤[7]。它也与软脑膜和蛛网膜基质细胞伴随穿支血管有关,在某些情况下这些穿支血管加大了大脑皮层之间的间隙导致形成沟回[6],以及特定的位置如沿着大脑中动脉的分支形成侧裂。血管周围的脑膜上皮细胞,特别是其增殖,确定可能存在生长因子的异常产生或抑制因子的丢失,如神经纤维蛋白2(neurofibrillar protein 2,NF2)基因失活剂,这是导致脑膜瘤形成的条件[7]。可见皮层下或者实质内脑膜瘤具有良性脑膜瘤的组织学和临床特征,脑膜瘤的年龄、性别和肿瘤定位的分布通常与大多数典型脑膜瘤相似[3]。
脑膜瘤中囊性形成的几种机制已被提出,如蛛网膜下腔加宽、缺血性坏死、瘤周脱髓鞘、囊性变性伴或不伴出血、脑水肿转化为瘤周囊肿,以及肿瘤细胞或反应性星形胶质细胞分泌[8]。囊性脑膜瘤的MRI表现为T1加权图像低信号,T2加权图像高信号,瘤周水肿高度重合,本组病例1、3、4符合以上特点。由于实质内脑膜瘤缺乏硬脑膜附着,诸如囊肿形成和瘤周水肿等特征在儿童时期相对常见[9]。
本组3例患者呈囊实性,脑膜瘤中的囊腔在成人中很少发生,约1.6%~7%,在儿童人群中增加到10%以上,在实质内脑膜瘤时显著增加。囊性脑膜瘤占所有颅内脑膜瘤的3%~5%[8]。脑膜瘤的囊腔可能是瘤内或瘤外,囊性脑膜瘤通常位于脑凸面,通常为纤维组织学。囊性脑膜瘤在术前MRI上可能被误诊为原发性神经胶质瘤或转移性肿瘤。此外,囊性脑膜瘤可表现为壁性结节,并被误诊为血管母细胞瘤、毛细胞性星形细胞瘤和神经节-胶质细胞瘤。囊性非典型脑膜瘤的发生率脑膜瘤为12%,高于所有脑膜瘤,与其他亚型的比较,提示非典型脑膜瘤倾向于形成囊肿。本组2例囊实性脑膜瘤均为非典型性脑膜瘤,且Ki-67均高于3%。
因为囊肿通常与神经胶质瘤或转移性肿瘤相关,而在脑膜瘤中更少见。病变周围实质脑膜瘤的瘤周水肿强烈发生在附着病变的周围脑组织区域(图1B、图3B、图4A),而大多数胶质瘤或转移性肿瘤的瘤周水肿倾向于包围整个肿瘤表面。然而,其特征并不适用于所有的实质内脑膜瘤,病例2中(图2B)在整个肿瘤表面周围出现瘤周水肿,因此出现了大多数原发性实质内或者皮层下脑膜瘤的影像学特征,如囊性成分、整个肿瘤周围的瘤周水肿、无硬膜尾征,使术前准确诊断极为困难。
大多数脑膜瘤为I级,占80%~90%,而5%~15%为Ⅱ级,1%~3%为Ⅲ级,脑膜上皮型最常见,其次是纤维型[9]。原发性脑实质内脑膜瘤WHO Ⅰ级脑膜瘤最常见的是成纤维细胞型,WHO Ⅱ级中,最常见的组织学类型是非典型,最不常见的组织学类型是Ⅲ级间变型[2]。本组2例患者首次手术后为WHO Ⅱ级,非典型性。
WHO Ⅱ级非典型脑膜瘤占所有脑膜瘤的5%~7%,因其增殖率更高,并可侵袭脑[10],因此复发的可能性更高。由于补充治疗的作用尚未确定,手术入路和切除的范围对预后至关重要。在没有发现硬脑膜附着的情况下,完全切除肿瘤理论上可能代表了这些患者的治愈。本研究所有患者均全切肿瘤,3例患者进行了术后辅助放疗,仍有1例复发,原因不确定。放射治疗有利于残余脑膜瘤的治疗,对于非典型或恶性脑膜瘤,建议在初次手术后立即进行放疗,但对于儿童需要慎重考虑。
文献报道推测成纤维细胞亚型占优势,高级别脑膜瘤的发病率更高。原发性实质内脑膜瘤与凸面脑膜瘤在成纤维细胞型占主导地位方面的相似性以及世界卫生组织Ⅱ级和Ⅲ级脑膜瘤的较高比例,可能意味着原发性实质内脑膜肿瘤与凸面脑膜瘤具有相同的起源[11]。然而,有必要进一步研究发育病理生理学,以阐明原发性脑实质内脑膜瘤的确切起源。
典型脑膜瘤的手术治疗原则同样适用于本组4例患者,肿瘤全切是预防肿瘤复发的最重要因素。切除整个囊肿壁是最佳的,即使神经影像学没有显示囊肿壁的增强。然而,囊肿壁经常紧紧地附着在周围的脑组织上,在不损害邻近脑组织的情况下可能难以切除。肿瘤和囊肿壁全切除后,囊性脑膜瘤与实性脑膜瘤的治愈率无显著差异[11]。本组病例2术后第4天出现水肿加重,1周时出现癫痫大发作,随后1周出现嗜睡,小便失禁,烦躁,胡言乱语,右侧手脚偏瘫。虽然经过积极治疗,3个月后恢复正常。但如果首次手术时预见性地去骨瓣减压,则术后并发症或许可避免。病例3术中肿瘤切除后虽然脑组织塌陷,但仍需要考虑术后可能出现水肿,遂同时去骨瓣减压,术后第3天(图3G)可见脑水肿膨出,避免了再次出现并发症;因此对于肿瘤体积较大,术前中线移位明显,尤其是需要手术权衡是否全切肿瘤的患者,应同时进行去骨瓣减压。
脑膜瘤的复发取决于切除的程度、肿瘤的位置和组织学亚型,切除的范围似乎是影响脑膜瘤预后的最关键的因素。但是本组病例1术后复发,外院手术,为原位复发,而且Ki-67进行性增大,WHO肿瘤级别增加,文献均未查到针对间变性或恶性脑膜瘤的药物,亦无临床药物实验进行,这给临床带来极大困扰,迫切需要寻找新的治疗途径。
利益冲突:所有作者均声明不存在利益冲突。
[参 考 文 献]
[1] Vuckovic' N,Kozic' D,Vulekovic' P,et al.MR and MRS characteristics of intraventricular meningioma[J].J Neuroimaging,2010,20(3):294296.
[2] Papic V,Lasica N,Jelaca B,et al.Primary intraparenchymal meningiomas:a case report and a systematic review[J].World Neurosurg,2021,153:5262.
[3] Zhang J,Chi LY,Meng B,et al.Meningioma without dural attachment:case report,classification,and review of the literature[J].Surg Neurol,2007,67(5):535539.
[4] Diyora B,Kukreja S,Dhal G,et al.Extra-axial cystic meningioma without dural attachment in an adult:case report and review of literature[J].Asian J Neurosurg,2022,17(2):173177.
[5] Ueno Y,Tanaka A,Nakayama Y,et al.Intracerebral cyst associated with meningioma[J].Clin Neurol Neurosurg,1999,101(4):271274.
[6] Ohba S,Abe M,Hasegawa M,et al.Intraparenchymal meningioma:clinical,radiologic,and histologic review[J].World Neurosurg,2016,92:2330.
[7] Tekkk IH,Cinel L,Zorludemir S.Intraparenchymal meningioma[J].J Clin Neurosci,2005,12(5):605608.
[8] Boukobza M,Cebula H,Pop R,et al.Cystic meningioma:radiological,histological,and surgical particularities in 43 patients[J].Acta Neurochir,2016,158(10):19551964.
[9] Park JS,Sade B,Oya S,et al.The influence of age on the histological grading of meningiomas[J].Neurosurg Rev,2014,37(3):425429.
[10]Claus EB,Bondy ML,Schildkraut JM,et al.Epidemiology of intracranial meningioma[J].Neurosurgery,2005,57(6):10881095.
[11]Ketter R.Correspondence of tumor localization with tumor recurrence and cytogenetic progression in meningiomas[J].Neurosurgery,2009,64(6):E1206.
[12]Abedalthagafi M,Bi WL,Aizer AA,et al.Oncogenic PI3K mutations are as common as AKT1 and SMO mutations in meningioma[J].Neuro Oncol,2016,18(5):649655.