动物可食性组织中甲砜霉素、氟苯尼考胺及氟苯尼考残留的测定


【摘要】建立高效液相色谱法测定动物可食性组织中氟苯尼考、氟苯尼考胺和甲砜霉素残留量。试样经过乙腈-乙酸乙酯-氨水(体积比5∶15∶80)混合提取液提取,4%氯化钠溶液和正己烷液分配净化,再经HLB固相萃取柱净化,高效液相色谱仪测定,外标法定量。结果表明,甲砜霉素在25~5000 ng/mL、氟苯尼考胺和氟苯尼考在5~500 ng/mL浓度范围内呈现良好的线性关系,甲砜霉素检测限为10μg/kg,氟苯尼考及氟苯尼考胺检测限为2.0μg/kg,回收率均值为73.6%~91.2%,批内、批间RSD值均小于20%。本方法专属性强,灵敏度高,适用于动物可食性组织中甲砜霉素、氟苯尼考胺及氟苯尼考残留的测定。
【关键词】动物可食性组织;氟苯尼考;氟苯尼考胺;甲砜霉素;高效液相色谱法
【DOI编码】10.3969/j.issn.1674-4977.2024.03.002
Determination of Thiamphenicol, Flufenicomide and Flufenicol Residues in Edible Animal Tissues
LIU Kai
(Liaoning Inspection, Examination & Certification〔Liaoning Institute forAgro-product Veterinary Drugs and Feed Control〕, Shenyang 110036, China)
Abstract: A high-performance liquid chromatography method has been established for the determination of flufenicol, flufenicomide, and thiamphenicol residues in edible animal tissues. The sample was extracted with a mixed extraction solution of acetonitrile-ethyl acetateammonia (volume ratio 5∶15∶80) and purified by 4% sodium chloride solution and n-hexane liquid-liquid distribution, and then purified with HLB solid-phase extraction column. The sample was determined by high-performance liquid chromatography and quantified using an external standard method. The results showed that there was a good linear relationship between the concentration range of 25 ng/mL to 5000 ng/mL of thiamphenicol, and between the concentrations of 5 ng/mL to 500 ng/mL of flufenicol and flufenicomide. The detection limit of thiamphenicol was 10μg/kg, while that of flufenicol and flufenicomide was 2.0μg/kg. The average recovery was 73.6% to 91.1%, and the RSD were<20%. This method is suitable for the determination of thiamphenicol, flufenicomide, and flufenicol residues in edible tissues of animals.
Keywords: edible tissues of animals; flufenicol; flufenicomide; thiamphenicolresidues; high performance liquid chromatography method
甲砜霉素和氟苯尼考是氯霉素的主要替代品,应用较广,具有潜在的体内蓄积危险[1-3],并且由于操作不慎引起残留的可能性很大。因此,甲砜霉素和氟苯尼考胺可能在动物可食性组织中发生残留。
GB 31650—2019《食品安全国家标准食品中兽药最大残留限量》规定,在牛、羊、猪、家禽、鱼的靶组织中,甲砜霉素的最大残留限量均为50μg/kg;氟苯尼考在猪肉、猪皮+脂、猪肾、猪肝、禽肉、禽皮+脂、禽肾、禽肝、牛/羊肉、牛/羊肾、牛/羊肝、鱼肉+皮的最大残留限量分别为300、500、500、2000、100、200、750、2500、200、300、3000、1000μg/kg。
目前,美国采用GC/MS法、欧盟和日本均推荐HPLC法测定组织中氟苯尼考的残留量[4-6]。国内对于动物可食性组织中氟苯尼考(FF)、氟苯尼考胺(FFA)和甲砜霉素(TAP)检测的研究主要集中于三方面:一是水产品中氟苯尼考、氟苯尼考胺的检测[7],二是动物可食性组织中甲砜霉素和氟苯尼考的同时检测[8-10],三是液相色谱质谱法、气相色谱质谱法对氯霉素类药物的残留检测[11-13]。而对于动物可食性组织中甲砜霉素、氟苯尼考及其代谢物氟苯尼考胺的同时检测却未见报道。
因此,制定动物可食性组织中甲砜霉素、氟苯尼考胺和氟苯尼考的检测方法,可以大大提高甲砜霉素、氟苯尼考胺和氟苯尼考检测效率,在促进畜牧业可持续发展,保障人民身体健康,维护国家食品安全等方面都具有重要意义。甲砜霉素、氟苯尼考胺和氟苯尼考如图1~图3所示。

1材料与方法
1.1仪器与材料
Waters E2695高效液相色谱(美国Waters公司);高速冷冻离心机(Biofuge Strators Centrifuge,德国Thermo Fisher Scientific公司);均质器(PRO250,美国Pro Scientific公司);氮吹仪(OA-SYS,美国Organomation Associates.Inc公司);MilliQ超纯水器(美国Millipore公司);氟苯尼考对照品(纯度98.0%)、氟苯尼考胺对照品(纯度92.3%)、甲砜霉素对照品(纯度99.7%)、乙酸乙酯(色谱纯)、乙腈(色谱纯)、氨水(分析纯)。
1.2标准溶液的配制
精密称取氟苯尼考、甲砜霉素、氟苯尼考胺对照品适量(相当于各有效成分10 mg),用乙腈稀释成浓度为100μg/mL对照品储备液,置于-20℃环境中保存。
1.3标准曲线溶液的配制
分别准确吸取甲砜霉素、氟苯尼考及氟苯尼考胺标准储备液适量,经初始流动相稀释分别配置成不同浓度的混合标准溶液,其中,甲砜霉素的浓度分别为25.0、50.0、300.0、600.0、2500.0、5000.0μg/L,氟苯尼考胺和氟苯尼考对照品浓度分别为5.0、10.0、25.0、50.0、100.0、500.0μg/L系列对照溶液,上机测定。
1.4方法
1.4.1样品溶液的制备
取试料2 g(精确至±1%)于50 mL离心管中,加提取液(乙腈-乙酸乙酯-氨水,5+15+80)15 mL,涡旋1 min,10,000 r/min离心5 min,移取上清液。残渣用15 mL提取液重复提取一次,合并两次提取液于离心管中,混匀。-20℃冷冻1 h,10,000 r/min离心5 min,上清液置于100 mL鸡心瓶中,加入5 mL正丙醇,50℃减压浓缩至干。加入5 mL 4%氯化钠溶液-甲醇(95+5)溶液溶解残渣,振荡3 min,转入50 ml离心管中,加入5 ml甲醇氯化钠溶液重复溶解残渣,合并溶解液。加入10 ml正己烷,振荡5 min,5000 r/min离心5 min,弃去正己烷层,再加入10 mL正己烷,重复上述操作,加入0.5 ml氨水,混匀,为备用液。HLB固相萃取柱依次用3 mL甲醇、3 mL水润洗。备用液过柱,依次用3 mL水、3 mL水-甲醇-氨水(180+19+1)淋洗,真空抽干,再用3 mL氨水-甲醇(3.3+ 96.7)洗脱,50℃下氮气吹干,残渣用2 mL流动相溶解过0.22μm滤膜作为试样溶液。供高效液相色谱仪测定。
1.4.2色谱条件
色谱柱:C18(250 mm×4.6 mm,粒径5μm);流动相:乙腈+0.8 mol/L庚烷磺酸钠离子对缓冲溶液(21+79);流速:0.7 mL/min;柱温:30℃;进样量:20μL。荧光检测器:激发波长235 nm;发射波长295 nm。
1.4.3检测限与定量限的确定
称取2 g空白组织,加适量混合标准溶液,按样品前处理方法处理后测定。待测物的信噪比S/N>3(按PtP算)为方法的检出限;待测物的信噪比S/N>10(按PtP算)为方法的定量限。
1.4.4方法的添加回收率与精密度
分别制备低、中、高3种浓度水平的阳性添加样品,每种浓度水平进行5份样本分析,重复3次。根据当日的标准曲线和阳性添加样品的响应值,计算样品的提取回收率,并计算样品的批内、批间相对标准偏差。
2结果与分析
2.1方法专属性考察
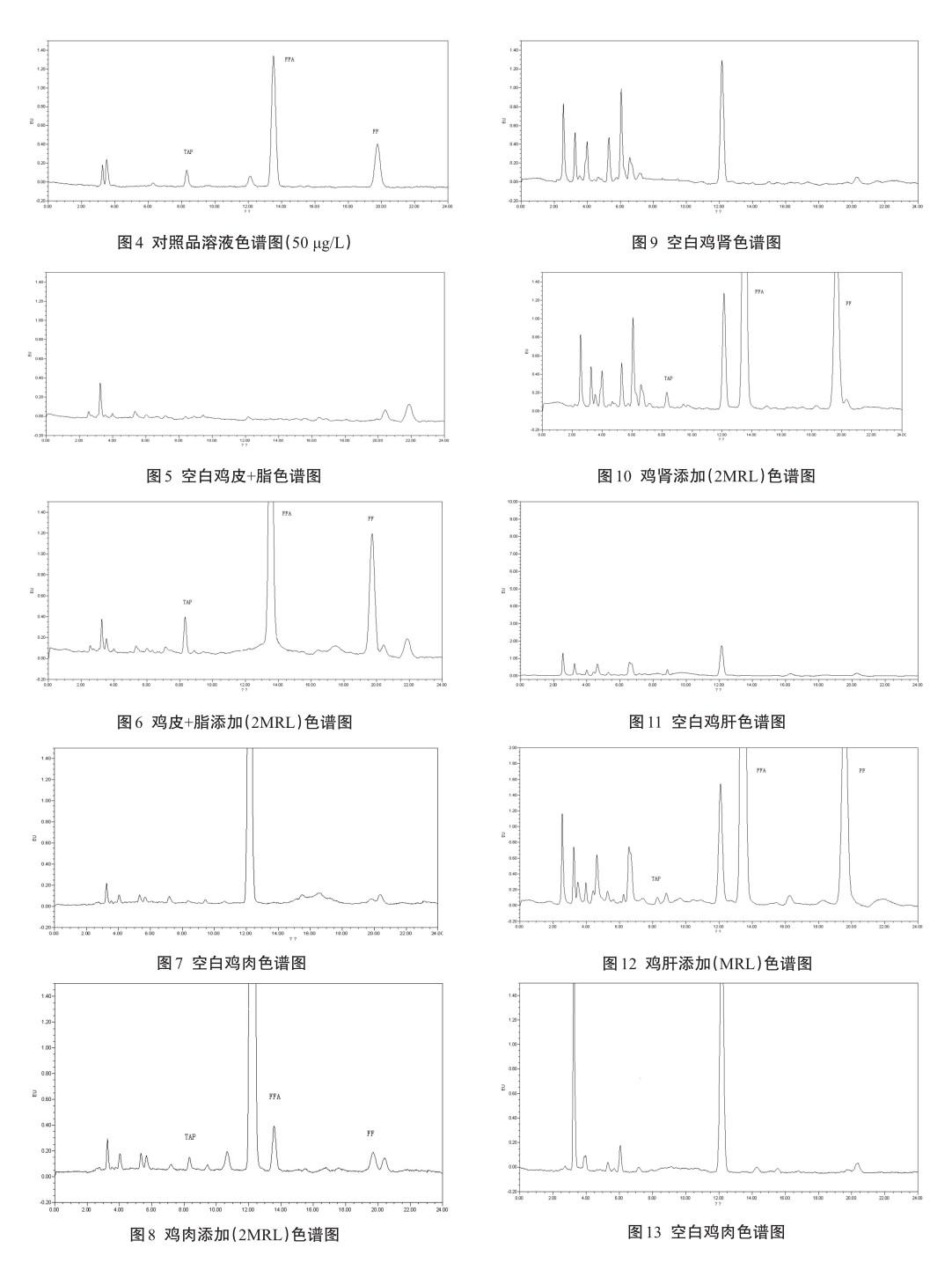
对照品溶液、空白样品、添加回收色谱图见图4~图34。


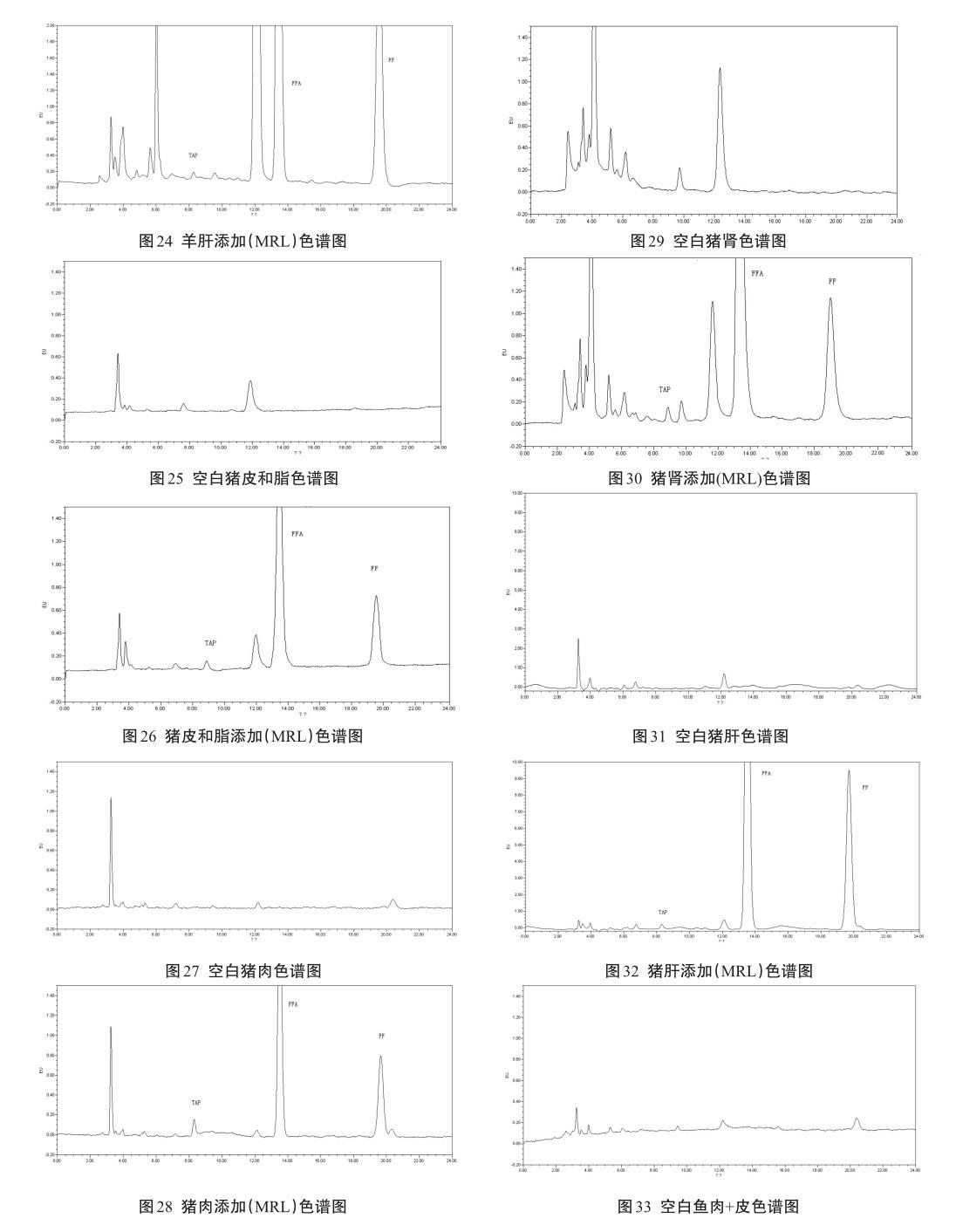

图4~图34的结果显示,在本研究的前处理条件和仪器条件下,样品中内源性的杂质对检测无干扰,具有较好的专属性。
2.2线性范围
将峰面积设定为纵坐标,对照溶液的浓度设定为横坐标,得到标准曲线,见表1。

2.3检测限与定量限的确定
甲砜霉素在猪肉、猪皮+脂、猪肾、猪肝、禽肉、禽皮+脂、禽肾、禽肝、牛/羊肉、牛/羊肾、牛/羊肝、鱼肉+皮中检出限均为10μg/kg,定量限为50.0μg/kg;氟苯尼考及氟苯尼考胺在猪肉、猪皮+脂、猪肾、猪肝、禽肉、禽皮+脂、禽肾、禽肝、牛/羊肉、牛/羊肾、牛/羊肝、鱼肉+皮中检出限均为2.0μg/kg,定量限为10.0μg/kg。
2.4方法的添加回收率与精密度
采用标准添加法,在空白组织中添加高、中、低3种浓度的混合标准工作液进行精密度和准确度的测定,每次5个重复,并进行3次重复实验。由表2~表5可知,在高、中、低3种浓度下,
甲砜霉素的回收率在71.8%~98.7%,氟苯尼考胺的回收率在70%~ 98.6%,氟苯尼考的回收率在70.2%~99.4%,批内变异系数≤13.2%;批间变异系数≤7.8%。
3讨论
3.1流动相的优化
本实验使用高效液相色谱仪[14-17],A泵入磷酸盐溶液,B泵入乙腈,通过调节两泵流速,从而改变流动相极性。当乙腈比例从15%调节到40%时,各待测物质的出峰时间均缩短;当乙腈比例是21%时,各待测物峰与杂质峰充分分离,峰形较好。由于氟苯尼考胺为弱碱性极性的性质,在C18反相色谱柱中几乎不保留[18-21],因此本实验采用离子对色谱原理进行分析。本实验采用的离子对试剂是庚烷磺酸钠,与氟苯尼考胺生成弱极性离子对,弱极性离子对分布在疏水固定相表面,然后再被流动相洗脱下来。随着庚烷磺酸钠浓度的增加,氟苯尼考胺出峰时间不断延长,当庚烷磺酸钠浓度达到0.8 mol/L时,氟苯尼考胺与杂质峰充分分离,峰形较好。
3.2光谱条件的确定
较紫外检测器检测,本实验采用的荧光检测器样品杂质峰少、干扰少,可将甲砜霉素、氟苯尼考与氟苯尼考胺与组织中的其他组分完全分开,而且荧光检测器灵敏度更高[22-24]。根据文献报道,将激发波长从200~280 nm,发射波长从255~400 nm做依次检测,确定在激发波长235 nm,发射波长295 nm荧光条件下,可获得较大的甲砜霉素、氟苯尼考与氟苯尼考胺信号。
3.3提取溶剂的选择

甲砜霉素与氟苯尼考属于弱极性化合物,微溶于水,易溶于有机溶剂。氟苯尼考胺极性强,微溶于水,在弱碱性条件下以分子状态存在,易溶于有机溶剂[25-27]。本实验比较了乙酸乙酯、乙腈、丙酮、氨化乙酸乙酯(体积比2∶98)、氨化乙腈(体积比2∶98)、氨水乙酸乙酯乙腈混合提取液(体积比2∶49∶49)、氨水乙酸乙酯乙腈混合提取液(体积比5∶15∶80)。结果表明:乙酸乙酯、乙腈、丙酮、氨化乙酸乙酯(体积比2∶98)、氨化乙腈(体积比2∶98)、氨水乙酸乙酯乙腈混合提取液(体积比2∶49∶49)对甲砜霉素和氟苯尼考的提取效率较好,回收率较高,但对氟苯尼考胺的提取效率较差,回收率较低。氨水、乙酸乙酯、乙腈混合提取液(体积比5∶15∶80)对甲砜霉素、氟苯尼考及氟苯尼考胺的提取效率较好,回收率较高,而且杂质峰相对较少。
4结束语
本试验建立的样品前处理分析方法净化效果好,灵敏度高,甲砜霉素检测限为10μg/kg,氟苯尼考及氟苯尼考胺检测限为2.0μg/kg,回收率均值为73.6%~91.1%,批内、批间RSD< 20%。空白基质对检测上述3种药物无干扰,专属性强,适用于动物可食性组织中甲砜霉素、氟苯尼考胺及氟苯尼考残留的测定。
【参考文献】
[1]李蔚然,汤晓艳.我国和CAC动物源性食品中农药最大残留限量标准比对分析[J].农产品质量与安全,2022(1):50-56.
[2]刘桂兰,程转红,刘爱玲,等.中欧美羊用药物批准现状及研发方向分析[J].兽医导刊,2015(5):44-46.
[3]周迎春,韩文凤,刘少博.我国动物源性食品中兽药残留的原因分析[J].粮食与油脂,2021,34(5):160-162.
[4]高鹏飞,龚威,汤亚云,等.牛、羊肉和牛、羊奶中兽药残留现状分析及检测技术研究进展[J].中国兽药杂志,2022,56(1):77-85.
[5]彭文绣,韩宁宁,王轩,等.鸡蛋中氟苯尼考残留的现状及思考[J].中国兽药杂志,2023,57(10):83-89.
[6]萧志梅.氟苯尼考的临床应用及市场状况[J].中国兽药杂志,2000(5):53-54.
[7]张建民,钟超平.兽用广谱抗生素氟苯尼考的合成(一)[J].国外医药(抗生素分册),1999(1):13-16.
[8] ORLAMDO E A,ROQUE A G C,LOSEKANN M E,et al. UPLC-MS/MS determination of florfenicol and florfenicol amine antimicrobial residues in tilapia muscle[J].Journal of Chromatography B,2016,1035:8-15.
[9]舒安丽,于潇萌.畜禽市场行情及中国肉鸡养殖中抗生素使用情况分析[J].中国动物保健,2013,15(6):20-22.
[10]堵鹤明.我国鸡蛋价格波动及传导机制研究[D].石家庄:河北经贸大学,2020.
[11]吕冰峰,刘敏,裴新荣.2018年鸡蛋的国家食品安全监督抽检结果分析[J].食品安全质量检测学报,2020,11(1):319-323.
[12]杨修镇,李有志,薄永恒,等.2019年全省鸡蛋风险监测结果给予的启示[J].山东畜牧兽医,2020,41(3):58-60.
[13]边文文,范芳芳,魏宁果.动物源性食品中氯霉素类药物残留量风险分析[J].农产品加工,2019(11):59-61.
[14] ZHANG Q Q,YING G G,PAN C G,et al. Comprehensive Evaluation ofAntibiotics Emission and Fate in the River Basins of China: Source Analysis, Multimedia Modeling, and Linkage to Bacterial Resistance[J].Environmental Science & Technology:ES&T,2015,49(11):6772-6782.
[15]熊玥,宋慧敏,石慧慧,等.当前兽药非法添加现象与防控对策[J].中国兽医杂志,2020,56(8):101-104.
[16]杨宁,家禽生产学[M].北京:中国农业出版社,2010.
[17]李亚男,杨帆,王丹,等.氟苯尼考的药效学及其对禽源致病菌的治疗作用[J].广东畜牧兽医科技,2015,40(1):1-4.
[18]梁梦颖.鸡常见病的症状与防治措施[J].湖北畜牧兽医,2020,41(11):23-24.
[19]杨文.氟苯尼考治疗鸡巴氏杆菌病的临床观察[J].内江科技,2003(5):21.
[20]王自然,阮明华.氟苯尼考琥珀酸钠对人工诱发鸡大肠杆菌病的疗效观察[J].中国畜牧兽医,2010,37(4):212-214.
[21]王海花,曹素芳,张桂云,等.复方氟苯尼考对实验性鸡慢性呼吸道疾病的疗效试验[J].中国兽医杂志,2008(6):61-62.
[22]王霓霓.主要贸易国家和地区食品中农兽药残留限量标准[M].北京:中国标准出版社,2010.
[23]赵文贵.从强化兽药休药期着手确保动物食品安全[J].畜牧兽医科技信息,2010(10):6.
[24]陈大伟,赵敏,刘茵茵,等.氟苯尼考在产蛋前期鸡蛋中的残留规律及膳食暴露评估[J].食品安全质量检测学报,2020,11(24):9487-9495.
[25]陈玲,朱焕星,高迎春,等.浅谈我国兽药残留标准存在的问题及建议[J].山东畜牧兽医,2012,33(7):72-73.
[26]张苏珍,王益军,贺燕等.禽蛋产业中兽药使用存在的问题及对策建议[J].安徽农学通报,2019,25(12):114-115.
[27]陈月明.我国禽蛋产品药物残留现状与控制[J].中国动物检疫,2017,34(4):32-35.
【作者简介】
刘凯,女,1975年出生,高级畜牧师,学士,研究方向为畜产品药物残留检测。
(编辑:李钰双)

