成人丘脑胶质瘤与成人脑干胶质瘤分子遗传特征的差异与预后相关
郭瑶 赖名耀 李少群 周江芬 李海南 蔡林波
【摘要】 目的 分析成人丘脑胶质瘤与成人脑干胶质瘤分子遗传特征的差异,为成人丘脑胶质瘤精准诊疗提供依据。方法 收集19例成人丘脑胶质瘤及9例成人脑干胶质瘤的肿瘤组织样本,采用二代测序技术(NGS)检测425个肿瘤相关基因,分析成人丘脑胶质瘤与成人脑干胶质瘤的基因点突变、基因拷贝数变异等分子遗传特征及差异。结果 在收集的标本中,成人丘脑及脑干的弥漫中线胶质瘤发生率差异无统计学意义(P>0.05),但丘脑更易发生胶质母细胞瘤(P=0.026)。成人丘脑胶质瘤TP53突变、TERT启动子突变、CDK4/6扩增、PTEN突变、EGFR扩增比例高于成人脑干胶质瘤,H3K27M突变、IDH1突变、MCL1扩增、NF1突变、ATRX突变、FAT1突变比例低于脑干胶质瘤,其中TERT启动子突变比例在两者中有显著差异(P=0.026);成人丘脑胶质瘤中发生PI3K 信号通路激活比例显著高于成人脑干胶质瘤(P=0.016)。单因素分析结果显示成人丘脑胶质瘤中TP53突变(P=0.01)、CDK4/6扩增(P=0.02)、EGFR扩增(P=0.04)和ARID1A(P=0.048)突变均与患者低生存显著相关,而成人脑干胶质瘤中FAT1突变(P=0.024)和MCL1扩增(P=0.017)与患者低生存显著相关。结论 成人丘脑较脑干更易发生胶质母细胞瘤,而且二者分子遗传特征也存在明显差异,提示成人丘脑胶质瘤是不同于成人脑干胶质瘤的一类具特殊遗传肿瘤谱的肿瘤。
【关键词】 胶质瘤;丘脑;脑干;分子遗传
【中图分类号】 R739.41 【文献标志码】 A 【文章编号】 1672-7770(2024)03-0273-07
丘脑胶质瘤属于临床罕见肿瘤,发病率低,占颅内肿瘤1%~5%,而成人丘脑胶质瘤发病率更低,仅仅占颅内肿瘤1%,主要治疗手段包括手术、放疗及化疗等,少数患者接受激光间质热疗(laser interstitial thermal therapy,LITT),但预后差,中位生存时间仅13.6个月,肿瘤切除程度、术后放化疗是影响预后主要因素[12]。但由于丘脑位于大脑半球中央深部、解剖结构复杂、功能重要、毗邻重要功能区及血管,手术切除肿瘤极具挑战,临床亟须寻找新治疗方法提高丘脑胶质瘤的疗效。2021年Wang等[3]的研究结果显示成人丘脑胶质瘤与大脑半球胶质瘤在H3K27M突变、异柠檬酸脱氢酶1(isocitric dehydrogenase 1,IDH1)突变、O6-甲基鸟嘌呤甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)启动子甲基化、Ki-67增殖指数等方面存在明显差异,提示丘脑胶质瘤可能是一种特殊类型的胶质瘤。因此,为进一步了解成人丘脑胶质瘤分子遗传特征,探索更有效的精准治疗方案,本研究拟开展对成人丘脑胶质瘤及成人脑干胶质瘤的分子遗传特征差异与预后相关研究。现报告如下。
1 资料与方法
1.1 一般资料 共纳入28例胶质瘤患者,其中男20例,女8例;年龄18~66岁;丘脑胶质瘤19例,脑干胶质瘤9例,见表1。纳入标准:(1)年龄≥18岁;(2)影像学确诊病变主体位于丘脑或脑干,经过2名中级职称以上有经验的放射诊断医师确认;(3)按照2021年世界卫生组织中枢神经系统肿瘤分类标准病理确诊的胶质瘤患者。排除标准:(1)影像学确诊病变位置位于中线以外而病灶边缘累及丘脑及脑干;(2)复发胶质瘤。
1.2 方法
1.2.1 肿瘤组织病理学检查 所有标本经中杉公司行苏木精伊红(hematoxylin eosin,HE)染色(染色浓度为工作液),光镜观察选择含肿瘤组织蜡块,采用全自动免疫组化进行检测。对其中所有肿瘤石蜡标本进行H3K27M免疫组化标记,部分肿瘤进行相关免疫组化标记GFAP(单克隆抗体为鼠单抗UMAB129和EP13)、Olig-2(单克隆抗体为鼠单抗OT17C7和免单抗EP112)、IDH1(单克隆抗体为鼠单抗H09)、P53(GM70097)、ATRX(D5)和Ki-67(GM027)。
1.2.2 肿瘤组织二代测序技术(next generation sequencing,NGS)检测 使用425基因探针(世和基因)在HiSeq 4000平台(Illumina)上测序行NGS检测,步骤如下:肿瘤组织DNA提取处理、高通量测序文库构建及质控、探针富集肿瘤驱动基因、文库混合与上样测序。
1.2.3 生物信息学分析 数据质量控制使用Trimmomatic[4],质控后数据使用BWA[5](0.7.12)的MEM算法,使用GATK version 3.4-0将比对结果的局部比对优化[67]。SNVs/Indels/CNVs异分析:点突变(SNVs)与插入缺失(Indels)的分析,使用VarScan2(2.3.9)[8],设置最低检出频率为0.01,P值设置为0.05,生成VCF结果及注释[9]。拷贝数变异(CNVs)分析使用ADTEx(1.0.4)[10]。
1.3 统计学分析 (1)分子特征分析基于患者突变信息进行OncoPrint作图;(2)两组间分子差异分析:当单组样本量≤4时,进行Fisher精确检验;当单组样本量>4时,进行Pearson卡方检验;(3)预后相关基因分析:首先进行Cox单因素分析,选择P<0.05的基因进行Cox多因素分析,并使用Kaplan-Meier法绘制生存曲线。
2 结 果
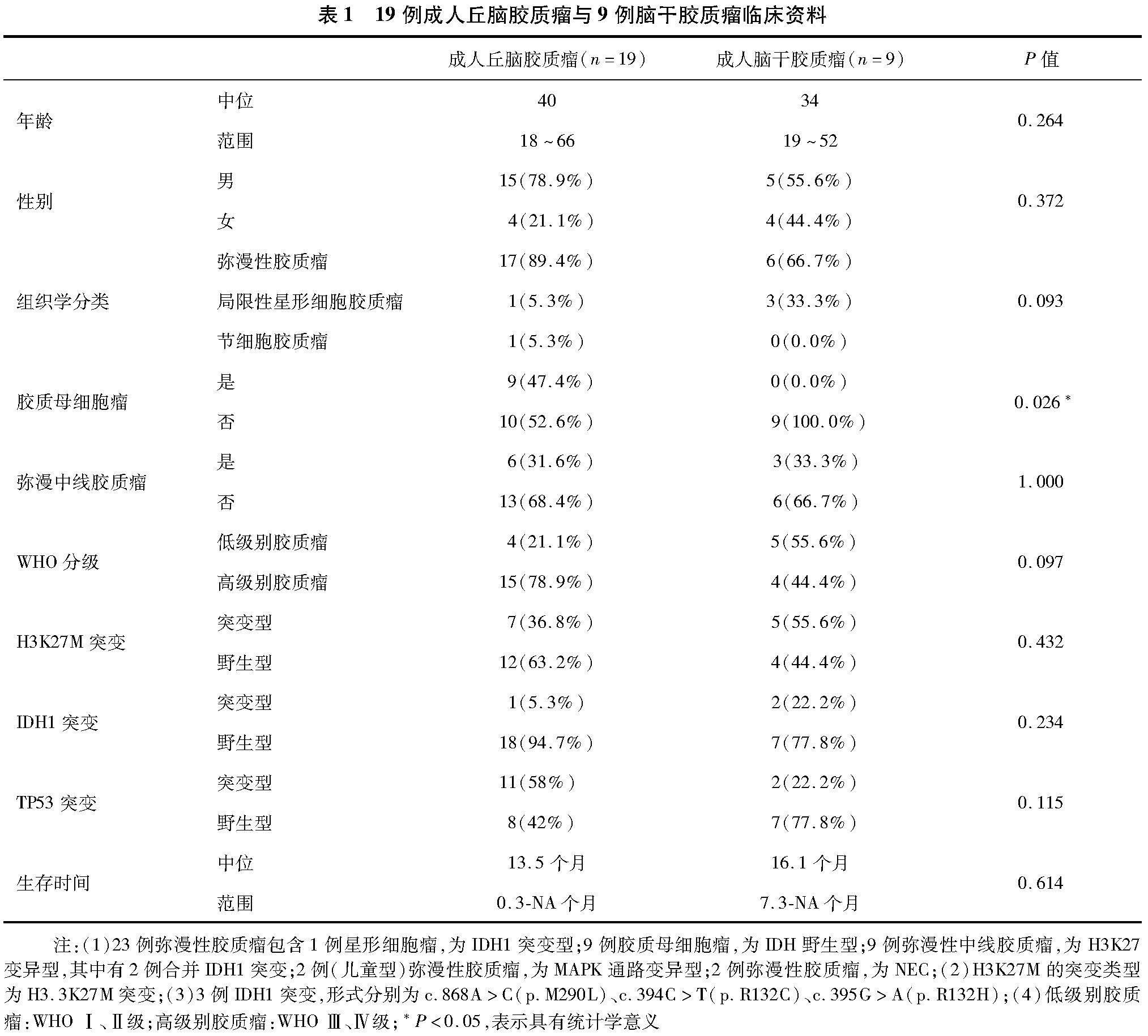
2.1 患者基本资料及临床特征 成人丘脑胶质瘤中高级别(WHO Ⅲ、Ⅳ级)胶质瘤15例(15/19,78.9%)、弥漫中线胶质瘤6例(6/19,31.6%)、胶质瘤母细胞瘤9例(9/19,47.4%);成人脑干胶质瘤中高级别胶质瘤4例(4/9,44.4%)、弥漫中线胶质瘤3例(3/9,33.3%)、无胶质母细胞瘤(0/9,0.0%);丘脑、脑干的高级别胶质瘤及弥漫中线胶质瘤发生率差异无统计学意义(P>0.05),但丘脑较脑干更容易发生胶质瘤母细胞瘤(分别为47.4% 和0.0%,P=0.026)。
2.2 NGS分析成人丘脑胶质瘤与脑干胶质瘤的分子差异
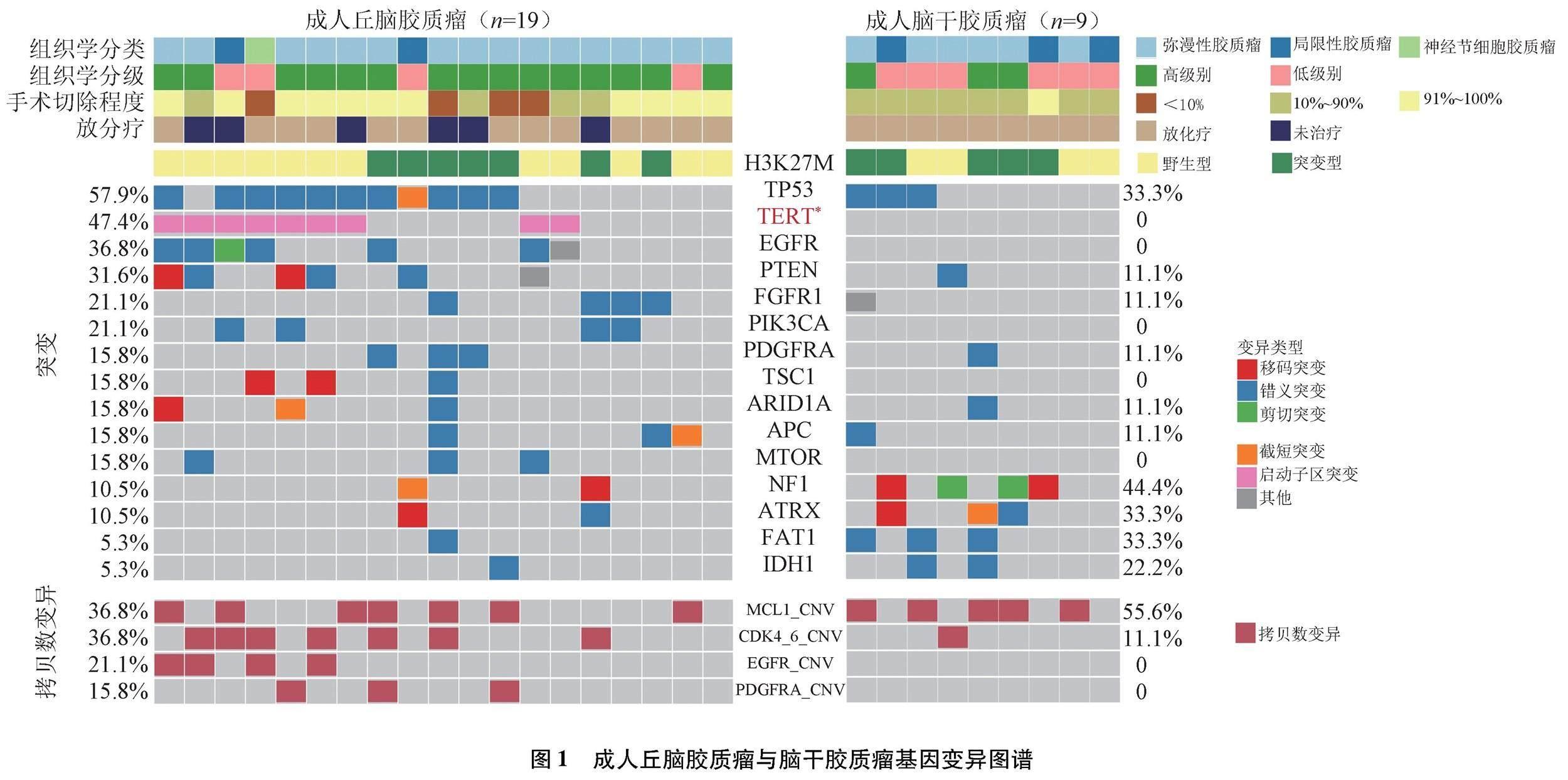
2.2.1 成人丘脑胶质瘤与脑干胶质瘤基因变异特征的差异 采用NGS对19例丘脑胶质瘤和9例成人脑干胶质瘤肿瘤组织样本检测425个肿瘤相关基因变异发生情况。
36.8%(7/19)的成人丘脑胶质瘤患者中检测到H3K27M突变。同时检测到既往报道过的中线胶质瘤生物标志物,包括TP53突变(11/19,57.9%)、TERT启动子突变(9/19,47.4%)、PTEN突变(6/19,31.6%)、EGFR扩增(7/19,36.8%)、IDH1突变(1/19,5.3%)等。而成人脑干胶质瘤中存在H3K27M突变(5/9,55.6%)、MCL1扩增(5/9,55.6%)、NF1突变(4/9,44.4%)、TP53突变(2/9,22.2%)、ATRX突变(3/9,33.3%)、FAT1突变(3/9,33.3%)及IDH1突变(2/9,22.2%)等等,未见TERT启动子突变、EGFR变异、PDGFRA扩增等中线胶质瘤生物标志物。比较成人丘脑和脑干胶质瘤患者基因变异情况(至少3例患者发生的基因变异才被认为有意义),结果显示成人丘脑胶质瘤患者发生TERT启动子突变的频率明显更高(分别为47.4%和0.0%,P=0.026)。见图1。
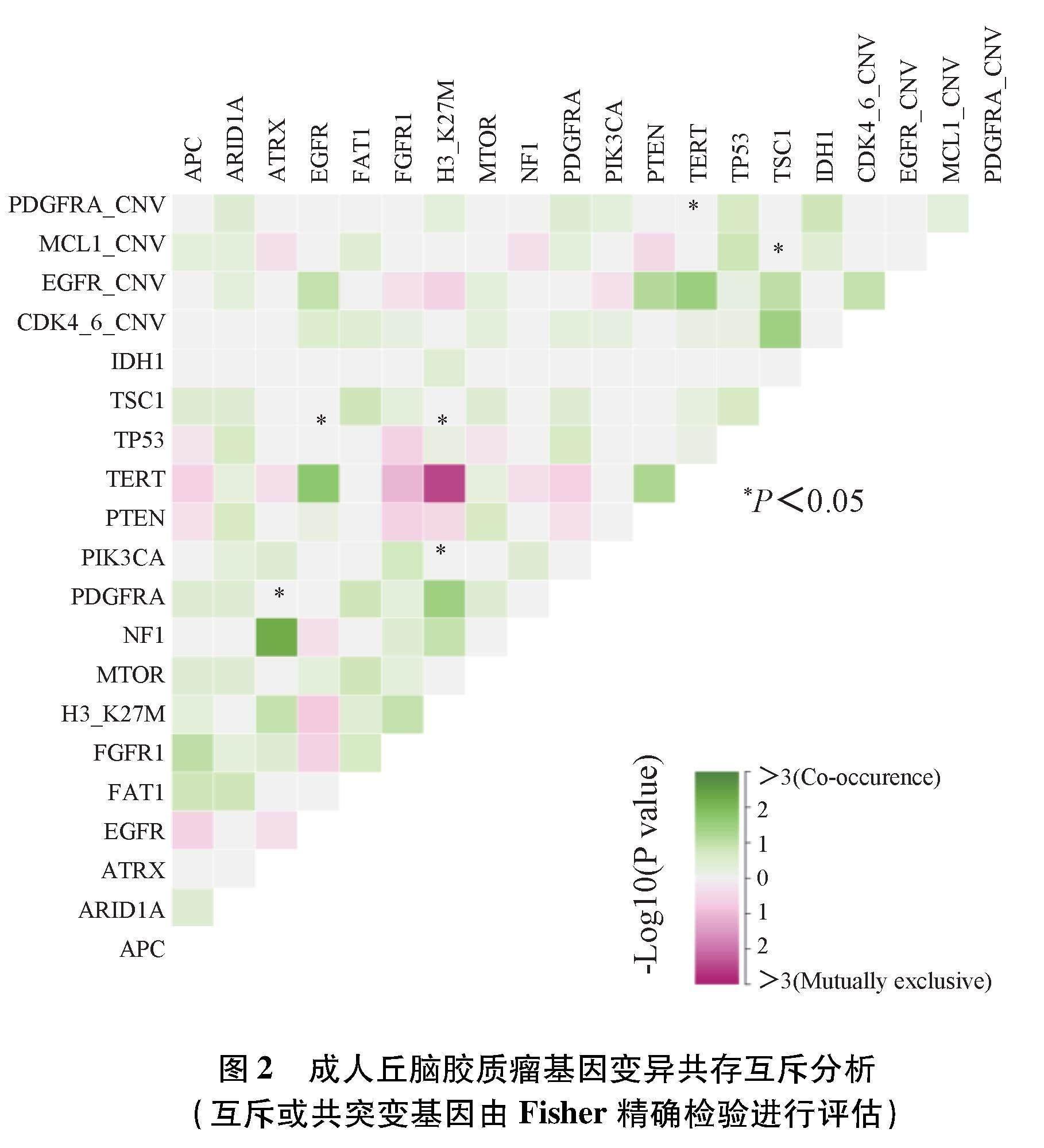
进一步比较分子间的相关性,结果显示成人丘脑胶质瘤中H3K27M基因突变与TERT启动子突变相互排斥,与PDGFRA突变明显重叠;TERT启动子突变经常与EGFR变异共同存在。见图2。
2.2.2 成人丘脑胶质瘤与脑干胶质瘤信号通路激活差异 癌症基因组图谱(The Cancer Genome Atlas,TCGA)研究分析显示胶质母细胞瘤关键基因变异导致相关信号通路激活[1113],参考Osada等的研究成果[14],分析包括RTK/RAS、TP53、PI3K、CELL CYCLE、WNT、NOTCH、HIPPO、MYC、TGF-β信号通路激化,28例胶质瘤信号激活发生包括RTK/RAS(25/28,89.3%)、TP53(14/28,50%)、PI3K(13/28,46.4%)、CELL CYCLE(9/28,32.1%)、WNT(8/28,28.6%)、NOTCH(6/28,21.4%)、HIPPO(5/28,17.9%)、MYC(4/28,14.3%),其中PI3K通路激活在成人丘脑胶质瘤中的占比显著高于成人脑干胶质瘤(分别为63.2%和11.1%,P=0.016)。见图3。
2.2.3 成人丘脑胶质瘤与脑干胶质瘤预后基因差异
2.2.3.1 成人丘脑胶质瘤与脑干胶质瘤预后差异成人丘脑胶质瘤患者中位总生存期为13.5个月(0.3-NA个月),成人脑干胶质瘤患者中位总生存期为16.1个月(7.3-NA个月),两者无显著性差异(P=0.614)。见图4。
2.2.3.2 成人丘脑胶质瘤与脑干胶质瘤预后基因差异 本研究为进一步确定基因变异是否与成人丘脑胶质瘤患者的生存相关,对整个队列中至少3个患者发生的基因变异进行单因素分析发现,TP53突变(11/19,57.9%)、CDK4/6扩增(7/19,36.8%)、EGFR扩增(4/19,21.1%)和ARID1A突变(3/19,15.8%)与患者生存显著相关(P<0.05)。见图5。值得注意的是,在成人脑干胶质瘤中没有观察到这种关系(表2),其生存与FAT1突变和MCL1扩增显著相关(P<0.05)。见图6。
为进一步排除混淆因素,将放/化疗、TP53突变、CDK4/6扩增、EGFR扩增和ARID1A突变这5个因素纳入多因素分析,结果发现放/化疗(HR=0.16,95%CI=0.05~0.55,P=0.003)、EGFR扩增(HR=3.69,95%CI=1~13.6,P=0.04)、ARID1A突变(HR=3.77,95%CI=0.922~15.4,P=0.048)可能是成人丘脑胶质瘤独立预测因子;而成人脑干胶质瘤患者由于例数过少,无法进行多因素分析。
3 讨 论
丘脑与脑干解剖位置毗邻,丘脑高级别胶质瘤是一种不同于幕上大脑半球高级别胶质瘤的一类肿瘤[11],本研究发现成人丘脑比脑干更易发生胶质母细胞瘤(P<0.05),丘脑胶质瘤中IDH1突变发生率为6.2%,而成年人脑干胶质瘤中IDH1发生率为9%~13.6%,明显低于大脑半球胶质瘤的56.5%[3,1213]。TERT启动子突变频率在成人丘脑胶质瘤明显高于脑干胶质瘤(P=0.026),而且成人丘脑胶质瘤中发生H3K27M突变患者的肿瘤组织中未能检测到TERT启动子突变,H3K27M野生型患者肿瘤组织中TERT启动子突变发生率为61.5%,两者存在互斥,并且H3K27M和TERT基因野生型患者预后明显优于H3K27M突变或TERT启动子突变的患者[14]。另外在中线胶质瘤中RTK/RAS信号通路激活最为常见[15],同样成人丘脑胶质瘤与脑干胶质瘤也最容易发生RTK/RAS信号通路激活,但PI3K通路激活在两者之间存在差异(P=0.016)。因此,成人丘脑胶质瘤在胶质母细胞瘤发生率、IDH1突变、TERT启动子突变及PI3K信号通路激活与成人脑干胶质瘤存在差异,提示成人丘脑胶质瘤是一类有别成人脑干胶质瘤的肿瘤。
H3K27M作为中线胶质瘤诊断和分类的重要分子标记,在成人丘脑胶质瘤中H3K27M突变发生率为37.4%,而在成人脑干胶质瘤中发生率为55.6%,两者发生率没有统计学差异(P=0.432),且研究显示H3K27M突变并不影响成人中线胶质瘤的预后[16]。进一步研究发现,H3K27M突变不影响幕上胶质瘤预后(P=0.603),而幕下胶质瘤合并H3K27M突变患者预后较差(P<0.000 1)[17],在成人脑干胶质瘤中H3K27M突变患者中位生存时间仅为9个月,明显低于H3K27M野生型患者(P<0.001)[18]。同样,本研究发现丘脑胶质瘤H3K27M突变不影响预后(P=0.65),而成人脑干胶质瘤H3K27M突变的患者有预后较差趋势,但差异无统计学意义(P=0.17);另外本研究中2例患者H3K27M突变同时存在IDH1突变。因此,虽然丘脑与脑干解剖位置毗邻,即使相同H3K27M突变对于成人丘脑胶质瘤与成人脑干胶质瘤的预后影响并不一样,但需要扩充样本量证实上述观点。
成人丘脑胶质瘤与脑干胶质瘤与预后相关的分子特征亦不同,其中与成人脑干胶质瘤预后相关的基因改变包括FAT1突变、MCL1扩增,而与成人丘脑胶质瘤相关包括TP53突变、EGFR扩增、ARID1A突变、CDK4/6扩增。而且成人丘脑胶质瘤中ARID1A突变、CDK4/6扩增不仅与预后相关,而且有望成为成人丘脑胶质靶向治疗潜在位点,尤其成人丘脑胶质瘤中CDK4/6扩增发生率高达31.8%,在临床前研究发现CDK4/6的抑制剂对患者来源的二维和三维胶质母细胞瘤细胞培养模型及患者来源的异种移植瘤模型均显示抗肿瘤作用[1920],因此,该研究为下步CDKs抑制剂在成人丘脑胶质瘤靶向治疗的临床试验提供理论基础。
综上所述,丘脑与脑干位置毗邻,这两个位置的胶质母细胞瘤发生率存在差异,而且分子遗传变异也存在差异,并与预后相关的分子特征也存在差异,提示成人丘脑胶质瘤与成人脑干胶质瘤具有不同遗传肿瘤谱。本研究为成人丘脑胶质瘤精准治疗提供依据,但该研究存在不足包括研究分析数据仅仅基于425基因、病例数较少等,后续研究将进一步扩大病例数及整合基因组、转录组、蛋白组学等多组学数据分析两者差异。
利益冲突:所有作者均声明不存在利益冲突。
[参 考 文 献]
[1] Niu XD,Wang TW,Zhou XW,et al.Surgical treatment and survival outcome of patients with adult thalamic glioma:a single institution experience of 8 years[J].J Neurooncol,2020,147(2):377386.
[2] Zhang P,Wang XC,Ji N,et al.Clinical,radiological,and pathological features of 33 adult unilateral thalamic gliomas[J].World J Surg Oncol,2016,14:78.
[3] Wang TW,Niu XD,Gao T,et al.Molecular characteristics of thalamic gliomas in adults[J].J Mol Neurosci,2021,71(8):15981604.
[4] Bolger AM,Lohse M,Usadel B.Trimmomatic:a flexible trimmer for Illumina sequence data[J].Bioinformatics,2014,30(15):21142120.
[5] Li H,Durbin R.Fast and accurate short read alignment with Burrows-Wheeler transform[J].Bioinformatics,2009,25(14):17541760.
[6] McKenna A,Hanna M,Banks E,et al.The Genome Analysis Toolkit:a MapReduce framework for analyzing next-generation DNA sequencing data[J].Genome Res,2010,20(9):12971303.
[7] van der Auwera GA,Carneiro MO,Hartl C,et al.From FastQ data to high confidence variant calls:the Genome Analysis Toolkit best practices pipeline[J].Curr Protoc Bioinformatics,2013,43(1110):11.10.111.1011.10.33.
[8] Koboldt DC,Zhang QY,Larson DE,et al.VarScan 2:somatic mutation and copy number alteration discovery in cancer by exome sequencing[J].Genome Res,2012,22(3):568576.
[9] Robinson JT,Thorvaldsdóttir H,Winckler W,et al.Integrative genomics viewer[J].Nat Biotechnol,2011,29(1):2426.
[10]Riaz N,Havel JJ,Makarov V,et al.Tumor and microenvironment evolution during immunotherapy with nivolumab[J].Cell,2017,171(4):934949.e16.
[11]Zuo MR,Li M,Chen N,et al.IDH1 status is significantly different between high-grade thalamic and superficial gliomas[J].Cancer Biomark,2017,20(2):183189.
[12]Chen LH,Pan CC,Diplas BH,et al.The integrated genomic and epigenomic landscape of brainstem glioma[J].Nat Commun,2020,11(1):3077.
[13]Zhou CH,Zhao H,Yang F,et al.Clinical and genetic features of brainstem glioma in adults:a report of 50 cases in a single center[J].J Clin Neurol,2021,17(2):220228.
[14]Osada Y,Saito R,Shibahara I,et al.H3K27M and TERT promoter mutations are poor prognostic factors in surgical cases of adult thalamic high-grade glioma[J].Neurooncol Adv,2021,3(1):vdab038.
[15]Li HN,Shan CG,Wu SN,et al.Genomic profiling identified novel prognostic biomarkers in Chinese midline glioma patients[J].Front Oncol,2020,10:607429.
[16]Meyronet D, Esteban-Mader M, Bonnet C, et al. Characteristics of H3 K27M-mutant gliomas in adults[J].Neuro Oncol,2017,19(8):11271134.
[17]Wang L,Li Z,Zhang M,et al. H3K27M-mutant diffuse midline gliomas in different anatomical locations[J].Hum Pathol,2018,78:8996.
[18]Daoud EV,Rajaram V,Cai CY,et al.Adult brainstem gliomas with H3K27M mutation:radiology,pathology,and prognosis[J].J Neuropathol Exp Neurol,2018,77(4):302311.
[19]Riess C,Koczan D,Schneider B,et al.Cyclin-dependent kinase inhibitors exert distinct effects on patient-derived 2D and 3D glioblastoma cell culture models[J].Cell Death Discov,2021,7(1):54.
[20]Golebiewska A,Hau AC,Oudin A,et al.Patient-derived organoids and orthotopic xenografts of primary and recurrent gliomas represent relevant patient avatars for precision oncology[J].Acta Neuropathol,2020,140(6):919949.