超声引导下起搏器植入构建犬慢性心力衰竭模型的方法
王清 马学龄 梁小燕 美迪娜·叶尔肯 芦颜美

【摘要】目的 探讨超声引导下起搏器植入构建犬慢性心力衰竭(CHF)模型的方法。方法 随机选择健康犬5只,在超声引导下,将人用起搏电极经颈外静脉植入右心室心尖部,连接人用起搏器后,将其放置在右侧颈部囊袋中,采用心室非同步起搏模式,180次/min(3 d),220次/min(3 d),250次/min(3周),输出电压4.0 V,脉宽0.5 ms。通过观察起搏前后犬的临床表现、超声心动图、血浆脑钠肽水平以及心脏形态学变化来评价犬CHF模型构建的成效。结果 5只犬经右心室起搏4周后均出现食欲减退、呼吸困难、活动量减少等临床表现,超声心动图证实左室射血分数降低,酶联免疫吸附试验检测血浆脑钠肽水平升高,病理染色结果显示胶原纤维增多,透射电子显微镜结果显示心肌肌原纤维断裂、肌节损伤、Z线消失、线粒体溶解和破碎。结论 采用超声引导经颈外静脉植入人用起搏器建立的犬CHF模型操作方便,成功率高,是一种安全高效的CHF模型构建方法。
【关键词】超声引导;起搏器;犬;慢性心力衰竭
【DOI】10.16806/j.cnki.issn.1004-3934.2024.05.018
Ultrasound-Guided Pacemaker Implantation to Construct A Canine Model of Chronic Heart Failure
【Abstract】Objective To explore the method of constructing canine chronic heart failure(CHF) model by ultrasound-guided pacemaker implantation.Methods Five healthy canines were randomly selected.Under the guidance of ultrasound,the human pacemaker electrode was implanted into the right ventricular apex through the external jugular vein.After connecting the human pacemaker,it was placed in the right neck pocket.The ventricular asynchronous pacing mode was used with a pacing frequency of 180 beats per minute for 3 days,followed by 220 beats per minute for 3 days and finally 250 beats per minute for 3 weeks,the output voltage was 4.0 V and the pulse width was 0.5 ms.The effectiveness of constructing a canine CHF model was assessed by the clinical manifestations,echocardiography results,plasma brain natriuretic peptide(BNP) levels,and cardiac morphological changes before and after pacing.Results After 4 weeks of right ventricular pacing,5 canines showed clinical manifestations such as loss of appetite,dyspnea and decreased activity.Echocardiography confirmed a decrease in left ventricular ejection fraction.The plasma BNP level was increased by ELISA.The results of pathological staining showed that collagen fibers were increased.Transmission electron microscopy results showed that myocardial myofibrils were broken,sarcomeres were damaged,Z-lines were disappeared,and mitochondria were dissolved and cracked.Conclusion The canine model of CHF established by ultrasound-guided external jugular vein implantation of a human pacemaker is easy to operate and has a high success rate.It is a safe and efficient method for constructing a CHF model.
【Keywords】Ultrasound-guided;Pacemaker;Canine;Chronic heart failure
慢性心力衰竭(chronic heart failure,CHF)是心血管疾病进展的最终阶段,具有较高的发病率和死亡率,在医疗、社会和经济方面是一个重大问题[1-3]。多年来,人们已建立了各种动物心力衰竭模型以研究CHF[4-5]。其中,大动物(如犬)模型更接近人类的CHF病理生理过程并具有优势[6-7]。然而,目前构建一个成功的犬CHF模型仍然不易,需良好的实验条件和操作技术。在本研究中,笔者对目前犬CHF模型的构建进行了改进,旨在简化起搏器植入方案,提高模型成功率,为今后研究CHF机制提供更好的实验基础。
1 材料和方法
1.1 材料
人用起搏器(创领心律医疗公司,中国),人用螺旋电极(创领心律医疗公司,中国),电生理仪LEAD-7000(四川锦江电子科技公司,中国),经胸多普勒超声成像系统(Philips公司,美国),透射电子显微镜(JEOL Ltd.公司,日本)。
1.2 动物与手术
1.2.1 动物与术前准备
本实验采用5只1~2岁的健康比格犬,雌雄不限,体重(18±2)kg,由新疆医科大学动物实验中心提供,该研究经新疆医科大学伦理委员会批准实施(IACUC-201902-K03)。实验前禁食12 h,备皮,称重。用0.5 mL舒泰联合0.5 mL陆眠宁以1:1的比例对犬进行麻醉,气管插管,呼吸机辅助呼吸,随后予以戊巴比妥(3 g/100 mL)静脉持续泵入维持麻醉。起搏器植入术后起搏前、起搏后通过超声心动图检查了解心脏结构和功能,分别测定舒张期和收缩期左心室后壁厚度、舒张期和收缩期室间隔厚度、左心室舒张末期内径、左心室收缩末期内径等指标,并计算左心室短轴缩短率和左室射血分数。同时,将人用起搏器和人用螺旋电极经高压灭菌处理备用。
1.2.2 手术步骤
手术全程遵从无菌操作原则,建立静脉通道,术中给予青霉素320万IU+100 mL 0.9%NaCl静脉滴注。充分暴露颈外静脉,经颈外静脉穿刺后依次送入导引钢丝、血管鞘,在超声引导下送入人用螺旋电极,超声视野下见螺旋电极跨越三尖瓣到达右心室心尖部后,在犬颈部与锁骨之间的皮下作长5~6 cm切口做为囊袋,将电极尾端与人用起搏器相连埋入囊袋。起搏器植入后用程控仪将起搏器程控为心室非同步起搏(VOO)模式(输出电压4.0 V,脉宽0.5 ms),心电图提示起搏功能良好后固定电极,逐层缝合皮肤。考虑到犬术后感染和急性左心衰竭的可能,在犬麻醉苏醒前,采用程控仪关闭起搏器。
1.2.3 术后处理
术后每日给予青霉素320万IU+10 mL 0.9%NaCl静脉推注以预防感染。同时每天观察犬有无囊袋感染、出血和渗液。至第14天,观察犬的一般情况,并在犬清醒状态下给予超声心动图检查,复查电极及起搏器位置。明确起搏器无移位、无损毁或电极断裂等情况后程控起搏器,将起搏器频率调整为180次/min(3 d),220次/min(3 d),250次/min(3周),输出电压4.0 V,脉宽0.5 ms。起搏4周后完善超声心动图检查,检测血浆脑钠肽(brain natriuretic peptide,BNP)水平。
最后将犬处死,取出心脏,留心肌组织标本进行病理和透射电子显微镜检测。另一组正常犬心肌组织标本作为对照。
1.3 统计学分析
使用SPSS 26.0软件进行统计学分析,使用Image J软件对病理进行定量分析,使用GraphPad Prism 9.5.1软件制作统计图。计量资料用均数±标准差(±s)表示,犬CHF模型自身前后对照比较采用配对t检验;对照组、CHF组两组间定量资料比较,采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 起搏前及起搏4周后犬的一般情况
5只犬术后一般情况良好,饮食、活动均无明显变化,有2只犬在术后出现囊袋感染,经囊袋抽液和抗生素治疗后,囊袋感染控制并机化,且所有犬术区愈合良好。5只犬经4周起搏后,均出现食欲减退、呼吸困难、活动量减少等临床表现,2只犬可见心包积液,4只犬可见腹腔积液。
2.2 起搏前后超声心动图检查
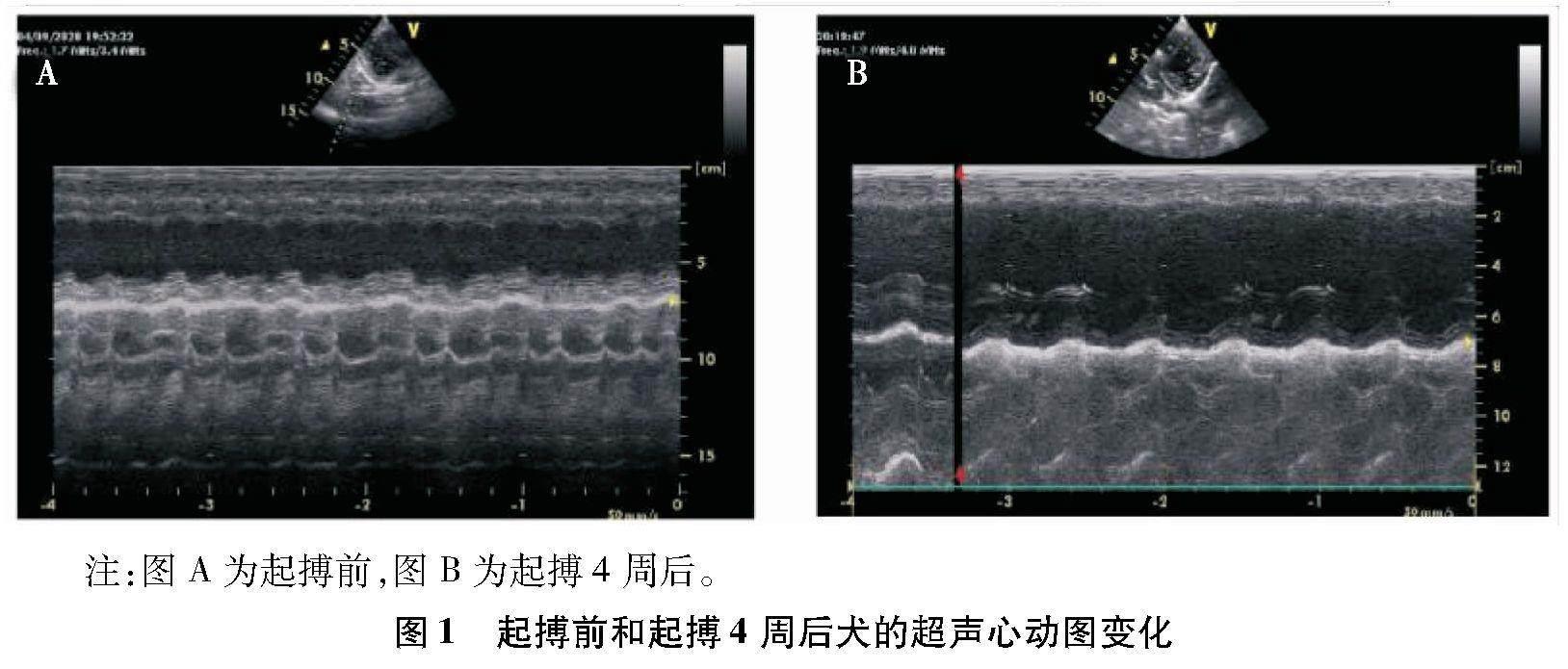
在起搏器植入术后起搏前和起搏4周后对犬进行超声心动图检查。与起搏前相比,起搏4周后犬的射血分数由60.55%±2.38%降至32.15%±5.45%(P<0.01)、左心室短轴缩短率由36.05%±1.88%降至17.21%±3.22%(P<0.01)。另外,起搏4周后犬的收缩期左心室后壁厚度显著降低(P<0.01)、舒张期左心室后壁厚度、舒张期和收缩期室间隔厚度明显降低(P<0.05),而左心室舒张末期内径明显增加(P<0.05)、左心室收缩末期内径显著增加(P<0.01)。见图1和表1。
2.3 起搏前后血浆BNP变化
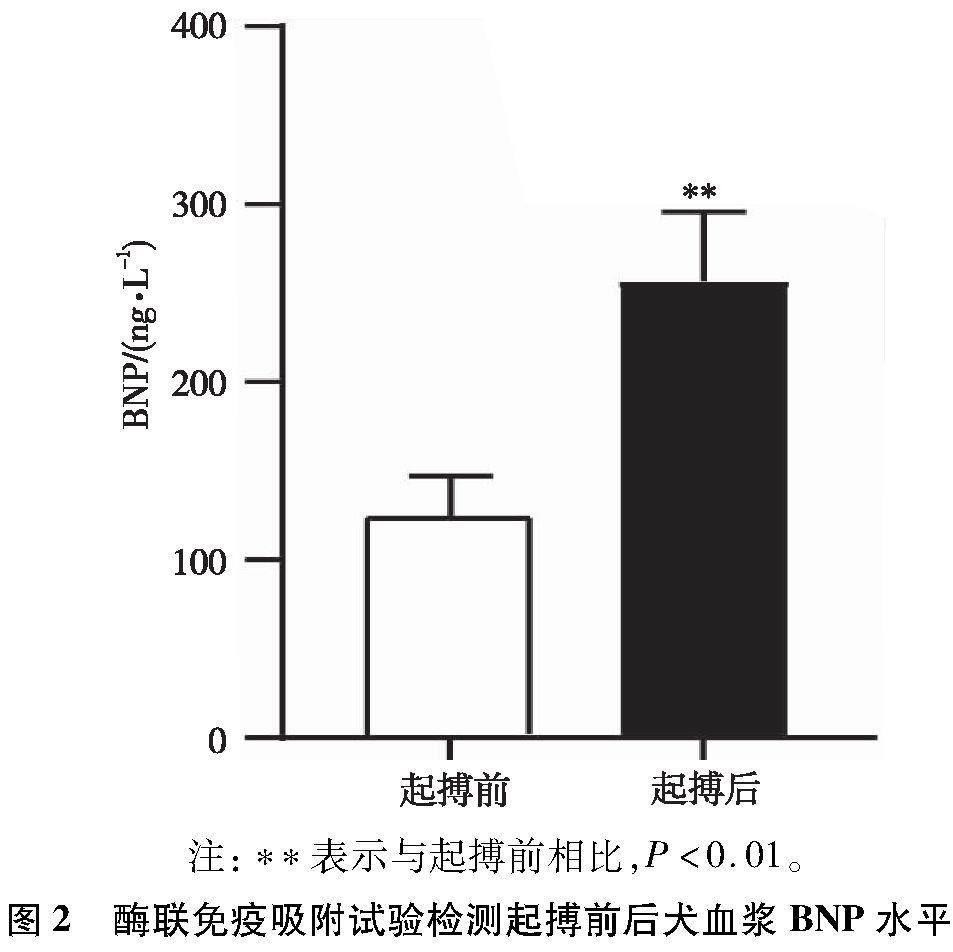
采用酶联免疫吸附试验检测起搏前后犬血浆BNP水平的变化。与起搏前相比,起搏后犬的血浆BNP水平显著高于起搏前,差异有统计学意义(P<0.01)。见图2。
2.4 病理变化
分别给对照组(Control组)和CHF组的心肌组织进行天狼星红染色和Masson染色,比较二者变化。与Control组相比,CHF组可见明显的胶原纤维沉积,见图3A。天狼星红染色和Masson染色的心肌组织定量分析显示,与Control组相比,CHF组的胶原容积分数显著增加,差异有统计学意义(P<0.01),见图3B。
2.5 透射电子显微镜变化
分别给Control组和CHF组的心肌组织进行透射电子显微镜检查,Control组显示肌节排列整齐、Z线分布形态和线粒体形态正常。而CHF组观察到心肌肌原纤维断裂、肌节损伤、Z线消失、线粒体溶解和破碎,见图4。
3 讨论
CHF是多种心脏疾病的最终阶段。研究CHF的前提是制作与人类CHF病理生理机制相似的动物模型。现有的心力衰竭模型有容量超负荷心力衰竭模型、压力超负荷心力衰竭模型、充血性心力衰竭模型和心肌缺血性心力衰竭模型等[8-11]。起搏犬CHF模型则模拟了充血性心力衰竭模型,使用大动物(如犬)进行造模,是研究充血性心力衰竭发病机制的重要模型之一[12]。然而,开胸手术、起搏导致的心源性猝死和急性左心衰竭、术后感染以及起搏器植入后引起的囊袋感染是导致该模型成功率较低的主要原因[13-14]。为提高模型的可操作性、重复性和实验性,以及提高模型的成功率,本实验在前人研究[15-16]的犬CHF模型基础上进行了一些改进。
在实验条件上:(1)采用超声引导下完成整个手术,并且植入过程与临床类似,该模型未选择X射线引导,避免了X射线对实验人员带来的影响。(2)为预防感染,本研究在构建起搏犬CHF模型的术中术后给予青霉素预防感染[17],这在一定程度上降低了术后感染的风险,且减少了术后囊袋感染的发生。本研究中有2只犬出现囊袋感染现象,经囊袋抽液和抗生素治疗后,囊袋感染控制并机化。(3)在本次研究中,笔者使用了人用起搏器和人用螺旋电极。这与以往的实验有所不同,以往的实验通常选择动物用起搏器以及改装后的人用螺旋电极来进行造模[18]。使用人用起搏器和人用螺旋电极,极大地简化了实验方案,为今后提供了更为便捷的造模方法。(4)术后过分躁动可能会导致犬自行咬断导线而致电极脱位。为避免这一问题,在本研究中,笔者采用植入术后关闭起搏器2周的方法来减少术后犬出现过分躁动的现象。结果显示5只犬均未出现电极脱位。此外,术后囊袋感染和高频率起搏很容易导致感染性心内膜炎、脓毒血症和急性左心衰竭,这些因素共同作用可能增加犬的死亡风险。本研究中,术后关闭起搏器,给予2周的恢复期,在此期间给予抗生素预防感染和加强护理,降低了犬的死亡风险,从而提高了起搏器植入术的成功率。综上,术后2周非起搏阶段可能对促进犬术后恢复、减少植入后死亡具有一定的优势。
总之,本研究采用超声引导下起搏器植入方法,成功构建了犬CHF模型。该方法操作简便,模型制作高效且安全,动物死亡率较低。这为今后构建大动物CHF模型提供了重要的参考价值,同时为深入研究人类CHF的发病机制奠定了实验基础。
参考文献
[1]Emmons-Bell S,Johnson C,Roth G.Prevalence,incidence and survival of heart failure:a systematic review[J].Heart,2022,108(17):1351-1360.
[2]Savarese G,Lund LH.Global public health burden of heart failure[J].Card Fail Rev,2017,3(1):7-11.
[3]Savarese G,Becher PM,Lund LH,et al.Global burden of heart failure:a comprehensive and updated review of epidemiology[J].Cardiovasc Res,2023,118(17):3272-3287.
[4]Cops J,Haesen S,de Moor B,et al.Current animal models for the study of congestion in heart failure:an overview[J].Heart Fail Rev,2019,24(3):387-397.
[5]Pilz PM,Ward JE,Chang WT,et al.Large and small animal models of heart failure with reduced ejection fraction[J].Circ Res,2022,130(12):1888-1905.
[6]Dixon JA,Spinale FG.Large animal models of heart failure:a critical link in the translation of basic science to clinical practice[J].Circ Heart Fail,2009,2(3):262-271.
[7]Hasenfuss G.Animal models of human cardiovascular disease,heart failure and hypertrophy[J].Cardiovasc Res,1998,39(1):60-76.
[8]Sedmera D,Neckar J,Benes J,et al.Changes in myocardial composition and conduction properties in rat heart failure model induced by chronic volume overload[J].Front Physiol,2016,7:367.
[9]Cumbermack KM,Cheng J,Nong Y,et al.A juvenile murine heart failure model of pressure overload[J].Pediatr Cardiol,2011,32(2):145-153.
[10]Khan MS,Smego D,Ishidoya Y,et al.A canine model of chronic ischemic heart failure[J].Am J Physiol Heart Circ Physiol,2023,324(6):H751-H761.
[11]Luo Q,Jin Q,Zhang N,et al.Antifibrillatory effects of renal denervation on ventricular fibrillation in a canine model of pacing-induced heart failure[J].Exp Physiol,2018,103(1):19-30.
[12]Levent P,Kocaturk M,Akgun E,et al.Platelet proteome changes in dogs with congestive heart failure[J].BMC Vet Res,2020,16(1):466.
[13]da Costa A,Kirkorian G,Cucherat M,et al.Antibiotic prophylaxis for permanent pacemaker implantation[J].Circulation,1998,97(18):1796-1801.
[14]Rahman R,Saba S,Bazaz R,et al.Infection and readmission rate of cardiac implantable electronic device insertions:an observational single center study[J].Am J Infect Control,2016,44(3):278-282.
[15]Belevych AE,Terentyev D,Terentyeva R,et al.The relationship between arrhythmogenesis and impaired contractility in heart failure:role of altered ryanodine receptor function[J].Cardiovasc Res,2011,90(3):493-502.
[16]Powers JC,Recchia F.Canine model of pacing-induced heart failure[J].Methods Mol Biol,2018,1816:309-325.
[17]徐威,张春霞,赵冰,等.永久性心脏起搏器植入术后感染患者的护理[J].中国循证心血管医学杂志,2013,4(5):424.
[18]张曼,匡晓晖,冯玉凡,等.一种快速起搏右心室诱导犬慢性心衰模型的新方法[J].四川动物,2016,35(2):261-265.