HPLC同时测定竹笋中8种酚酸类物质含量的方法研究及其应用
摘要:【目的】为实现竹笋中3,4-二羟基苯乙酸、对羟基苯甲酸、香草酸、咖啡酸、对羟基苯甲醛、丁香醛、阿魏酸、3-羟基肉桂酸等8种酚酸类化合物的快速检测,建立一种基于高效液相色谱-二极管阵列(HPLC-PDA)检测方法。【方法】采用Symmetry C18(4.6 mm×250 mm,5 μm)色谱柱,乙腈和乙酸-水(体积比0.5∶99.5)为流动相,在流速1.0 mL/min、进样量10 μL和柱温30 ℃的条件下梯度洗脱,检测波长275 nm。【结果】8种酚酸的分离度均在1.5以上,在1.0~50.0 μg/mL的线性范围内,线性关系良好,相关系数R≥0.999 0,检出限[信号强度(S)与噪声强度(N)之比(S/N)为3]为0.12~0.69 μg/mL,定量限(S/N=10)为0.36~2.08 μg/mL,精密度、重复性、稳定性实验相对标准偏差(RSD)均小于5%,加标回收率为80.99%~129.12%,RSD均小于5%。应用该方法,检测了苦竹(Pleioblastus amarus)和苦篱竹(Arundinaria acerba)竹笋中酚酸类物质的含量,8种酚酸总量为(9.35±0.08)~(38.60±0.12)mg/kg;比较了自然生长和避光处理生长条件下苦竹笋中酚酸含量的变化,发现避光处理的竹笋中6种酚酸含量显著降低,总含量下降达46.2%。【结论】HPLC-PDA检测方法简单方便,灵敏度高,准确可靠,适用于竹笋中酚酸类物质的测定;避光处理可以有效降低苦竹笋样品中酚酸类物质的含量。
关键词:竹笋;酚酸类物质;高效液相色谱;苦竹;苦篱竹;避光处理
中图分类号:S718 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)03-0237-08
Simultaneous determination of eight phenolic acids in bamboo shoots by HPLC and its applications
HUANG Yongjian, XUN Hang, ZHANG Bao,YOU Junhao, YAO Xi, TANG Feng*
(International Center for Bamboo and Rattan, Key Laboratory of National Forestry and Grassland Administration/Beijing for Bamboo and Rattan Science and Technology, Beijing 100102, China)
Abstract:【Objective】Phenolic acids are present in almost all plant-derived foods, and are associated with the organoleptic and nutritional properties of foods. A high-performance liquid chromatography-photo-diode array (HPLC-PDA) method was established for the simultaneous detection of eight phenolic acids in bamboo shoots: 3,4-dihydroxyphenylacetic acid, 4-hydroxybenzoic acid, vanillic acid, caffeic acid, 4-hydroxybenzaldehyde, syringaldehyde, ferulic acid and 3-hydroxycinnamic acid. 【Method】Eight phenolic acids were separated on a Symmetry C18 column (4.6 mm×250 mm, 5 μm). Acetonitrile (phase A) and 0.5% acetic acid solution (phase B) were used as the mobile phase, the injection volume was 10 μL, and the detection wavelength was 275 nm. The analysis was performed at 30 ℃ with a flow rate of 1.0 mL/min. 【Result】Eight phenolic acids were successfully separated (resolutiongt;1.5), and had a good linear relationship (R ≥ 0.999 0) with a linear range of 1.0-50.0 μg/mL. The detection limits (S/N=3) were 0.12-0.69 μg/mL and the quantification limits (S/N=10) were 0.36-2.08 μg/mL. Precision, repeatability, and stability tests yielded relative standard deviations (RSD) of lt;5%. Additionally, the recoveries of phenolic acids were 80.99%-129.12%, and the RSD values associated with the recoveries were also lt;5%. The phenolic acid contents in the actual samples of Pleioblastus amarus bamboo shoots and Arundinaria acerba bamboo shoots were determined using an established method. The contents of eight phenolic acids in the actual bamboo shoots samples varied from (9.35±0.08)to (38.60±0.12) mg/kg. A comparative analysis of phenolic acids in P. amarus bamboo shoots grown under a shading treatment and normal conditions was conducted based on this method. Compared to the shoots grown under normal conditions, the contents of six phenolic acids in P. amarus bamboo shoots grown under the shading treatment were lower, and the content of total detected phenolic acids decreased by 46.2%.【Conclusion】The method developed here is simple, sensitive, accurate and reliable, and is suitable for determining phenolic acids in bamboo shoots. The results showed that a shading treatment downregulated the accumulation of phenolic acids in P. amarus bamboo shoots.
Keywords:bamboo shoots; phenolic acids; HPLC; Pleioblastus amarus; Arundinaria acerba; shading treatment
竹笋是一种富含膳食纤维、高蛋白、低脂肪的天然食品。在我国可食用竹笋资源非常丰富,并具有悠久的食用历史。苦笋是一类具有苦味的竹笋统称,例如苦竹属(Pleioblastus)苦竹(Pleioblastus amarus)的竹笋和青篱竹属(Arundinaria)苦篱竹(Arundinaria acerba)笋等。苦笋具有清热祛湿利尿等功效[1],是营养丰富并具有明确药用价值的可食用竹笋。
不同竹种竹笋的口感和营养存在明显差异。苦竹笋等很多竹笋都有一定程度的苦涩味,涩味主要来源是单宁、草酸等,而苦味物质主要包括苦味氨基酸、氰苷、总黄酮、总生物碱等[2-3]。近年来,通过对苦味物质代谢途径的解析可知,竹笋的苦味与L-苯丙氨酸、L-酪氨酸等苦味氨基酸相关代谢途径有着密切的联系[4-5]。由于L-苯丙氨酸、L-酪氨酸是植物苯丙烷代谢通路和酪氨酸代谢通路的核心起点,一系列酚酸类物质的生物合成自然与此关系密切,并成为多种植物食品、饮品的苦涩滋味来源。酚酸在植物中以结合态和游离态两种形式存在,普遍认为植物源食物中的游离态酚酸更易于被人体吸收和被味觉系统感知[6-7]。通过食物摄入的酚酸类物质,对人体具有抗氧化、抗癌、降血糖以及减肥等多种生理功能[8]。但是,过于强烈的苦涩味,会严重影响竹笋的食用口感。因此,竹笋特别是苦竹笋的苦味物质含量检测与调控受到关注。
国内外对荞麦(Fagopyrum esculeatum)、柠檬(Citrus limon)、丹参(Salvia miltiorrhiza)等植物产品中酚酸类物质的检测研究较多[9-11],多采用高效液相色谱(HPLC)、超高效液相色谱(UPLC)和超高效液相色谱-质谱联用(UPLC-MS)等检测方法,由于UPLC和UPLC-MS法的设备比较昂贵,HPLC法仍是检测酚酸类物质有效实用的方法。但有关竹笋中多种酚酸类物质的同时检测鲜见研究报道。本研究选择与L-苯丙氨酸、L-酪氨酸等苦味氨基酸代谢通路相关的3, 4-二羟基苯乙酸等8种酚酸类物质,采用反相高效液相色谱法,建立了一种准确、快速的检测方法。同时,采用该方法比较了自然生长和避光处理的苦竹笋中酚酸类物质的含量。以期为优良笋用竹品种的选育、定向培育的相关检测提供方法和依据。
1 材料与方法
1.1 材料、试剂与仪器
苦竹笋,采自四川省宜宾市长宁县(自然生长和避光处理两种生长条件,避光处理:对未出土的竹笋采取4 d的套袋处理后进行采集)、乐山市夹江县、福建省南平市建瓯市;苦篱竹笋,采自广东省肇庆市广宁县。
试剂:乙腈和甲醇(色谱纯),默克生物科技有限公司;甲醇(分析醇),天津市富宇精细化工有限公司;3, 4-二羟基苯乙酸、对羟基苯甲酸、香草酸、咖啡酸、对羟基苯甲醛、丁香醛、阿魏酸、3-羟基肉桂酸(纯度≥98%)8种标准品,上海源叶生物科技有限公司。实验室用水为自制超纯水。
仪器:2996高效液相色谱系统、Symmetry C18色谱柱(4.6 mm×250 mm, 5 μm),美国Waters公司;DC-0506恒温水浴锅,上海恒平科学仪器有限公司;R-220旋转蒸发仪,瑞士Buchi公司;BP221S电子天平,德国Sartorius公司;KQ-800E超声波清洗器,昆山市超声仪器有限公司;Cascada An超纯水仪,美国Pall公司。
1.2 标准溶液配制
1.2.1 标准品溶液配制
分别准确称取3,4-二羟基苯乙酸等8种标准品约5 mg,用甲醇溶解,定容至5 mL,配制质量浓度为1.06 mg/mL的3, 4-二羟基苯乙酸、1.10 mg/mL的对羟基苯甲酸、1.04 mg/mL的香草酸、1.00 mg/mL的咖啡酸、0.94 mg/mL的对羟基苯甲醛、1.02 mg/mL的丁香醛、1.04 mg/mL的阿魏酸和1.05 mg/mL的3-羟基肉桂酸标准溶液,密封置于4 ℃冰箱中保存。
酚酸混合标准品溶液:精确移取上述8种酚酸类物质标准品溶液,置于10mL容量瓶中,用甲醇定容,配置成混合标准品母液,质量浓度均为100 μg/mL,密封置于4 ℃冰箱中保存。
1.2.2 工作曲线溶液的配制
精确移取不同体积的混合标品母液,置于5 mL容量瓶中,用甲醇定容,得到1.0、5.0、10.0、20.0、30.0、40.0、50.0 μg/mL的标准工作液,置于4 ℃冰箱中保存,检测前经0.45 μm微孔滤膜过滤。
1.3 竹笋样品提取
分别称取粉碎后的竹笋样品50.0 g,置于500 mL圆底烧瓶中,加入体积分数85%甲醇溶液300 mL,在水浴中加热回流提取2 h,趁热过滤,得到提取液,重复提取3次,合并提取液,浓缩并定容至10 mL,置于4 ℃冰箱保存。检测前过0.45 μm微孔滤膜,进样量为10 μL。
1.4 检测方法
1.4.1 标准曲线的线性范围和检测限、定量限测定
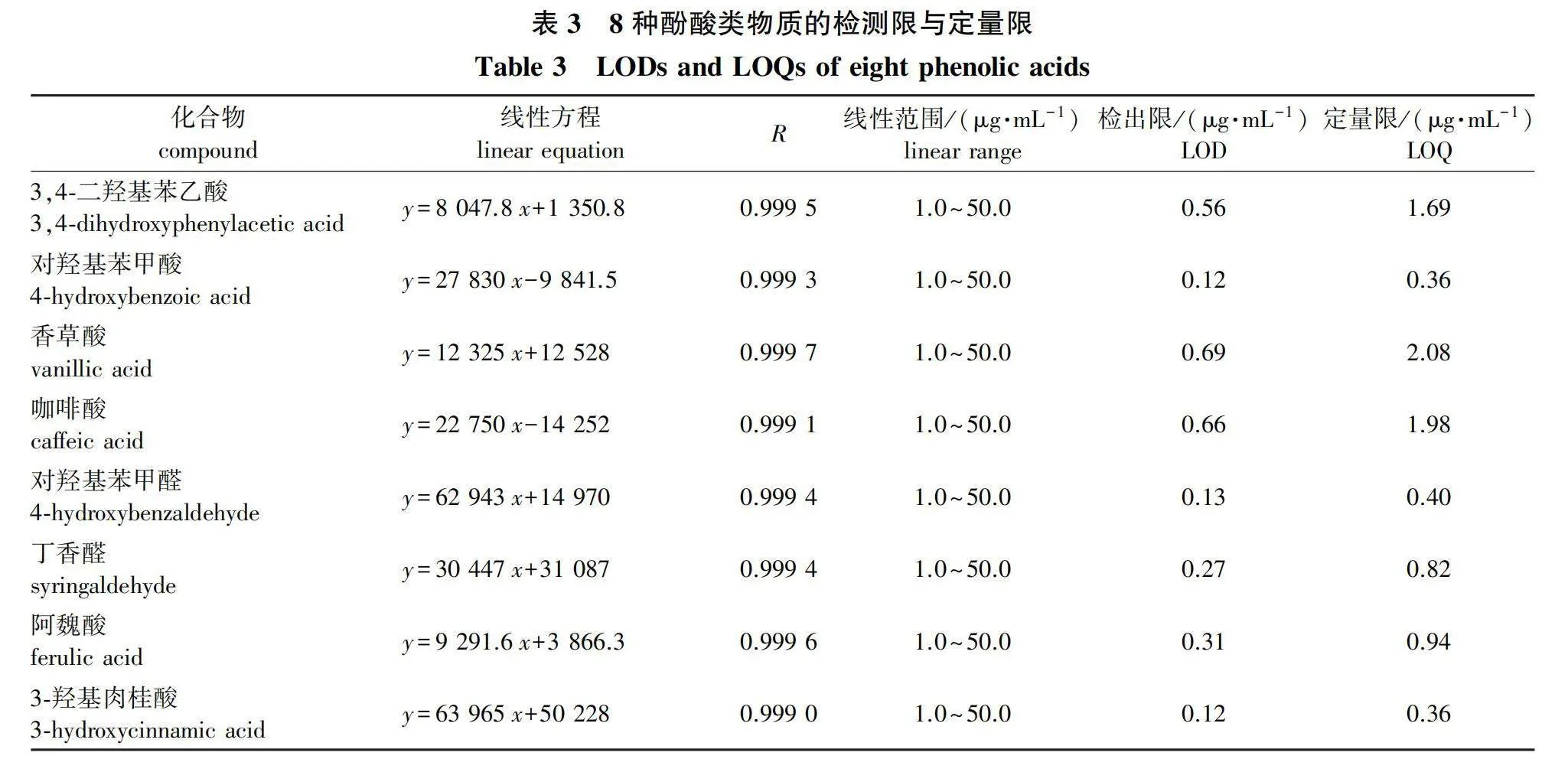
以标准溶液的浓度为横坐标,以峰面积为纵坐标,绘制标准工作曲线,并计算线性回归方程和相关系数。以最低浓度的标准溶液进样,以信号强度(S)比噪声强度(N)等于3(S/N=3)的方法计算检测限,以信号强度(S)比噪声强度(N)等于10(S/N=10)的方法计算定量限。
1.4.2 精密度、重复性、稳定性和加标回收率测定
将同一浓度的标准品,重复进样6次,分别计算8种组分的相对标准偏差(RSD),考察检测方法的精密度。
准确称取6份采自四川宜宾的苦竹笋样品50.0 g,提取并进样检测,考察检测方法的重复性。
在24 h内,将加标后四川宜宾的苦竹笋提取液样品,放置不同时间(0、2、4、6、8、12、24 h)后,进样检测,考察样品的稳定性。
以采自四川宜宾的苦竹笋为试样,准确称取50.0 g样品,分别加入8种酚酸类物质标准储备溶液,添加量分别为1.00、2.00、4.00 mg/kg,进行加标回收率实验,计算8种组分的添加回收率和相对标准偏差(RSD)。
1.5 HPLC检测
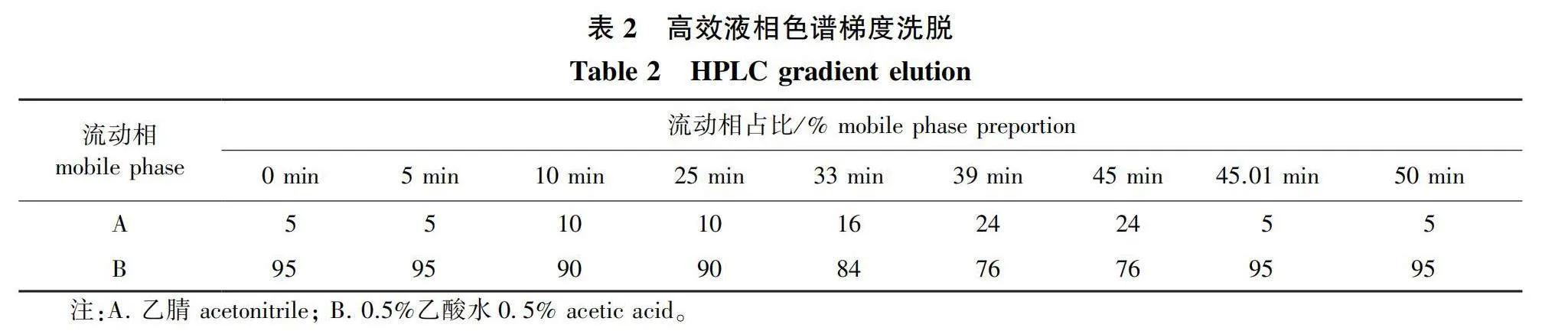
Waters 2996高效液相色谱系统,具二极管阵列检测器;Symmetry C18色谱柱(4.6 mm×250 mm, 5 μm);采用双流动相(A、B)进行梯度洗脱,流动相A为乙腈,流动相B为乙酸-水(体积比为0.5∶99.5);流速1.0 mL/min;进样量10 μL;检测波长为275 nm;柱温30 ℃。
1.6 数据处理
所有实验至少重复3次,实验原始数据使用SPSS 22软件进行统计学分析,后通过Origin 2018绘图软件进行液相色谱图绘制。
2 结果与分析
2.1 色谱分离条件的优化
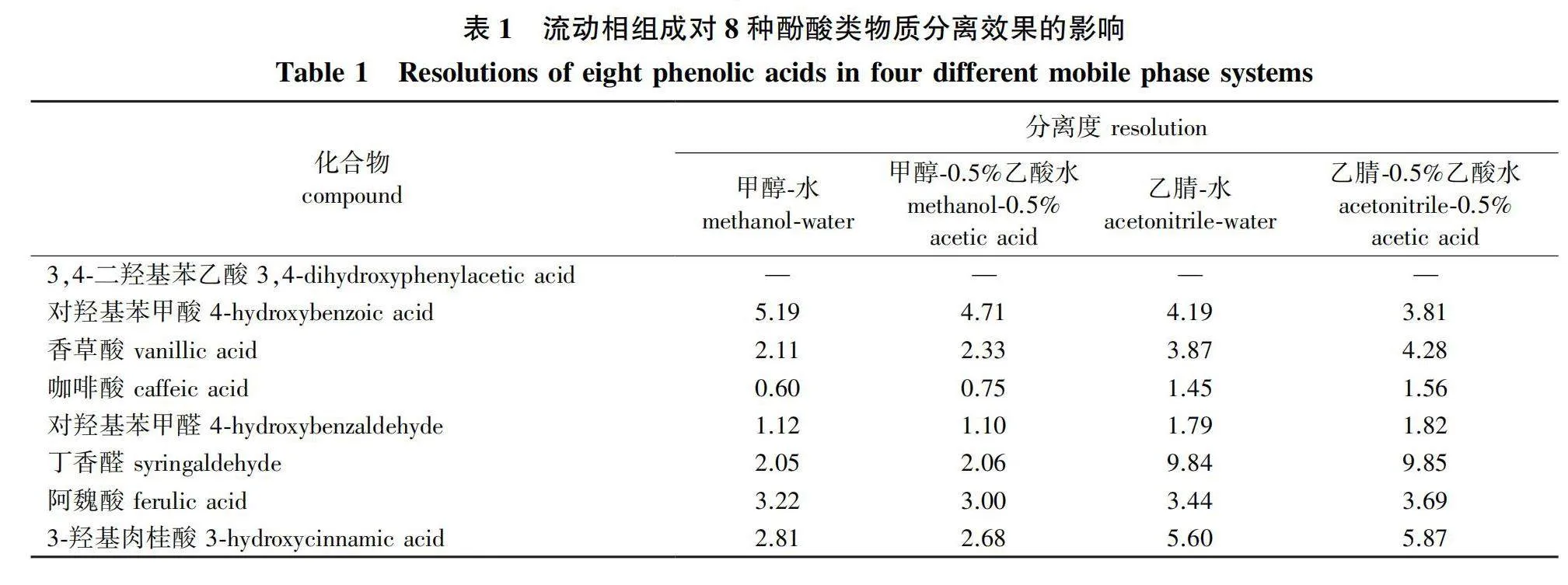
分别以甲醇-水、甲醇-0.5%(体积分数,下同)乙酸水溶液、乙腈-水、乙腈-0.5%乙酸水溶液等为流动相,分析8种酚酸类物质标准品的分离效果(表1)。
分离度即两个组分保留值之差与其平均峰宽值之比,是液相色谱方法中的一个重要的参数,用来描述色谱图中两个相邻峰之间的分离程度。分离度越高,表示两个组分之间的分离越好,峰的重叠越少,从而可以更准确地定量和定性。分离度值大于等于1.5通常被认为是两个峰良好分离的标准。由表1可见,甲醇-水和甲醇-0.5%乙酸水溶液作为流动相时,分离效果较差,香草酸和咖啡酸两个物质之间的分离度分别是0.60和0.75,表明这两个物质保留时间相近,未能完全分离。采用乙腈-水做为流动相时,8种酚酸类物质能达到较为理想的分离效果,香草酸和咖啡酸实现了较好的分离,实际样品检测同样达到理想的分离效果。使用乙腈-0.5%乙酸水溶液为流动相时,待测物保留时间更短,峰型更好。
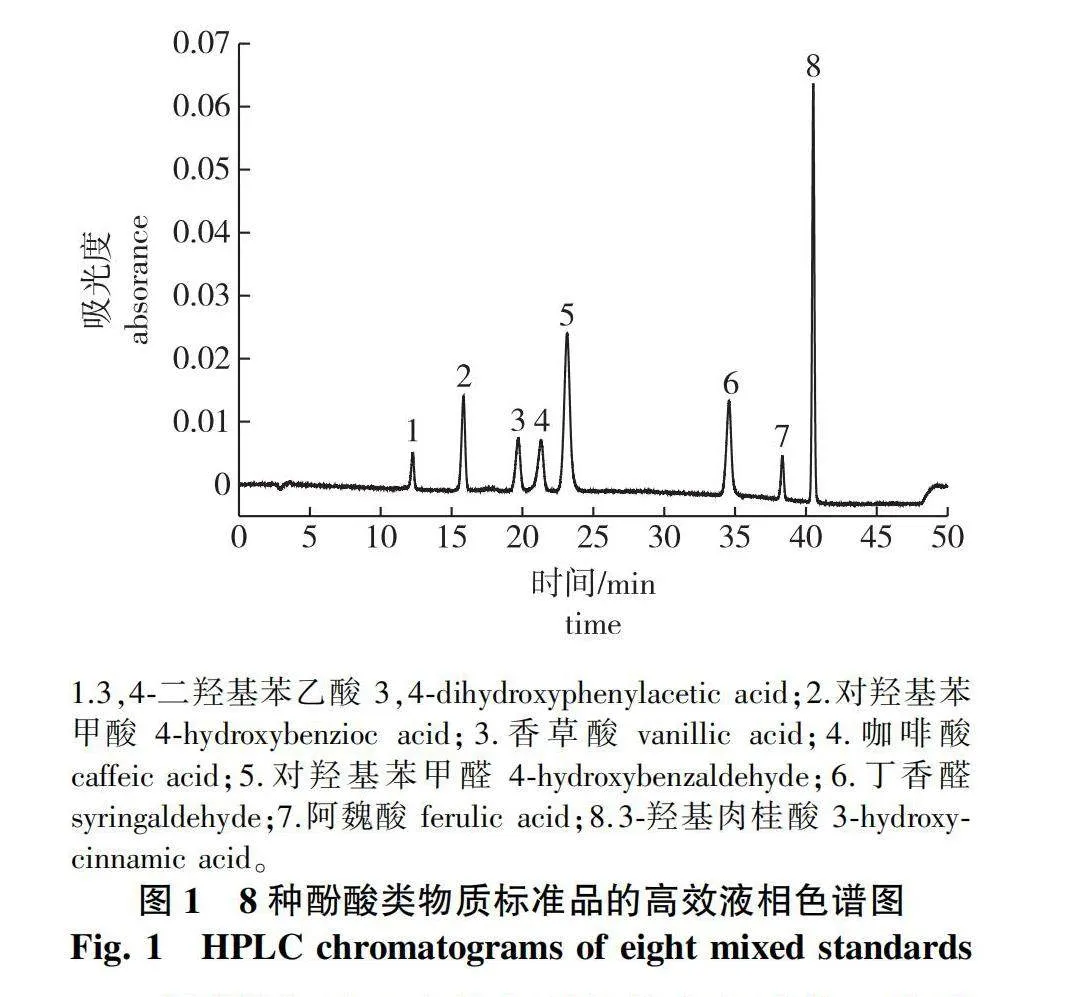
高效液相色谱梯度洗脱流动相占比见表2。8种酚酸类物质标准品的高效液相色谱图见图1。
洗脱梯度对于液相色谱的分离起到核心作用,液相洗脱梯度优化结果表明:在开始的5 min内,以5%流动相A(乙腈)和95%流动相B(0.5%乙酸水)进行洗脱,酚酸类物质能与苦竹笋中极性较大的共提物有很好的分离;5~10 min,将流动相A的比例从5%逐渐加大到10%,在10~25 min,以10%流动相A和90%流动相B进行洗脱,可以使3,4-二羟基苯乙酸等前5种酚酸类物质达到很好的分离效果;然后,逐渐加大A相的比例,丁香醛等后3种酚酸类物质也能够均匀分开;在洗脱45 min后将流动相A和B的体积比调整回至5∶95,并保持至程洗脱序结束,以清洗色谱柱为下一次进样做好准备。
2.2 检测方法验证
2.2.1 线性方程考察以及检出限、定量限测定结果
将质量浓度1.0~50.0 μg/mL的系列混合标准溶液进样检测,得到每种酚酸类物质的标准曲线,相关系数R≥0.999 0。供试酚酸类成分的检出限(S/N=3)范围为0.12~0.69 μg/mL,定量限(S/N=10)范围为0.36~2.08 μg/mL,表明此方法灵敏度较高(表3)。
2.2.2 精密度、重复性、稳定性和加标回收率
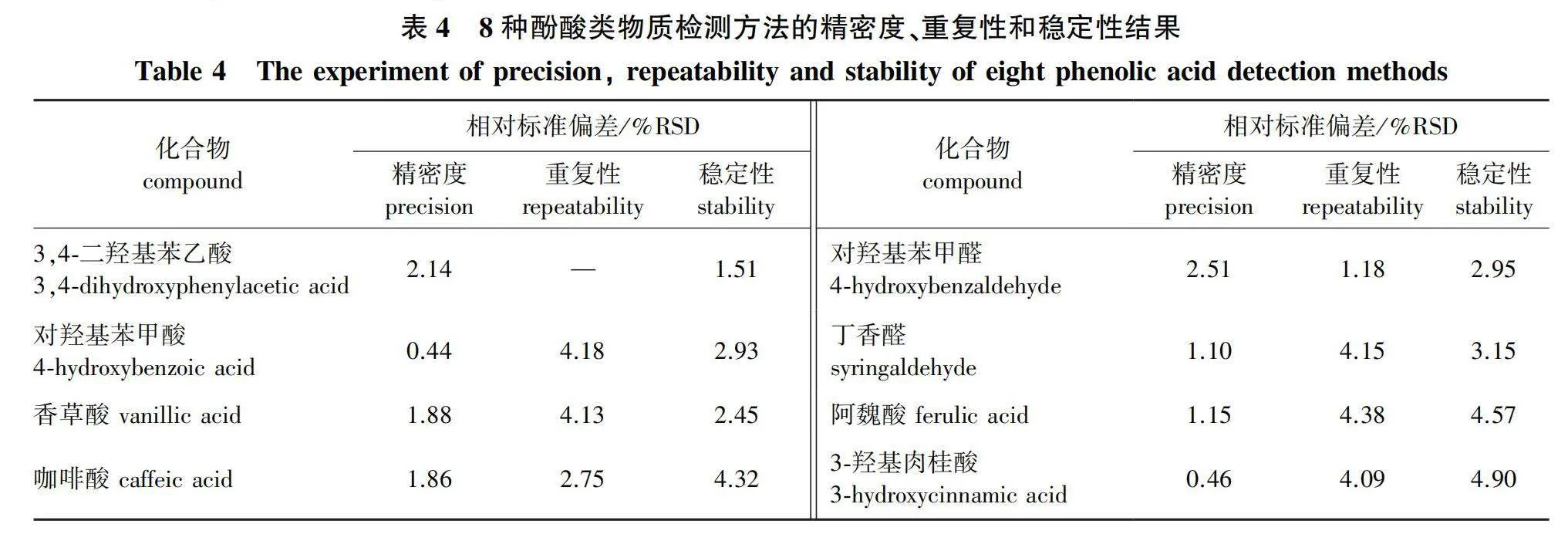
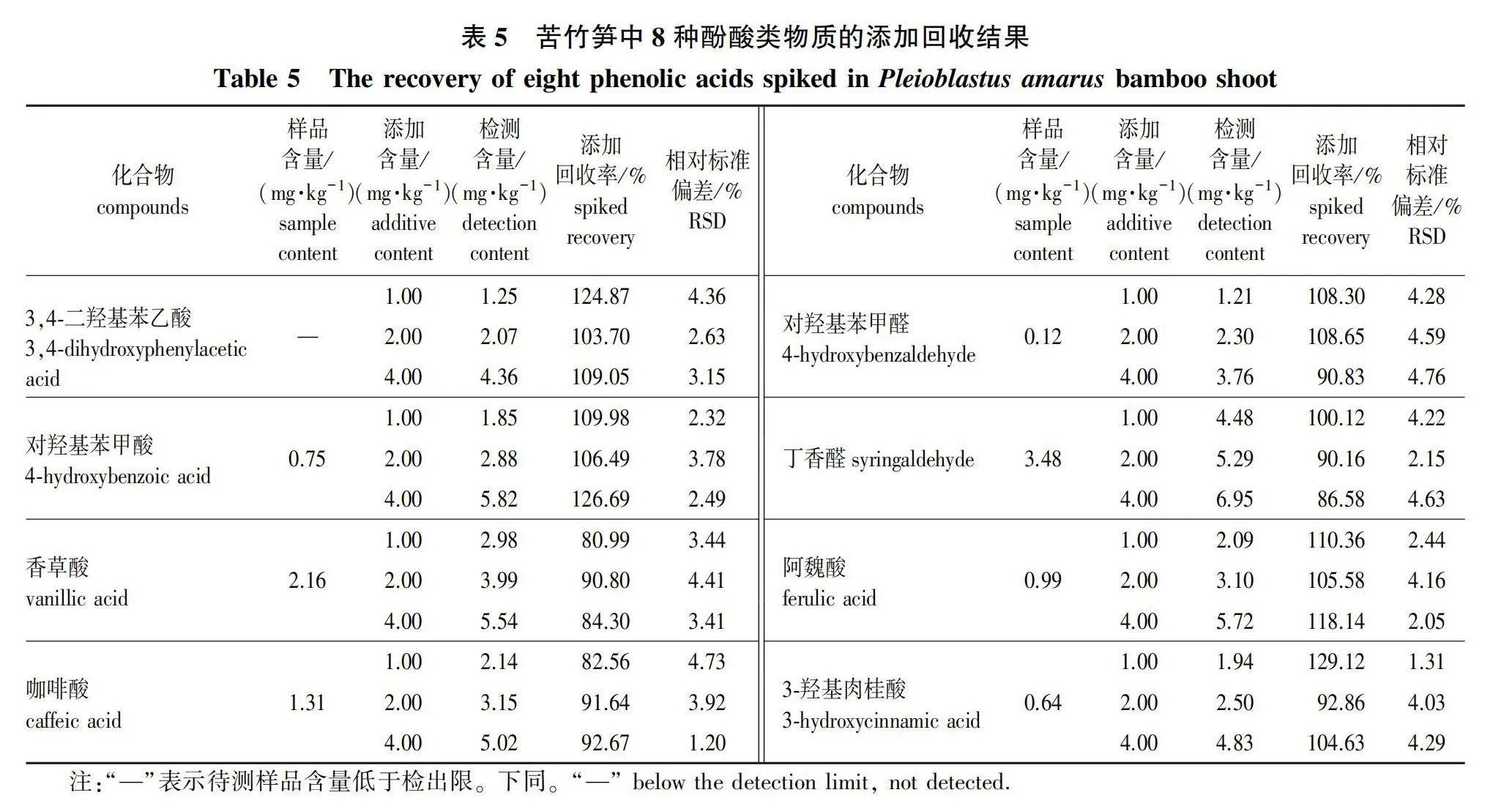
方法的精密度、重复性和稳定性结果见表4。酚酸类物质的添加回收结果见表5。
由表4可见,10 μg/mL的混合标品连续进样6次,8种组分的精密度的相对标准偏差(RSD)值为0.44%~2.51%,表明仪器精密度良好;苦竹笋样品重复提取6次并进样,7种组分的重复性的RSD值为1.18%~4.38%,表明方法重复性好;对加标后的待测样品在24 h内间隔不同时间进样检测(0、2、4、6、8、12、24 h),8种组分的稳定性RSD值为1.51%~4.90%,表明样品提取溶液在24 h之内稳定性良好。
由表5可知,添加8种酚酸类物质含量分别为1.00、2.00和4.00 mg/kg时,8种组分的添加回收率在80.99%~129.12%,RSD值为1.20%~4.76%,满足检测要求。
2.3 竹笋样品检测结果
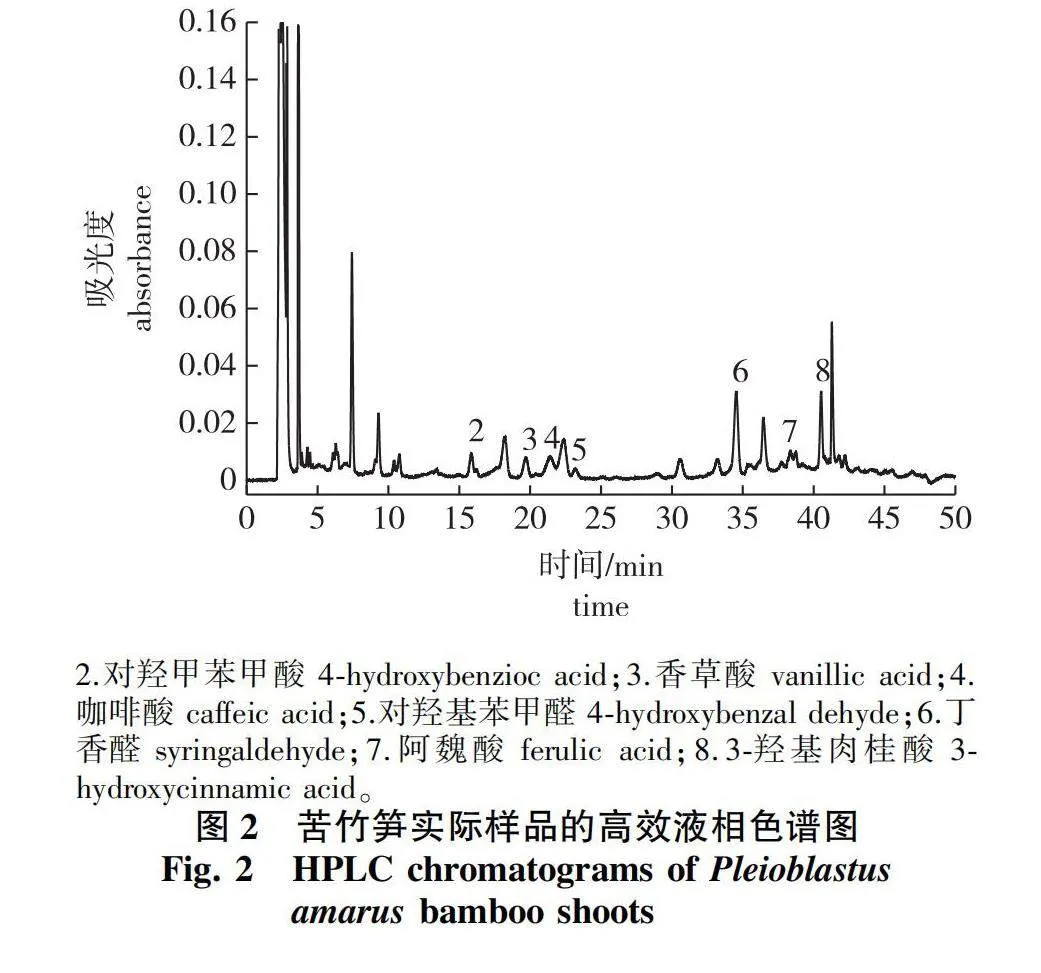
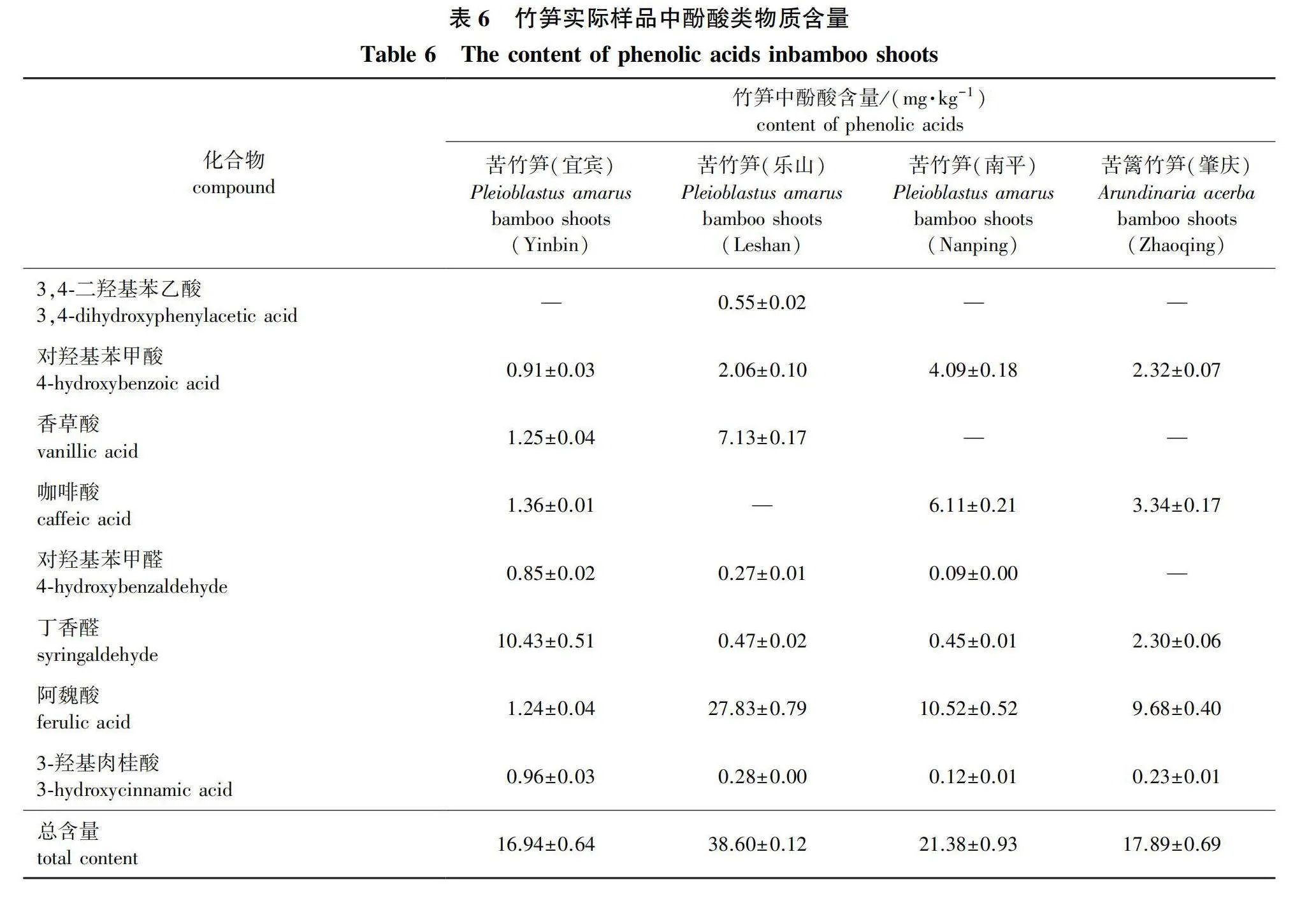
竹笋实际样品检测结果见图2和表6。
结果表明,采自四川的苦竹笋样品中检出7种酚酸类成分,福建的苦竹笋样品和广东的苦篱竹笋样品中,分别检出6种和5种酚酸类物质。检出酚酸类物质总量最高是四川乐山的苦竹笋,酚酸类物质总检出量达38.60 mg/kg,其余依次为:苦竹笋(福建南平,21.38 mg/kg)>苦篱竹笋(广东肇庆,17.89 mg/kg)>苦竹笋(四川宜宾,16.94 mg/kg)。表明所构建的方法适用于不同竹笋样品中8种酚酸类物质的检测。
2.4 生长期避光处理对苦竹笋中酚酸含量的影响
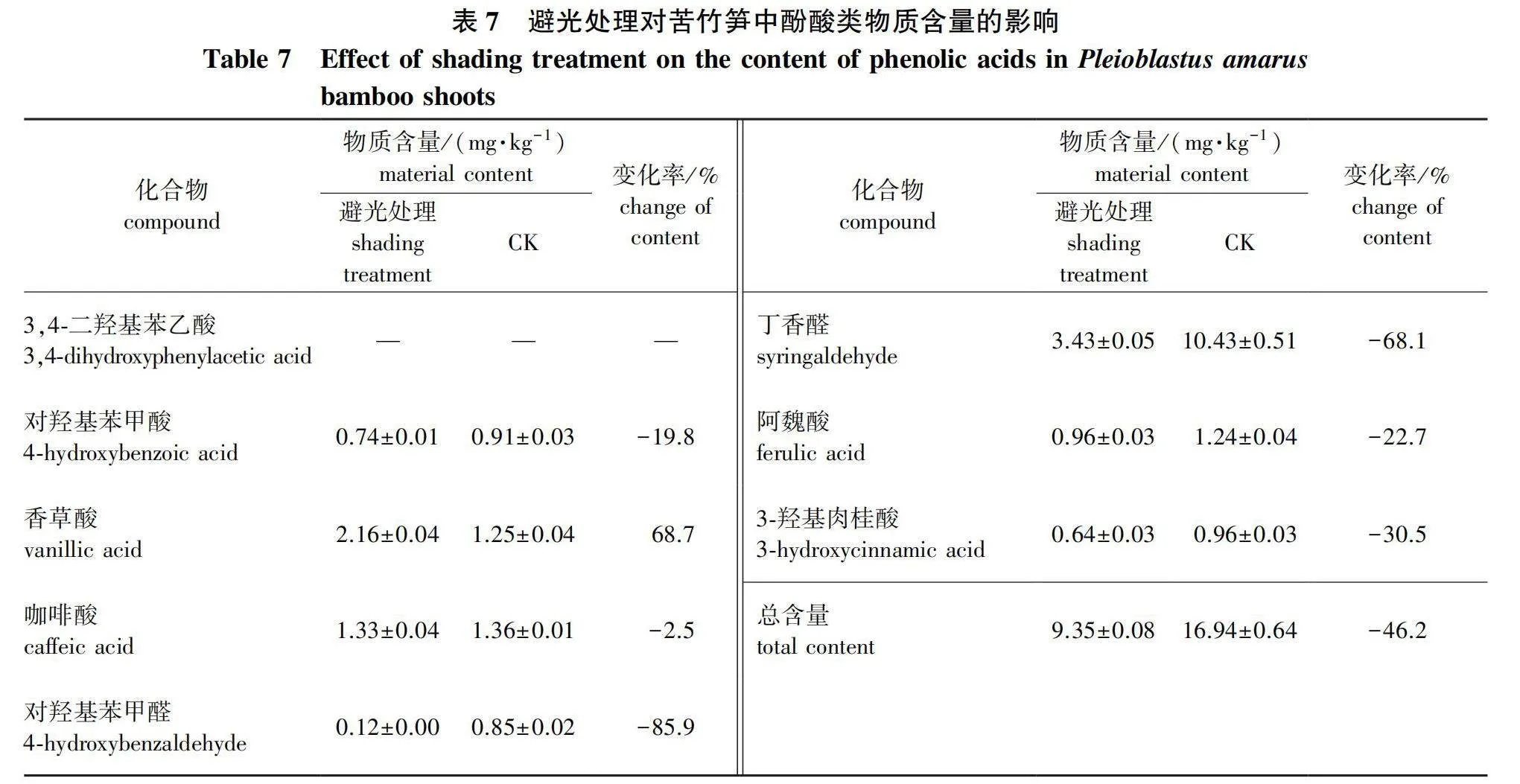
避光处理对苦竹笋中酚酸含量的影响见表7。
在实际生产和相关研究中,人们发现通过覆土、套袋(管)等避光栽培措施,可以有效降低竹笋的苦味,使竹笋食用口感更好[12-14],然而避光对竹笋中具体苦味物质积累的影响,目前尚缺乏了解。因此,采用构建的检测方法,比较了自然生长(CK)和避光处理条件下苦竹笋中的酚酸类物质的含量,结果表明,避光处理的苦竹笋与酪氨酸代谢通路相关的酚酸类物质中,对羟基苯甲醛含量降低85.9%、丁香醛含量降低68.1%、对羟基苯甲酸含量降低19.8%,而香草酸含量上升了68.7%;与苯丙氨酸代谢通路相关酚酸类物质含量均降低,3-羟基肉桂酸降低30.5%,阿魏酸降低22.7%,咖啡酸降低2.5%;总含量下降了46.2%。
3 讨 论
目前,竹笋的研究多集中在其营养组成方面,如蛋白、可溶性膳食纤维、多糖等化学成分以及生物活性[15-17],关于小分子化合物的研究极少。研究表明,酚酸类物质可能是竹笋中主要生物活性物质之一[18-19]。另一方面,酚酸类物质是食品苦味的重要贡献者。如对羟基苯甲酸是苦味西葫芦中最主要的活性成分[20];对羟基苯甲醛是热加工燕麦中主要的苦味物质[21];羟基肉桂酸及其衍生物是白葡萄酒中主要的苦味物质[22];阿魏酸也具有苦味[23]。对苦竹笋来说,苦味也是苦竹笋独特的风味特征,但苦味过强则会严重影响食用口感。目前竹笋中主要活性物质的研究多采用分光光度法,如总黄酮、总生物碱等化合物的含量检测[2-3,24-25],但这些方法均不能明确是哪些物质导致竹笋的苦味口感。因此,亟须建立检测与苦味紧密相关的酚酸类的方法。同样,目前对竹笋中酚酸类物质的检测多采用分光光度法,通过测定总酚含量进行表征[26],但不能够反映主要酚酸的种类及其含量。本研究成功构建了竹笋中8种酚酸类物质的检测方法,并通过对实际样品的检测进行了验证。该方法简单方便、灵敏度高、准确可靠,适用于竹笋中酚酸类物质的测定。
光照对于酚酸类化合物的生成有着显著的促进作用[27],避光处理则不利于酚酸类物质的积累。在咖啡、茶叶和酿酒葡萄的栽培中,适当遮阴可以有效调控植物中酚酸类物质的含量,改善产品的口味[28-30]。本研究通过比较自然生长和避光处理的苦竹笋中酚酸类物质的含量,得到了类似的结论,即避光处理抑制了苦竹笋中部分酚酸类物质的生成,降低了苦竹笋中与苯丙烷代谢通路及酪氨酸代谢通路相关的酚酸类物质的含量。研究结果为有效调控苦竹笋中酚酸含量提供了支撑。
参考文献(reference):
[1](清)赵学敏.本草纲目拾遗:十卷[M].北京:人民卫生出版社,1963.ZHAO X M. Compendium of medica [M].Beijing:People’s Medical Publishing House,1963.
[2]崔逢欣,丁兴萃,李露双,等.毛竹笋呈味物质种类、含量与辛辣味强度的关系[J].林业科学研究,2017,30(6):1041-1049.CUI F X,DING X C,LI L S,et al.Relationship between types and contents of flavour substances and spicy intensity in moso bamboo(Phyllostachys edulis) shoots[J].For Res,2017,30(6):1041-1049.DOI: 10.13275/j.cnki.lykxyj.2017.06.023.
[3]章志远,丁兴萃,崔逢欣,等.感官评定方法确定麻竹笋苦涩味物质成分及与口感的关系[J].食品科学,2017,38(5):167-173.ZHANG Z Y,DING X C,CUI F X,et al.Identification of bitter and astringent components in ma bamboo shoots and their relationship with taste by sensory evaluation[J].Food Sci,2017,38(5):167-173.DOI: 10.7506/spkx1002-6630-201705027.
[4]GAO Q,JIANG H,TANG F,et al.Evaluation of the bitter components of bamboo shoots using a metabolomics approach[J].Food Funct,2019,10(1):90-98.DOI: 10.1039/c8fo01820k.
[5]李露双,董文慧,丁兴萃,等.麻竹笋转录组测序及苦涩味物质合成基因差异表达分析[J].林业科学研究,2018,31(4):38-46.LI L S,DONG W H,DING X C,et al.Transcriptome sequencing and differential expression analysis of bitter and astringent substances biosynthesis related gene in Dendrocalamus latiflorus[J].For Res,2018,31(4):38-46.DOI: 10.13275/j.cnki.lykxyj.2018.04.006.
[6]CHU Y F,SUN J,WU X Z,et al.Antioxidant and antiproliferative activities of common vegetables[J].J Agric Food Chem,2002,50(23):6910-6916.DOI: 10.1021/jf020665f.
[7]CHAMORRO S,VIVEROS A,ALVAREZ I,et al.Changes in polyphenol and polysaccharide content of grape seed extract and grape pomace after enzymatic treatment[J].Food Chem,2012,133(2):308-314.DOI: 10.1016/j.foodchem.2012.01.031.
[8]乔丽萍,傅瑜,叶兴乾,等.酚酸生物活性研究进展[J].中国食品学报,2013,13(10):144-152.QIAO L P,FU Y,YE X Q, et al.Recent advances of phenolic acid bioactivities[J].J Chin Inst Food Sci Technol,2013,13(10):144-152.DOI: 10.16429/j.1009-7848.2013.10.032.
[9]陈清艳.HPLC法同时测定荞麦中8种酚酸类成分[J].食品工业,2022,43(2):279-282.CHEN Q Y.Simultaneous determination of eight phenolic acids in buckwheat by HPLC[J].Food Ind,2022,43(2):279-282.
[10]赵希娟,庞雯辉,谭涛,等.UPLC-Q-TOF-HRMS技术结合SWATH采集方法同时测定柠檬果实中26种生物活性成分的含量[J].食品与发酵工业,2022,48(23):306-314.ZHAO X J,PANG W H,TAN T,et al.Simultaneous determination of 26 bioactive components in lemon fruits based on UPLC-Q-TOF-HRMS and SWATH acquisition mode[J].Food Ferment Ind,2022,48(23):306-314.DOI: 10.13995/j.cnki.11-1802/ts.030869.
[11]方鑫,杨峥,王晨旭,等.丹参DnaJ基因的鉴定及胁迫响应分析[J].南京农业大学学报,2022,45(1):94-102.FANG X,YANG Z,WANG C X,et al.Identification and stress response analysis of DnaJ gene in Salvia miltiorrhiza[J].J Nanjing Agric Univ,2022,45(1):94-102.DOI: 10.7685/jnau.202104017.
[12]李明良,陈双林,郭子武,等.覆土栽培对高节竹笋呈味氨基酸的影响[J].浙江林业科技,2015,35(2):54-57.LI M L,CHEN S L,GUO Z W,et al.Influence of soil sealing on flavor amino acid in shoot from Phyllostachys prominens stand[J].J Zhejiang For Sci Technol,2015,35(2):54-57.DOI: 10.3969/j.issn.1001-3776.2015.02.012.
[13]童龙,张磊,李彬,等.覆土栽培对绿竹笋品质与适口性的影响[J].江西农业大学学报,2018,40(3):487-493.TONG L,ZHANG L,LI B,et al.Influence of soil-covered cultivation on quality and palatability of Dendrocalamopsis oldhami shoot[J].Acta Agric Univ Jiangxiensis,2018,40(3):487-493.DOI: 10.13836/j.jjau.2018064.
[14]王晓娟,马光良,陈洪,等.不同覆盖措施对梁山慈竹出笋和竹笋适口性的影响[J].南京林业大学学报(自然科学版),2022,46(2):143-149.WANG X J,MA G L,CHEN H,et al.Effects of different mulching measures on bamboo shooting and palatability of Dendrocalamus farinosus[J].J Nanjing For Univ (Nat Sci Ed),2022,46(2):143-149.DOI: 10.12302/j.issn.1000-2006.202103054.
[15]徐圣友,曹万友,宋曰钦,等.不同品种竹笋蛋白质与氨基酸的分析与评价[J].食品科学,2005,26(7):222-227.XU S Y,CAO W Y,SONG Y Q,et al.Analysis and evaluation of protein and amino acid nutritional components of different species of bamboo shoots[J].Food Sci,2005,26(7):222-227.DOI: 10.3321/j.issn:1002-6630.2005.07.055.
[16]苏玉,李璐,黄亮,等.超微化雷竹笋膳食纤维对高脂血症小鼠的影响[J].食品科学,2019,40(15):203-210.SU Y,LI L,HUANG L,et al.Superfine dietary fiber from Phyllostachys praecox shoots improves hyperlipidemia in mice[J].Food Sci,2019,40(15):203-210.DOI: 10.7506/spkx1002-6630-20180604-037.
[17]CHEN G J,CHEN X H,YANG B,et al.New insight into bamboo shoot (Chimonobambusa quadrangularis) polysaccharides:impact of extraction processes on its prebiotic activity[J].Food Hydrocoll,2019,95:367-377.DOI: 10.1016/j.foodhyd.2019.04.046.
[18]LIU L L,LIU L Y,LU B Y,et al.Evaluation of antihypertensive and antihyperlipidemic effects of bamboo shoot angiotensin converting enzyme inhibitory peptide in vivo[J].J Agric Food Chem,2012,60(45):11351-11358.DOI: 10.1021/jf303471f.
[19]SINGH P,RATHORE M,PRAKASH H G.The nutritional facts of bamboo shoots have a potential and prospects for utilization as a health food:a review[J].Asian J Dairy Food Res,2021,40(4): 388-397.DOI: 10.18805/ajdfr.dr-1586.
[20]何乐,王大成,吴立军,等.苦味西葫芦化学成分研究[J].中国现代中药,2007,9(7):10-12.HE L,WANG D C,WU L J,et al.Studies on the chemical constituents of Cucurbita pepo cv. Dayangua[J].Mod Chin Med,2007,9(7):10-12.DOI: 10.13313/j.issn.1673-4890.2007.07.014.
[21]MOLTEBERG E L,SOLHEIM R,DIMBERG L H,et al.Variation in oat groats due to variety,storage and heat treatment.II:sensory quality[J].J Cereal Sci,1996,24(3):273-282.DOI: 10.1006/jcrs.1996.0059.
[22]DUIZER L M,LANGFRIED A.Sensory characterization during repeated ingestion of small-molecular-weight phenolic acids[J].J Sci Food Agric,2016,96(2):513-521.DOI: 10.1002/jsfa.7118.
[23]VÈRETTE E,NOBLE A C,SOMERS T C.Hydroxycinnamates of Vitis vinifera:sensory assessment in relation to bitterness in white wines[J].J Sci Food Agric,1988,45(3):267-272.DOI: 10.1002/jsfa.2740450310.
[24]李雪蕾,丁兴萃,张闪闪,等.不同光强下麻竹笋不同部位苦涩味物质含量的变化[J].南京林业大学学报(自然科学版),2015,39(3):161-166.LI X L,DING X C,ZHANG S S,et al.The distributions of bitter and astringent taste compounds in the bamboo shoot of Dendrocalamus latiflorus under different light intensities[J].J Nanjing For Univ (Nat Sci Ed),2015,39(3):161-166.DOI: 10.3969/j.issn.1000-2006.2015.03.029.
[25]朱玉燕,邬波龙,赵宇瑛,等.绿竹笋苦味物质成分分析[J].食品科技,2015,40(8):77-80.ZHU Y Y,WU B L,ZHAO Y Y,et al.Analysis of bitter compounds in harvested bamboo shoots[J].Food Sci Technol,2015,40(8):77-80.DOI: 10.13684/j.cnki.spkj.2015.08.018.
[26]董春凤,赵一鹤.储藏时间和温度对甜龙竹笋采后品质的影响[J].竹子学报,2021,40(4):80-86.DONG C F,ZHAO Y H.Effects of storage time and temperature on postharvest quality of Dendrocalamus brandisii shoots[J].J Bamboo Res,2021,40(4):80-86.DOI: 10.12390/jbr2022040.
[27]李倩,梁宗锁,董娟娥,等.丹参品质与主导气候因子的灰色关联度分析[J].生态学报,2010,30(10):2569-2575.LI Q,LIANG Z S,DONG J E,et al.Grey correlation for main climatic factors and quality of Danshen(Salvia miltiorrhiza Bunge)[J].Acta Ecol Sin,2010,30(10):2569-2575.
[28]SOMPORN C,KAMTUO A,THEERAKULPISUT P,et al.Effect of shading on yield,sugar content,phenolic acids and antioxidant property of coffee beans (Coffea arabica L cv. Catimor) harvested from north-eastern Thailand[J].J Sci Food Agric,2012,92(9):1956-1963.DOI: 10.1002/jsfa.5568.
[29]陈勤操,戴伟东,蔺志远,等.代谢组学解析遮阴对茶叶主要品质成分的影响[J].中国农业科学,2019,52(6):1066-1077.CHEN Q C,DAI W D,LIN Z Y,et al.Effects of shading on main quality components in tea(Camellia sinensis(L) O. Kuntze) leaves based on metabolomics analysis[J].Sci Agric Sin,2019,52(6):1066-1077.DOI: 10.3864/j.issn.0578-1752.2019.06.010.
[30]SCAFIDI P,PISCIOTTA A,PATTI D,et al.Effect of artificial shading on the tannin accumulation and aromatic composition of the Grillo cultivar (Vitis vinifera L.)[J].BMC Plant Biol,2013,13:175.DOI: 10.1186/1471-2229-13-175.
(责任编辑 李燕文)

